基于TLR4/MyD88/NF-κB信号通路探讨雷帕霉素对狼疮小鼠肾脏的保护作用
2023-04-18康红丽潘秀虹崔久明尤燕舞
康红丽,潘秀虹,崔久明,尤燕舞
(1.右江民族医学院研究生学院,广西百色533000;2.广西医学科学院·广西壮族自治区人民医院肾内科,广西南宁530000)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是具有临床异质性的复杂的累及多个系统和器官的自身免疫性疾病。狼疮性肾炎(lupus nephritis,LN)是系统性红斑狼疮累及肾脏所致的最常见的并发症之一,也是影响患者预后的一个最主要因素[1]。目前对于SLE的常规治疗方法包括使用糖皮质激素和/或免疫抑制剂治疗,虽可以部分缓解病情,但毒副作用大,且重症患者可能会出现严重的脏器损伤[2-3]。因此,还需要我们进一步探索LN的药物治疗。
研究发现Toll 样受体4/髓系分化因子88/核转录因子κB(Toll-like Receptor 4/myeloid differentiation factor 88/nuclear factor-kappa B, TLR4/MyD88/NF-κB)信号通路与 LN 的肾小球损伤密切相关[4]。雷帕霉素(rapamycin, RAPA)作为大环内酯类免疫抑制剂可用于预防肾移植术后的急性排斥反应[5],但是基于TLR4/MyD88/NF-κB信号通路研究RAPA对LN的治疗作用还少有报道。本研究选用经典狼疮模型MRL/lpr小鼠,通过分析雷帕霉素对MRL/lpr小鼠蛋白尿水平、自身抗体水平、肾组织病理变化、TLR4/MyD88/NF-κB信号通路蛋白和基因的表达水平及肾组织细胞凋亡等的作用,试图阐明雷帕霉素对LN的作用机制和作用靶点,为狼疮性肾炎的治疗提供理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物C57BL/6小鼠和MRL/lpr小鼠各20只,购买于上海斯莱克实验动物有限公司,实验动物合格证号2017000504481。饲养于右江民族医学院实验动物中心(NO.SYXK 2017-0004)SPF级动物房。
1.1.2 主要仪器Thermo scientific GeminiAS全自动染色机、自动化封片机 ClearVueTM、3DHistech Pannoramic Midi扫描仪、OLYMPUS显微镜、OLYMPUS激光共聚焦显微镜。
1.1.3 主要试剂RAPA、HE、Masson、PAS、PASM染色试剂盒、Trizol试剂(北京索莱宝科技有限公司);BCA蛋白定量试剂盒(南京建成生物工程研究所);ELISA试剂盒(武汉华美生物工程有限公司);qRT-PCR及cDNA合成试剂盒(莫纳生物科技有限公司),Anti-TLR4 Ab、MyD88Ab、phospho-NF-κB-p65Ab(江苏亲科生物研究中心有限公司),TUNEL原位细胞凋亡检测盒(江苏凯基生物技术股份有限公司)。
1.2 方法
1.2.1 动物分组及处理20周龄C57BL/6小鼠和MRL/lpr小鼠各20只,分为正常对照组、治疗组、狼疮组、狼疮治疗组,每组10只。正常对照组野生型C57BL/6小鼠、狼疮组MRL/lpr小鼠腹腔注射生理盐水溶液,治疗组野生型C57BL/6小鼠、狼疮治疗组MRL/lpr小鼠腹腔注射RAPA 2.0 mg/kg,每天1次,连续注射28天。第29天处死小鼠。
1.2.2 各组小鼠24小时尿蛋白及自身抗体检测在实验第28天代谢笼收集24小时尿液并记录 24 h 尿量。按照南京建成生物公司提供的尿蛋白测定试剂盒(CBB法)说明书检测各组小鼠24小时尿蛋白水平。小鼠麻醉后采用摘眼球取血法留取血清,严格按照武汉华美生物工程有限公司试剂盒说明书操作步骤进行ELISA检测各组小鼠血清anti-dsDNA、ANA、anti-Sm抗体水平。
1.2.3 肾脏病理学检查采用颈椎脱臼法处死小鼠,将肾脏标本固定在4%多聚甲醛,石蜡包埋后3 μm切片,按照北京索莱宝试剂说明书行HE、Masson、PAS、PASM染色。400倍光镜下观察15个视野肾组织切片,进行肾组织狼疮性肾炎的活动性指数评分。肾组织病理评分结果判定根据2016年国际肾脏病学会/肾脏病理学会(International Society of Nephrology/Renal Pathology Society,ISN/RPS)狼疮性肾炎病理分型的共识评分标准进行活动性指数(activity index, AI)和非活动性指数(chronic index, CI)评分评定。
1.2.4 实时荧光定量PCRqRT-PCR检测肾组织TLR4、MyD88和NF-κB-p65mRNA表达。使用Trizol试剂提取总RNA,并合成cDNA,按照莫纳生物Mon ScriptTMRTIII All-in-One Mix with ds Dnase试剂盒操作进行。引物设计参照GenBank中的mRNA序列,由上海生工生物合成,按照莫纳生物MonAmpTMSYBRGreen qPCR Mix试剂盒操作说明进行检测。应用LightCycler96实时荧光定量PCR仪进行荧光定量PCR。每个样品设2个复孔,取平均扩增循环次数Ct值。以内参GAPDH为对照,计算相对定量ΔCt 值。以对照组为对照,计算相对定量ΔΔCt 值。采用相对定量2-ΔΔCt法比较三个基因的mRNA的表达差异。2-ΔΔCt代表实验组目的基因相对于对照组的变化倍数。ΔΔCt值=实验组(目的基因 Ct值-内参基因Ct值)-对照组(目的基因 Ct 值-内参基因Ct值)。荧光定量 PCR 扩增基因引物序列TLR4 F序列:CAGAATGAGGACTGGGTGAGA,R序列:CTGTAGTGAAGGCAGAGGTGA;MyD88 F序列:ATCGCTGTTCTTGAACCCTCG,R序列:CTCACGGTCTAACAAGGCCAG,NF-κB-p65 F序列:TCGAGTCTCCATGCAGCTACGG,R序列:CGGTGGCGATCATCTGTGTCTG;GAPDH F序列:ATCATCCCTGCATCCACT,R序列:ATCCACGACGGACACATT。
1.2.5 肾组织免疫荧光取小鼠的肾脏组织,4%多聚甲醛液固定后,石蜡包埋3 μm 切片,脱蜡,PBS洗3次,每次5 min;山羊血清室温封闭1小时;柠檬酸盐修复液高温高压抗原修复,PBS洗3次,每次5 min; TLR4、MyD88、p-NF-κB-p65山羊抗兔抗体4 ℃冰箱孵育过夜;荧光二抗孵育,室温60 min,PBS洗3次,每次5 min;(含DAPI)抗荧光淬灭封片液封片,共聚焦显微镜下观察拍照。通过Image J对TLR4、MyD88的平均荧光强度进行半定量分析。对于p-NF-κB-p65通过多个视野观察计数入核的阳性细胞数计算所占百分比来分析。
1.2.6 TUNEL染色法检测小鼠肾脏细胞凋亡按照江苏凯基生物技术股份有限公司的TUNEL凋亡试剂盒操作说明检测,大体步骤如下:肾组织进行常规石蜡包埋、切片、脱蜡后,用蛋白酶K工作液进行样本通透,过氧化氢封闭内源性过氧化物酶,根据切片数量和组织大小取适量TdT酶反应液于37 ℃温箱内避光反应60 min,辣根过氧化物酶偶联的抗地高辛孵育避光反应30 min,DAB室温下显色,苏木素溶液室温孵育后流水冲洗,脱水透明封片。细胞核染成棕黄色及褐色的细胞为凋亡细胞,而细胞核呈蓝色的细胞为未凋亡细胞。随机选取20个不重叠的400倍镜视野,观察所计数的凋亡细胞数和总细胞数,最后按照细胞凋亡率计算公式:凋亡细胞数/细胞总数×100%计算各组的凋亡率。

2 结 果
2.1 四组小鼠24小时尿蛋白水平比较狼疮组24小时尿蛋白水平高于正常对照组,狼疮治疗组低于狼疮组,比较差异均有统计学意义(P<0.05)。说明雷帕霉素可减可轻狼疮组小鼠尿蛋白水平。见表1。
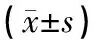
表1 四组小鼠24小时尿蛋白水平比较
2.2 四组小鼠24周龄末血清ANA、anti-dsDNA、anti-Sm水平比较狼疮组血清ANA、anti-dsDNA、anti-Sm水平高于正常对照组,狼疮治疗组低于狼疮组,比较差异均有统计学意义(P<0.05)。说明雷帕霉素可降低狼疮组小鼠血清ANA、anti-dsDNA、anti-Sm抗体水平。见表2。

表2 四组小鼠24周龄末血清ANA、anti-dsDNA、anti-Sm水平比较
2.3 雷帕霉素改善狼疮组小鼠肾脏病变肾组织HE、Masson、PAS、PASM染色结果显示,狼疮组肾组织的肾小球出现中性粒细胞浸润、大量系膜细胞增生及系膜基质增生、新月体形成、肾间质的中性粒细胞淋巴细胞浸润等表明肾脏结构损害的病理改变,在狼疮治疗组病理损害明显改善,表现为肾小球中性粒细胞浸润减少,系膜细胞系膜基质增生减少,肾间质的炎症细胞浸润,血管周围炎症减轻。狼疮组与正常对照组相比,狼疮组AI评分(14.00±1.00)明显高于正常对照(0),差异有统计学意义(P<0.05)。狼疮治疗组AI评分(7.00±1.00)与狼疮组(14.00±1.00)相比显著降低,差异有统计学意义(P<0.05)。狼疮组CI评分(5.00±1.00)明显高于正常对照(0),差异有统计学意义(P<0.05)。狼疮治疗组CI评分(5.00±1.00)与狼疮组(5.33±1.54)相比,差异无统计学意义(P>0.05)。见图1、图2。
2.4 雷帕霉素对狼疮组小鼠肾组织TLR4、MyD88、NF-κB-p65 mRNA表达水平的影响狼疮组肾组织TLR4、MyD88、NF-κB-p65 mRNA表达水平高于正常对照组,狼疮治疗组上述肾组织表达水平低于狼疮组,比较差异均有统计学意义(P<0.05)。见表3。
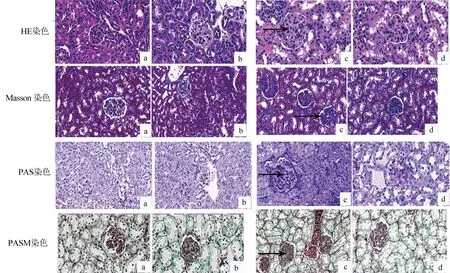
注:a.正常对照组;b.治疗组;c.狼疮组;d.狼疮治疗组

AI评分:狼疮组与正常对照组相比,*P<0.05,狼疮组与狼疮治疗组相比,#P<0.05;CI评分:狼疮组与正常对照组相比,*P<0.05
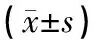
表3 四组TLR4、MyD88、NF-κB-p65 mRNA表达水平2-ΔΔCt比较
2.5 雷帕霉素对狼疮组小鼠肾皮质TLR4、MyD88、p-NF-κB-p65蛋白表达的影响如图3所示,各组小鼠肾组织免疫荧光染色后发现,TLR4、MyD88、p-NF-κB-p65主要表达于肾小管和肾小球的部分内皮细胞、系膜细胞及足细胞中。结果分析如表4所示,狼疮组TLR4、MyD88、NF-κB-p65 蛋白表达水平高于正常对照组,狼疮治疗组低于狼疮组,比较差异均有统计学意义(P<0.05)。见图3、表4。
2.6 TUNEL染色观察肾组织细胞凋亡TUNEL染色分析各组小鼠凋亡细胞,狼疮组细胞凋亡率(54±3)%与正常对照组(5±1)%相比,差异有统计学意义(P<0.05)。狼疮治疗组的凋亡率(36±2)%与狼疮组的(54±3)%相比,差异有统计学意义(P<0.05)。见图4。

注:a.四组TLR4免疫荧光结果;b.四组MyD88免疫荧光结果;c.四组NF-κB-p65免疫荧光结果
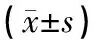
表4 四组TLR4、MyD88、NF-κB-p65 蛋白表达水平比较
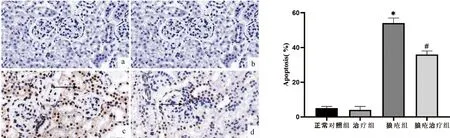
注:a.正常对照组;b.治疗组;c.狼疮组;d.狼疮治疗组 注:狼疮组与正常对照组相比,*P<0.05;狼疮治疗组与狼疮组相比,#P<0.05
3 讨 论
SLE作为一种多因素且复杂的自身免疫性疾病,其特点是各种细胞和分子异常。先天免疫和适应性免疫功能失调均与其发生密切相关,本研究旨在探讨RAPA改善LN肾损伤的可能机制。
RAPA作为哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)的抑制剂,1999年开发上市批准雷帕霉素为免疫抑制剂[6],越来越多的研究关注RAPA治疗狼疮性肾炎的作用机制。2006年,FERNANDEZ等人[7]报道了对9名传统治疗无效的SLE患者,RAPA 似乎是一种更安全有效的治疗方法。该研究持续了6~48个月,结果表明RAPA使SLE患者的 T 细胞活化,并改善了患者的临床症状。也有研究表明雷帕霉素具有直接的抗增殖特性,能够抑制系膜[8]和上皮细胞的增殖[9],改善LN的肾组织损害。
TLR作为天然免疫的眼睛,在感染性疾病和多种慢性疾病的发病机制中起着监视和识别不同的病原相关分子模式[10]和损伤相关分子模式的作用[11]。TLR4是由POLTORAK等人[12]于1998年发现的由 TLR4 基因编码的表面先天免疫受体,研究表明TLR4基因敲除纯合子小鼠(Toll-like receptor 4 gene knockout mouse,TLR4 KO)或应用了TLR4抑制剂的狼疮小鼠免自身抗体的产生受到了显著抑制,肾组织病理改变如肾小球免疫复合物沉积和系膜细胞增生也显著较轻,这些均提示TLR4参与了自身免疫过程[13-14]。TLR4信号通路的激活可以诱导NF-κB,通过经典途径产生促炎细胞因子和/或通过替代途径产生 I 型干扰素和抗炎细胞因子[15-16]。XIE等人[17]发现了NF-κB的激活,参与了LN的发生发展。我们课题组之前的研究也发现NF-κB的激活也参与了LN的病理进展[18]。
但是RAPA对TLR4/MyD88/NF-κB信号通路的影响还少有报道。在我们的研究中,我们证实 RAPA 可减轻MRL/lpr小鼠狼疮性肾炎的严重程度。不仅是从蛋白尿水平、自身抗体水平及肾脏组织病理方面,同时RT-PCR和免疫荧光结果显示,狼疮模型组肾组织TLR4/MyD88/NF-κB通路的基因和蛋白的表达量显著增高,肾组织细胞凋亡率增加,这些表明所探索的模型激活了TLR4/MyD88/NF-κB通路,导致了肾组织细胞凋亡率的增加。此外,RAPA治疗后,肾组织中TLR4/MyD88/NF-κB通路的mRNA和蛋白表达量下降,肾组织的细胞凋亡率减少。
综上,本研究表明RAPA对于LN的治疗作用可能与抑制LN肾组织中的TLR4/MyD88/NF-κB信号通路并改善肾组织的细胞凋亡率有关,为狼疮性肾炎的治疗提供理论和实验基础。
