SKA3在食管鳞状细胞癌中表达及其与临床病理参数的关系
2023-04-18林思彤陈罡罗文奇陈肖瑜潘如冰张凤友
林思彤,陈罡,罗文奇,陈肖瑜,潘如冰,张凤友
(1.广西医科大学第一附属医院病理科,广西南宁 530021;2.广西医科大学附属肿瘤医院病理科,广西南宁 530021)
食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)是全球范围内常见的恶性肿瘤之一。在2020年全球癌症统计中显示,食管癌新发病例约为60万,死亡病例约54万[1],而中国是全球食管癌发病率较高的国家之一[2]。因此,深入探讨食管癌的发生发展机制具有重要意义。纺锤体与着丝粒相关蛋白3(spindle and kinetochore associated protein 3,SKA3/C13orf3)是SKA蛋白复合体的重要组成部分,是一种促进肿瘤恶性转化的新基因,其过表达与多种肿瘤的发生发展密切相关[3-4]。SKA3生物功能主要是参与调节染色体的分离以及有丝分裂过程中着丝粒的定位[5]。在前期研究中,我们首次报道了甲状腺乳头状癌中SKA3蛋白的表达及临床意义[6]。然而目前在食管癌相关文献中尚无SKA3基因的研究报道。本研究通过大数据队列研究及免疫组织化学染色实验,分析了SKA3基因在食管鳞状细胞癌中的表达意义及其与临床病理参数的关系。
1 材料与方法
1.1 材料收集本研究收集了广西医科大学附属肿瘤医院2018年6月至2022年3月期间行食管癌根治术切除的手术标本,其中包含75例食管鳞状细胞癌和配对的20例正常食管组织。本研究经过广西医科大学附属肿瘤医院医学伦理委员会审批,所有患者均已签署知情同意书(LW20222092)。
1.2 免疫组织化学染色免疫组织化学染色采用通用SP试剂盒(链霉卵白素-生物素法检测系统)(北京中杉金桥公司,#SP-9000型);一抗:SKA3抗体(北京博奥森公司,#bs-7848R,1∶400稀释)。免疫组化实验步骤按照SP-9000试剂盒说明书执行,采用枸橼酸抗原修复液直接水浴修复,采用DAB显色试剂盒(北京中杉金桥公司,ZLI-9017)显色。免疫组化染色结果判读:根据阳性染色的肿瘤细胞百分数打分:“0%”代表0分,“<10%”代表0分,“11%~25%”代表1分,“26%~50%”代表2分,“51%~75%”代表3分,“76%~100%”代表4分。染色强度:“0”(阴性),“1”(细胞质呈浅黄色),“2”(细胞质呈棕黄色),“3”(细胞质呈棕褐色)。免疫组化染色最终得分根据肿瘤细胞阳性表达百分数和染色强度的乘积计算得出。样本得分大于4分为高表达,小于等于4分为低表达。
1.3 样本队列数据来源公共队列样本数据来自肿瘤基因组图谱(TCGA) (https://portal.gdc.cancer.gov) 的食管鳞状细胞癌队列数据,该队列包含109例(肿瘤96例、正常对照13例)的mRNA测序数据和患者临床参数数据。基因芯片GSE23400(肿瘤51例、正常样本51例)、GSE45670(肿瘤28例、正常样本10例)及GSE161533(肿瘤28例、正常样本28例)的队列数据来自(GEO)数据库(https://www.ncbi.nlm.nih.gov/geo)(27008011)。
1.4 数据分析通过卡方检验分析SKA3蛋白在ESCC中表达水平及其与临床病理参数的关系。Linkedomics(http://www.linkedomics.org/login.php)软件筛选与SKA3共表达的正或负相关基因。DAVID软件对共表达基因进行基因本体论(Gene Ontology,GO) 富集分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genome,KEGG)通路分析。GEPIA(http://gepia.cancer-pku.cn) (28407145)软件分析SKA3 mRNA在多种常见恶性肿瘤中的表达以及在食管癌中表达与细胞周期关键调控蛋白CCND1、CDK1及CDK4的相关关系。
1.5 统计学方法利用SPSS 20.0软件进行统计学分析,卡方检验分析免疫组化SKA3蛋白在食管癌中高表达组和低表达组之间的统计学意义。t检验分析SKA3基因的表达在TCGA-ESCA队列和GEO高通量芯片队列中肿瘤组和正常对照组间的统计学意义。Spearman法筛选SKA3的共表达正负相关基因,筛选标准为:P<0.05,r>0.4或<-0.4。Spearman法分析SKA3与细胞周期调控蛋白的相关性。
2 结 果
2.1 SKA3蛋白在食管鳞状细胞癌组织中的表达免疫组化染色显示SKA3蛋白在食管鳞状细胞癌细胞质中呈棕黄色,如图1所示。相较于正常食管组织,SKA3蛋白在食管鳞状细胞癌组织中显著高表达(χ2=18.424,P<0.001)。见表1。

A:SKA3蛋白在食管鳞状细胞癌中高表达,细胞质呈棕黄色(IHC);B:SKA3蛋白在正常食管上皮组织几乎不表达(IHC)

表1 SKA3蛋白在食管鳞状细胞癌与癌旁正常组织中的表达[n(%)]
2.2 SKA3 蛋白与食管鳞状细胞癌患者临床病理特征的关系SKA3蛋白在食管低分化癌中表达增高(P<0.05)。比较不同特征 ESCC 患者 SKA3 高表达率,即神经侵犯患者SKA3 高表达率高于无神经侵犯患者(P<0.05)。在临床分期Ⅲ~Ⅳ期组中SKA3 表达高于Ⅰ~Ⅱ期组(P<0.05)。不同年龄、性别、肿物大小、浸润深度、淋巴结转移、癌栓浸润及肿瘤位置的 ESCC 患者 SKA3 蛋白高表达率差异均无统计学意义(P>0.05)。见表2。
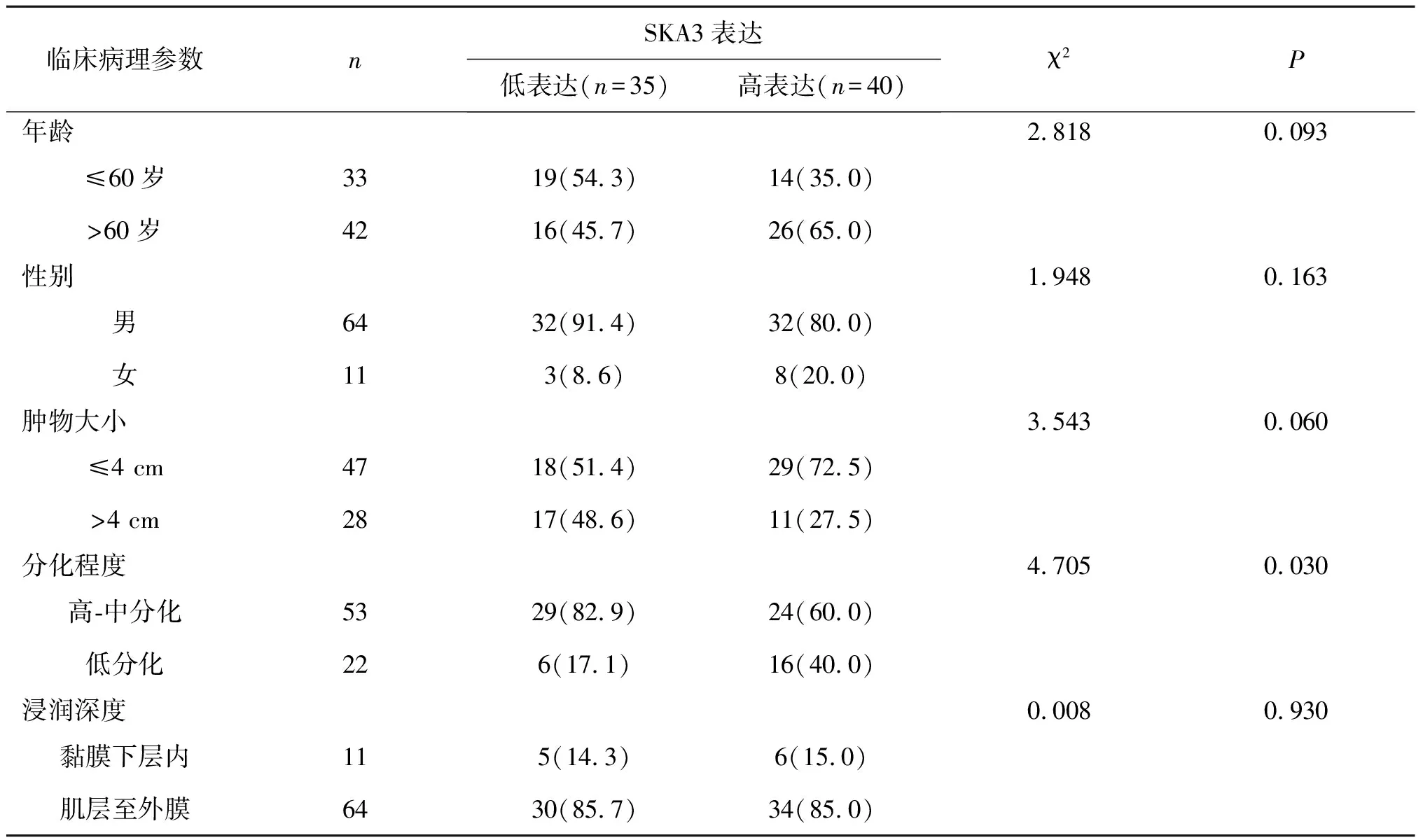
表2 SKA3蛋白的表达与食管鳞状细胞癌临床病理参数的关系[n(%)]
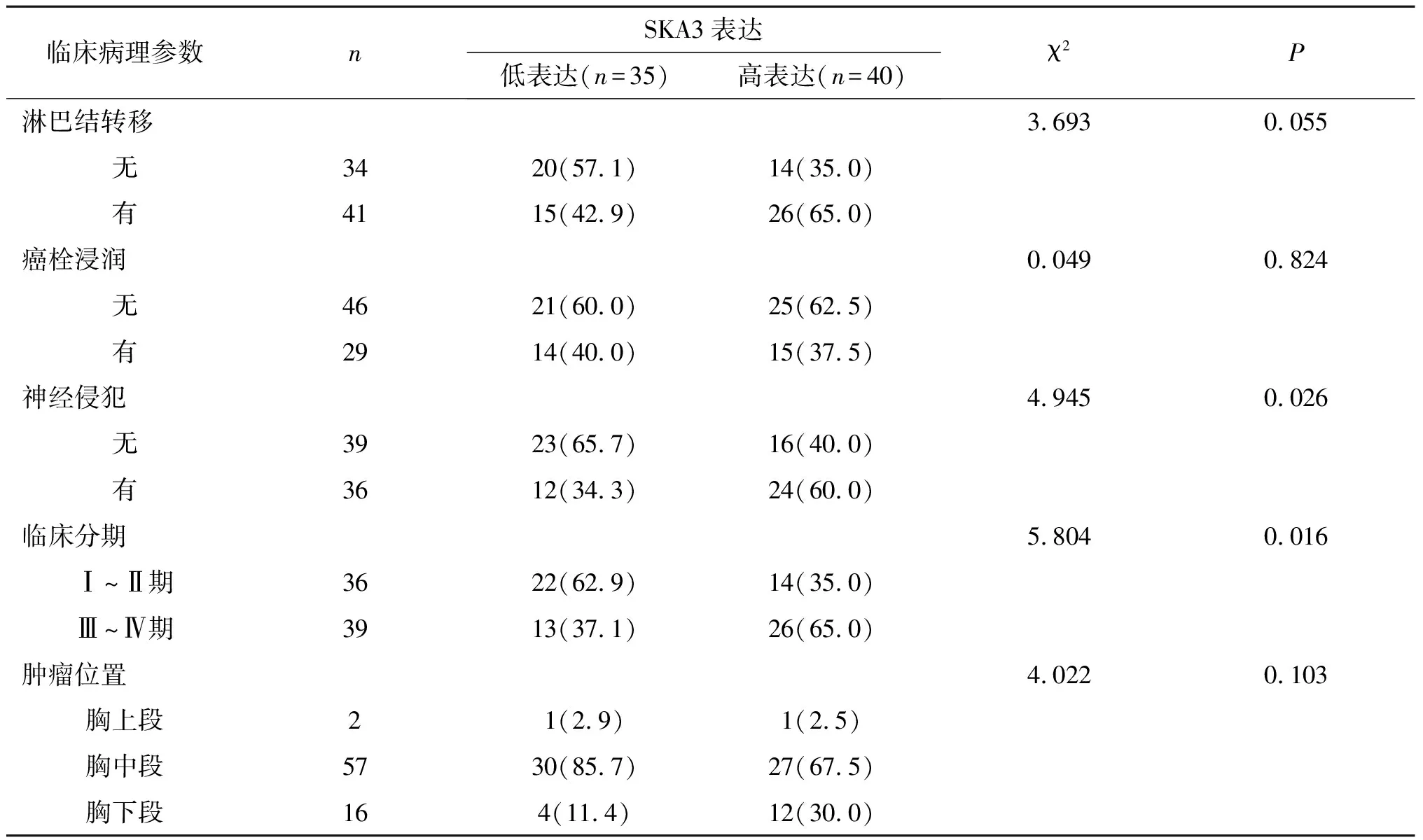
续表2
2.3 SKA3 mRNA在食管癌中的表达从TCGA数据库和GEO中获取4个队列共 203例食管鳞状细胞癌及102例正常对照组织的SKA3 mRNA表达数据,分别为TCGA-ESCC[癌(2.752±0.071),正常(0.991±0.238)]、GSE23400[癌(2.828±0.007),正常(2.775±0.008)]、GSE45670[癌(8.642±0.064),正常(7.628±0.326)]、GSE161533[癌(5.899±0.055),正常(5.561±0.042)]。结果显示,与正常食管组织相比,SKA3 mRNA在食管鳞状细胞癌均表达上调,差异有统计学意义(P均<0.001)。见图2。

A:TCGA数据库队列;B:GEO数据库GSE23400;C:GEO数据库GSE45670;D:GEO数据库GSE161533
2.4 食管癌中SKA3基因的共表达基因及其功能分析通过Linkedomics在线软件筛选食管癌中与SKA3基因共表达的相关基因。获得与SKA3共表达的基因772个,其中正相关基因567个(P<0.05,r>0.4) ,负相关基因205个(P<0.05,r<0.4)。GO富集分析显示,以上正相关共表达基因参与:细胞分裂、细胞周期、有丝分裂等生物学过程(biological process, BP);细胞成分(cellular component, CC)主要富集于细胞浆、细胞核形成、着丝粒组成等;分子机制(molecular function,MF)方面主要参与结合蛋白质、poly(A) RNA 结合、ATP结合等。KEGG通路分析显示这些基因主要富集在:DNA复制、细胞周期、范科尼贫血(Fanconi anemia)通路、基因错配修复、核酸剪接体等路径。
2.5 食管癌中SKA3基因表达与细胞周期调控基因的关系如图3示:在食管癌中SKA3基因的表达与细胞周期调控基因CCND1(r=0.17,P=0.015)、CDK1(r=0.71,P<0.001)及CDK4(r=0.52,P<0.001)均呈正相关,差异均有统计学意义。
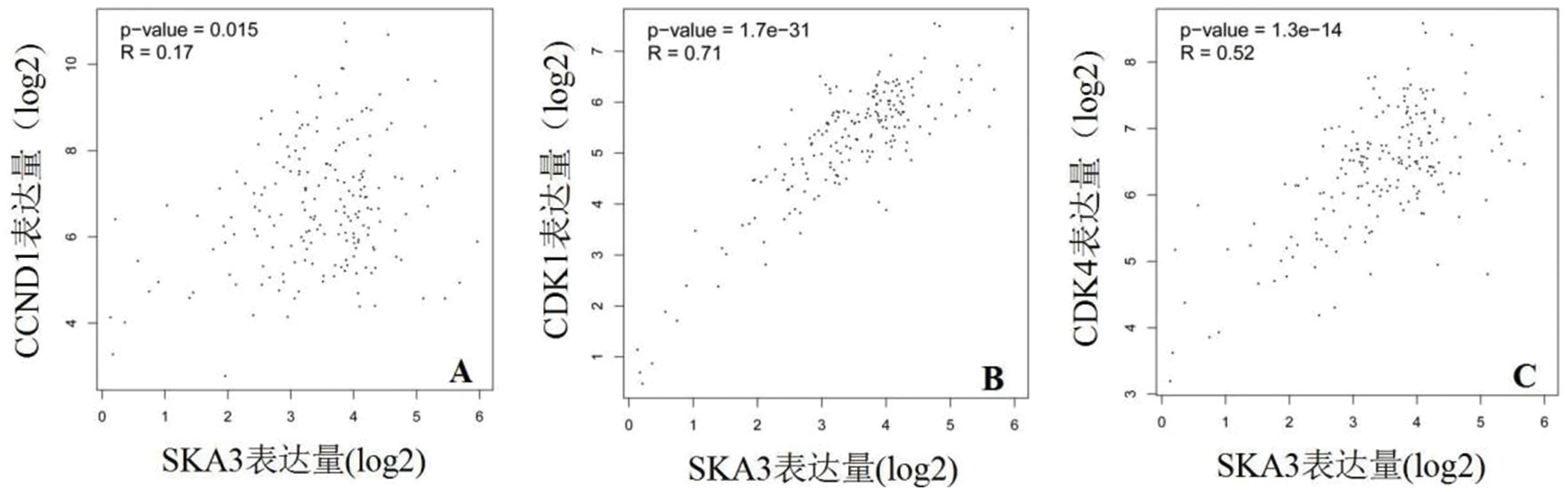
A:SKA3与CCND1呈正关性;B:SKA3与CDK1呈正关性;C:SKA3与CDK4呈正关性
3 讨 论
许多研究证实,SKA3在细胞增殖、侵袭、迁移及肿瘤发生等过程中发挥重要作用,在多种恶性肿瘤中表达上调[7-10]。基于TCGA数据库,我们发现SKA3在诸如乳腺癌、肺腺癌、胃腺癌、结肠腺癌及脑胶质母细胞瘤等中均为高表达。在本研究中,我们首次通过TCGA及GEO大样本的生物信息数据库,提取了4组独立的ESCC的队列数据,分析SKA3 mRNA在食管鳞状细胞癌及食管正常组织中的表达,发现SKA3 mRNA在食管鳞状细胞癌中表达上调。进一步对课题组收集的组织进行免疫组织化学染色,结果显示SKA3蛋白在食管鳞状细胞癌中亦显著高表达,免疫组化蛋白表达结果与我们采集的4个生物信息表达队列的结果一致,支持SKA3在食管鳞状细胞癌中高表达的结论。SKA3蛋白在晚期食管鳞状细胞患者中的表达显著高于早期患者,且分化越差,有神经侵犯的患者中SKA3蛋白表达越高,这均说明SKA3可能与食管鳞状细胞癌的进展和复发有关。以上结果提示我们,SKA3基因在食管鳞状细胞癌的发生进展中具有重要作用。
共表达基因的GO功能富集分析显示,多种生物学进程和通路与SKA3基因相关。我们发现SKA3基因参与细胞分裂、细胞周期、有丝分裂等多种重要的生物学过程。研究表明,SKA3蛋白是纺锤体和着丝粒相关蛋白复合体的重要组成亚基,其主要功能是确保有丝分裂中精确的染色体分离和稳定微管-动粒的活动,敲除SKA3可激活纺锤体装配检查点,姐妹染色单体失去黏附,导致中期有丝分裂停止[11-12]。SKA3通过NDC80复合物控制和调控有丝分裂,也调控细胞增殖和凋亡。SKA3潜在作用介导了肿瘤细胞周期和进展[13]。HOU等研究者发现,在肝细胞癌中SKA3可通过激活周期蛋白CDK2/P53磷酸化促进肿瘤细胞的增殖[14]。此外,SKA3还可以通过阻止PLK1蛋白的降解影响乳腺癌细胞的生长[10],并通过激活EGFR-PI3K-Akt通路促进肺腺癌细胞的转移[15]。更有趣的是,研究还发现靶向SKA3可影响PLK1-Akt通路轴心调控糖代谢抑制喉癌的化疗抵抗[16]。ZHAO等[17]研究表明,circ-SKA3作为癌基因通过诱骗miR-326增加髓母细胞瘤的表达,从而促进髓母细胞瘤的发展。SKA3可能通过细胞周期、DNA损伤、激素雄激素受体、激素雌激素受体、PI3K/Akt、Ras/MAPK等因素影响肾乳头状细胞癌预后不良[18]。我们通过KEGG分析发现SKA3主要参与DNA复制、细胞周期、基因错配修复等分子通路。相关分析表明SKA3与细胞周期调控因子CCND1、CDK1及CDK4存在正相关关系。SKA3与CDK1的磷酸化对于有丝分裂过程中SKA复合物的着丝点定位至关重要,基因相互作用通过调控细胞周期促进细胞增殖[14]。综上结果表明SKA3作为SKA家族的重要成员,参与了细胞周期的调控,可能是通过影响细胞周期蛋白调控细胞周期进程,在肿瘤的形成和增殖中发挥重要作用。而SKA3在食管鳞状细胞癌中的促癌机制研究仍需大量的体内外实验的佐证。
总之,本研究通过大数据库的筛选和免疫组化实验验证,证实SKA3在食管鳞状细胞癌中显著高表达,SKA3高表达可能与食管鳞状细胞癌发生发展密切相关,并可能通过调控细胞周期进程而促进肿瘤的进展,这为食管癌的发生发展分子机制研究提供了新思路。
