植物病原菌氧化固醇结合蛋白的功能及其靶向抑制剂研究进展
2023-04-18张芷萌刘晓飞刘颖超董金皋
刘 静, 郝 楠, 张芷萌, 刘晓飞, 刘颖超, 赵 斌, 董金皋
(河北农业大学 华北作物改良与调控国家重点实验室,河北 保定 071000)
绿色新农药的开发和利用有利于农业增产增收和可持续发展,而基于靶标蛋白的合理分子设计是新农药创制中最为活跃的研究领域[1-2]。目前的新农药小分子设计还依赖于已知的农药靶标蛋白,但大量、多次、重复使用单一靶标农药,无疑会增大有害生物的抗药性风险,即使轮换使用靶标相同或近似的农药也会增加有害生物的抗药性风险。因此,基于新的作用靶标开发与环境相容的绿色新农药,不仅可以从根本上解决有害生物的抗性问题,而且更具有重要的现实意义[3]。
氧化固醇结合蛋白 (oxysterol-binding protein,OSBP) 是近年来发现的一种新型卵菌抑制剂作用靶标,并且在不同物种中拥有自己特异的底物,这就为农药的选择性提供了最佳设计方案。杜邦公司开发的超高效卵菌抑制剂氟噻唑吡乙酮目前已成为氧化固醇结合蛋白抑制剂的成功典范[4],但是氟噻唑吡乙酮的超高活性仅限于针对卵菌,对植物病原真菌的活性较差,因此,如何有效利用氧化固醇结合蛋白新靶标来开发超高效广谱抗菌化合物,将是未来农药设计的热点。本文将详细阐述氧化固醇结合蛋白家族在植物病原菌中的功能,并探讨其晶体结构与底物的结合特征,为靶向杀菌剂开发提供科学依据。
1 氧化固醇结合相关蛋白在植物病原菌中广泛存在
氧化固醇结合相关蛋白 (oxysterol binding protein-related proteins, ORPs;在卵菌中被称为OSBP) 包含一个保守的脂质结合蛋白家族,从属于脂质转运蛋白 (lipid transfer proteins, LTPs) 超家族[5-8],在酵母、植物和哺乳动物中高度同源。ORPs/OSBP 的核心功能是在细胞膜之间对脂质分子进行非囊泡转运,但对膜间的磷脂酰肌醇四磷酸 (phosphatidylinositol 4-phosphate, PI(4)P) 浓度梯度具有严重依赖性;除此之外,它在信号转导、脂质代谢等过程中也发挥重要作用[9]。近年来,随着研究人员对氧化固醇结合蛋白研究的不断深入,该蛋白家族各成员间的生物学功能也将日益清晰,特别是在人类和酵母中的相关研究 (例如ORP5/8、Osh3/4 等)。
1.1 氧化固醇结合相关蛋白家族在植物病原菌中的同源性
氧化固醇结合相关蛋白在植物病原菌中分布广泛。目前关于氧化固醇结合蛋白的研究主要集中在构巢曲霉、黄曲霉和卵菌中,植物病原菌中常见的成员及其大小见表1。在卵菌中仅仅存在1~2 个成员,但在真菌中存在7 个及以上并形成了5 个亚家族,且与卵菌氧化固醇结合蛋白家族亲缘关系较远。
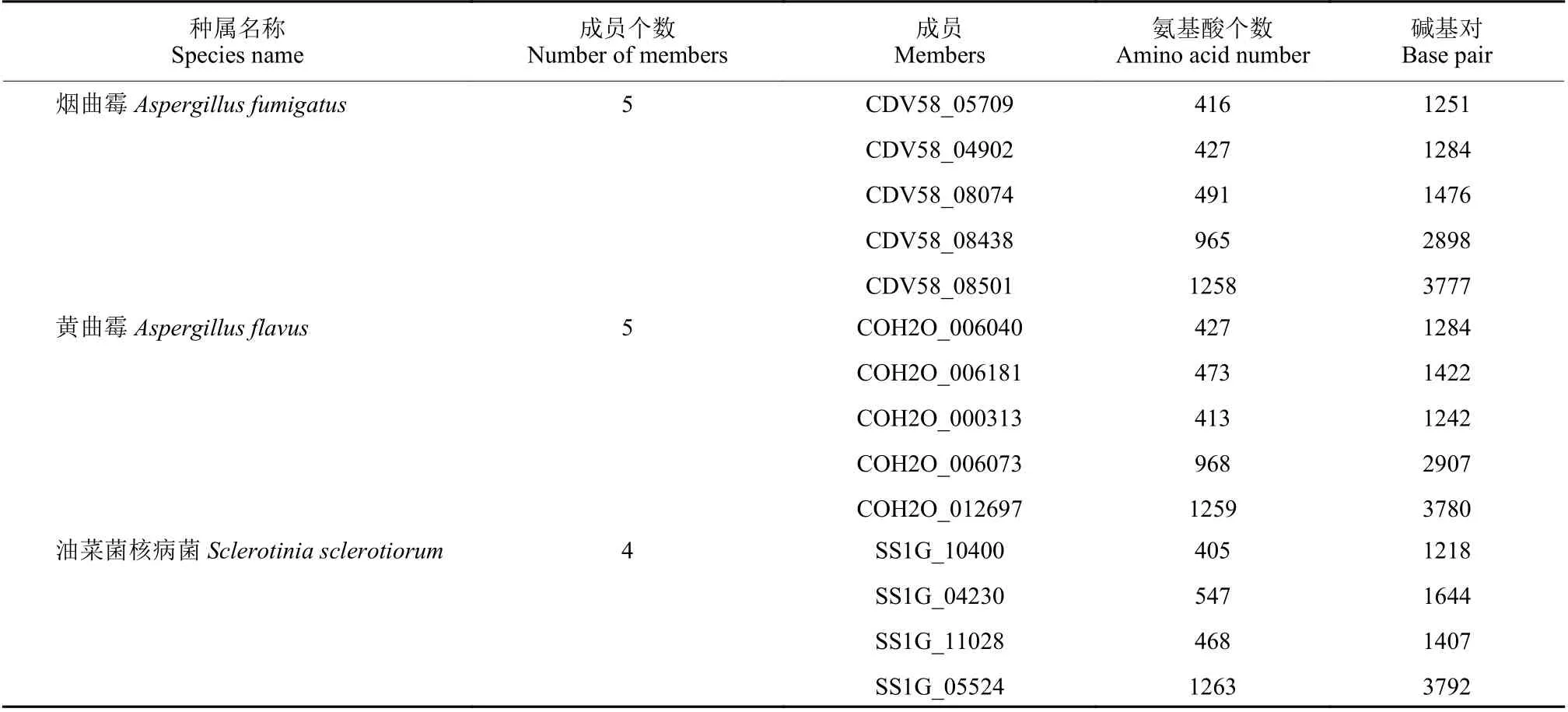
表1 常见植物病原菌中的氧化固醇结合蛋白Table 1 Oxysterol-binding proteins in some common plant pathogens
1.2 氧化固醇结合蛋白家族的结构
氧化固醇结合蛋白家族存在两种分类系统。一种是根据氧化固醇结合蛋白相关结构域 (OSBPrelated domain,ORD 结构域) 和PH 结构域(pleckstrin homolgy domain, PH domain) 序列差异进行分类,例如人类中的12 个ORP 成员可分成6 个亚家族:亚家族Ⅰ (OSBP 和ORP4)、亚家族Ⅱ (ORP1 和ORP2)、亚家族Ⅲ (ORP3、ORP6、ORP7)、亚家族Ⅳ (ORP5 和ORP8)、家族Ⅴ(ORP9) 和亚家族Ⅵ (ORP10 和ORP11)。在每个亚家族间ORD 结构域的氨基酸序列相似性高达70%以上,而在不同的亚家族间ORD 序列的相似性较低。在酿酒酵母中含有7 个Osh 蛋白,它们被分为3 个亚家族:Osh1p(Swh1p) 和Osh2p、Osh4p(Kes1p) 和Osh5p(Hes1p) 以及Osh6p 和Osh7p (图1)[15]。另外一种是目前较为通用的分类方式,它根据蛋白质结构域的差异将氧化固醇结合蛋白家族分为2 个亚家族:一类只含有ORD 结构域,被称作短链O R P s;另一类除了含有ORD 外,还含有N 末端结构域,这种被称作长链ORPs。Osh1-Osh3 3 个Osh 蛋白为长链ORPs,它们除了含有ORD 结构域外,都还包含1 个PH 结构域,其中Osh1 和Osh2 还分别含有2 个ANK 重复结构域,Osh3 含有一个GOLD 结构域。Osh4-Osh7 这4 个成员只含有ORD 结构域,可归为短链ORPs。在大多数真核生物中,N 末端结构域包含多个不同部分,分别行使不同功能,比如ORD 结构域、PH 结构域、FFAT 基序、锚蛋白重复序列和GOLD 结构域等。
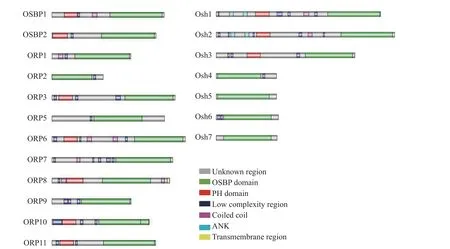
图1 人和酿酒酵母中的ORPs 家族结构分析[15]Fig.1 The human and yeast ORPs families[15]
ORPs 蛋白都含有一个调节脂质结合的C 端ORD 结构域,而在ORD 结构域N 端还存在一个类似桶状结构的标志性保守序列“EQVSHHPP”,它在所有ORPs 蛋白家族中都存在[16-17]。例如,Osh3 的ORD 结构域的N 端形成了一个β-桶状结构,固醇分子通过这个桶状结构被运输到其他细胞组分[18]。大多数真核生物氧化固醇结合蛋白家族的N 端都包含一些重要的功能结构域[19],比如PH 结构域、FFAT 基序 (FFAT motif)、锚蛋白重复结构域 (ankyrin repeats domain,ANK) 以及黄金结构域 (GOLD domain) 等,这些结构域在甾醇运输、信号转导、脂质代谢等方面执行不同的功能。
ORPs 家族蛋白主要位于胞浆中,它通过特定的靶向结构域 (如PH 结构域) 与膜室相关联[18]。PH 结构域由100~120 个氨基酸组成,它们都具有由7 股两个反平行β折叠和C 端两性螺旋组成的共同结构[20]。由于PH 结构域中的关键残基和连接β折叠的长度变化,不同PH 域之间的序列保守性较低,仅具有7%~30%的一致性[21-22],但在大多数已知的ORP 家族蛋白晶体结构中,PH 结构域却显示出高度的结构相似性[23]。不同物种的磷脂酰肌醇磷酸 (phosphatidylino-sitol phosphates,PIPs) 富集在不同的细胞膜上,PH 结构域与高尔基体或细胞膜相互作用将PIPs 进行转运。除此之外,PH 结构域与特定PIPs 结合还可以促进这些脂质转移蛋白与细胞器内膜的相互作用,这种双向的生物学功能在ORPs[24-28]、CERT[29]和FAPP2(Four-phosphate adaptor protein 2) 中较为常见。OSBP 和ORP9L 的PH 结构域通过与PI(4)P 相互作用将蛋白质招募于高尔基体[30]。同样,Osh1 的PH 结构域也与PI(4)P 相互作用,并靶向高尔基体[24]。ORP1L 的PH 结构域靶向细胞核,而ORP3 的PH 结构域[31-32]、ORP6 和ORP7 的PH结构域定位于质膜 (plasma membrane, PM)[33]。ORP的膜靶向性也与其它结构域相关,如FFAT 基序和ANK 重复序列。ANK 区域和ORP1L的PH 结构域协同作用,将蛋白质定位于核体附近[34]。通过PH 结构域对PI(4)P 和Arf-GTP 的检测,对反式高尔基网络结构(trans-Golgi network,TGN)上的OSBP 进行了精确定位[35-36]。经蛋白序列比对发现,人类和酵母中的所有长链ORPs 都包含PH 结构域、FFAT 基序、锚蛋白重复序列、跨膜区和GOLD结构域等多个靶向结构域。
FFAT 基序具有保守的“EFFDAXE”序列,可作为靶向信号将蛋白定位于内质网 (endoplasmic reticulum,ER) 表面和核膜上[37-38]。许多含有F F A T 基序的长链O R P s (包括人的O S B P、ORP1、ORP2、ORP3、ORP4、ORP5、ORP6、ORP7 和ORP9) 被招募到内质网的表面[32-33]。FFAT 基序与囊泡膜蛋白 (vesicle associated membrane protein,VAMP) 相关蛋白 (VAMP associated proteins,VAPs) 结合后,VAPs 通过C 末端跨膜结构固定在内质网上。Scs2 是酵母VAP 同系物,它可与包括Osh1、Osh2 和Osh3 在内的多个含有FFAT 基序的ORPs 结合[39]。Scs2缺失后,酵母将错误的FFAT 定位到细胞质[32-33]。缺少FFAT 基序的长链ORP8 在其C 末端形成一个跨膜螺旋,这一跨膜区域会将ORPs锚定在内质网膜上,从而取代FFAT 基序的作用[40]。
ANK 是由33 个氨基酸组成的串联重复模块,折叠成两个由β-折叠分隔的反平行α-螺旋结构[41]。例如ORP1L、Osh1 和Osh2 等一些OPRs 蛋白均含有该结构域,它在蛋白质间的相互作用中执行重要功能[42-43]。酵母Osh1 中的锚蛋白结构域与Nvj1 (nucleus-vacuole junction,Nvj) 相互作用,Nvj1 是核膜外的一种完整膜蛋白,是Osh1定位到核-液泡连接处所必需的。这对于Osh1 在细胞核膜与液泡之间通过ORD 结构域运输固醇(例如胆固醇、麦角甾醇及其它氧化固醇) 和PIPs具有重要作用。ORP1L 中的锚蛋白重复序列与PH结构域协同作用,通过与内质体GTPase-Rab7 相互作用,有助于该蛋白定位至内质网和膜接触位点中,并执行调控脂质运输的功能[44-45]。
GOLD 结构域是在真核高尔基体和脂质运输蛋白中发现的,它通常介于90~150 个氨基酸之间。在酵母长链ORPs (Osh3) 的N 端,存在一个与其它蛋白质结合的GOLD 结构域[46]。通过生物信息学分析可知GOLD 结构域可形成一个紧凑的β-折叠[47],但目前还没有发现与Osh3 同源的GOLD 结构域及其生物学功能。
1.3 氧化固醇结合蛋白家族的晶体结构
氧化固醇结合蛋白中解析的第1 个晶体结构是酵母Osh4 (也称为Kes1),也是目前研究最为深入和广泛的。Osh4 含有434 个氨基酸,包含核心ORD 结构域,可与胆固醇、麦角甾醇和其他含氧甾醇等配体结合。Osh4 在由顶部封闭的内腔中结合单个甾醇,甾醇的3β-羟基朝向疏水通道的底部,与口袋底部的极性残基直接接触,但氧化固醇中的羟基并不直接与蛋白质间相互作用,表明Osh4 可以容纳结构类似的多种甾醇,甾醇的疏水侧链与顶部结构相连,形成闭合构象 (图2A);顶部的开关通过“打开和关闭”的方式来吸收或释放配体,当Osh4 空载时,N 末端盖子容易发生蛋白质水解,这时顶部开关是打开的,便于配体摄取(图2B)[48];但Osh3 的ORD 疏水空腔很小,不会与甾醇结合 (图2C)[16,48];通过Osh 同系物与PI(4)P的复合物晶体结构可以看到,PI(4)P 结合Osh3、Osh4 和Osh6 的结构是相同的,均是竞争性结合与甾醇相同的内部结合位点 (图2D);Osh4 通过酰基链来调节PI(4)P 与其空腔的结合 (图2E),使PI(4)P 的酰基链与疏水通道发生松散的非特异性相互作用 (图2F)[48]。Kes1/Osh4 结合蛋白的结构未知,后续通过对其深入研究将有助于确定Kes1/Osh4 调节囊泡转运的分子机制。
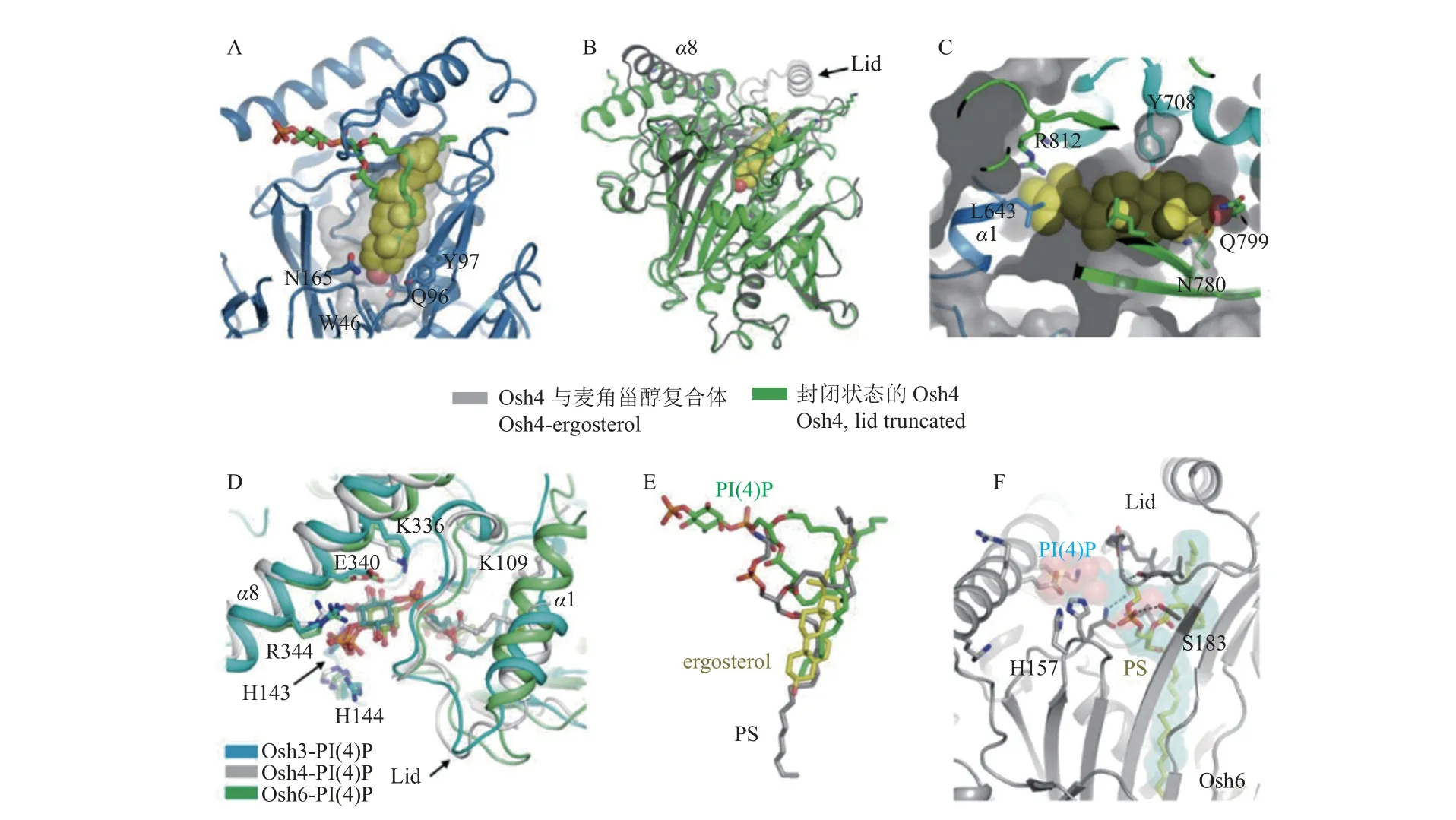
图2 ORD 与配体结合模式[55]Fig.2 The binding model of ligand with ORDs[55]
目前已经研究报道的OSBP/ORPs 的脂质配体主要是PI(4)P 和磷脂酰丝氨酸 (phosphatidylserine,PS),其中PI(4)P 是所有ORPs 的共同配体[49-51],ORP10 的配体PI(4)P 和PS 在体外脂质体之间以及内质网和其它细胞器之间表现出脂质交换活性[52];缺乏ORD 结构域的ORP6 突变体可导致PS 标记的偏移,影响PI4P 和PS 在内质网和质膜接触位点的转运[53]。酵母和人类ORPs 中保守的基本功能是由ORD 结构域的PI(4)P 结合介导的,说明非囊泡性PI(4)P 转运是真核生物中ORPs 的基本功能[54]。
2 氧化固醇结合蛋白在植物病原菌中执行重要生物学功能
2.1 甾醇分子由内质网向线粒体转运的动态机制
尽管特定的脂质合成反应发生在许多不同的细胞器中,但细胞脂质合成的主要部位是内质网。蛋白质在细胞器中的分布由特定的蛋白质基序介导,并通过化学修饰或构象变化进行调节。每个细胞器都有其特有的脂质成分,从而确保膜相关生化反应的进行,如离子运输、各种底物的代谢和信号转导等[56]。
ORPs 在细胞内参与脂质转运的证据最初是从酵母Osh 蛋白的研究中获得的。在酿酒酵母中,单独敲除7 个Osh 基因后其表型未发生显著变化,而当其全部敲除后则不能正常生长,这表明Osh 蛋白在维持生存能力的核心功能中是相互协同的[57]。Drin 团队发现,Osh4 以相互排斥的方式结合麦角甾醇和PI(4)P,并在不同膜之间对甾醇和PI(4)P 进行反交换[58]。因此,他们提出了一个模型,即以Osh4 作为PI(4)P 和甾醇交换剂,以PI(4)P 梯度作为能量源,对脂质分子进行浓度梯度运输,并在体外得到了试验证实 (图3)[55,59]。PI(4)P 在反式高尔基体和质膜的胞质表面富集,但不存在于内质网中,这意味着膜室之间存在巨大的PI(4)P 浓度梯度。在酵母中,这种梯度由磷脂酰肌醇激酶4 (phosphatidy linositol 4 kinase)Pik1 和Stt4 维持,分别通过反式高尔基体和质膜中磷脂酰肌醇 (phosphatidylinositol,PI) 的磷酸化生成PI(4)P[60];相反,内质网中的主要磷酸酶Sac1 会将PI(4)P 降解为PI;同时,Osh4 通过摄取PI(4)P 来下调细胞PI(4)P 水平[61],并将从内质网中提取的甾醇转移到反式高尔基体和质膜中[62]。Osh4 从内质网中摄取甾醇,然后在高尔基体中对甾醇和PI(4)P 进行反交换,随后将PI(4)P 转运至内质网。Sac1 在内质网中将PI(4)P 转化为PI,从而维持甾醇/PI(4)P 转运循环[6,55]。酵母Osh 蛋白的研究为其它真核生物ORPs 的脂质分子转移机制提供了证据,Du 等通过原核表达获得ORPs 家族重组蛋白,并通过甾醇转移试验证明OSBP、ORP9L和ORP5 的ORD 结构具有体外甾醇转移活性[63]。此外,细胞内ORPs 表达水平的调控也会影响细胞内甾醇的转运。综上,ORPs 的一个共同特征是结合PI(4)P 和甾醇分子并将其在内质网与质膜或反式高尔基体之间进行反向运输[64]。
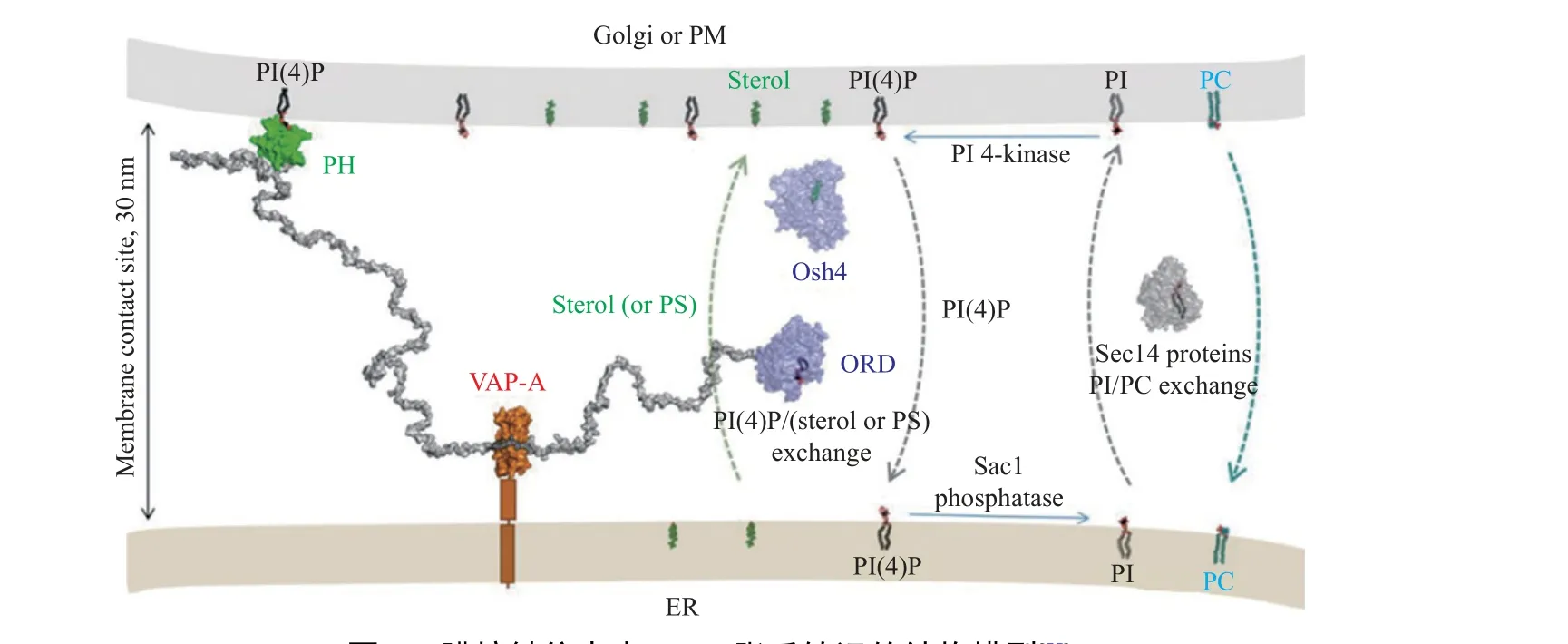
图3 膜接触位点中ORP 脂质转运的结构模型[55]Fig.3 Structural model of lipid transport by ORP homologues in a membrane contacts site[55]
2.2 非囊泡运输
在细胞内脂质的运输分为2 种形式:囊泡运输和非囊泡运输。一直以来,囊泡运输被认为是细胞内脂质运输的主要形式。然而,近期的研究表明,非囊泡运输也在脂质运输中发挥着重要作用[65-67]。在非囊泡运输过程中,膜接触位点起着关键作用[68-69]。内质网是脂质代谢最重要的单细胞器,并且大多数脂质生物合成酶定位于内质网中。虽然内质网的一些脂质运输是由膜结合的囊泡介导的,但对于不参与囊泡运输的细胞器 (例如线粒体) 和绕过囊泡的脂质,都需要重要的非囊泡运输途径[70-71]。这些脂质被直接输送到分泌途径的后期,在那里发挥作用[72-73],或者它们必须快速地选择性地被替换[74]。
膜接触位点 (membrane contact site, MCS) 是细胞内膜隔室之间形成的紧密区域,并且膜间存在10~30 nm 的间隙[75-76]。此外,还富含一些对高尔基体功能和结构具有重要作用的脂质转移蛋白,例如氧化固醇结合蛋白、神经酰胺转运蛋白、膜磷脂转移蛋白等[77-78]。不同氧化固醇结合蛋白家族的膜接触位点有所差异但却具有相似的功能,主要在MCS 处进行脂质代谢与物质运输。虽然这种运输机制尚不清楚,但也表明了MCS 的作用。MCS 蛋白质可能分为两类:一类是使两个膜接触的蛋白质。在这一结构类别中,除了细胞核与液泡之间的桥联功能外,其余大部分功能都已明确[79]。另一类蛋白质是脂质转移蛋白,它们在MCS处与供体和受体膜相互作用发挥功能 (图4)。脂质结合蛋白与其配体结合并穿过MCS 的狭窄间隙。具有双特异性靶向的脂质结合蛋白可以引导两种特定膜之间的扩散,如果它能够同时结合两个受体,那么其对膜的亲和力将增加很多倍,对MCS也具有了更强的靶向性。大多数ORPs 向内质网和反式高尔基体转运,并在膜接触位点附近聚集,进而在非囊泡运输中起重要作用。
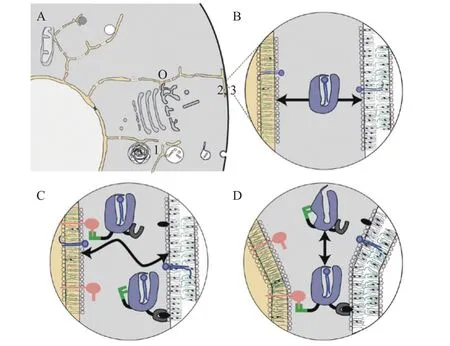
图4 作用于膜接触部位的脂质结合蛋白[80]Fig.4 Lipid-binding proteins acting at membrane contact sites[80]
2.3 氧化固醇结合蛋白在病菌致病力中的作用
氧化固醇结合蛋白广泛存在于真核生物中,但其底物在不同物种中是不同的。在哺乳动物中为胆固醇,在真菌中为麦角甾醇,而在植物中则为β-谷甾醇 (图5)[81]。麦角甾醇主要在内质网膜上从头合成,并转运到质膜[82-83],其中氧化固醇结合蛋白在内质网膜和质膜之间的甾醇转运中起直接作用。丝状真菌是通过连续的顶端伸长和分枝生长形成菌丝和菌丝体,而麦角甾醇在这一过程中扮演着十分重要的角色,氧化固醇结合蛋白则负责麦角甾醇的连续运输[84],也在细胞信号传导和细胞极性生长中发挥重要作用[61]。当麦角甾醇合成和转运受到抑制时,菌丝就会产生顶端膨大、分枝畸形等症状从而致使生长受到抑制[85]。
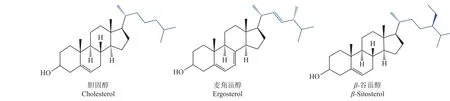
图5 不同物种中的甾醇结构Fig.5 Sterol structure in different species
氧化固醇结合蛋白在丝状真菌中广泛存在,并且是特异保守的[86]。例如在构巢曲霉中存在5 个编码Osh 基因,AnoshA、AnoshB、AnoshC、AnoshD 和AnoshE,它们在细胞内定位不同,从而在不同的细胞器之间行使运输磷脂和固醇的功能。它们都具有一个ORD 结构域,并且AnoshC在真菌生长和发育中扮演重要角色,该结构域敲除后生长受到严重抑制。研究人员通过缺失AnoshE,发现突变型与野生型相比分生孢子有明显降低,说明Osh 蛋白能够促进分生孢子的生成[10]。在稻瘟病菌中存在6 个ORPs 成员,范军课题组研究发现,MoORPs 可以增强病原体毒力并激活植物免疫。同时敲除MoORP1 和MoORP3,可消除真菌菌落径向生长;而同时敲除MoORP1 和MoORP2,则会损害真菌对大麦和水稻的毒力[14]。
ORPs 基因在真核生物中具有广泛的保守性,其基因组中编码多个同源ORPs 基因。有人认为酿酒酵母的Osh 基因具有重叠的基本功能[87],缺乏Osh 蛋白家族会导致细胞失去正常极化,生长异常[88]。任何一个家族成员都在保持细胞活力方面发挥着作用,例如仅Osh4p 就足以维持适当的细胞极化[89]。此外,研究证明哺乳动物和酵母中的ORPs 的一个亚群在体外脂质体之间运输固醇[90],酵母Osh6 和Osh7 以及哺乳动物ORP5 和ORP8介导着磷脂酰丝氨酸 (PS) 从内质网到质膜的运输[91]。据报道,Osh6、Osh7 和ORP5 不与固醇结合[44]。然而,Osh6 和Osh7 被认为在体外脂质体之间运输胆固醇,尽管比Osh4 和Osh5 慢[92]。此外,ORP5 和ORP8 被认为在体外结合或运输固醇[93]。考虑到ORPs 家族内分子和功能的多样性[94],以及ORP 在细胞周期和发育中具有不同的作用[95],我们认为仅将一种功能归于该蛋白质家族过于简单。从大量膜脂的运输到信号脂质的调节反应,ORPs 的功能将根据其配体的性质而变化。为全面了解这些蛋白质在细胞生理学中的作用,首先需要确定ORPs 家族成员的结构,确定其在细胞内的相互作用蛋白,进而阐明ORPs 在细胞中的功能。
3 基于植物病原菌氧化固醇结合蛋白的靶向杀菌剂设计合成研究初探
新靶标的发现是农药创制的开始,此阶段工作内容主要有靶标识别和结构解析、靶向活性化合物的筛选以及先导化合物的识别优化等3 方面[96]。靶标识别和验证是农药创制的第1 步,一旦确定了靶标,往往需要通过基因敲除或RNA 干扰等研究手段进行确认,证实靶标蛋白的活性及其在致病过程中的作用。当靶标被发现并确认后,通常会通过蛋白晶体解析的方法获得其靶酶结构,进而利用基于蛋白结构和基于药效团的虚拟筛选方法,从数以百万计的小分子化学库中高通量筛选活性化合物,通过聚类分析进行化合物的分类,并通过结合能的比较确定先导化合物,得到高效先导化合物后即可进入到合成优化阶段[97]。
在医药开发领域中,目前已存在多种以氧化固醇结合蛋白为靶标的抗白血病和抗病毒药物。例如ORP4 是一个与细胞生长调节密切相关的氧化固醇结合蛋白成员。研究发现,吡嗪双甾体类天然产物Ritterazine B 正是一种以ORP4 为靶标的白血病抑制剂[98];肠道病毒复制天然产物抑制剂OSW-1 和TTP-8307 都能够通过抑制氧化固醇结合蛋白的表达从而发挥作用[99-100]。
在农药开发领域中,国外农药企业巨头正在积极布局氧化固醇结合蛋白抑制剂开发。2008 年杜邦公司创制出具有超高活性的卵菌氧化固醇结合蛋白抑制剂氟噻唑吡乙酮[101-102],它能显著抑制霜霉Pseudoperonospora cubensis游动孢子释放、孢子萌发和病斑扩展等致病过程,还能有效抑制向日葵霜霉病菌P.halstedii、罗勒霜霉病菌Peronospora belbahrii和烟草疫霉P.nicotianae等[103]。杜邦公司基于卵菌氧化固醇结合蛋白,并在保留噻唑哌啶环及异噁唑环的条件下,发现化合物的1[90]和2[104](图6) 在40 mg/L 时对葡萄霜霉病和马铃薯晚疫病的防效均为100%。化合物3 和4 对根肿菌纲、卵菌纲、壶菌纲、接合菌纲、子囊菌纲、担子菌纲和半知菌纲具有较好杀菌活性[105];化合物5 对致病疫霉P.infestans和轴霜霉Plasmopara.vitcola有较好的保护活性[106]。化合物6 可控制担子菌纲、子囊菌纲、卵菌纲和半知菌纲等广谱的植物真菌病害[107]。这些化合物在结构上继承了氟噻唑吡乙酮的骨架结构4-(噻唑-2-基)哌啶 (图6),表现出不同程度的杀菌能力。此外,先正达公司Sulzer 等也开启了基于氧化固醇结合蛋白的杀真菌化合物设计研究,并在第十四届IUPAC 农药化学国际会议上做了相应报告[108]。由此可见,氧化固醇结合蛋白已成为了国际农药研究的热点。此外,我国科学家也在氧化固醇结合蛋白抑制剂开发中做出了较大贡献,华中师范大学杨光富团队和西北农林科技大学刘西莉课题组通过整合分子对接、分子动力学模拟和分子力场泊松玻尔兹曼表面积 (Molecular Mechanics/Poisson Boltzmann Surface Area) 计算,系统地研究了辣椒疫霉氧化固醇结合蛋白与氟噻唑吡乙酮的相互作用,并以哌啶基噻唑异噁唑啉为先导,设计合成并发现了对辣椒疫霉高活性的目标分子[109];商品化OSBP 抑制剂氟噻唑吡乙酮登记为卵菌病害防治药剂,为拓展靶向氧化固醇结合蛋白类药剂的杀菌谱,南开大学范志金课题组基于真菌氧化固醇结合蛋白和噻唑哌啶类先导结构开展的分子设计合成,发现一类结构更简单的异噻唑联噻唑哌啶类高活性目标分子,大部分化合物对立枯丝核病菌Rhizoctonia cerealis、花生褐斑病菌Cercospora arachidicola、黄瓜灰霉病菌Botrytis cinerea和小麦赤霉病菌Fusarium graminearum具有广谱杀菌活性,且优于阳性对照氟噻唑吡乙酮,研究结果拓展了氧化固醇结合蛋白从靶向卵菌到真菌病害的新杀菌剂创制[110-111]。
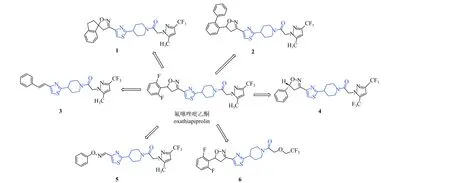
图6 卵菌氧化固醇结合蛋白抑制剂开发Fig.6 Oomycete oxysterol-binding protein inhibitor development
4 总结和展望
氧化固醇结合蛋白及其相关蛋白作为脂质转移蛋白通过运输交换脂质,可以在内质网和高尔基体之间交换PI(4)P 和固醇,促进脂质的代谢。目前,相对于酵母,一些丝状真菌中的Osh 蛋白质、哺乳动物中的ORPs 家族蛋白质的工作环境更加复杂,除了ORP5/8 的ORD 结构域之外,其他ORPs 的ORD 结构域都是未解之谜;细胞内的膜接触位点虽然已被证明对于细胞的生命活动极为重要,特别是对于氧化固醇结合蛋白参与脂质代谢所提供的环境支撑作用,但是其具体的生物学意义仍有待去探索验证;此外,真菌氧化固醇结合蛋白的高级结构尚未被解析,这极大地制约了以其为靶标的真菌抑制剂的开发。因此,探究植物病原真菌氧化固醇结合蛋白新靶标的结构与功能,将为靶向杀菌分子的设计奠定理论基础,将对我国绿色农药新品种创制和保障粮食安全做出贡献。
