电针对小鼠海马C3/C3aR/STAT3信号通路的影响
2023-04-17陈丽敏郭婉清温若兰郑雪花林岚王丰董卫国
陈丽敏 ,郭婉清 ,温若兰 ,郑雪花 ,林岚 ,王丰 ,董卫国
1.福建中医药大学针灸学院,福建 福州 350122; 2.福建中医药大学附属第三人民医院,福建 福州 350108;3.福建中医药大学中西医结合学院,福建 福州 350122
阿尔茨海默病(Alzheimer disease,AD)是一种以慢性、持续进展性记忆减退及认知功能障碍为主要特征的中枢神经系统退行性疾病。AD确切发病机制迄今尚未阐明。大量研究表明,AD发病与β淀粉样蛋白(Aβ)级联、Tau蛋白异常磷酸化、神经元突触丢失等因素密切相关[1]。近年来,补体介导的神经胶质细胞突触吞噬参与AD越来越受到重视[2]。大脑中星形胶质细胞-小胶质细胞-神经元突触之间可以通过C3/C3aR/STAT3信号通路进行交互,参与AD的发生发展,抑制胶质细胞与补体信号间的交互作用可能是治疗AD的新策略[3]。本研究观察电针对快速老化模型小鼠SAMP8海马突触功能及C3/C3aR/STAT3信号通路的影响,从补体角度探讨电针改善AD突触功能障碍的可能机制,为电针治疗AD提供实验依据。
1 实验材料
1.1 动物
SAMP8小鼠24只、抗快速老化小鼠SAMR1 12只,6月龄,雄性,体质量(35±5)g,购于北京华阜康生物科技股份有限公司,动物生产许可证号SCXK(京)2019-0008。饲养于福建中医药大学SPF级动物实验中心,温度(22±2)℃,湿度50%~60%,12 h明暗交替,自由摄食饮水,动物使用许可证号SYXK(闽)2019-0002。本实验经福建中医药大学动物伦理委员会批准(2020033),实验过程严格依据国家动物保护法和实验动物伦理要求进行。
1.2 主要试剂与仪器
补体3(C3)抗体(货号Sc-28294)、补体3a受体(C3aR)抗体(货号Sc-133172),美国Santa Cruz Biotechnology公司;胶质纤维酸性蛋白(GFAP)抗体(货号3670)、信号传导和转录激活因子3(STAT3)抗体(货号9139)、p-STAT3抗体(货号9145)、离子钙结合衔接分子1(Iba1)抗体(货号17198),美国CST公司;β-actin抗体(货号20536-1-AP),美国Proteintech公司;突触后致密物95(PSD-95)抗体(货号ab18258)、突触素(Syn)抗体(货号ab32127)、C3抗体(货号ab11862),英国Abcam公司;超敏ECL试剂盒(货号MAO186-1),上海碧云天生物技术公司;反转录试剂盒(货号R123-01)、荧光定量试剂盒(货号Q311-02),南京Vazyme公司。0.25 mm×15 mm华佗牌无菌针灸针、G6805-Ⅰ电针仪(苏州医疗用品厂有限公司),CFX 96 Touch实时荧光定量PCR仪(美国Bio-Rad公司),DM i8倒置荧光显微镜(德国Leica公司),Morris水迷宫测试系统(上海欣软信息科技有限公司),HM 525 NX冰冻切片机(美国Thermo Fisher Scientific公司)。
2 实验方法
2.1 分组及干预
将24只SAMP8小鼠随机分为模型组12只、电针组12只,另取12只SAMR1小鼠作为对照组。使用自制网兜将电针组小鼠固定,参照《实验针灸学》[4]取“百会”向前斜刺2 mm、“大椎”向下斜刺2~3 mm、双侧“肾俞”向脊柱方向斜刺3~4 mm,连接电针仪,正极接“大椎”,负极接“肾俞”(两侧隔日交替),连续波,频率2 Hz,电流强度1.5~2 mA,以小鼠后肢及尾部微微颤抖但不嘶叫为度,每日20 min,8 d为1个疗程,每个疗程间隔2 d,共3个疗程。模型组和对照组固定相同时间,不进行干预。
2.2 取材
干预结束后,各组随机取6只小鼠以0.3%戊巴比妥钠腹腔注射麻醉,脱颈处死,断头取脑,分离海马,置于无RNA酶冻存管中,液氮暂存后转入-80 ℃冰箱,左侧海马用于免疫印迹检测,右侧海马用于实时荧光定量PCR。剩余小鼠麻醉后,分别经预冷生理盐水和4%多聚甲醛灌注,快速断头取脑,将全脑置于4%多聚甲醛中固定24 h,依次投入15%、20%、30%蔗糖溶液,梯度脱水至组织沉底,OCT包埋组织,连续冠状面切片(15 μm),-20 ℃冰箱保存备用。
2.3 指标检测
2.3.1 Morris水迷宫实验
电针干预结束后,进行Morris水迷宫实验,包含适应性训练、定位巡航实验和空间探索实验。实验前先对小鼠进行适应性训练2 d。定位巡航实验为期5 d,将逃生平台置于第Ⅲ象限,并低于水面1 cm,依次将小鼠从每个象限中点贴壁放入水中,记录小鼠90 s内找到平台的时间,即为逃避潜伏期。若小鼠在90 s内未找到平台,则该小鼠的逃避潜伏期计为90 s,并引导小鼠至平台上学习15 s。第8日进行空间探索实验,撤去逃生平台,将小鼠从第Ⅰ象限放入水中,记录小鼠90 s内穿越原平台的次数及在原平台象限(第Ⅲ象限)停留的时间。
2.3.2 免疫荧光染色
取脑组织切片,室温复温30 min,PBS冲洗5 min×3次,组化笔在组织周围画圈,滴加1%Triton X-100 25 μL破膜1 h,PBS冲洗5 min×3次,5%BSA 37 ℃封闭1 h,滴加一抗混合液(GFAP 1∶300、C3 1∶100、Iba1 1∶200、C3aR 1∶200),4 ℃摇床过夜。次日复温,PBS冲洗5 min×3次,滴加二抗,室温避光孵育1 h,PBS冲洗5 min×3次,避光滴加含DAPI的抗荧光淬灭剂,封片。荧光显微镜下观察海马CA1区GFAP与C3共定位、Iba1与C3aR共定位情况,对共定位阳性细胞数进行统计分析。
2.3.3 免疫印迹法检测
取海马组织,称重,加入裂解液(组织∶裂解液∶PMSF=10 μg∶100 μL∶1 μL),放入匀浆机中研磨,冰上静置30 min,4 ℃、14 000 r/min离心10 min,取上清液,BCA法进行蛋白定量。蛋白上样,电泳(20 V、10 min,80 V、40 min,120 V、50 min),4 ℃、300 mA转膜,5%封闭液室温封闭2 h,置一抗(β-actin 1∶1 000、Syn 1∶3 000、PSD-95 1∶3 000、C3 1∶1 000、C3aR 1∶1 000、STAT3 1∶1 000、p-STAT3 1∶1 000)中,4 ℃摇床孵育过夜。TBST洗10 min×3次,加入二抗,室温孵育2 h,TBST洗10 min×3次。滴加ECL发光液,凝胶成像系统进行扫描,Image Lab软件分析各条带灰度值。以目的蛋白灰度值/β-actin灰度值计算蛋白相对表达量。
2.3.4 实时荧光定量PCR检测
取海马组织,加入Trizol 1 mL,匀浆机研磨1 min,冰上静置10 min。加入氯仿200 µL,剧烈震荡15 s,冰上静置10 min,4 ℃、14 000 r/min离心15 min,吸取上层水相至新的EP管中,加入等体积异丙醇,上下震荡混匀,冰上静置10 min,离心15 min。弃上清液,加入75%乙醇1 mL洗涤RNA,冰上静置3 min,离心5 min,弃上清液,室温风干,加入DEPC水30 µL,吹打至RNA充分溶解,测定RNA浓度。配制反转录体系,42 ℃反应2 min,加入5× Hiscript Ⅱ qRT Super MixⅡ,50 ℃、15 min,85 ℃、2 min进行反转录。配制PCR反应液,95 ℃预变性30 s;95 ℃、10 s,60 ℃、30 s,共40个循环;95 ℃、10 s,60 ℃、60 s,95 ℃、15 s,绘制熔解曲线。2-∆∆Ct法计算目的基因相对表达量。引物序列见表1。

表1 各基因PCR引物序列
3 统计学方法
采用SPSS23.0统计软件进行分析。计量资料以±s表示,水迷宫定位巡航实验数据使用重复测量方差分析,进行球形检验,P<0.05用Greenhouse-Geisser进行校正并分析各效应的主效应,P>0.05用重复测量的单变量方差进行分析。其他指标符合正态性采用方差分析,方差齐用LSD法进行两两比较,方差不齐用Games Howell检验。P<0.05表示差异有统计学意义。
4 结果
4.1 电针对模型小鼠行为学的影响
与对照组比较,模型组小鼠Morris水迷宫实验逃避潜伏期明显延长,穿越原平台次数及原平台象限停留时间明显减少(P<0.01);与模型组比较,电针组小鼠Morris水迷宫实验逃避潜伏期明显缩短,穿越原平台次数及原平台象限停留时间明显增加(P<0.01,P<0.05)。结果见表2、表3。
表2 各组小鼠Morris水迷宫实验逃避潜伏期比较(±s,s)

表2 各组小鼠Morris水迷宫实验逃避潜伏期比较(±s,s)
注:与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
组别对照组模型组电针组只数6 6 6 1 d 33.63±29.03 82.01± 5.27**58.61±11.76#2 d 20.23± 7.98 69.51±20.01**49.49± 7.66#3 d 15.87±15.01 62.97±10.04**38.79±13.47##4 d 11.81± 3.43 56.34±17.41**34.96±10.35##5 d 6.98± 4.78 48.83±19.08**23.16± 6.60##
表3 各组小鼠穿越原平台次数及原平台象限停留时间比较(±s)
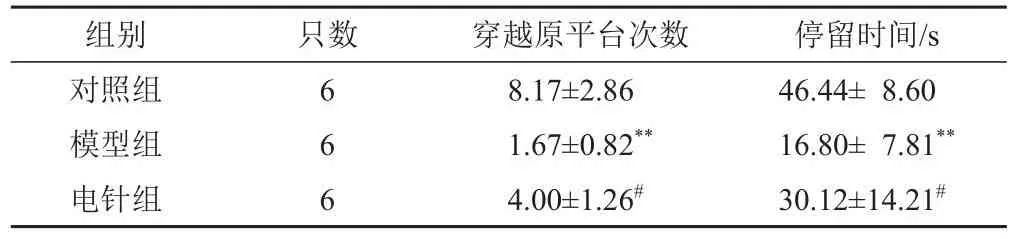
表3 各组小鼠穿越原平台次数及原平台象限停留时间比较(±s)
注:与对照组比较,**P<0.01;与模型组比较,#P<0.05
组别对照组模型组电针组只数6 6 6穿越原平台次数8.17±2.86 1.67±0.82**4.00±1.26#停留时间/s 46.44± 8.60 16.80± 7.81**30.12±14.21#
4.2 电针对模型小鼠海马CA1区GFAP与C3、Iba1与C3aR共定位的影响
与对照组比较,模型组小鼠海马CA1区GFAP与C3、Iba1与C3aR共定位阳性细胞数明显增加(P<0.01);与模型组比较,电针组小鼠海马CA1区GFAP与C3、Iba1与C3aR共定位阳性细胞数明显减少(P<0.01)。见图1、图2、表4。

图1 各组小鼠海马CA1区GFAP与C3共定位情况(免疫荧光染色,标尺=50 μm)
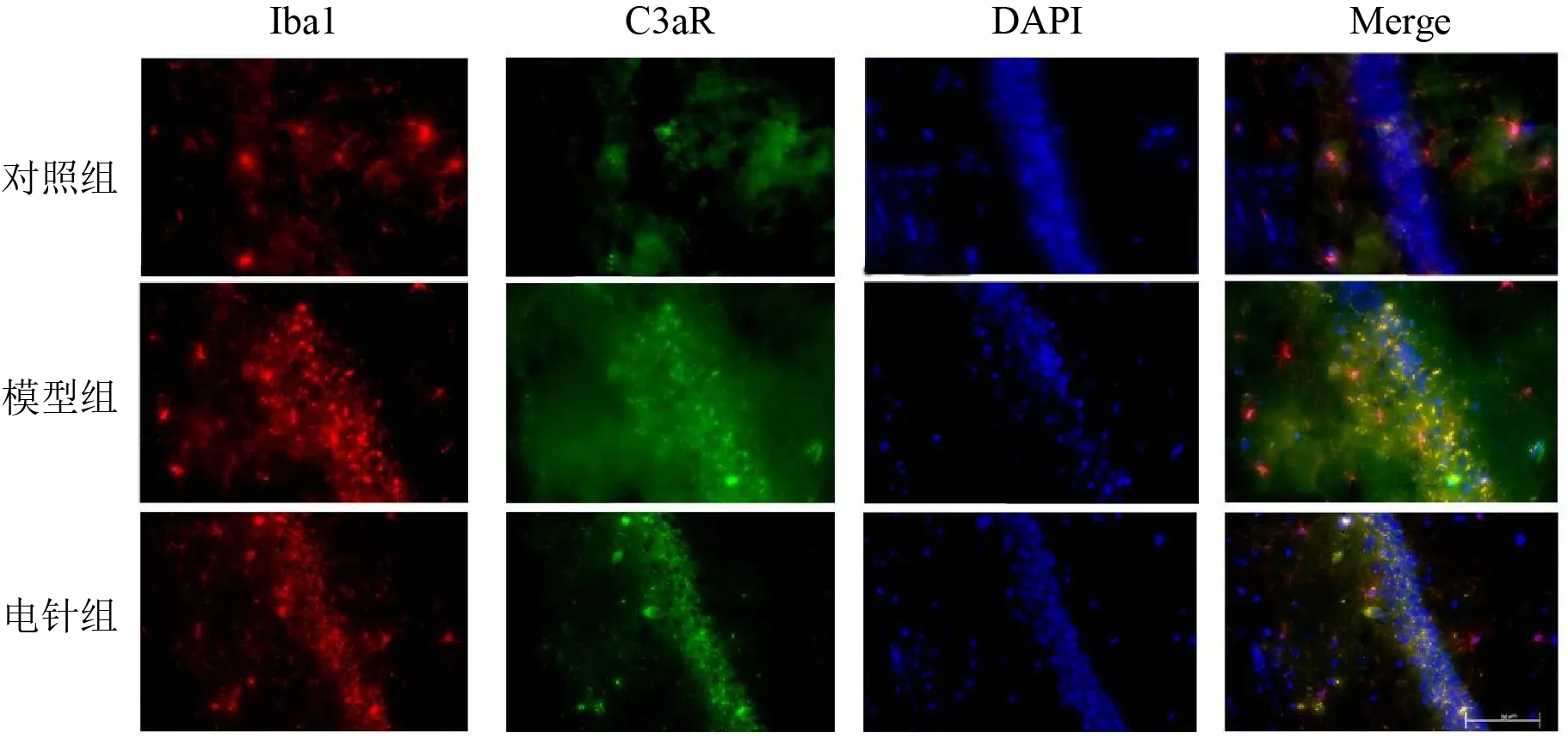
图2 各组小鼠海马CA1区Iba1与C3aR共定位情况(免疫荧光染色,标尺=50 μm)
表4 各组小鼠海马CA1区GFAP-C3、Iba1-C3aR共定位阳性细胞数比较(±s,个)
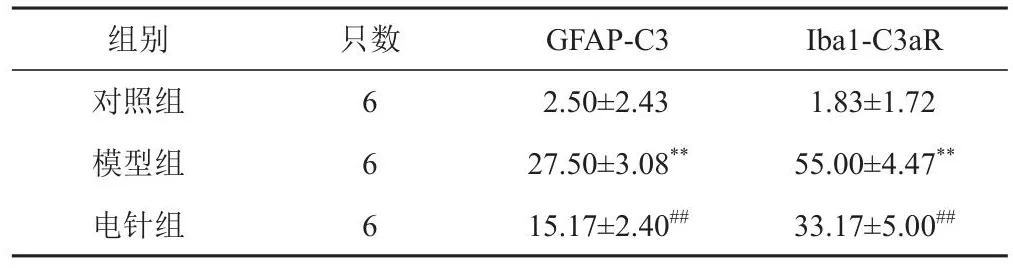
表4 各组小鼠海马CA1区GFAP-C3、Iba1-C3aR共定位阳性细胞数比较(±s,个)
注:与对照组比较,**P<0.01;与模型组比较,##P<0.01
组别对照组模型组电针组只数6 6 6 GFAP-C3 2.50±2.43 27.50±3.08**15.17±2.40##Iba1-C3aR 1.83±1.72 55.00±4.47**33.17±5.00##
4.3 电针对模型小鼠海马组织蛋白表达的影响
与对照组比较,模型组小鼠海马组织Syn、PSD-95蛋白表达明显降低(P<0.01),C3、C3aR、STAT3、p-STAT3蛋白表达明显升高(P<0.01);与模型组比较,电针组小鼠海马组织Syn、PSD-95蛋白表达明显升高(P<0.01),C3、C3aR、STAT3、p-STAT3蛋白表达明显降低(P<0.05,P<0.01)。见图3、表5。
表5 各组小鼠海马组织Syn、PSD-95、C3、C3aR、STAT3、p-STAT3蛋白表达比较(±s)

表5 各组小鼠海马组织Syn、PSD-95、C3、C3aR、STAT3、p-STAT3蛋白表达比较(±s)
注:与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
组别对照组模型组电针组只数6 6 6 Syn 1.00±0.04 0.69±0.07**0.85±0.05##PSD-95 1.00±0.08 0.67±0.09**0.83±0.07##C3 1.00±0.42 2.33±0.33**1.80±0.16#C3aR 1.00±0.21 1.59±0.05**1.34±0.10##STAT3 1.00±0.11 1.76±0.18**1.33±0.10##p-STAT3 1.00±0.16 2.17±0.12**1.80±0.24##

图3 各组小鼠海马组织Syn、PSD-95、C3、C3aR、STAT3、p-STAT3蛋白免疫印迹
4.4 电针对模型小鼠海马组织mRNA表达的影响
与对照组比较,模型组小鼠海马组织C3、C3aR、STAT3 mRNA表达明显升高(P<0.01);与模型组比较,电针组小鼠海马组织C3、C3aR、STAT3 mRNA表达明显降低(P<0.01,P<0.05)。见表6。
表6 各组小鼠海马组织C3、C3aR、STAT3 mRNA表达比较(±s)
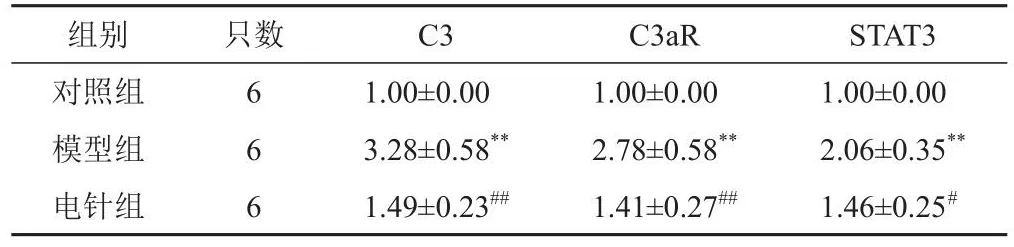
表6 各组小鼠海马组织C3、C3aR、STAT3 mRNA表达比较(±s)
注:与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
组别对照组模型组电针组只数6 6 6 C3 1.00±0.00 3.28±0.58**1.49±0.23##C3aR 1.00±0.00 2.78±0.58**1.41±0.27##STAT3 1.00±0.00 2.06±0.35**1.46±0.25#
5 讨论
AD属中医学“痴呆”“呆病”等范畴。研究发现,运用“益肾调督”针灸法,选取大椎、百会、肾俞可治疗AD[5]。大椎为“三阳督脉之会”,具有温阳通督、调神醒脑功效。百会为“三阳五会”,可平补一身之阳气,又内应于脑,为治疗神经系统疾患要穴。肾俞为肾的背俞穴,《经穴命名浅解》记载“穴近肾脏,为肾藏经气转输之处,主治肾脏疾患”,肾精输注于此,又可通过足太阳膀胱经上输于脑,充养脑髓。诸穴合用,可振奋阳气,疏通督脉经气,益肾填精,聪脑益智。作为针灸疗法的重要组成部分,电针在AD的治疗中已取得一定疗效,可能与电针改善AD大脑内炎症反应、抗细胞凋亡等有关[6]。电针频率是影响电针疗效的重要因素。研究发现,低频电针刺激所产生的效应更接近人体生物电刺激,能更好地调节并促进脑神经功能恢复[7]。多项研究表明,2 Hz电针可有效改善AD模型小鼠的学习记忆能力,治疗AD[8-10]。基于以上文献和本课题组前期研究[11-13],并考虑到实验动物的耐受性,本实验选择电针频率2 Hz。
SAMP8小鼠可模拟迟发性AD的疾病过程[14-15]。研究发现,6月龄起,SAMP8小鼠脑内便可见明显Aβ肽沉积、高度磷酸化Tau蛋白[16-19],其增长数量与年龄成正比。此外,SAMP8小鼠还存在神经元丢失[20]、胶质细胞增生[21]等病理变化,是目前较常用的AD动物模型。SAMR1与SAMP8有相似的遗传背景,被广泛用于实验的空白对照。本实验Morris水迷宫实验结果显示,随着时间推移,模型组小鼠逃避潜伏期仍长于对照组,原平台象限停留时间及穿越原平台次数明显少于对照组,说明SAMP8小鼠已表现出学习记忆能力障碍。经电针治疗后,电针组小鼠学习记忆能力得到明显改善。
课题组前期实验研究发现,电针可抑制补体1q(C1q)及小胶质细胞标记物Iba1表达[11],改善突触功能[12-13]。因此,本研究进一步观察电针对补体介导的胶质细胞突触吞噬的影响。研究表明,星形胶质细胞可分泌C1q下游成分C3,C3经C3裂解酶裂解成C3a和C3b[3,22],C3a可与小胶质细胞上的C3aR特异性结合,吞噬突触,还可激活小胶质细胞内的STAT3[23]。C3/C3aR/STAT3信号通路参与调控AD中Tau蛋白磷酸化,抑制该信号通路能减轻AD中Tau蛋白磷酸化,减少突触丢失[3,24]。以上说明星形胶质细胞-小胶质细胞-神经元突触之间可发生交互作用。GFAP是星形胶质细胞特有的中间丝蛋白,参与维持细胞骨架,可由激活的星形胶质细胞分泌并作为反映星形胶质细胞活化的重要标记物[25]。Iba1是小胶质细胞的标记蛋白。本实验研究结果显示,电针可减少SAMP8小鼠海马CA1区GFAP与C3共定位、Iba1与C3aR共定位阳性细胞数,降低C3、C3aR、STAT3蛋白表达及mRNA水平,提示电针能够抑制SAMP8小鼠海马CA1区C3/C3aR/STAT3信号通路。
AD是一种以进行性认知功能障碍为主要临床表现的神经退行性疾病。相关研究发现,认知功能障碍是由突触功能受损或丢失造成[26],在与认知功能相关的海马区尤为明显。突触是神经元传递信息的特定结构,被认为是产生学习记忆、进行其他神经活动的关键部位。突触上存在多种突触蛋白,如Syn、PSD-95等,这些蛋白共同参与维持突触功能。Syn是突触前成分中具有调节突触小泡功能的蛋白,可参与囊泡运输及分泌等,是反映突触功能的指标之一[27]。PSD-95位于突触后膜,主要起结构支架作用,可与相关受体蛋白及信号结合,调控突触连接的产生并对突触的维护有重要作用[28]。本实验中,与模型组比较,电针组小鼠海马突触相关蛋白Syn、PSD-95表达明显升高,提示电针可改善突触功能,与既往研究结果[12-13,29]一致。
综上,电针“大椎”“百会”“肾俞”可改善突触功能,提高AD模型小鼠学习记忆能力,其机制可能与抑制海马C3/C3aR/STAT3信号通路有关。
