经羧甲基壳聚糖诱导的葡萄柚果实转录组WRKY基因分析及抗性相关基因挖掘
2023-04-05刘胜红黄二宾杜嵘宇
杨 清,刘胜红,黄二宾,杜嵘宇,王 芳,2,邓 佳,3,*
(1.西南林业大学 林学院,云南 昆明 650224; 2.西南喀斯特山地生物多样性保护国家林业和草原局重点实验室,云南 昆明 650224; 3.西南山地森林资源保育与利用教育部重点实验室,云南 昆明 650224)
葡萄柚(CitrusparadisiMacf.)是芸香科柑橘属植物,又叫西柚,有较高的营养、保健、医药研究价值。柑橘类水果因果实质地软化在采后贮藏运输过程中易受到霉菌感染引发青、绿霉病、酸腐病和黑腐病等生理性病害,缩短贮运寿命,降低其经济价值。其中,最常见和最严重的柑橘属果实采后侵染性病害是由指状青霉(Penicilliumdigitatum)引起的绿霉病和扩展青霉(Penicilliumexpansum)引起的青霉病[1]。对于柑橘采后病害的防治,目前普遍采用气调、涂膜、留树贮藏、化学贮藏等方式。化学杀菌剂通常采用苯并咪唑类和取代苯类的杀菌剂,虽然是最有效的手段,但使用农药会导致抗药性、农药残留、污染环境等问题的产生,所以未来研究的重点是结合多种保鲜技术的综合防治[2]。
壳聚糖(chitosan,CTS),化学名为β-(1,4)聚-2-胺基-D-葡萄糖,是一种含氮的高分子阳离子聚合物,在自然界储量丰富,最初由节肢动物的外壳提取而来,应用于农业生产中不会对植物产生毒副作用,经土壤中微生物分解后又可被植物吸收[3-4]。除此之外,CTS具有良好的生物相容性、可生物降解性、果蔬保鲜、杀菌杀虫、抵御逆境、抗病诱导、促进生长、提高产量等特性[5]。壳聚糖诱导植物抗病的方式主要是直接抑菌作用及诱导抗病性;诱导植物的结构抗病性或诱导植物产生抗性蛋白、木质胶、木质素与植保素和改变植物的代谢方式等[6-7]。羧甲基壳聚糖(carboxymethyl chitosan,CMCS)是壳聚糖羧甲基化反应后的衍生物,它在保持壳聚糖优良特性的基础上,还具有良好的水溶性,所以羧甲基壳聚糖为主体的保鲜剂更有研究和应用前景[8-9]。WRKY转录因子和抗性相关基因主要与植物的抗逆性、衰老和信号转导等生理过程有关,WRKY参与调控植物抗逆相关的信号传导及抗性物质合成代谢,提高植物抗逆能力。
本实验用1.5% CMCS溶液浸泡处理3 min,诱导葡萄柚24 h后,采用二代高通量测序技术,对葡萄柚进行转录组测序,对抗性相关的差异表达基因进行了功能注释与比较分析,对壳聚糖的抑菌作用和诱导作用进行了初步研究,为诱导葡萄柚抗性的分子研究奠定基础,从而为壳聚糖在生产实践上的应用提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
指状青霉和扩展青霉为西南林业大学重点实验室从贮藏的里约红葡萄柚发病果实上分离鉴定的菌种。于马铃薯葡萄糖琼脂培养基(PDA)上培养完成后,配制成浓度为1×105CFU·mL-1的孢子悬浮液(血球计数板计数)。
1.1.2 试剂
羧甲基壳聚糖(CMCS),羧基化度≥80%,pH值8~10,水分≤10%,采购于上海腾准生物科技有限公司。
1.2 实验方法
1.2.1 损伤接种
葡萄柚果实表面经无菌水冲洗晾干之后采用75%的乙醇对果实表面进行擦拭消毒,晾干后分别用1.5% CMCS溶液和无菌水(对照组,CK)浸泡葡萄柚果实3 min,室温自然晾干。病原菌接种参照Bi等[10]的方法并稍作修改,用打孔器在葡萄柚果实赤道部位等距离地刺4个4 mm×4 mm的小孔。孔内汁液自然晾干后,用移液枪分别向每个果实孔洞中定量注入20 μL浓度为1×105CFU·mL-1的P.digitatum和P.expansum孢子悬浮液。待孔内汁液全部吸收后单果包装,置于塑料筐内室温贮藏,每天观察测定果实发病率和病斑直径。
1.2.2 损伤自然发病
果实浸泡及损伤处理同1.2.1节,果实打孔后单果包装,置于塑料筐内室温贮藏,每天观察测定果实发病率和病斑直径。
1.2.3 无损伤接种发病
果实浸泡处理同1.2.1节,室温自然晾干后,采用分别装有浓度为1×105CFU·mL-1的P.digitatum、P.expansum孢子悬浮液的手持气压式喷雾器对果实喷雾接菌,以果实表面湿润但不滴水为宜,待果皮表面菌液全部晾干后单果包装,置于塑料筐内室温贮藏,每天测定果实发病率和病斑直径。
1.2.4 转录组果实处理及取样
6个葡萄柚果实处理同上。置于室温条件下贮藏24 h后对葡萄柚果实进行取样,取样时迅速分离果皮果肉,分别包装于自封袋中,并迅速于-80 ℃超低温冰箱贮藏。
1.3 果实样本转录组测序分析
6个葡萄柚果皮样品总RNA的提取、cDNA文库的构建以及转录组深度测序均委托基地奥司完成。
1.3.1 文库构建、测序数据分析
筛选FDR<0.05且|log2FC|>1的基因为显著差异基因,对达到此标准的DEGs进行GO功能和KEGG富集分析,差异基因表达量用平均值±标准误差来表示,数据为3次重复的平均值。
1.3.2 基于蛋白序列的葡萄柚WRKY进化树构建
利用开放阅读框(ORF)(https://www.ncbi.nlm.nih.gov/orffinder)预测筛选出的CsWRKY基因的氨基酸序列,从TAIR数据库中获得了72个拟南芥WRKY转录因子家族成员的氨基酸序列,使用MAGA11.0软件对葡萄柚WRKY蛋白和拟南芥中WRKY蛋白的氨基酸序列进行多重序列比对,利用邻接法(NJ,neighbor-joining)构建系统发育树,bootstrap值设为1 000,构建拟南芥WRKY转录因子家族与CsWRKY的系统进化树。进化树结果用在线软件Evolview(http://www.evolgenius.info/evolview/)进行美化。
1.3.3 荧光定量PCR(qRT-PCR)检测
采用RNAprep Pure总RNA提取试剂盒提取与测序同批的样品总RNA,用Hifair®Ⅲ 1st Strand cDNA Synthesis SuperMix for qPCR试剂盒反转录成cDNA。利用Primer3 Plus进行引物设计,Primer design进行引物校正,引物序列见表1。qRT-PCR体系采用Hieff UNICON®Universal Blue qPCR SYBR Green Master Mix和Corbett Rotor-Gene300荧光定量PCR仪进行检测,反应程序如下:95 ℃ 2 min,95 ℃ 10 s,60 ℃ 1 min,72 ℃ 25 s,共40个循环。随机选取9个DEGs进行表达分析,以Action为内参基因,采用2-ΔΔCT估算待测差异基因的表达水平。

表1 qRT-PCR用引物序列
1.4 数据分析
运用SPSS Statistics 22.0软件对数据进行单因素方差分析,利用t检验方法分析不同处理组间差异,以P<0.05表示差异显著,发病率用平均值±标准误差来表示,并使用Excel 2010软件进行数据统计和图表绘制。
2 结果与分析
2.1 CMCS诱导对葡萄柚抗指状青霉和扩展青霉的效果
由图1-A、B可知,CMCS诱导间隔24 h损伤接种P.digitatum,CK、CMCS处理接种后第2天发病率分别为66.67%和33.33%,第3天发病率分别为100%和66.67%,CMCS处理组果实发病率显著低于CK组果实(P<0.05);CMCS诱导处理果实接种P.digitatum第6~8天,病斑直径显著小于CK组(P<0.05)。综上所述,与对照组相比,CMCS处理显著降低葡萄柚果实P.digitatum的发病率和病斑直径(P<0.05)。由图1-C、D可知,CMCS诱导间隔24 h损伤接种P.expansum,CK、CMCS处理接种后第2天发病率分别为83.33%和25.00%,第3天发病率分别为100%和66.67%,处理间差异显著(P<0.05);接种P.expansum第6、7天,CMCS处理组比对照组的病斑直径小且增长速率降低,但两者差异不显著。
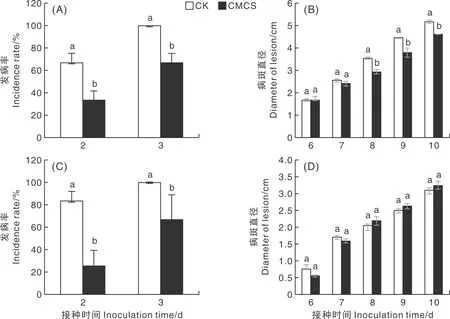
图中没有相同字母代表差异显著(P<0.05),下同。
由图2可知,CMCS诱导间隔24 h,损伤自然发病第4天,CK发病率为100%,CMCS处理果实发病率为75%,显著低于CK组果实(P<0.05);第4、5天 CMCS处理的病斑直径小于CK,分别降低41.67%和40.93%。综上所述,CMCS浸泡处理能显著降低葡萄柚果实损伤自然发病率和病斑直径。
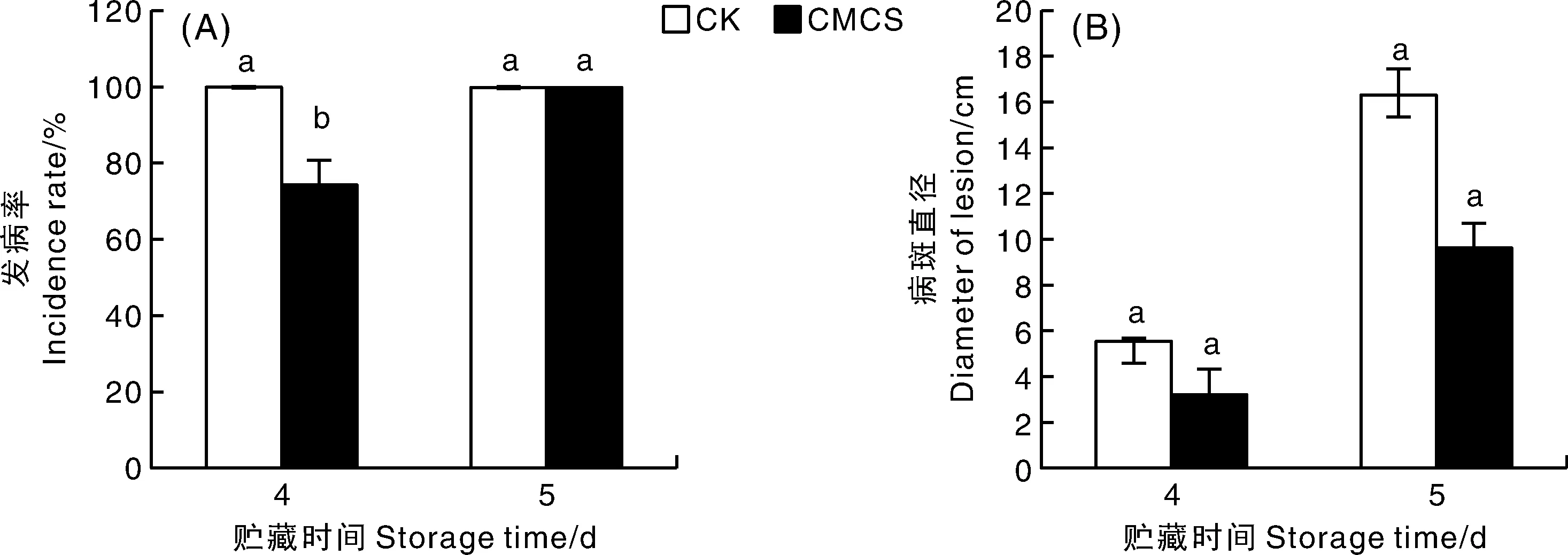
图2 CMCS诱导处理葡萄柚果实损伤自然发病情况
由图3-A、B可知,CMCS诱导间隔24 h,无损伤接种P.expansum第14 、15天,CK发病率分别为75%、100%,CMCS处理的发病率分别仅为25%和50%,CMCS处理果实发病率显著低于CK果实(P<0.05);第14、15天 CMCS处理的病斑直径小于CK,较CK分别降低53.70%和40.41%,其中第15天两者处理病斑直径差异显著(P<0.05)。综上所述,与CK相比,CMCS浸泡处理能显著降低无损伤接种P.expansum的发病率和病斑直径。CK和CMCS处理的果实无损伤接种P.digitatum均未发病。

图3 CMCS诱导处理葡萄柚果实不损伤接种P. expansum的发病情况
2.2 测序数据质控报告
对上述1.5%CMCS浸泡诱导处理和对照的葡萄柚果皮进行转录组测序,测序质量控制后,结果如表2所示,诱导24 h的样品共获得33.60 Gb clean data。CK和CMCS碱基Q20平均值分别为98.19%和98.18%,碱基Q30平均值分别为94.27%和94.24%,GC含量分别达43.79%和43.75%;以上数据表明,本次转录组测序数据量和质量都较高,准确性高,可用于后续实验分析。

表2 碱基信息统计表
2.3 参考基因组比对结果统计
由表3可知,对诱导处理组和对照组进行转录组测序,所获得的纯净序列中,能定位到基因组上的纯净序列平均值分别为33 268 189条和32 837 615条,占比为81.68%~82.25%;在参考序列上,能比对上多个序列的基因的平均值为731 203.33和715 577.67条,占比为1.74%~1.89%;在参考序列上,只有唯一比对位置序列基因的平均值为32 536 985.33和32 122 037.33条,占比为79.85%~80.50%。其中能定位到纯净序列上的基因占比都超过81.68%,而在参考序列上有多个比对位置的基因序列数均小于2%;以上数据说明本次测序不存在污染并且参考基因组选择合适,所选参考基因组组装能满足信息分析的需求。
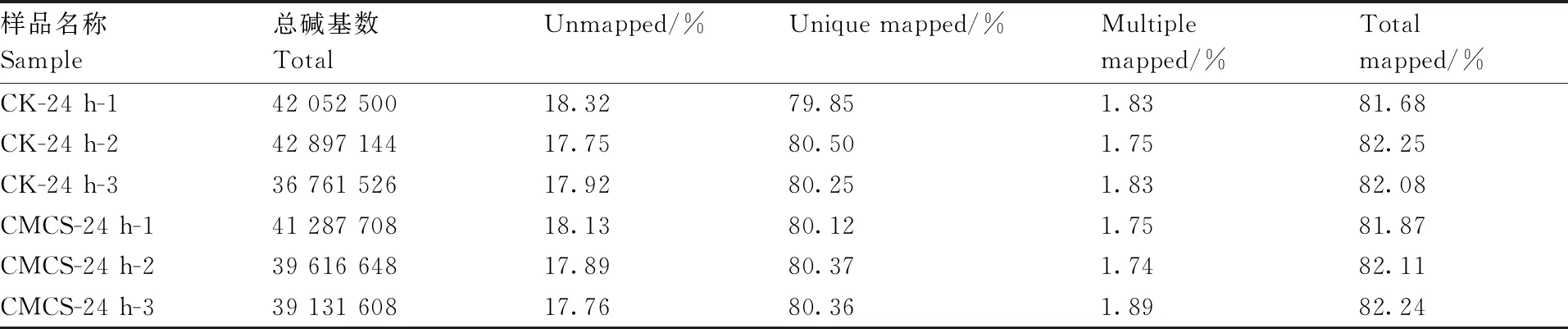
表3 基因比对率统计表
2.4 组装质量统计
将上述测序结果的unigene序列使用Trinity软件进行分析统计。从图4-A可知,N50的数量远低于基因的数量,而且其长度高于基因的平均长度,平均GC含量为39.32%。说明基因的组装质量合格,效果较好,可用于后续数据的分析和挖掘。
2.5 Unigene基本注释
2.5.1 注释结果汇总
由图4-B的unigene基本功能注释可知,处理组测序得到的39 390个基因,有27 337条(69.40%)unigene被注释到Nr数据库、24 842条(63.07%)unigene被注释到KEGG数据库、14 330条(36.38%)unigene被注释到KOG数据库、17 718条(44.98%)unigene被注释到SwissProt数据库;总共有27 467条(69.73%)unigene被注释到数据库,没有注释到数据库的一共有11 923(30.27%)条。其中,12 990条unigene在4个数据库中都有注释。
2.5.2 Nr注释
Nr可以将核酸数据和蛋白数据联系起来,并确定物种相似性。由图4-C可以看出,CMCS处理的葡萄柚果实样品注释到Nr数据库中31.21%的unigene与甜橙(Citrussinensis)已发表基因组序列匹配度最高,其次是克莱门柚(Citrusclementina),占30.53%;粳稻(OryzasativaJaponicaGroup),占10.23%;温州蜜柑(Citrusunshiu),占2.47%;扁桃(Prunusdulcis),占1.95%;所涉及的unigene数目分别为8 533、8 345、2 796、675和533条。

图4 Unigene长度分布图(A)、四大数据库注释维恩图(B)和Nr注释物种分布图(C)
2.6 CMCS诱导处理葡萄柚果皮差异表达基因分析
2.6.1 差异表达基因筛选
为了探究CMCS诱导处理对葡萄柚果皮的差异基因表达情况,以FDR<0.05且|log2FC|>1为条件筛选显著差异表达基因。结果如图5所示,CK-24 h-vs-CMCS-24 h,总共筛选出85个差异表达基因,其中上调基因67个,下调基因18个。

图5 差异基因统计图(A)、差异基因火山图(B)
2.6.2 差异表达基因的GO功能分类统计
如图6所示,CMCS处理组,DEGs都被涉及到生物过程(biological process)、细胞组分(cellular component)和分子功能(molecular function)3个大类,总共包括在37个二级亚类。生物过程包括19个亚类,其中,以细胞过程(cellular process)、代谢过程(metabolic process)、应激反应(response to stimulus)和单生物过程(single-organism process)富集的DEGs最多,分别为50、46、38和38个,该4个亚类可能与细胞的能量代谢、生长等相关;细胞组分包括12个亚类,其中以细胞(cell)、细胞区域(cell part)和细胞器(organelle)富集到最多的DEGs,分别为42、41和29个,该3个亚类可能与细胞内物质的运输、转运相关;分子功能的亚类数目最少,仅有6个,其中以催化活性(catalytic activity)、结合(binding)和核酸结合转录因子活性(nucleic acid binding transcription factor activity)富集到最多的DEGs,分别为22、23和10个。

图6 GO富集分类柱状图
2.6.3 差异表达基因的KEGG生物通路分类统计
由图7可知,DEGs被富集到20条pathway上,其中显著富集(P<0.05)的pathway是戊糖、葡萄糖醛酸转换(pentose and glucuronate interconversions)、亚油酸代谢(linoleic acid metabolism)、维生素B6代谢(vitamin B6metabolism)、油菜素类酯生物合成(brassinosteroid biosynthesis)和代谢途径(metabolic pathways)5条通路,富集的差异基因个数分别是2、1、1、1、10个。余下通路按照显著性差异水平由高到低依次为硫胺素代谢(thiamine metabolism)、类胡萝卜素生物合成(carotenoid biosynthesis)、植物昼夜节律(circadian rhythm-plant)、α-亚麻酸代谢(alpha-linolenic acid metabolism)、丙氨酸、天冬氨酸和谷氨酸代谢(alanine, aspartate and glutamate metabolism)、内质网中的蛋白质加工(protein processing in endoplasmic reticulum)、甘氨酸、丝氨酸和苏氨酸代谢(glycine, serine and threonine metabolism)、谷胱甘肽代谢(glutathione metabolism)、乙醛酸和二羧酸代谢(glyoxylate and dicarboxylate metabolism)、次生代谢产物生物合成(biosynthesis of secondary metabolites)、过氧化物酶体(peroxisome)、苯丙烷生物合成(Phenylpropanoid biosynthesis)、MAPK植物信号通路(MAPK signaling pathway-plant)、植物激素信号转导(plant hormone signal transduction)、碳代谢(carbon metabolism)。

图7 KO富集气泡图
2.7 WRKY转录因子表达情况分析
根据差异表达基因的统计结果,以P<0.05,|log2FC|>1为差异基因筛选条件,筛选WRKY家族差异表达基因,log2FC>1即为上调的差异基因,log2FC<-1为下调的差异基因。如表4所示,CMCS诱导处理葡萄柚果皮转录组测序结果中,WRKY家族差异表达基因相较于对照组均显著上调。其中,有5个WRKY基因显著上调,分别是Unigene0016512(WRKY40)、Unigene0022945(WRKY53)、Unigene0004228(WRKY24)、Unigene0030218(WRKY54)、Unigene0015122(WRKY30)。

表4 CMCS诱导WRKY转录因子的表达量
2.8 抗病性相关差异基因筛选分析
由表5可知,在DEGS富集的20条通路中,显著富集通路5条(P<0.05),筛选出与抗病性相关的基因11个,在多个与植物病害防卫相关的通路中都有表达。所有通路中的DEGS既有上调表达又有下调表达,上调差异基因表达量均显著高于未诱导处理(表6),下调差异基因表达量显著低于未诱导处理(表7)。其中,与抗病性相关的上调表达基因6个,分别编码蛋白磷酸酶(PP2C)、丙氨酸-乙醛酸氨基转移酶(AGT1)、热激蛋白(HSP17.4、HSP22.0)、谷氨酰胺环转移酶(GGCT2;2)和9-顺式-环氧类胡萝卜素双加氧酶(NCED1),经CMCS诱导处理显著上调表达;与抗病性相关的下调表达基因共5个,分别编码果胶甲酯酶(PME44、PME7)、脂氧合酶(LOX2.1)、过氧化物酶(PER63)和细胞色素P450(CYP92C6)。这些差异基因富集的通路分别是植物激素信号转导途径、次生代谢、过氧化物酶体、内质网中的蛋白质加工、谷胱甘肽代谢。

表5 CMCS诱导葡萄柚24 h的差异基因
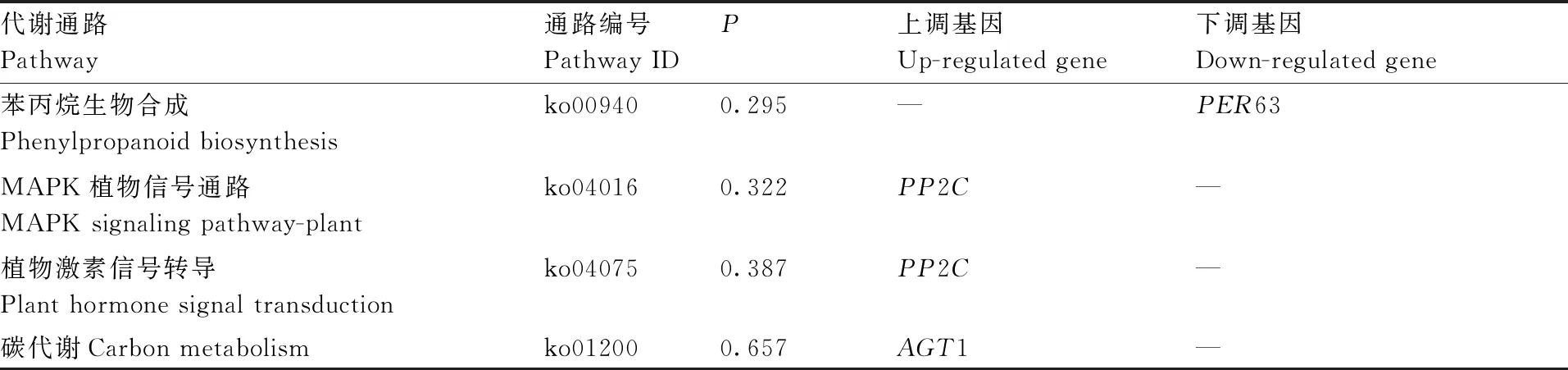
续表5 Continued Table 5

表6 CMCS诱导葡萄柚抗病性相关的上调差异基因表达量
2.9 抗病性相关差异基因与WRKY差异基因相关性聚类热图分析
对筛选出的相关抗病性差异表达基因(11个)和WRKY差异基因(5个)做相关性聚类分析,通过聚类图(图8)可以清楚地看到,这些基因按照抗性相关上调差异基因和抗性相关下调差异基因聚成两类。WRKY差异基因(Unigene0016512(WRKY40)、Unigene0022945(WRKY53)、Unigene0004228(WRKY24)、Unigene0030218(WRKY54)、Unigene0015122(WRKY30))与上调抗病性相关差异基因(PP2C、AGT1、HSP17.4、HSP22.0、GGCT2;2NCED1)呈显著正相关,与下调抗病性相关基因(PME44、PME7、LOX2.1、PER63、CYP92C6)呈显著负相关。
2.10 基于蛋白序列的葡萄柚果皮WRKY进化树分析
为准确地对葡萄柚果皮中WRKY基因家族进行分类和功能预测,选择差异表达的5个CsWRKY蛋白与拟南芥72个WRKY蛋白序列构建系统发育树(图9)。结果表明,WRKY进化树聚为6组,葡萄柚果皮差异表达WRKY基因聚在一组,CsWRKY40、CsWRKY24和CsWRKY54与AtWRKY5有较高同源性;CsWRKY53与AtWRKY73的同源性最高;CsWRKY30与AtWRKY16和AtWRKY52的同源性最高。葡萄柚WRKY基因与拟南芥WRKY基因同源性越高,亲缘关系越近,蛋白功能越相似。
2.11 荧光定量PCR验证
随机对WRKY、抗病性相关富集通路中筛选出的8个差异基因进行qRT-PCR验证,结果表明,WRKY40、WRKY53、WRKY24、WRKY54、GGCT2;2、NCED1上调,PME7、LOX2.1下调,8个基因的调控趋势与转录组学数据一致,转录组学结果得到验证(图10)。
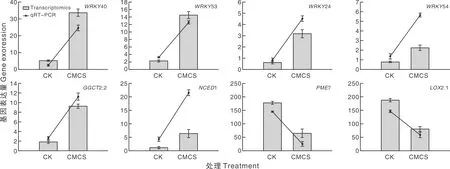
图10 八个关键差异基因的qRT-PCR检测
3 讨论与结论
本研究结果表明,采用1.5%的CMCS溶液诱导处理葡萄柚果实,可显著降低果实P.digitatum和P.expansum的发病率及病斑直径增长速度。进一步对上述处理果皮进行转录组测序,结果表明,CMCS处理诱导果实抗病性相关基因的表表达,KEGG分析发现,CMCS诱导的差异基因富集在抗病相关的多条代谢通路,包括次生代谢、植物激素信号转导途径、过氧化物酶体、苯丙烷生物合成、谷胱甘肽代谢等通路。
此外,从WRKY转录因子家族中筛选出5个差异基因(Unigene0016512(WRKY40)、Unigene0022945(WRKY53)、Unigene0004228(WRKY24)、Unigene0030218(WRKY54)、Unigene0015122(WRKY30)),其蛋白序列与72个拟南芥WRKY蛋白序列进行进化分析,发现葡萄柚5个WRKY差异基因和拟南芥的一簇WRKY基因有较高同源性,蛋白功能相似;相关性聚类分析结果表明,5个WRKY基因与上调抗病性相关差异基因(PP2C、AGT1、HSP17.4、HSP22.0、GGCT2;2、NCED1)呈显著正相关,推测WRKY基因的表达对其他抗病基因有一定的激活作用;同时,5个WRKY基因与下调抗性相关基因(PME44、PME7、LOX2.1、PER63、CYP92C6)呈显著负相关;可推测WRKY基因能抑制抗性相关防御酶活性和部分下游抗病基因的表达,来参与采后果实的抗病过程。
WRKY转录因子在与抗病相关的早期防卫应答调节中扮演重要角色,主要依赖SA信号途径和JA信号途径来发挥作用[11]。有研究证实,同时敲除AtWRKY11和AtWRKY17或只敲除AtWRKY11可减弱拟南芥对病原菌的抗性[12];AtWRKY52基因的过表达使拟南芥具有耐青枯病能力[13];在拟南芥中过表达GmWRKY16基因可以显著提高拟南芥对干旱,盐害等逆境的抗性[14];拟南芥WRKY7、WRKY11和WRKY17可以调控内质网伴侣基因的转录水平来参与防御反应[15]。
植物信号转导过程中蛋白磷酸酶(PP2C)可参与许多生物过程,其在响应病原菌、盐碱和干旱等过程中发挥重要作用[16],研究表明在拟南芥和青蒿等植物中,PP2C对ABA信号途径起负调控作用[17]。在拟南芥中过表达PP2C基因可增强转基因植株对外源胁迫的抗性[18]。9-顺式-环氧类胡萝卜素双加氧酶(NCED)是脱落酸(abscisic acid, ABA)的合成限速酶。研究表明,拟南芥中的AtNCED3[19]和番茄中的LeNCED1的过表达使内源性ABA积累增加,植株耐旱性增强;杨树的转录组研究,在干旱胁迫中,NCED基因表达明显,ABA含量明显增加[20];CsNCED1与柑橘叶片和果实的ABA合成有关[21]。本实验中CMCS诱导处理葡萄柚后,果实PP2C和NCED1显著上调表达,表明CMCS诱导可以增强PP2C和NCED1的基因表达量,调控内源性ABA含量,并提高果实抗性。
丙氨酸-乙醛酸氨基转移酶(AGT1)是植物光呼吸的关键酶。AGT1是具有丝氨酸-乙醛酸氨基转移酶(SGAT)活性的丙氨酸乙醛酸氨基转移酶,能发挥SGAT的功能。SGAT是过氧化物酶体中标志性酶,具有减少和消除活性氧的功能,对于光呼吸途径的正常运转和碳、氮的代谢起着重要作用,还与植物的抗病性和衰老等生理过程密切相关[22]。SGAT在甜瓜中的过量表达起到了抵抗霜霉病的作用[23]。本研究中,在过氧化物酶体、代谢途径、氨基酸代谢和碳代谢通路中,AGT1基因显著上调,说明CMCS诱导能增强AGT1表达,发挥SGAT抗氧化的作用,降低病害侵袭造成的氧化胁迫损伤危害。
植物体在病原菌侵染胁迫下,热激蛋白(HSP)能够防止功能蛋白的变性,修复已变性的蛋白,防止细胞损伤,响应环境压力,提高植株对逆境的耐受力[24]。HSP20家族成员最多、分布最广泛,调控植物的生长发育并参与胁迫。在抗逆机制中,HSP的积累和表达是抗逆的主要环节[25]。本研究中HSP17.4B和HSP22.0基因经CMCS诱导后被激活,并显著上调表达,说明CMCS诱导葡萄柚果实防御体系形成过程中有HSP20家族的参与。
谷氨酰胺环转移酶(GGCT)参与谷胱甘肽降解,与植物抗逆性、花粉管的生长有关[26]。有研究表明,拟南芥响应胁迫时,参与抗坏血酸-谷胱甘肽循环的上调基因被激活,谷胱甘肽含量增加,减轻植物体内的重金属毒性和生长抑制[27];本研究中,CMCS诱导调控葡萄柚果实谷胱甘肽代谢途径,GGCT2;2基因表达量显著上调,说明CMCS诱导激活谷胱甘肽代谢通路参与果实抗病体系的建立。
果胶甲酯酶(PME)是细胞壁代谢的关键酶之一,对植物细胞壁有降解作用,破坏植物防御,PME44和PME7是该基因家族的成员。研究表明,拟南芥植株受到病菌侵染时,PME基因表达量大幅上升[28];在嘎拉苹果发育过程中,PME基因表达量增加,果实硬度显著下降[29];本研究中,CMCS处理后,果实PME44、PME7基因表达量显著下调,减缓细胞壁降解,强化物理屏障防护能力。
脂氧合酶(LOX)是植物脂肪酸代谢途径中的关键限速酶,可以催化不饱和脂肪酸产生大量的活性氧,这些活性氧参与细胞膜脂的过氧化,破坏质膜,从而导致细胞坏死[30]。研究证实,辣椒CaLOX1在盐胁迫和干旱下表达量提高,过表达CaLOX1的拟南芥对ABA的抗性增强,通过调控ABA响应基因来提高对盐和干旱的胁迫[31]。本研究中,CMCS处理后,葡萄柚果实中LOX基因表达量降低,推测CMCS能缓解果实细胞质膜被破坏,延缓细胞衰老死亡。
植物过氧化物酶(peroxidase,POD或Prx)是氧化还原酶中的一种,可催化去除H2O2,参与木质部合成及外源胁迫响应。在柑橘中,CsPrx25通过细胞壁木质化和维持活性氧平衡,提高柑橘细菌性溃疡病的抗逆性[32]。经CMCS处理的葡萄柚果实,参与苯丙烷生物代谢的PER63基因表达量显著下调,由此推测,CMCS可能增强果皮细胞壁木质化,提高抗病性。
细胞色素P450(cytochrome P450,CYPs)被称为“万能的生物催化剂”,包括CYP71、CYP92、CYP73等多个家族。CYPs基因是植物防御体系响应外界胁迫的重要组成部分,其表达受环境胁迫因子诱导,可通过脂肪酸、激素以及萜类、黄酮类等物质的生物合成和调节作用,保护植物免受各种不利因子损伤[33]。CYP74B16通过催化脂肪酸的降解参与植物抗病信号通路[34]。本实验CMCS诱导处理葡萄柚果实,CYP92C6基因表达量在油菜素类酯生物合成、次生代谢和代谢途径中显著下调,推测CMCS对抗性物质的合成具有调节作用。
上述实验结果表明,采后CMCS浸泡处理可诱导提高葡萄柚果实对P.digitatum和P.expansum抗病性,通过转录组分析发现CMCS可以诱导WRKY转录因子与其他抗性基因相互作用,在葡萄柚果实抗病反应中发挥了重要的调控作用,为葡萄柚抗性相关基因挖掘和抗性响应的分子机制提供理论基础。揭示了CMCS诱导果实产生抗性作用的机理,并为今后葡萄柚的采后运输和保存提供了一定的现实指导意义。
