柯乐猪PRLR基因多态性与繁殖性状的关联性
2023-04-05郭小江杨红文谭元成王春源张依裕
杨 酸,郭小江,杨红文,熊 力,李 晨,谭元成,王春源,张依裕,*
(1.贵州大学 动物科学学院,高原山地动物遗传育种与繁殖教育部重点实验室,贵州 贵阳550025; 2.贵州省农业农村厅,贵州 贵阳550001)
柯乐猪属云贵高原乌蒙乌金猪类群,是贵州省优良的地方猪种质资源,具有肉质优良、耐粗饲、适宜放养、生长速度缓慢、繁殖性能差等特点,是乌蒙喀斯特山区真正的“乌金猪”,也是贵州省不可多得的宝贵猪种资源[1-2]。一直以来,当地研究所对柯乐猪进行了种质资源的保种、选育和利用等研究工作,但均未开展柯乐猪品系选育,研究缺乏系统性。目前对于该猪种的研究集中在肉质性状[3-4]、毛色[5]、饲养方式[6]和耐粗饲特性[7]等方面,在繁殖性状方面的研究甚少。近年来,猪的繁殖性状逐渐作为重点改良目标性状进而快速提高猪的重要经济性状,且母猪繁殖性状的改良已是提高母猪年断奶仔猪数的首要考虑因素,于母猪的繁殖性能而言,产仔数是评定其繁殖力的一个最重要的指标。也有研究表明,增加窝产活仔数可显著提高初生窝重和断奶窝重[8],初生窝重又是断奶窝重的基础,断奶窝重是母猪繁殖性能各项指标的总体现[9]。这些常见的繁殖性能指标遗传力偏低[10],受不同因素的影响,人们偏向于采用全基因组关联研究来探究猪繁殖性状的遗传结构相关问题[11],其中,单核苷酸多态性(single nucleotide polymorphism, SNP)被用来评估动物之间的亲缘关系,即使用全基因组SNP面板作为标记和统计方法,同时捕捉大量SNP的影响[12]。目前,大多数SNP发现的候选基因或QTL(数量性状位点)已被确定,这些数据将成为突破性育种技术的推动力,并提高养猪业的生产效率。由此,对于产仔数少、繁殖力低的地方品种,从分子层面探究遗传性状的差异,并确定控制表型性状的基因或与该基因紧密连锁的遗传标记,对该品种直接进行基因型选择或标记辅助选择,能够有效提高地方品种的选育效率。
催乳素(prolactin,PRL)是一种蛋白质激素,具有多种生物学功能,包括适应性应激反应、渗透调节、子宫功能、乳腺的增殖和分化、泌乳等方面[13]。PRL通过其多种形式的膜相关受体发挥作用,催乳素受体(prolactin receptor,PRLR)基因较长,其总长度大于100 kb,至少由10个外显子和9个内含子组成,且第一外显子是可变的[14]。PRLR基因早已被证明与母猪繁殖性状有显著关联[15],在大白猪、长白猪、杜洛克猪[16]、藏猪[17]、波兰猪[18]、定远猪[19]和松辽黑猪[20]等多个中外猪种上针对其繁殖性状已有不同程度的研究。PRLR是否能作为柯乐猪在繁殖性能方面的关键候选基因至今未能证明。因此,本文以柯乐猪为研究对象,利用Sanger直接测序法查找PRLR基因的SNP位点,并与柯乐猪的7个繁殖性状做关联性分析,进一步寻找与柯乐猪繁殖性状相关的遗传标记,为其繁殖性能改良和在养猪生产中的应用提供科学依据。
1 材料与方法
1.1 材料
试验猪群来自贵州省赫章县柯乐猪保种场,随机选择柯乐猪母猪204头,采集约0.25 g耳组织,置于75%乙醇的离心管中,放入冰盒带回实验室,转入-20 ℃冰箱保存待用。记录该猪群母猪头胎的总产仔数、产活仔数、初生窝重、初生个体重、断奶窝仔数、断奶窝重和断奶个体重等数据。
1.2 基因组DNA提取
参照陈文娟[21]的苯酚-氯仿-异戊醇抽提法提取母猪耳组织DNA,用1%琼脂糖凝胶电泳和核酸浓度检测仪(NanoDrop2000)联合检测基因组DNA的浓度和纯度,置于-20 ℃保存。
1.3 引物设计与合成
根据NCBI中猪PRLR基因的DNA参考序列(登录号:NC_010458.4),结合在线软件Primer Premier 3.0(http://primer3.ut.ee/)设计猪PRLR引物序列(表1),P1引物位置在第2外显子内,P2引物位置在第8外显子内,P3引物的位置在第3内含子和第4外显子之间,P4引物的位置在第6、第7外显子,以及第6、第7部分内含子之间。引物由生工生物工程(上海)股份有限公司合成。
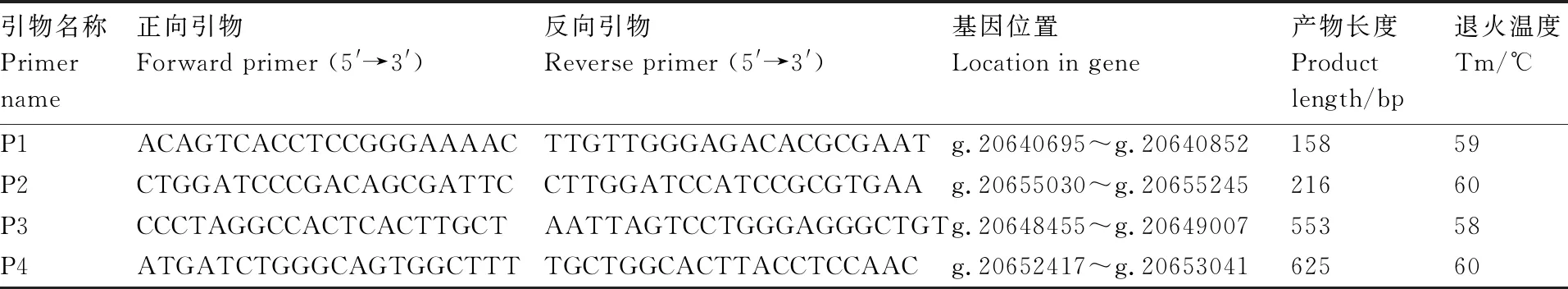
表1 PRLR基因扩增引物信息
1.4 PCR扩增与SNP检测
PCR反应体系(20 μL):1 μL DNA,10 μL 2×TaqPCR master mix,上、下游引物各1 μL (10 mmol·L-1),7 μL ddH2O。PCR反应程序:95 ℃预变性5 min;95 ℃变性30 s,最适温度退火40 s,72 ℃延伸30 s,共35个循环;72 ℃延伸5 min,最后4 ℃保存。PCR产物经1.2%的琼脂糖凝胶电泳检测,将检测合格的样本送生工生物工程(上海)股份有限公司进行双向测序,测序结果采用DNAStar软件中的MegAlign和Editseq程序进行SNP位点筛选,同时进行基因分型。
1.5 数据处理
通过RNAfold web server (http://rna.tbi.univie.ac.at/cgi-bin/RNAWebSuite/RNAfold.cgi)预测mRNA二级结构,并对比参考序列和柯乐猪PRLR基因SNPs的mRNA二级结构;利用Excel 2010软件计算PRLR基因各个位点的基因型频率、等位基因频率、遗传杂合度 (heterozygosity, He)、有效等位基因数 (number of effective alleles, Ne)、多态信息含量 (polymorphism information content, PIC)和Hardy-Weinberg平衡;用SHEsis在线软件 (http://analysis.bio-x.cn/)对SNP位点连锁不平衡(linkage disequilibrium, LD)和单倍型进行计算分析;采用SPSS 22.0软件的一般线性模型(general linearmodel, GLM)分析PRLR基因SNPs与繁殖性状的关联性,以及PRLR基因SNPs双倍型与繁殖性状的差异显著性,分析时采用以下模型:性状观察值=群体均值+基因型效应+随机残差效应,再用Duncan’s法进行多重比较,结果用平均值±标准误表示,P<0.05表示差异显著。
2 结果与分析
2.1 PCR扩增结果
琼脂糖凝胶电泳检测结果表明,4对引物的PCR扩增条带清晰,无冗余杂带(图1),与预设片段大小相符,可用于进一步分析。

M,DL 2000 DNA marker;1~3,P1扩增产物;4~6,P2扩增产物;7~9,P3扩增产物;10~12,P4扩增产物。
2.2 SNPs位点筛查
在柯乐猪PRLR基因第8外显子检测到1个SNP突变位点(g.20655220 C>T)(图2),在第4内含子检测到2个SNP突变位点(g.20648859 C>T和g.20648931 C>T),3个SNP位点均存在3种基因型,即CC、CT、TT。其中g.20655220 C>T突变导致丝氨酸变成脯氨酸,为错义突变。
2.3 柯乐猪PRLR基因SNP位点遗传特性
柯乐猪PRLR基因的多态位点遗传多态性分析结果(表2)表明,g.20655220 C>T、g.20648859 C>T和g.20648931 C>T优势基因型均为CC,其频率分别是0.583、0.657和0.755,优势等位基因均为C,频率分别是0.762、0.784和0.853;遗传指数分析中,g.20655220 C>T和g.20648859 C>T属于中度多态(0.25

表2 柯乐猪PRLR基因SNPs群体遗传信息
2.4 SNPs连锁不平衡、单倍型和双倍型分析
利用在线软件SHEsis对检测到的3个SNPs位点进行连锁不平衡分析(表3),根据D′值和相关系数(r)判断位点之间是否存在连锁,位点g.20655220 C>T与g.20648859 C>T之间的D′值为0.111,r为0.001;g.20655220 C>T与g.20648931 C>T之间的D′值为0.022,r为0,g.20648859 C>T与g.20648931 C>T之间D′值为1.000,r为0.627。由此可得,g.20648859 C>位点与g.20648931 C>T位点之间有较强的连锁不平衡效应(D′>0.85,r>0.33)。

表3 PRLR基因SNP位点的连锁不平衡分析
对柯乐猪PRLR基因3个SNP位点进行单倍型和双倍型分析,结果(表4)显示,3个SNP位点在204头柯乐猪群体中共检测到5种单倍型和9种双倍型,其中,优势单倍型是H1(CCC),频率为0.610;劣势单倍型是H5(TTT),频率为0.049;优势双倍型是H1H1(CCCCCC),频率为0.382,劣势双倍型是H2H3(TTTTTT),频率为0.039。

表4 PRLR基因单倍型和双倍型分析
2.5 柯乐猪PRLR基因mRNA二级结构
RNAfold web server预测结果表明,g.20655220 C>T导致PRLR基因mRNA序列二级结构发生一定改变,且mRNA二级结构最小自由能有所提高,由-648.40 kcal·mol-1变为-647.90 kcal·mol-1,可能会使得mRNA二级结构稳定性降低。其突变前跟突变后的mRNA二级结构见图3。

图3 柯乐猪PRLR基因mRNA二级结构
2.6 PRLR基因SNPs与柯乐猪繁殖性状的关联性分析
利用SPSS18.0软件中的单因素方差分析来分析PRLR基因3个SNPs位点与柯乐猪繁殖性状的关联性,结果(表5)显示,g.20655220 C>T位点CC基因型母猪的初生个体重、断奶窝重和断奶个体重均显著(P<0.05)高于CT基因型,但与TT基因型差异不显著(P>0.05);g.20648859 C>T位点不同基因型在各繁殖性状上均无显著差异(P>0.05);g.20648931 C>T位点CT基因型母猪的初生个体重、初生窝重和断奶窝重均显著(P<0.05)高于CC基因型和TT基因型,且该位点在初生个体重上,CC基因型显著(P<0.05)高于TT基因型。
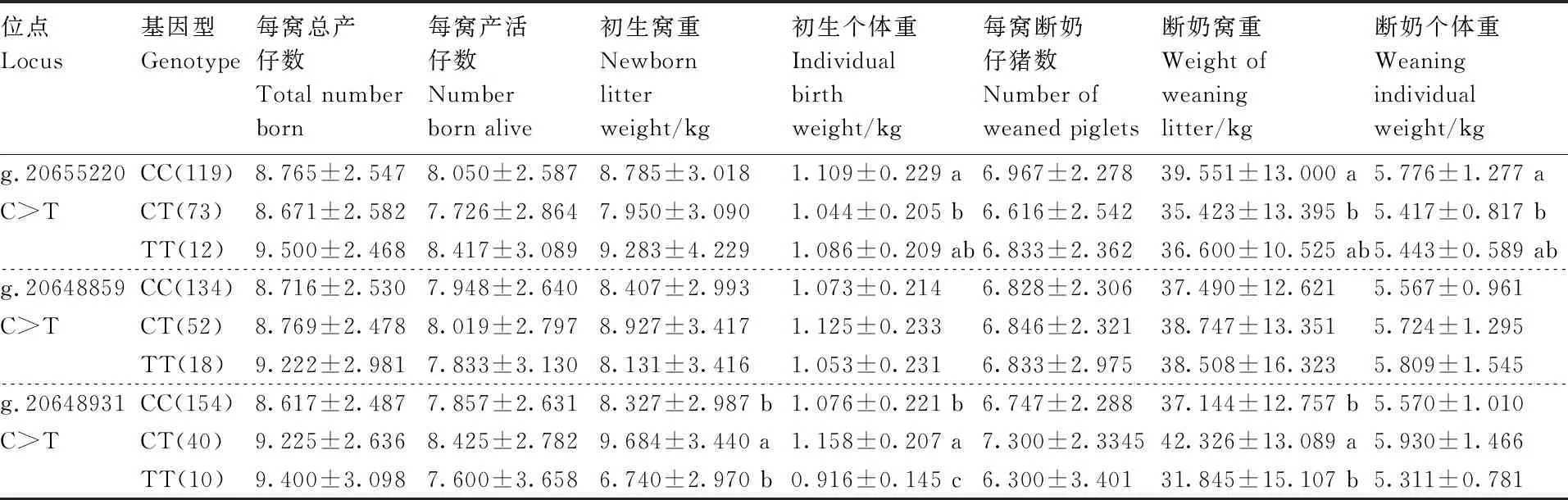
表5 柯乐猪PRLR基因SNP位点与繁殖性状的关联性
2.7 PRLR基因双倍型与柯乐猪繁殖性状的关联性
将PRLR基因3个SNPs组成的双倍型与可乐猪繁殖性状进行关联性分析,结果(表6)显示,双倍型H1H5(CTCTCT)个体的总产仔数显著(P<0.05)多于H2H4(CTCTCC)双倍型个体,且产活仔数均多于其余双倍型;双倍型H1H3(CCCTCT)个体的初生窝重和初生个体重均显著(P<0.05)高于H1H4(CTCCCC)个体和H3H5(CTTTTT)个体,双倍型H2H3(CCTTCT)的初生个体重、断奶窝重和断奶个体重均显著(P<0.05)高于H3H5(CTTTTT)。
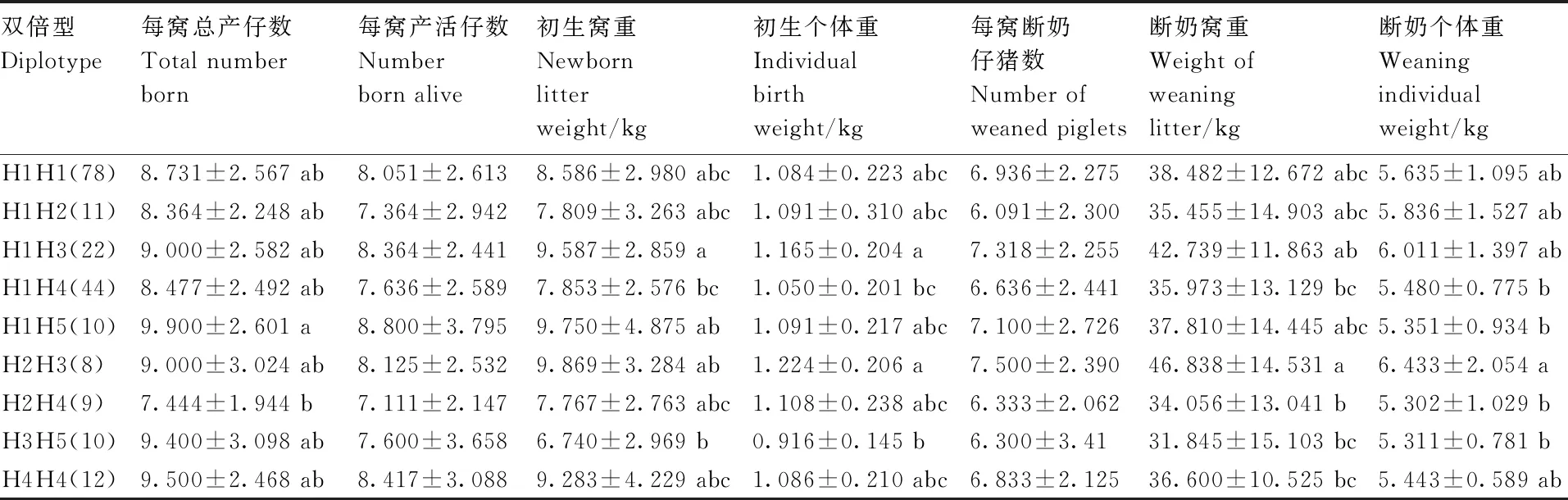
表6 柯乐猪PRLR基因3个SNP位点双倍型与繁殖性状的关联性
3 讨论
与大部分国内外猪种相比,柯乐猪具有产仔数低、性成熟早、繁殖率低的生理特性,经采集,本试验研究群体的平均总产仔数和产活仔数分别为8.63头和7.92头,而近些年杂交猪种的频繁应用,地方猪种的生存空间进一步缩小,大概是由于地方猪种繁殖力较低下,且生长缓慢、育种周期更长[22],因此,提高地方猪种繁殖力是当前研究的一个重点及热点。PRLR基因作为母猪繁殖性状的重要候选基因之一,在大脑中的广泛表达突出了催乳素在调节神经元功能中的多效性作用,能够促进乳腺发育、维持泌乳功能,并对家畜性腺发育和母体行为产生影响[23]。本研究在柯乐猪PRLR基因第8外显子检测到1个SNP突变位点(g.20655220 C>T),在第4内含子检测到2个SNP突变位点(g.20648859 C>T和g.20648931 C>T),3个位点呈现不同的多态性:g.20655220 C>T和g.20648859 C>T属于中度多态(0.25
PRLR基因定位于猪的16位染色体,与母猪的繁殖性状密切相关,已有大量学者对PRLR基因多态性和母猪产仔性能展开研究。Sun等[26]研究表明,PRLR基因在5个山东地方猪种和3个国外猪种的受试群体中存在多态性位点,且产仔数性状的效应明显,遗传多态性丰富,并证实了该基因比RBP4基因的遗传效应更大;Birgitte等[27]早在2002年就已证实PRLR基因是大白×梅山F2杂交母猪初情年龄、产活仔数和产仔数的主效基因或标记。本研究在柯乐猪PRLR基因上新发现的3个多态位点中,g.20655220 C>T位点对柯乐猪母猪初生个体重、断奶窝重和断奶个体重的影响达显著性水平,该位点的CC基因型母猪的初生个体重、断奶窝重和断奶个体重均显著高于CT基因型。与此类似,Vashi等[28]研究显示,PRLRCC基因型与印度本土猪的断奶窝重呈正相关;范一萍等[29]在大白猪群体上的验证显示,其纯合基因型BB基因型个体的断奶窝重显著高于杂合基因型AB基因型,且其内含子上的g.20648931 C>T位点对其初生个体重、初生窝重和断奶窝重的影响也达到显著水平,其中,g.20648931 C>T位点CT基因型母猪的初生个体重、初生窝重和断奶窝重均显著高于CC基因型和TT基因型,且该位点在初生个体重上,CC基因型又显著高于TT基因型。出现此类情况的原因可能与样本量较少,且均为头胎繁殖数据相关,尤其在地方猪种群体中,普遍呈现性成熟较早的情况,而有些后备母猪的身体可能还没有完全发育成熟,从而造成头胎繁殖数据的一定局限性。因此,后期有必要进一步展开研究,对经产母猪繁殖性状进行关联分析。
在产仔数方面,本研究中PRLR基因3个SNPs位点与柯乐猪产仔数和产活仔数的关联性均未达到显著水平,这与胡慧艳等[30]的研究结论相同,其表示PRLR基因对产仔数不存在显著影响。将PRLR基因3个SNPs组成的双倍型与可乐猪繁殖性状进行关联性分析发现,H1H5(CTCTCT)双倍型个体在总产仔数上显著高于H2H4(CTCTCC)双倍型个体,且其产活仔数均高于其余双倍型,由此初步认为双倍型H1H5(CTCTCT)为有利双倍型,在产仔数的培育过程中可作为分子标记辅助选择的参考。另外,双倍型H1H3(CCCTCT)个体的初生窝重和初生个体重均显著高于H1H4(CTCCCC)个体和H3H5(CTTTTT)个体;在断奶窝重和断奶个体重方面,双倍型H2H3(CCTTCT)为最优组合,均高于其他双倍型,且在初生个体重、断奶窝重和断奶个体重上均显著高于H3H5(CTTTTT)。综上所述,g.20655220 C>T位点的CC基因型是改善柯乐猪母猪繁殖性状,特别是初生个体重、断奶窝重和断奶个体重的有利基因型。双倍型H1H5(CTCTCT)是产仔数和产活仔数的有利双倍型,H2H3(CCTTCT)在断奶窝重和断奶个体重上为较优双倍型。
