核心素养视域下的高中化学项目式学习
——以“模拟侯氏制碱法制备纯碱及产品含量测定”为例
2023-04-05王长艳
张 晶 王长艳
(北京中学 北京 100018)
一、项目的提出
元素化合物知识是中学化学重要的基础知识,《普通高中化学课程标准(2017 年版2020 年修订)》中,关于金属及其化合物性质的学习要求是:结合真实情境中的应用实例或通过实验探究,了解钠、铁及其化合物的主要性质,了解这些物质在生产、生活中的应用。[1]有研究表明,将学习内容主题化,设置真实情境和挑战性问题任务,可以促使知识结构化、功能化、素养化,有利于学生建构认识模型,使核心素养的发展具体化、整合化。[2]
项目式学习以真实情境将学生带入学习环境中,学生可以围绕某个具体学习项目,参与真实问题的解决,并在学习过程中内化核心知识、养成学科思想方法、发展核心素养。
“模拟侯氏制碱法制备纯碱及产品含量测定”一课,采用项目式学习的方式,以模拟纯碱的制备及其含量测定作为学习任务。首先,查阅资料,了解纯碱的制备历史;其次,自主设计模拟侯氏制碱法的实验,迁移应用碳酸钠与碳酸氢钠性质,进一步掌握物质制备及分离提纯的方法;最后,设计实验测定样品中碳酸钠的含量,建立定量测定混合物中物质含量的思维模型。
二、项目学习实施过程
1.查阅文献,了解纯碱的制备历史
学生通过查阅资料,了解工业生产纯碱的发展历史以及侯德榜先生的生平。工业制碱法大致经历了三个阶段,如图1所示。
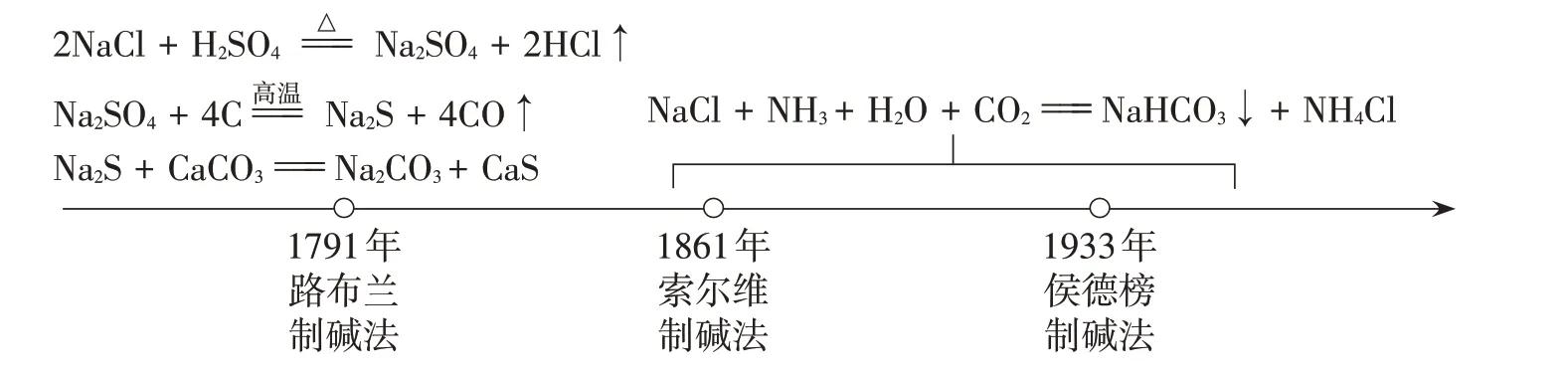
图1 纯碱制备发展历史及主要实验原理
学生发现历史上纯碱的制备是一个漫长的探索过程。在了解历史上各种制备纯碱的方法时,引导学生进行思考,这种制碱方法的原理是什么?优点是什么,有无缺点?可以如何改进?
路布兰制碱法的生产过程在固相进行,难以实现连续生产,不仅需要高温,还需要硫酸作为原料,导致设备腐蚀严重,原料没有充分利用,副产品多,产品质量不高。引导学生思考:是否应该发展可以在液相进行的反应?科学家也是这样想的,就出现了索尔维制碱法。这种制碱方法无需高温,产品纯度高达99%,工艺简单,原料便宜,适合大规模生产,但是该工艺被英、法、德、美等国垄断,设计图纸和技术对外严格保密;侯德榜先生对索尔维制碱法进行了重新审视,并且将氨碱法和合成氨工业联合起来,可同时生产纯碱(Na2CO3)和氮肥(NH4Cl),并且将索尔维制碱法中原先废弃的CaCl2变为了NH4Cl,成功解决了排放CaCl2污染土壤的问题。在学习的过程中,学生沿着纯碱制备的发展历史,通过寻找核心反应,了解如何控制反应条件实现纯碱的制备,不仅为后续设计模拟制备纯碱方案提供理论指导,并且可以学习侯德榜先生敢于创新、不断进取的科学态度。侯德榜先生将制碱法的原理分享给了全世界,这种无私的精神,更值得赞扬,在这个过程中不仅可以增强学生的民族自信,也发展了学生科学态度与社会责任的核心素养。
2.设计方案,模拟实验室制备纯碱
依据侯德榜制碱法的反应原理及物质间转化关系,结合实验室现有实验条件,引导学生找到可以利用NH4HCO3作为NH3和CO2的替代反应物,从而在实验室中可以制备NaHCO3。反应方程式为
再将NaHCO3灼烧得到Na2CO3。
其次,确定实验室制备NaHCO3的反应条件。
制备NaHCO3的反应为液相反应,因此,影响该反应的因素主要为温度和反应物浓度。在学习过程中,引导学生对反应物的浓度和反应的温度进行思考:要保证Na+和HCO在溶液中达到饱和才会析出NaHCO3固体,为了促进碳酸氢钠沉淀的析出,就需要促进平衡向生成沉淀的方向移动,设法增大Na+和HCO的浓度,可以选择饱和氯化钠溶液作为反应物,再依据化学方程式的定量关系确定所加碳酸氢铵的质量。通过降温可使溶解度减小,但温度过低,又会使碳酸氢铵等析出,温度过高,反应物NH4HCO3会受热分解,因此,需要选择合适的温度。从表1中的数据可以发现,NH4HCO3在40 ℃就已经分解,所以反应温度不能高于40 ℃,实际上35 ℃就已经分解,那么温度低一些好不好呢?温度低,反应物溶解度小,导致反应物的浓度减小,也不利于碳酸氢钠的析出。在实际情境中,要考虑温度和浓度对反应的影响。结合表1中的数据,最后确定反应温度为30~35 ℃。
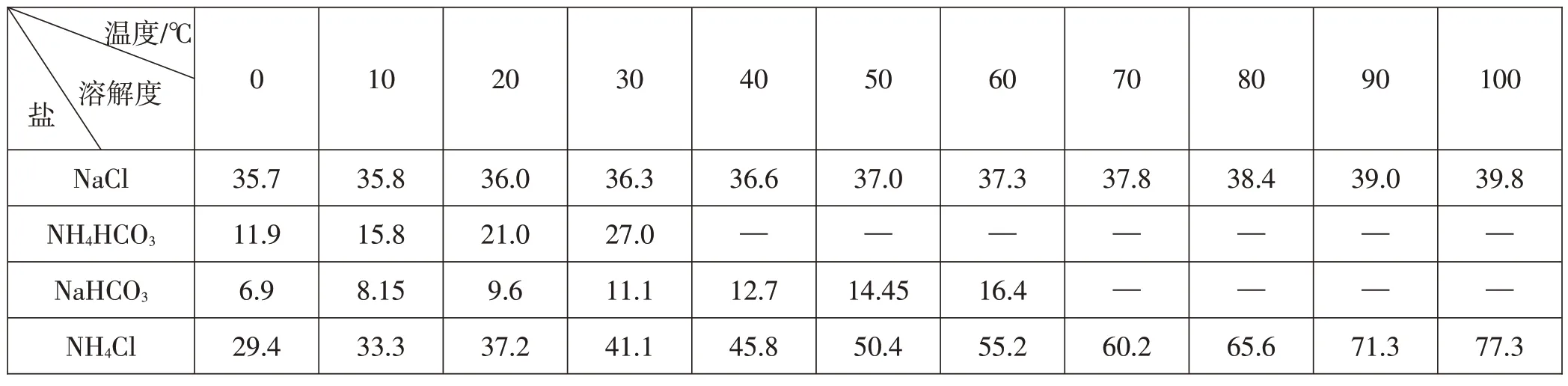
表1 NaCl、NaHCO3、NH4HCO3、NH4Cl四种盐在不同温度下的溶解度
最终确定模拟侯氏制碱法的实验流程及操作如下:
实验过程示意图如图2所示。

图2 模拟侯氏制碱法的实验过程示意图
①称量8.5 g NH4HCO3置于50 mL 烧杯中,加入20 mL 水进行初步溶解,将烧杯在30 ℃水浴中加热2 min,使固体充分溶解。
②另取20 mL饱和NaCl 溶液,置于小烧杯中,在30 ℃的水浴中加热。
③待温度恒定后,将NH4HCO3溶液缓慢加至饱和NaCl 溶液中,控制水浴温度为30~35 ℃,NH4HCO3溶液全部加完后,在该温度下不断搅拌约10 min,然后从水浴中取出烧杯,慢慢搅拌一段时间后静置。
④将静置后的烧杯中的溶液及固体进行抽滤。
⑤将抽滤后所得固体转入到蒸发皿中,小火烘干,再将固体移入坩埚,用玻璃棒轻轻搅拌,加热30 min,冷却至室温,称重。
通过实验,学生经历了从实验方案的设计、实验原料的选择、试剂用量的选择、温度的选择以及制备过程中的操作细节等实验探究过程,实现了工业生产的实验室模拟,从实验原理到实际操作的过渡和转化,体会了侯氏制碱法的产生过程,不仅加深了对侯氏制碱法原理层面的认识,更亲历了如何从一个实际问题出发,寻找实验原理,确定反应条件,选择实验装置的探究过程,发展了科学探究与创新意识的核心素养,并在真实任务情境中建构了进行物质制备与分离提纯的一般思维模型。
3.定性分析产品成分,定量测定各成分的含量
产品中碳酸钠的含量是多少呢?教师进一步引导学生确定定量测定的实验方案。
定性分析:首先引导学生分析所制得样品的主要成分,从反应原理来看,产品中可能存在的杂质为NH4HCO3、NaHCO3、NaCl、NH4Cl。但由于铵盐受热易分解,杂质可能为NaHCO3与NaCl。若取少量样品加水溶解,再向其中加入足量稀HNO3酸化的AgNO3溶液,出现白色沉淀,就可判定反应后的产物中含有NaCl,进而可确定所制得的样品中可能存在的物质为:Na2CO3、NaHCO3、NaCl。
定量测定:测定样品中Na2CO3、NaHCO3、NaCl 的含量。碳酸钠与盐酸的反应为两步反应:
若样品中含有碳酸钠,则用盐酸滴定样品时,记录第一阶段所用盐酸体积为V1,将所用盐酸的浓度与体积V1代入方程式Na2CO3+HCl==NaHCO3+NaCl 中进行计算,就可以得出样品中Na2CO3的含量,计算公式为ω(Na2CO3)=c(HCl)×M(Na2CO3)×V1/m;第二阶段参与反应的NaHCO3有原样品中灼烧未完全转化的NaHCO3,也有与Na2CO3反应新生成的NaHCO3,记录第二阶段消耗的盐酸体积为V2,将所用盐酸的浓度与体积V2-V1代入方程式NaHCO3+HCl==NaCl+H2O+CO2↑进行计算,就可以得出样品中NaHCO3的含量,计算公式为ω(NaHCO3)=c(HCl)×M(NaHCO3)×(V2-V1)/m。滴定过程中,第一阶段选择的指示剂为酚酞,滴定终点现象为溶液由红色变为粉红色,且半分钟不变色;第二阶段选择的指示剂为甲基橙,滴定终点现象为溶液由黄色变为橙色,且半分钟不变色,所采用的盐酸浓度均为0.2 mol/L,样品质量为1 g。最终测定结果为,样品中Na2CO3质量分数为41.2%,NaHCO3质量分数为14.3%,NaCl 质量分数为44.5%。其中一组同学的三次平行实验测定数据如表2 所示。
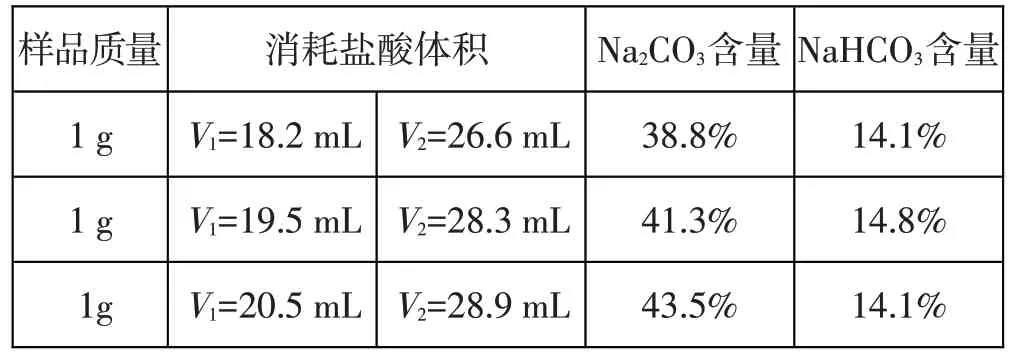
表2 某小组同学所测定的纯碱样品中Na2CO3与NaHCO3含量
在定性分析成分与定量测定实验的过程中,通过师生、生生互动讨论,展示思维过程,不仅迁移应用了Na2CO3、NaHCO3与酸反应的性质,更进一步建立了在利用滴定法测定组分含量的实验中,如何选择恰当指示剂的思维模型。在运用此模型解决实际问题的过程中,发展了学生证据推理与模型认知的核心素养。
三、反思与总结
在本项目学习完成后,各小组同学进行了班级交流与汇报,与其他同学分享了实验过程中自己的收获、反思及启发。学生在一个真实任务的引领下,进行查找资料、设计方案、实验探究、小组合作、班级交流等工作;教师及时引导学生分析总结学习过程中的得失,指导学生从化学视角出发,在真实情境中寻找解决问题的方法。项目任务和化学核心知识相互结合、相互支撑,学生在完成项目任务的过程中,学习了化学学科核心知识,落实了化学学科核心素养。
