‘赤霞珠’种子成熟过程中缩合单宁的变化及其与颜色参数的相关性
2023-04-01刘敖一夏弄玉王京京孙琪潘秋红
刘敖一,夏弄玉,王京京,孙琪,潘秋红
(中国农业大学食品科学与营养工程学院/农业农村部葡萄酒加工重点实验室,北京 100083)
葡萄果实中重要的酚类物质有酚酸、黄酮醇、黄烷醇、花色苷和单宁,它们可以在葡萄酒酿造过程中浸出、转化和衍生,从而决定了葡萄酒的颜色、口感、收敛性和陈酿潜力[1]。葡萄酒中酚类物质的种类和含量主要取决于果实,且与果实成熟度密切相关[2],基于此,越来越多的葡萄酒生产者对葡萄果实成熟采收时期的判断,除了考虑糖、酸含量之外,还特别关注酚类物质。
单宁是葡萄酒中一类非常重要的酚类物质,根据其结构和水解性质,可分为水解单宁(Hydrolyzed tannins)和缩合单宁(Condensed tannins)。水解单宁是由棓酸或棓酸衍生的酚羧酸与多元醇所组成的酯在酸、碱和酶的作用下产生的多元醇和酚羧酸,主要来源于橡木桶陈酿和外源性酚类,少量来源于葡萄的果皮和种子,对酸和热的稳定性不及缩合单宁;缩合单宁又称原花色素(Proanthocyanidins, PA),是由黄烷-3-醇单体聚合而成,葡萄酒中的PA主要来源于果皮和种子,葡萄种子的PA含量高于果皮,聚合度略低于果皮[3]。相对而言,葡萄果皮的PA容易浸出,在酒精发酵初期可大量浸提出来,而种子的PA浸出量较低,但在发酵后期或后浸渍阶段,种子PA浸出速度加快,使得其在红葡萄酒最终产品中的含量占比高于果皮PA[4]。葡萄果实不同来源的PA对葡萄酒滋味和口感有不同的影响,种子PA具有中等聚合度,总体上其涩感强度弱于果皮PA,优质葡萄酒的特点是种子单宁与果皮单宁的平衡[5]。在一些炎热葡萄酒产区,由于果实成熟和种子成熟不同步,导致酿酒葡萄采收时种子未达到成熟状态,从而对葡萄酒品质有较大影响[6]。因此,探究酿酒葡萄种子PA在果实发育过程的变化,找到快速判断种子PA成熟的方法对葡萄酒酿造具有重要的意义。但是由于种子PA提取难度和分析方法的复杂性,目前关于它的研究相对较少。
PA可以与口腔中的蛋白质结合,从而在口腔中引起涩感。许多研究表明,涩感强弱与PA浓度和平均聚合度(mean degree of polymerization, mDP)呈现正相关[7-10]。PA的溶解度随聚合度的增加而降低,利用其在丙酮水溶液中的溶解性,可分为可溶性PA和非可溶性PA[11]。通常认为,可溶性PA能够在发酵过程中进入酒体,从而对葡萄酒口感产生影响,而较高聚合度的非可溶性PA在葡萄果实中与细胞壁成分结合,不容易浸到酒体中,即使浸至酒体也可能因分子太大而重新形成沉淀,对最终葡萄酒产品涩感的影响是有限的。以往对于PA聚合度,主要关注其mDP值,测定方法是采用强酸处理使PA水解为单体, PA中的延伸单元可以与亲核试剂——间苯三酚结合,而末端单元不能与间苯三酚结合,从而实现对延伸单元和末端单元的分别计数,并计算mDP值[12]。从其测定原理可以看出,mDP值可以在一定程度上反映PA的聚合度大小,但不能反映PA的溶解性。因此,了解种子成熟过程中可溶性PA和非可溶性PA含量的变化,有助于预测其对葡萄酒感官质量的潜在影响,能够为优质葡萄酒原料采收时期的确定提供参考。
葡萄种子中的单宁主要分布在表皮。已有研究表明,葡萄种皮颜色的变化与葡萄浆果花色苷和果皮总酚含量均显著相关,这也说明种子的外观和颜色可作为浆果整体成熟度的额外指标[13]。在葡萄种子发育过程中,种子表皮颜色由绿色到褐色的变化与种子中总PA含量下降时段一致,其中部分原因可能是由于单宁的氧化而导致种子颜色的加深[11]。通过探究种子表皮颜色的变化规律,建立表面颜色和种子PA含量之间的相关性,以期为实际生产中种子PA成熟度的快速判别提供数据支撑。
1 材料和方法
1.1 试验材料
本研究所用的酿酒葡萄品种为‘赤霞珠’(Vitis viniferaL. cv. Cabernet Sauvignon),以可溶性固形物为标准,2019年在物候期E-L33、E-L35、E-L35.5、E-L36、E-L37、E-L38六个点采样,对应具体时间分别为转色前15 d,转色后0、6、15、46、67 d。采样时设置3个生物学小区,每个小区15株,每次每个小区随机选择30穗果,兼顾阴阳面果穗,共采样300粒,除了50粒用于测定糖、酸含量之外,其余的立即液氮速冻,低温速运至实验室,贮藏于﹣80℃超低温冰箱中备用。果实破碎后取种子,测定表面颜色,之后种子磨粉,用于测定PA及其组成单元的含量。
1.2 试验方法
1.2.1 葡萄果实可溶性固形物和可滴定酸含量测定
取50粒果实,去除种子,将果实破碎、离心(4054 r·min-1,常温)、取汁,采用数显手持糖量计(PAL-1,Atago,Japan)测定葡萄汁的可溶性固形物含量,用百分数表示。参照GBT 15038—2006《葡萄酒、果酒通用分析方法》,测定可滴定酸含量,用酒石酸(g·L-1)表示。
1.2.2 种子可溶性和非可溶性PA的提取与测定
参照Yu等[14]进行,稍作修改。可溶性PA的提取与测定:取100 mg种子样品粉末于2 mL离心管中,向样品中加入1 mL单宁提取缓冲液(70%丙酮,0.1%乙酸,Vol),在冰水中超声30 min,4 ℃下12 000 r·min-1离心10 min,取上清,沉淀按照上述步骤再提取两次,合并3次得到的上清液,即为可溶性PA的粗提液。沉淀用于非可溶性PA的测定。
将上清液与等体积氯仿混合充分,4 ℃下以4054 r·min-1离心5 min,弃下层有机相,重复3次;在上层溶液中加入等体积正己烷,涡旋混合,4 ℃下以9730 r·min-1离心5 min,保留下层溶液,重复3次。对所得下层溶液氮吹,直至液面基本不变,液氮速冻,放于﹣20 ℃下冷冻干燥后,用600 μL 50%(Vol)色谱级甲醇/水溶液复溶,即得到可溶性PA提取液。每个样品提取3份,分别用于以下测定。
取2 μL各样品可溶性PA提取液以及各2 μL的0、0.75、1、1.5、3 mg·mL-1(-)-表儿茶素标准溶液于96板各孔中,随后向各孔中加入100 μL 4-二甲基氨基肉桂醛(4-dimethyl-amino-cinnamaldehyde, DMACA)反应液(0.2% DMACA, w/v)溶于1∶1甲醇/3 N盐酸。将96孔板放入Spectramax190酶标仪(美国Molecular Devices)中,室温下轻轻震荡5 min后,在640 nm下测量各孔的吸光值。种子可溶性PA的含量用(-)-表儿茶素浓度对吸光值制作的标准曲线进行定量,单位为mg·g-1。
非可溶性PA的提取与测定:将上述提取可溶性PA时得到的沉淀冻干,向干燥粉末中加入500 μL丁醇/浓盐酸(95%丁醇,5%浓盐酸,Vol)溶液,涡旋震荡使沉淀重悬,置于冰水混合物超声处理30 min,4 ℃下以12 000 r·min-1离心10 min,取上清液,即得到非可溶性PA提取液。
将非可溶性PA提取液以及终浓度分别为0、0.05、0.1、0.15、0.2、0.4 mg·mL-1PB1标准品的丁醇盐酸溶液,分别加入到离心管中,共同在95 ℃下保温1 h,冷却到室温后,用丁醇浓盐酸将样品稀释5倍,取各样品100 μL依次加入到96孔板中,测量各样品550 nm的吸光值,各样品中非可溶性PA的含量用PB1浓度对相应吸光值绘制的标准曲线进行定量,单位为mg·g-1。
1.2.3 葡萄种子PA结构单元含量测定及平均聚合度计算
(1)种子可溶性PA和非可溶性PA中黄烷-3-醇的提取。为测定可溶性PA提取液中的游离态黄烷-3-醇,将上述的可溶性PA提取液,经过0.22 μm滤膜过滤后,在﹣20 ℃下冷冻干燥,冻干的粉末用0.1 mL 50%(Vol)色谱级甲醇/水溶液复溶,可用于可溶性PA中游离黄烷-3-醇含量的测定。
为测定可溶性PA中聚合体的黄烷-3-醇单元含量,将上述可溶性PA提取液,经过0.22 μm滤膜过滤后,在﹣20 ℃下冷冻干成粉末,用0.2 mL间苯三酚裂解液(含0.5 g·mL-1抗坏血酸,0.3 mol·L-1盐酸和50 g·L-1间苯三酚甲醇溶液)复溶;为测定非可溶性PA聚合体的黄烷-3-醇单元含量,则将上述提取得到的非可溶性PA粉末,直接用0.5 mL间苯三酚裂解液复溶。这些复溶液均在避光条件下,在50 ℃金属浴中静置20 min,这时非可溶性PA裂解为不带间苯三酚基团的末端单元和带间苯三酚基团的延伸单元。氮吹至干后,加入100 μL 50%(Vol)色谱级甲醇复溶,溶液用于非可溶性PA聚合体中各种黄烷-3-醇单元含量的测定。
(2)黄烷-3-醇的测定。利用实验室建立的高效液相色谱与质谱联用(HPLC-MS)分析方法[15]。仪器为 Agilent 1290 Infinity II UPLC与6460 triple quadrupole 质谱联用仪,配备 XTerra C18色谱柱。HPLC 洗脱条件如下:A相(含0.1%甲酸的超纯水溶液),B相(含0.1%甲酸的甲醇),流速 0.4 mL·min-1。洗脱程序:0~1 min,5%B;1~2 min,5%~10%B;2~17 min,10%~31%B;17~19 min,31%~95%B;19~20 min,95%~5%B;20~23 min,5%B。采用FIA(Flow Injection Analysis,每次进样量为2 μL)方法配合MassOptimizer软件(Agilent)对质谱检测条件进行优化。质谱检测器参数为:鞘气流速12 L·min-1,温度350 ℃;干燥气流速5 L·min-1,温度300 ℃;雾化气压30 psig;喷嘴电压500 V;毛细管电压2.5 kV;负离子扫描模式;碎裂电压94 V;碰撞能量13 eV。
可检测到的单体为儿茶素((+)-Catechin,C),表儿茶素((-)-Epicatechin,EC),表儿茶素没食子酸酯((-)-Epicatechin gallate,ECG)。其中游离单体从裂解前可溶性PA分离测出;延伸单元通过裂解后可溶与非可溶性PA的延伸单元单体与亲核试剂加成,单独测出计量;末端单元通过测定裂解后可溶性与非可溶性PA未与亲核试剂加成的单体测出(可溶性PA中的末端单元还需减去游离单元含量)。根据保留时间和质谱信息(表1)进行定性,儿茶素、表儿茶素、表儿茶素没食子酸酯的标准曲线进行定量,用mg·kg-1表示。

表1 各种黄烷-3-醇物质的保留时间和质谱信息Table1 Retention time and mass spectrum information of various flavan-3-ol compounds
(3)平均聚合度计算。平均聚合度(mDP)=(水解后的延伸单元摩尔数+水解后的游离单体摩尔数-水解前的游离单体摩尔数)/(水解后的游离单体摩尔数-水解前的游离单体摩尔数)[15]。
1.2.4 酿酒葡萄种子表面颜色测定
利用CM-3700A分光测色计(日本柯尼卡美能达公司)测得种子表面的明度L*值、色相a*值、色相b*值。通过下列公式计算得出色彩属性指标饱和度C、色泽比H、色角度h以及色光值s,以量化种皮的颜色属性,计算公式如下[16]:
其中,色泽比H为正数时代表红色,为负数时代表绿色,数值越大颜色越深;色光值s综合了色彩和明度;色角度h表示色彩的色相,色相环中0°代表紫红色,90°代表黄色,180°代表绿色,当h>100°时,随h值增加绿色变深,h<50°时,随h值的增大红色变浅;饱和度C代表色彩的鲜艳程度,也称色彩纯度,即样品除去L*后的单纯色相属性,数值代表与L*垂直的距离,色彩纯度随距离增加而增大,也可以反映出不同颜色色彩的鲜艳程度。
1.3 数据统计分析
数据分析主要采用Eecel、SPSS 20软件分析,黄烷-3-醇的定性定量分析主要采用Qualitative Analysis 10.0和QqQ定量分析软件(Quant-My-Way),绘图软件为Origin 2018,色卡查询及制作软件为Adobe Photoshop 2019。
2 结果与分析
2.1 果实可溶性固形物和可滴定酸含量变化
由图1可知,随着果实成熟,可溶性固形物含量持续升高,而可滴定酸含量相应下降。在转色后46 d,可溶性固形物达到了22.7%,可滴定酸含量为7.59 g·L-1,这时果实已经达到了采收标准。在转色后67 d时,可溶性固形物增至25.25%,可滴定酸含量为6.54 g·L-1,这时的果实被认为处于过熟状态。

图1 ‘赤霞珠’果实可溶性固形物(A)和可滴定酸含量(B)变化Figure1 Variation of soluble solid content (A) and titratable acid content (B) in 'Cabernet Sauvignon'
2.2 种子可溶性PA和非可溶性PA含量的变化
从图2可见,在葡萄果实发育过程中,可溶性PA含量呈现先上升后下降的趋势,峰值出现在转色启动后6 d,含量达到66.35 mg·g-1;相反,非可溶性PA含量持续上升,在本研究最后一个采样点(转色后67 d)达到最大,为6.92 mg·g-1。非可溶性PA含量远低于可溶性PA,但从其占总PA的比例看,随着种子发育,非可溶性PA占比开始变化平稳,随后逐渐增加。在转色期(0 d)占比最低,这说明种子中非可溶性PA占比可随转色后果实成熟进程而增加。

图2 果实发育过程中种子可溶性PA(A)、非可溶性PA(B)含量及非可溶性PA占比(C)的变化Figure 2 Variation patterns of soluble PA (A),insoluble PA (B) content and the proportion of insoluble PA (C) in seeds
2.3 果实种子PA结构单元的变化
无论是游离的黄烷-3-醇还是种子PA的结构单元,葡萄种子中可检测到的黄烷-3-醇主要有3种,分别是儿茶素(C)、表儿茶素(EC)和表儿茶素没食子酸酯(ECG),在种子成熟过程中,它们的含量变化呈现不同的趋势。
由图3可知,发育早期的种子中,游离单体中含量最高的是ECG;随着种子发育,游离的C、EC和ECG单体含量变化均为先增加后减小,暗示着随种子成熟,越来越多的游离态黄烷-3-醇参与到PA的形成中。

图3 葡萄种子发育过程中游离黄烷-3-醇单体的变化Figure 3 Variation of free-form flavan-3-ols during grape seed development
由表2可知,ECG是可溶性PA的主要末端单元,其在种子发育过程中含量变化不显著,而末端单元C和EC的含量随种子发育先增加后减小之后略微升高;EC是主要的延伸单元,但其含量在发育过程中变化也不显著,C和EC的延伸单元则呈现先减少后期略有增加的趋势。
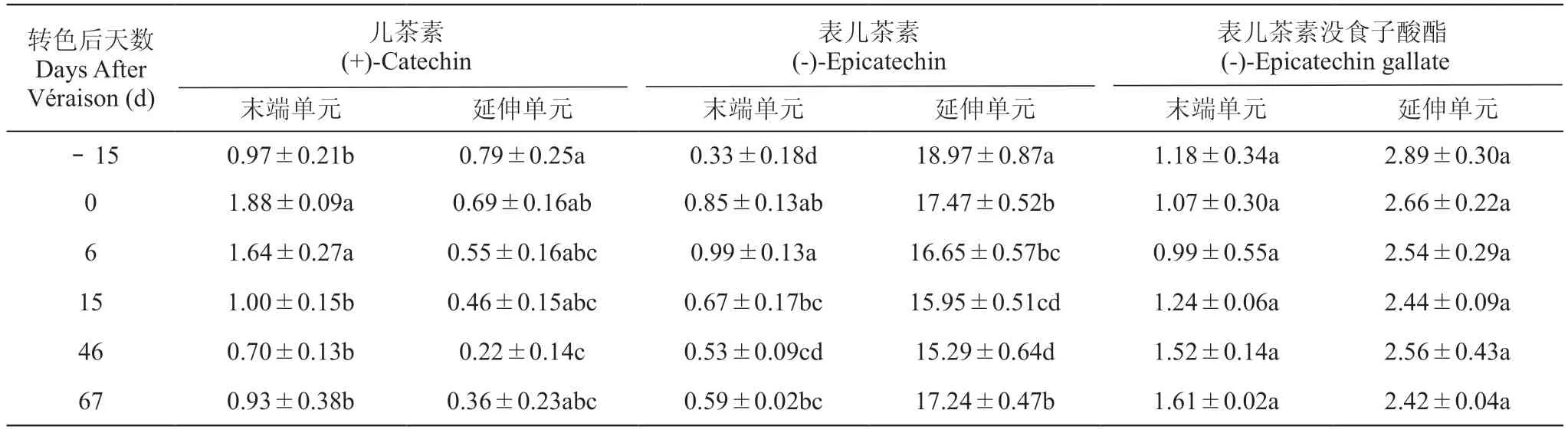
表2 葡萄种子发育各个时期可溶性PA的末端单元和延伸单元的含量Table 2 Contents of terminal and extension unit of soluble PA in grape seed developmentmg·g-1
由表3可知,葡萄种子中非可溶性PA末端单元以ECG为主,而延伸单元以EC为主,并且EC在非可溶性PA结构单元组成中有非常高的占比。随着种子的发育,末端单元的单体变化趋势相似,总体都是先增加后减少,在转色后15 d或46 d达到最大值;EC和ECG延伸单元都是先减少后增加,之后变化不显著,而C总体呈现增加趋势,这与非可溶性PA含量的增加是相符的。

表3 葡萄种子发育各个时期非可溶性PA的末端单元和延伸单元的含量Table 3 Contents of terminal and extension unit of insoluble PA in grape seed development mg·g-1
2.4 果实成熟过程中种子PA的mDP值变化

图4 种子发育过程中可溶性及非可溶性PA的 mDP值变化Figure 4 Variation of mDP in soluble PA and insoluble PA during grape seed development
在种子发育过程中,可溶性PA的mDP值先呈下降趋势,在转色启动开始达到最小为6.50,之后略有上升,变化不显著;而非可溶性PA的mDP值变化趋势与可溶性PA相似,但是达到最低的日期是在转色后15 d,为11.74,之后随着果实成熟,mDP值持续增加。在本研究的最后一个采样点转色后67 d,可溶性和非可溶性PA的mDP分别为7.45和16.87。
2.4 种子表皮颜色参数的变化
利用分光测色计测定不同发育时期葡萄种子表皮的颜色值L*、a*、b*,分析其表皮颜色参数的变化,并绘制色卡图,结果如图5所示,种子表皮由果实转色前15 d的深绿色到转色的浅绿色,转色后6 d‘赤霞珠’种子表皮开始转为浅棕色,接着为红棕色,颜色不断加深。

图5 果实发育过程中种子外观、表皮色卡及其L*、a*、b*值的变化Figure 5 Variation of seed appearance, coat epidermal color and L*, a*and b* values during berry
L*表示种子色彩明度,随颜色增亮而增大。在本研究中,种子表皮的L*值从果实转色开始逐渐下降,说明种子表皮的颜色是不断变暗加深的。a*为正值时,代表颜色偏向红色,为负值则代表颜色偏向绿色。从图5可见,在种子发育过程中,a*值由负变正,并逐渐升高,说明种子表皮的颜色是由绿色色调变为红色色调,且红色色调不断增加;而b*为正值则代表颜色偏向黄色,为负值则代表颜色偏向蓝色,该研究结果表明,b*值随种子成熟其正值减少,表示黄色色调不断减少。
2.5 种子表皮颜色与PA含量的相关性
对种子表面颜色相关参数及可溶性和非可溶性PA含量进行相关性分析,如表4所示。在葡萄种子发育过程中,可溶性PA和色角度呈极显著正相关,与其它参数相关性不明显。而非可溶性PA含量与L*值、b*值和饱和度呈极显著负相关,与a*值、色泽比和色光值呈极显著正相关,相似的相关关系也体现在非可溶性PA含量占比与各颜色参数之间、非可溶性PA占比与L*值、b*值和饱和度之间呈现显著负相关,而与a*值、色泽比和色光值呈现显著正相关性。在所有的表面颜色与PA含量之间的相关性中,非可溶性PA含量与色泽比的相关性系数最高,达到0.877。这些结果表明,在‘赤霞珠’种子的发育过程中,聚合度较大的非可溶性PA与种子表面颜色相关的L*、a*、b*、色泽比、色光值、色角度相关性都很强,可以用这些参数反映种子PA的含量状况。

表4 果实发育过程中种子表面颜色参数与PA间的相关性Table 4 Correlation coefficients between the coat color parameters and PA in the seeds during berrydevelopment.
分别将种子可溶性和非可溶性PA含量、非可溶性PA含量占比作为因变量,L*、a*、b*、色泽比H、色光值s、色角度h、饱和度C作为自变量,进行多元线性回归分析,结果如表5所示。
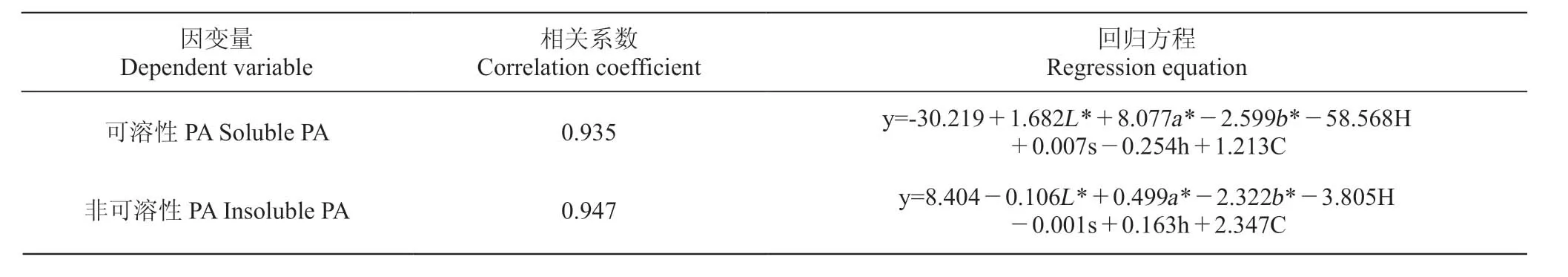
表5 不同发育时期‘赤霞珠’种子PA与表皮颜色的多元回归方程Figure 5 The regression equation of PA and seeds coat color of 'Cabernet Sauvignon' in different developmental stages
PA含量与种子表面颜色参数拟合建立的多元回归方程,相关系数(r)在0.935~0.947,表明拟合程度较好。其中非可溶性PA含量与表面颜色的回归方程相关系数最大,达到0.947,表明该多元回归方程可以充分反映不同发育时期‘赤霞珠’种子的PA含量。
3 讨论与结论
单宁在决定葡萄酒收敛性、颜色稳定和陈酿潜力等方面起着重要作用。本研究表明,在‘赤霞珠’果实转色之后种子中可溶性PA逐渐减少,而非可溶性PA相应增加,由于种子中可溶性PA含量显著高于非可溶性PA,其结果就是随种子成熟PA含量减少,这与前人研究结果相似。许多研究发现,葡萄成熟过程中,果皮单宁含量增加,种子单宁含量减少[17],并且认为这与种子中单宁氧化并逐渐形成种衣有关[18-19]。
PA溶解度的差异也反映了其聚合度的高低,可溶性PA有相对较低的聚合度,而非可溶性PA有较高的聚合度,在种子发育过程中这些非可溶性PA会与细胞壁蛋白、多糖等细胞成分发生氧化交联,造成溶解度降低[20]。在葡萄酒酿造过程中相对于非可溶性PA,可溶性PA的浸提率相对较高,因此,其对葡萄酒感官质量的影响相对较大。但另一方面,PA的收敛性强弱又与聚合度、分子结构密切相关,根据本研究结果,‘赤霞珠’种子中可溶性PA的mDP值在6.50~10.71,而非可溶性PA的mDP值在10.84~45.78。一般认为,只有聚合度<20的PA可浸提至葡萄酒中[21],低聚合度的PA会贡献苦味,而高聚合度PA会贡献涩味;随着 PA聚合度增加,涩感的最大强度(maximun intensity, Imax)增加,同时苦味的Imax和总延续时长(total duration)下降[22]。因此认为随种子成熟,高聚合度的PA增加而低聚合度的PA减少,有利于减轻所酿葡萄酒的苦味,在一定程度上增加涩感和丰满度。
除了聚合度之外,PA组成单元的没食子酯化率也与葡萄酒的涩感强度呈显著的正相关[21],具有较高的没食子酯化率的单宁会有“令人不愉悦”的涩感,表现出干燥、粗糙以及颗粒感[23]。本研究表明,随着种子成熟,游离的ECG显著降低,且非可溶性PA中ECG呈现增加的趋势,这暗示着种子的充分成熟,会使可浸出的ECG减少,间接地对所酿造的葡萄酒感官品质有正面作用。选择合适的采收时间,可以为葡萄酒酿造提供优质的种子PA。
PA是植物色素成分,在拟南芥、小麦和油菜等植物的种皮以及棕色棉纤维中积累,氧化后形成棕色色素[24]。在葡萄种子中PA主要分布在表皮,在成熟过程中,种子的变色原因之一被认为是酚类物质的氧化。根据本研究的结果,种子表皮颜色相关的参数与种子PA的含量具有显著的相关性,可以通过种子表面颜色的L*值、a*值、b*值、色泽比H、色光值s、色角度h和饱和度C做多元回归线性方程,来反映出种子PA的含量。酿酒葡萄种子在采收过程中,可以利用L*、a*、b*颜色模型对种子PA的含量和成熟度进行快速判断。本研究只初步证明种子表皮颜色与PA含量之间有相关性,但具体的合成机理仍然需要进一步确定。
