葡萄果实酒石酸研究进展
2023-04-01杨巧锋李长林裴忺龚林忠金莉王俊芳方林川
杨巧锋,李长林,裴忺,龚林忠,金莉,王俊芳,方林川
(1. 武汉市农业科学院,湖北武汉 430065;2. 湖北省农业科学院果树茶叶研究所,湖北武汉 430209;3. 山东省葡萄研究院/山东省酿酒葡萄与葡萄酒技术创新中心,山东济南 250100)
有机酸是果实代谢的重要产物之一,其构成组分及含量的差异与水果风味和品质有着密切关系[1]。果实中存在的有机酸多种多样,包括苹果酸、柠檬酸、酒石酸、草酸等,但果实往往以1~2种有机酸为主要积累目标。在葡萄果实中,酒石酸(2,3-二羟基丁二酸,Tartaric acid,TA)占有机酸含量的54.87%~69.78%,苹果酸、柠檬酸、草酸分别占有机酸含量的25%、10%、5%左右[2-3]。酒石酸作为葡萄果实中的主要有机酸,不仅影响浆果的风味,也对葡萄酒的颜色、口感、微生物稳定性和陈酿潜力起着重要作用[4-5]。
酒石酸不仅在葡萄属植物和天竺葵属植物中富集,也存在于其它水果如荔枝、蓝莓和一些柑橘类果实中,但在模式植物拟南芥中未见积累[6-7]。L-酒石酸是植物中酒石酸的主要形式,它的对应异构体D-酒石酸仅能在一些微生物种类中形成。葡萄作为典型的酒石酸型水果,葡萄汁的pH值主要取决于浆果中的酒石酸含量。更为重要的是,酒石酸作为葡萄酒“活力”的主要来源,平衡了酒精对味蕾的影响,并且有助于降低葡萄酒的pH值,使葡萄酒能够保存一定的时间,这是基于酒石酸特有的强酸性,在发酵过程中不易被代谢的特性[8-9]。然而,随着全球气温的升高,葡萄酒的保存和贮藏出现困难,这在很大程度上是由于葡萄的酸度受气候影响。对不同葡萄品种的众多研究均表明,气候变暖会导致葡萄酸度下降,尤其是酒石酸含量显著降低[10-11]。此外,酒石酸作为酸味剂和抗氧化剂具有很高的经济价值,广泛用于食品和酿酒工业[12-13]。因此,关于葡萄酒石酸合成及调控的研究对葡萄产业的发展具有重要意义。
酒石酸是抗坏血酸(Vc)分解代谢的产物[14-16],但它在植物界的分布有限。与其它果实有机酸研究相比,酒石酸在植物代谢途径中的功能及其合成途径还所知甚少。随着基因共表达网络和全基因组分析工具的发展,酒石酸代谢相关的研究将会取得突破。因此,本文旨在综述目前有关葡萄酒石酸生物合成途径的酶、中间产物及其调控过程的研究进展,以期为酒石酸代谢的深入研究提供参考。
1 酒石酸在葡萄中的含量特性
L-酒石酸是一种四碳有机酸,它在葡萄浆果发育的早期阶段合成,在葡萄开花后4周之内迅速积累,且在之后的发育过程中保持代谢稳定,未成熟果实中酒石酸的含量高于成熟果实[7,17]。早期的研究表明,酒石酸在叶片中合成,再转运至浆果中进行积累,然而Hale[18]证实浆果也是酒石酸合成的场所。酒石酸的含量与浆果的大小密切相关,且在不同品种之间差异很大。对葡萄浆果生长发育过程中酒石酸分布变化的研究表明,在果实发育早期靠近果皮的果肉外侧酒石酸含量最高,而在转色之后,果肉外侧酒石酸浓度迅速下降,而在其它组织中基本保持不变[19]。
对302份成熟葡萄样品有机酸组分特征及含量分布规律的研究发现,栽培品种葡萄的酒石酸含量高于苹果酸,大多数野生种葡萄中苹果酸含量高于酒石酸,中国野生种葡萄也属于高苹果酸类型[3,20]。对不同种群葡萄果实中有机酸含量的比较表明,东亚种群葡萄果实的有机酸含量均高于其他种群,尤其是酒石酸含量显著高于其他种群[3]。
2 酒石酸生物合成途径的中间产物及酶类
酒石酸的合成分为两个阶段:上游抗坏血酸合成阶段,下游抗坏血酸分解即合成酒石酸阶段。在高等植物中酒石酸的合成有三条途径,分别称为抗坏血酸C4/C5途径、抗坏血酸C2/C3途径和D-葡萄糖酸C4/C5途径(图1)。抗坏血酸C4/C5途径是葡萄中酒石酸合成的主要途径,在该代谢途径中,抗坏血酸首先转化为2-酮基-L-古洛糖酸,之后还原生成L-艾杜糖酸,再氧化生成六碳化合物5-酮基-D-葡萄糖酸。这个六碳中间体被未知的酶裂解生成一个四碳化合物,该中间产物即酒石酸半醛,并最终氧化生成酒石酸。在抗坏血酸C2/C3通路中,抗坏血酸在2位和3位碳之间裂解,形成二碳化合物草酸和四碳化合物L-苏氨酸,四碳化合物最终氧化生成酒石酸。D-葡萄糖酸C4/C5途径,只在豆科植物中被鉴定,D-葡萄糖酸直接转化为5-酮基-D-葡萄糖酸,之后通过与抗坏血酸C4/C5相同的步骤生成酒石酸[15-16,21]。
2.1 酒石酸合成前体物质抗坏血酸的主要合成途径
新鲜水果以富含Vc深受喜爱。然而,葡萄并不像其他水果那样积累大量的Vc,因为其中的Vc作为草酸和酒石酸合成的前体物质被消耗。抗坏血酸是生长发育所必需的多功能代谢物,是一种重要的抗氧化剂,参与植物防御非生物胁迫。抗坏血酸合成的主要途径是Smirnoff-Wheeler途径,也称为L-半乳糖途径,该途径也是葡萄中抗坏血酸合成的主要途径(图1),共有10种酶类参与。具体过程为D-葡萄糖依次在己糖激酶(HXK)、磷酸葡萄糖异构酶(PGI)、磷酸甘露糖异构酶(PMI)、磷酸甘露糖变位酶(PMM)及GDP-D-甘露糖焦磷酸化酶(GMP)作用下生成GDP-D-甘露糖。之后,该途径的第六个酶类:GDP-D-甘露糖-3'5'-异构酶 (GME)催化GDP-D-甘露糖生成GDP-L-半乳糖。GME是新陈代谢中的一个“节点”,因为GME不仅是抗坏血酸生物合成途径的关键酶,还是细胞壁生物合成途径的关键酶,参与非纤维素多糖的合成,因此,它可以控制碳流向抗坏血酸合成通路。随后,在GDP-L-半乳糖磷酸化酶(GGP/VTC2)、L-半乳糖-1-磷酸酯酶(GPP/VTC4)和L-半乳糖脱氢酶(GLDH)催化下分别产生L-半乳糖-1-磷酸、L-半乳糖和L-半乳糖-1,4-内酯,而L-半乳糖是该合成途径中的关键物质。最后,L-半乳糖-1,4-内酯脱氢酶(L-GalLDH)特异性催化L-半乳糖-1,4-内酯生成抗坏血酸,参与L-抗坏血酸生物合成最后一个阶段[22-23]。
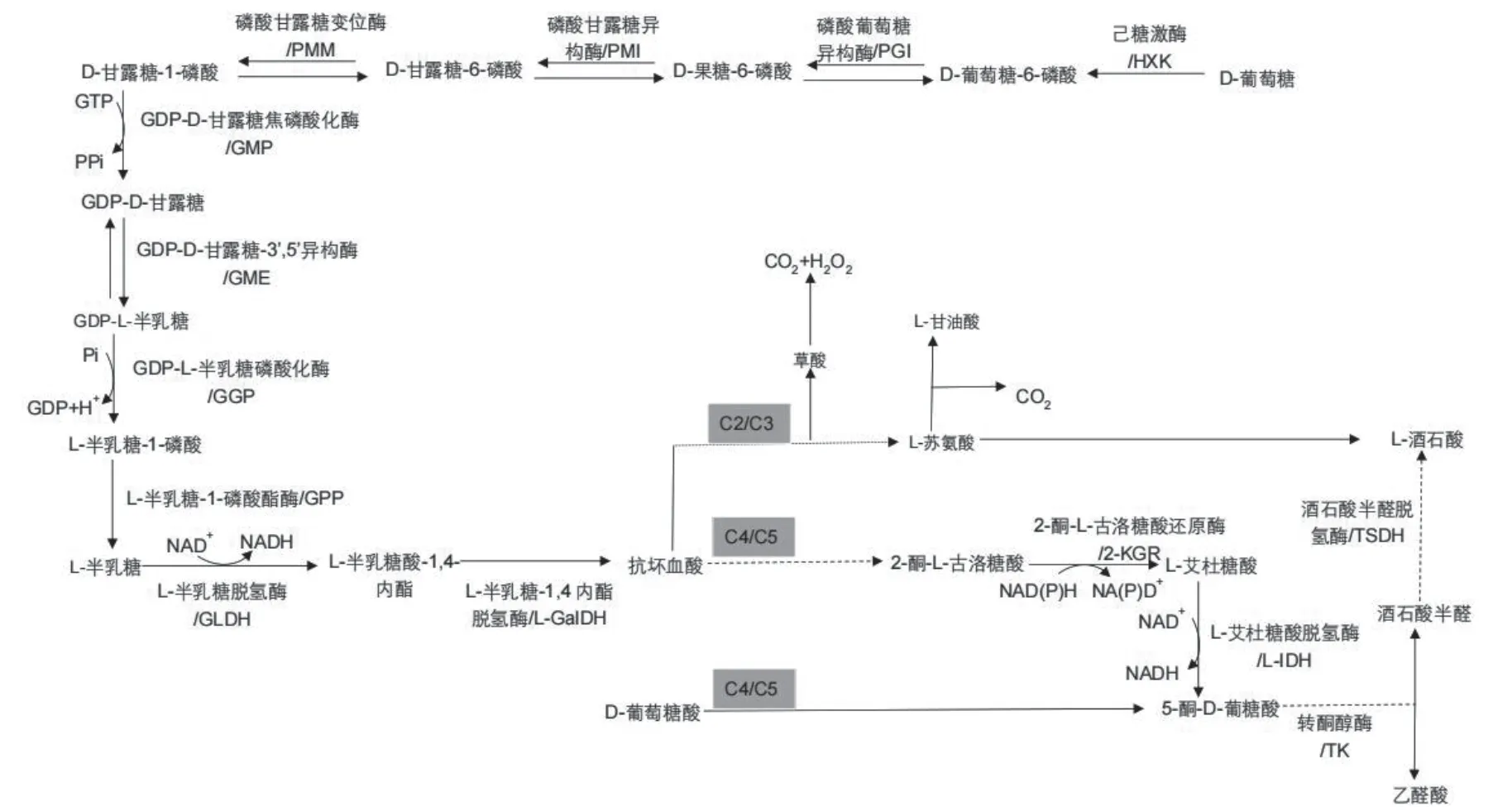
图1 植物中抗坏血酸和酒石酸氧化还原合成途径Figure1 Biosynthesis and redox pathways of ascorbic acid and tartaric acid in plant cell
2.2 L-艾杜糖酸脱氢酶
L-艾杜糖酸脱氢酶(L-IDH)是酒石酸合成途径第一个被鉴定和分析的酶,催化L-艾杜糖酸到5-酮基-D-葡萄糖酸的限速步骤[14,24]。在葡萄中该基因家族有三个成员,都定位在16号染色体上,其中VvLIDH1和VvLIDH3在基因上相距10kb,基因方向相同,然而VvLIDH2与它们方向相反,表明VvLIDH家族的不同成员由不同的启动子调控[25]。转录分析表明,VvLIDH1和VvLIDH3在幼果中的表达量高,这也与酒石酸开始积累的时间一致[26-28]。利用L-IDH抗体和浆果提取物的酶活分析发现,L-IDH蛋白丰度及其活性在果实发育早期达到高峰,与VvLIDH1和VvLIDH3的表达量一致[29-30]。
VvLIDH3(又称为Q1PSI9)是目前葡萄中唯一被证实能够氧化L-艾杜糖酸的家族成员[14]。表达谱分析表明,葡萄成熟浆果中VvLIDH3的表达量在夜晚升高[31];运用CRISPR/Cas9突变技术敲除VvLIDH3,导致酒石酸含量下降[32]。VvLIDH3属于“II类”植物山醇脱氢酶(SDH),它含有一系列关键氨基酸残基(His42、Gly112和Ser113)负责L-艾杜糖酸的结合和氧化,这些重要的氨基酸残基在葡萄VvLIDH1中同样保守。VvLIDH1与VvLIDH3具有高度一致性,只在非关键位点的3个氨基酸残基不一致[33-34],然而VvLIDH1在酒石酸合成中的功能还不明确。此外,负责艾杜糖酸结合的关键位点在天竺葵植物中也非常保守。VvLIDH2属于“I类”SDH,其参与山梨醇代谢,而不是酒石酸的合成。I类和II类SDH的表达模式不一样,前者表达量在植物发育整个过程中不断增加,后者与酒石酸合成的时间更加接近,在发育过程中表达量减少[19,34]。
在苹果和甜橙中,存在L-IDH同源基因,而它们并不积累酒石酸。对苹果基因组的进一步分析发现,12个L-IDH同源基因中,有11个与VvLIDH3的相似性低,并且缺少关键的氨基酸残基,仅有1个拷贝的植物“II类”SDH[35-36]。此外,对中国野生葡萄乌头叶蛇葡萄(Ampelopsis aconitifolia)的研究发现,其缺少L-IDH转录本并且没有酒石酸积累,进一步表明L-IDH对于酒石酸积累是必须的,也是葡萄浆果中酒石酸合成途径中最具特征的酶[14]。
2.3 2-酮-L-古洛糖酸还原酶
2-酮-L-古洛糖酸还原酶(2-KGR)催化2-酮-L-古洛糖酸生成L-艾杜糖酸。葡萄中存在与大肠杆菌2-KGR同源的基因,并且该基因与VvLIDH3表达模式相同。体外研究发现,该重组酶具有2-KGR酶的活性,底物亲和动力学试验发现,其主要活性为乙醛酸或羟基丙酮酸还原酶[12,37]。进一步研究发现,葡萄Vv2KGR与拟南芥羟基丙酮酸还原酶(AtHPR2)具有高度相似性,该酶参与羟基丙酮酸和乙醛酸还原代偿旁路[38]。然而,重组表达的Vv2KGR对L-艾杜糖酸、抗坏血酸、甲酸、山梨醇糖、D-葡萄糖、6-磷酸葡萄糖酸盐、5-酮-D-葡萄糖酸和D-葡萄糖酸都具有催化活性,但催化效率不高。利用X-射线晶体学和分子对接技术对Vv2KGR蛋白结构进行解析发现, 2-酮-L-古洛糖酸是最佳底物,并且GC-MS也证实该催化反应的产物是L-艾杜糖酸[12]。Vv2KGR与VvLIDH3在进化上类似,它们都保留了其原始酶活,即乙醛酸还原酶和山梨醇氧化酶活性,并且分别进化出新的功能参与酒石酸的合成。
2.4 转酮醇酶和酒石酸半醛脱氢酶
除了Vv2KGR和VvLIDH3,目前还没有对酒石酸生物合成途径中其余步骤的候选基因进行鉴定,包括酒石酸合成的第一个步骤,即从抗坏血酸或脱氢抗坏血酸转化为2-酮-L-古洛糖酸,以及最后两步,即5-酮基-D-葡萄糖酸转变成酒石酸半醛,然后变成酒石酸(图1)。有学者提出转酮酶(TK)可以将5-酮-D-葡萄糖酸裂解成4C和2C片段,最早发现转酮酶的作用是在卡尔文循环或磷酸戊糖循环途径中,但推测其可能在某些条件下以5-酮基-D-葡萄糖酸酯作为底物。酒石酸合成最后一步反应的催化酶类,推测是酒石酸半醛脱氢酶(TSDH),它可能是琥珀酸半醛脱氢酶或其异构体,进化过程中将酒石酸半醛作为新的首选底物[34]。
2.5 酒石酸合成其它相关候选基因研究
尽管酒石酸只在有限的植物种类中存在,但是存在多条生物合成途径。在牻牛儿苗科植物中,抗坏血酸C2/C3途径是合成酒石酸的主要途径。然而,在葡萄果实中,抗坏血酸C2/C3途径主要产生L-苏氨酸和草酸,酒石酸来源于另外一个单独的C4/C5途径。目前还不清楚为什么在葡萄中已经存在抗坏血酸C2/C3裂解方式,还进化出一条新的酒石酸合成途径。有一种推测可能是负责将L-苏氨酸转化为酒石酸的酶在葡萄中缺乏或者不活跃[35]。此外,除了葡萄属和天竺葵属植物,在马铃薯、柑橘类水果和梨中也检测到少量的酒石酸。这3个物种已经被证明包含一个L-IDH异构体或“II类”SDH。牛油果和罗望子也被认为是酒石酸型水果,这些植物也可能成为研究不同有机酸分布、酒石酸遗传和代谢的有用模型[19,34]。此外,利用广泛靶向代谢组学检测酒石酸合成的前体物质也有助于寻找酒石酸合成的其它步骤。
为了克服生化方法的局限性,利用QTL定位和全基因组关联分析(GWAS)来寻找定位酒石酸合成的遗传位点。过去十年,葡萄浆果酸度相关QTL的研究有一些突破,如与总酸度、可滴定酸、pH,以及苹果酸和幼果中各种酸比例相关的研究。然而关于酒石酸的遗传位点研究没有重大突破[1,39],这可能与酒石酸合成途径众多、调控位点复杂以及受多种因素影响等相关。尽管存在这些挑战,研究者利用矮化与持续开花突变体Picovine与‘白玉霓’无果肉突变体Ugni Blancflb杂交构建的遗传群体,在连锁群LG7和LG4上发现了两个酒石酸相关的重要并且稳定的QTL位点[40]。此外,全基因组关联分析在葡萄复杂生物学性状方面的应用越来越多。最近,研究者利用472份葡萄种质资源全基因组测序和GWAS分析了许多葡萄性状,包括酒石酸积累,鉴定到氧化还原酶超家族的一个潜在的去乙酰氧基-4-羟化酶。该酶催化2-氧戊二酸盐(五碳化合物)氧化为琥珀酸(四碳化合物),因此,推测该酶可能参与酒石酸合成的后两步反应过程,比如转化5-酮基葡萄酸生成酒石酸,不过仍然需要进一步试验证明该基因在酒石酸合成中的作用[41]。此外,对279份葡萄品种的GWAS分析也鉴定到与酒石酸积累相关的基因座[42]。
3 酒石酸在细胞内的转运
酒石酸一旦合成,就被转移到液泡中储存起来。铝激活的苹果酸转运蛋白VvALMT9很有可能参与苹果酸与酒石酸从胞质到液泡中的运输过程[43]。转录组和qPCR结果显示,VvALMT9在葡萄浆果发育的整个过程都有表达,在成熟果实中的表达量最高,说明该酶的活性在苹果酸和酒石酸积累之后,会持续保持比较高的活性。目前在植物细胞其他膜结构中还没有发现酒石酸运输的候选蛋白,但是已发现有一些与酒石酸前体抗坏血酸运输的候选蛋白。拟南芥中有12个抗坏血酸盐转蛋白(NAT)的候选基因,其中有3个(AtNat7、8、12)定位在细胞膜[22,43]。未来,在葡萄中分析与这些基因共表达、共定位的候选基因将有助于酒石酸转运的研究。
4 酒石酸代谢
葡萄浆果中的酒石酸形成稳定的酒石酸钾盐,储存在液泡中,远离潜在的分解代谢酶类,因此在成熟过程中酒石酸基本不受影响[34]。大肠杆菌和假单胞菌可以将D-酒石酸盐作为碳源,通过氧化作用转化为草酰乙酸或甘油酸,最终转化为丙酮酸。L-酒石酸能够被农杆菌通过碳固定的方式利用,该菌体是葡萄的宿主菌,其含有酒石酸代谢相关基因[44]。葡萄中的L-酒石酸盐能够被灰霉菌代谢,产生不同的有机酸,包括苹果酸、丙酮酸、醋酸盐、草酸和草酰乙酸等[45]。因此,当葡萄浆果完好无损时,酒石酸不会被分解,然而一旦遇到机械损伤或者病原菌入侵,酒石酸可能会被这些微生物代谢利用[35]。
5 酒石酸合成的调控
温度和光照会影响果实有机酸组分,这不仅关系到果实品质,而且关系到品种与其最适生长区在未来气候变化中的兼容性。然而,环境因素对浆果有机酸含量的影响在很大程度上取决于遗传背景,并且与浆果的发育阶段和栽培措施也有关系,这使得有机酸合成调控的研究更加复杂。欧亚种葡萄中苹果酸的含量随着光照强度的增加而降低,并且随着水分供应的减少而降低[46]。然而,目前关于环境条件对酒石酸生物合成调控的研究进展还较少。对比法国夏朗德地区不同气候条件对栽培种葡萄酒石酸合成的影响发现,葡萄中抗坏血酸和酒石酸的总量及浓度受到气候条件的影响。2011年(少雨、高温)成熟葡萄中酒石酸的总量及浓度是2013年(湿润、凉爽)的2~3倍。进一步的酶活分析发现,L-IDH酶活的第一个峰值出现在抗坏血酸水平最高的时候,并且随之带来酒石酸的大量积累。通过调查气候对不同生长阶段浆果酒石酸含量的影响,发现在幼果阶段,强光和限制水分能够促进抗坏血酸和酒石酸的合成[8],但在成熟阶段,光照对酒石酸含量的影响不明显[19],高温可以改变浆果中氨基酸和有机酸的浓度,然而成熟浆果中酒石酸的含量不受温度的影响[47];此外,遮荫处理导致浆果中L-酒石酸的浓度降低,同时浆果的粒质量减小,抗坏血酸总量减少,但草酸和苹果酸的浓度不受遮荫处理的影响[32]。为了进一步探索酒石酸合成途径中的遗传调控,开展启动子结构遗传分析、寻找合成途径的新酶类如催化5-酮基-D-葡萄酸到酒石酸的酶类,可能有助于取得新的进展。
6 展望
葡萄果实糖酸含量及其构成比例直接决定了果实品质,不同品种果实的有机酸含量与组分差异较大,筛选或培育高糖高酸的酿酒品种或高糖低酸的鲜食品种,对葡萄产业发展具有重要意义。酒石酸作为葡萄中的主要酸类,尽管50多年前已经被发现,然而对葡萄中酒石酸生物合成途径的生化和遗传机理研究还不够深入。继续利用传统的生化和分子方法可能会产生更多的候选基因,但也需要考虑其它可能性,也许酒石酸合成是非酶促反应,或一种酶负责多个步骤[19]。与此同时,可以分析常见代谢途径中的酶类是否具有潜在的其它功能,例如寻找那些表达模式与Vv2KGR和VvLIDH3一致,并且与酒石酸合成时间和部位一致的基因[34];再利用生物信息学和葡萄基因组数据库,通过序列比对的方法在葡萄全基因组范围内鉴定相关家族基因,并对其进化关系、基因定位、蛋白质结构和性质进行分析。
QTL定位在基因克隆及筛选鉴定方面起着重要作用,基于双亲本群体得到的图谱,鉴定出非常多的与果实品质性状相关的QTL和基因,可能会由于特定亲本品种或种类之间有限的遗传多样性受到限制,因此,选择适当的杂交亲本是酒石酸QTL定位成功的关键。随着高通量测序成本的降低,收集大量的种质资源进行GWAS分析有助于探明酒石酸在葡萄中的合成及遗传调控规律。利用SNP标记进行全基因组关联分析,找到与酒石酸含量性状显著相关的SNP位点,在此基础上对候选基因进行挖掘分析,还可以定位酒石酸相关的标记位点,为葡萄的品质育种提供一种切实可行的基础手段。
