共载姜黄素与阿霉素胶束的制备工艺优化及体外抗肿瘤评价
2023-04-01李芳婵韦志英罗小莉潘翠柳吴秀彩梁方耀潘真真李耀华广西中医药大学教学实验实训中心南宁50200广西高校中药提取纯化与质量分析重点实验室南宁50200广西中医药大学药学院南宁50200
李芳婵,韦志英,罗小莉,潘翠柳,吴秀彩,梁方耀,潘真真*,李耀华*(1.广西中医药大学教学实验实训中心,南宁 50200;2. 广西高校中药提取纯化与质量分析重点实验室,南宁 50200;. 广西中医药大学药学院,南宁 50200)
目前,乳腺癌约占女性癌症病例的24.5%,占癌症死亡的15.5%,发病率和病死率均居首位,已经成为严重威胁女性健康的恶性肿瘤[1],随着生活水平日益提高、环境污染和人口老年化的加剧,预计2070年新发乳腺癌病例将达到440万[2]。在我国乳腺癌每年新发病例约27.9万,并以每年2%的速度递增[3]。乳腺癌的主流治疗方案一般以化学治疗为主,配合手术切除和放射治疗的综合治疗,化疗药物大多是小分子细胞毒性药物,虽然能杀伤肿瘤细胞,但选择性和靶向性差,会对人体正常的组织细胞实行“无差别攻击”,使患者出现严重的毒副作用,化疗后期患者的生存质量差,以至于化疗难以持续,在临床中的应用有很多局限性[4-5]。因此,探索更好的化学治疗方案,提高乳腺癌治疗水平具有深远的理论和现实意义。
姜黄素(curcumin,CUR)是从姜黄根茎中提取的一种脂溶性多酚,具有抗肿瘤、抗菌、抗抑郁、抗炎、抗氧化等多种药理活性[6-9]。CUR的抗肿瘤作用,在近几年受到国内外的广泛关注,文献报道其通过调节如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、核转录因子-κB(nuclear transcription factor,NF-κB)及环氧化酶-2(cyclooxygenase-2,COX-2)等促炎因子和细胞因子的表达水平而抑制肿瘤细胞的增殖[10-12]。但因CUR为脂溶性多酚,难溶于水,口服给药吸收差,在普通给药方式下CUR的生物利用率很低,限制其临床应用。阿霉素(doxorubicin,DOX)是临床一线广谱抗肿瘤药物,通过激发拓扑异构酶Ⅱ裂解DNA从而破坏DNA的三级结构,并触发细胞凋亡途径,是临床治疗乳腺癌的化疗药物之一[13-14]。但是,DOX选择性较差,临床应用时出现明显的毒副作用,对心、肝、肾等正常组织和器官造成损伤,长期使用会引起患者强烈的过敏反应、心脏毒性和肝脏损伤[15-17]。联合用药是肿瘤治疗的新方向之一,将不同作用机制的抗肿瘤药物联合起来,降低肿瘤对化疗药物的耐药性,增强化疗药物对肿瘤的杀伤作用[18-20]。多项研究表明,CUR与DOX联用,增强了DOX的抗肿瘤作用,降低了DOX的给药剂量,从而降低DOX的毒副作用[21]。体外研究发现CUR和DOX联合给药,能够有效提高乳腺癌细胞MCF-7和MDAMB-231对DOX的敏感性,降低DOX的半数抑制浓度(IC50)[22]。另一研究发现,在DOX耐药细胞中,CUR和DOX联合给药能有效抑制ABC(ATP-binding cassette)转运蛋白家族中的外排蛋白ABCB4的活性,从而逆转乳腺癌细胞的DOX耐药[23]。此外,多项研究发现CUR能降低DOX诱导的心脏毒性。有研究揭示CUR可能是通过消除大鼠的炎症、凋亡、改善DNA氧化损伤和调节蛋白质氧化水平来改善DOX诱导的心脏毒性[24]。另有研究发现,与单用DOX给药的小鼠组相比,DOX和CUR联合给药组的小鼠血清心肌酶显著降低,抗氧化能力提高;进一步研究发现CUR通过 PI3K/Akt/mTOR通路抑制DOX诱导的心肌细胞焦亡[25]。因此,研究DOX和CUR联合用药具有理论和现实意义。
本研究以三嵌段共聚物聚己内酯-聚乙二醇-聚己内酯(PCL-PEG-PCL)为载体,采用薄膜-水化-超声法制备共载姜黄素/阿霉素胶束(CUR/DOX micelle)。以粒径、包封率和载药量为考察指标,单因素结合正交实验对CUR/DOX micelle制备工艺进行优化,确定其最优制备工艺条件。对CUR/DOX micelle进行表征,并考察其体外细胞摄取率和抗肿瘤活性。本研究通过制备胶束实现共载姜黄素与阿霉素,采用联合给药模式发挥协同抗肿瘤作用,为肿瘤治疗提供新的思路。
1 材料
1.1 仪器
旋转蒸发仪(上海爱朗仪器有限公司);JY92-2D超声波细胞粉碎仪(宁波新芝生物科技股份有限公司);LC2030高效液相色谱仪、RF-6000荧光分光光度计(日本岛津仪器有限公司);EM10透射电子显微镜(德国蔡司公司);纳米粒度分析仪(美国麦奇克有限公司);FreeZone 2.5冷冻干燥仪(美国Labconco公司);CT 15RE冷冻离心机(日本日立公司);Multiskan Sky型酶标仪(赛默飞世尔科技公司);LSR Fortessa流式细胞仪(BD公司)。
1.2 试药
姜黄素原料药(北京百灵威科技有限公司,批号:921105);姜黄素对照品(纯度:99.50%,成都曼斯特生物科技有限公司,批号:MUST-21022710);阿霉素(大连美仑生物技术有限公司,对其进行脱盐处理);PCL8000-PEG6000-PCL8000(山东岱罡生物科技有限公司);甲基偶氮唑盐(MTT,北京索莱宝科技有限公司,批号:829Z0513);人乳腺癌细胞MCF-7(中国科学院上海细胞生物学研究所);胎牛血清(美国Gemini,批号:A87F82H);1640培养基(赛默飞世尔科技有限公司,批号:8120133);磷酸缓冲盐(江苏凯基生物技术股份有限公司,批号:20211210);其他试剂均为分析纯。
2 方法与结果
2.1 CUR/DOX micelle的制备
采用薄膜-水化-超声法制备CUR/DOX micelle。称取处方量的CUR、脱盐DOX(CUR∶DOX=5∶1)和PCL-PEG-PCL,加入适量的二氯甲烷-丙酮混合溶液(1∶1)使其溶解后,减压旋转蒸发除去有机溶剂,直至在瓶底形成一层橘红色的薄膜。加入适量去离子水,水浴加热水化。水化后于冰浴中探头超声处理(250 W),过0.22 μm微孔滤膜除去游离CUR和DOX,即得。同法制备不含药的空白胶束、单载CUR胶束和单载DOX胶束。
2.2 CUR和DOX的含量测定
采用高效液相色谱法对CUR进行含量测定。色谱条件:流动相为甲醇-4%冰醋酸(48∶52),色谱柱为Hypersil C18(250 mm×4.6 mm,5 µm),检测波长为430 nm,柱温30℃;流速1 mL·min-1;进样量10 µL。经方法学验证表明方法的专属性良好;回归方程为Y=7.79×104X-5.95×103,r=0.9999(n=5),CUR在21.30~106.50 μg·mL-1内与峰面积线性关系良好。精密度和重复性RSD分别为1.8%、2.1%(n=6);平均加样回收率为99.17%,RSD为1.4%。
采用荧光分光光度法对DOX含量进行测定(避光操作),激发波长为485 nm,发射波长为590 nm,测定其荧光强度。回归方程为Y=0.2203X+32.13,r=0.9999(n=5),结果表明DOX在400~6400 ng·mL-1内与峰面积线性关系良好。精密度和重复性RSD分别为1.4%、1.0%(n=6);平均加样回收率为99.33%,RSD为2.5%。
2.3 包封率和载药量的测定
按“2.1”项下方法制备CUR/DOX micelle,并且取出部分进行冷冻干燥。采用高速离心法测定其载药量及包封率,称取一定量CUR/DOX micelle,计为WM,加入一定量甲醇超声10 min,超高速离心10 min(35 000 r·min-1),取上清液按“2.2”项下方法分别测定CUR和DOX的含量,计为Ws,投药量记为W总。按载药量及包封率的计算公式,分别计算CUR和DOX的包封率和载药量。
载药量(%)=WS/WM×100%;
包封率(%)=WS/W总×100%。
2.4 粒径测定
按“2.1”项下方法制备CUR/DOX micelle,分散在一定量的去离子水中,通过纳米粒粒度仪测定其粒径和多分散系数(PDI),平行测定3次,取其平均值。
2.5 CUR/DOX micelle处方工艺优化
2.5.1 正交实验因素和水平 在前期单因素实验基础上,选取对胶束制备影响较大的因素药物与PCL-PEG-PCL的比例(A)、水化温度(B)、超声时间(C)为考察因素,每个因素设定3个水平,以粒径、CUR和DOX的平均包封率和平均载药量为评价指标。按照正交实验设计表L9(34)设计实验,因素水平表见表1。

表1 因素水平表Tab 1 Factor and level
2.5.2 正交实验优选制备工艺 按照表1的因素和水平进行实验,考察胶束制备过程中药物与PCLPEG-PCL的比例(A)、水化温度(B)、超声时间(C)对CUR/DOX micelle制备工艺的影响,最终测定各实验样品胶束的粒径、包封率和载药量。采用加权评分法分析实验结果,设定胶束粒径的加权系数为0.5,包封率为0.25,载药量的加权系数为0.25,综合评分值=(粒径最小值/粒径×0.5+平均包封率/平均包封率最大值×0.25+平均载药量/平均载药量最大值×0.25)×100%。
正交实验结果见表2,方差分析结果见表3,最终优选的条件为A2B2C2,即药物与PCL-PEGPCL投料比为1∶10,水化温度为65℃,超声时间为6 min。因此,CUR/DOX micelle的制备工艺为:称取处方量的CUR、DOX(CUR∶DOX=5∶1)和PCL-PEG-PCL(药物与PCL-PEG-PCL投料比为1∶10),加入适量的二氯甲烷-丙酮混合溶液(1∶1)使其溶解后,减压旋转蒸发除去有机溶剂,直至在瓶底形成一层橘红色的薄膜。加入适量去离子水,65℃水浴加热水化。水化后于冰浴中探头超声处理处理6 min(250 W),过0.22 μm微孔滤膜除去游离CUR和DOX,即得。
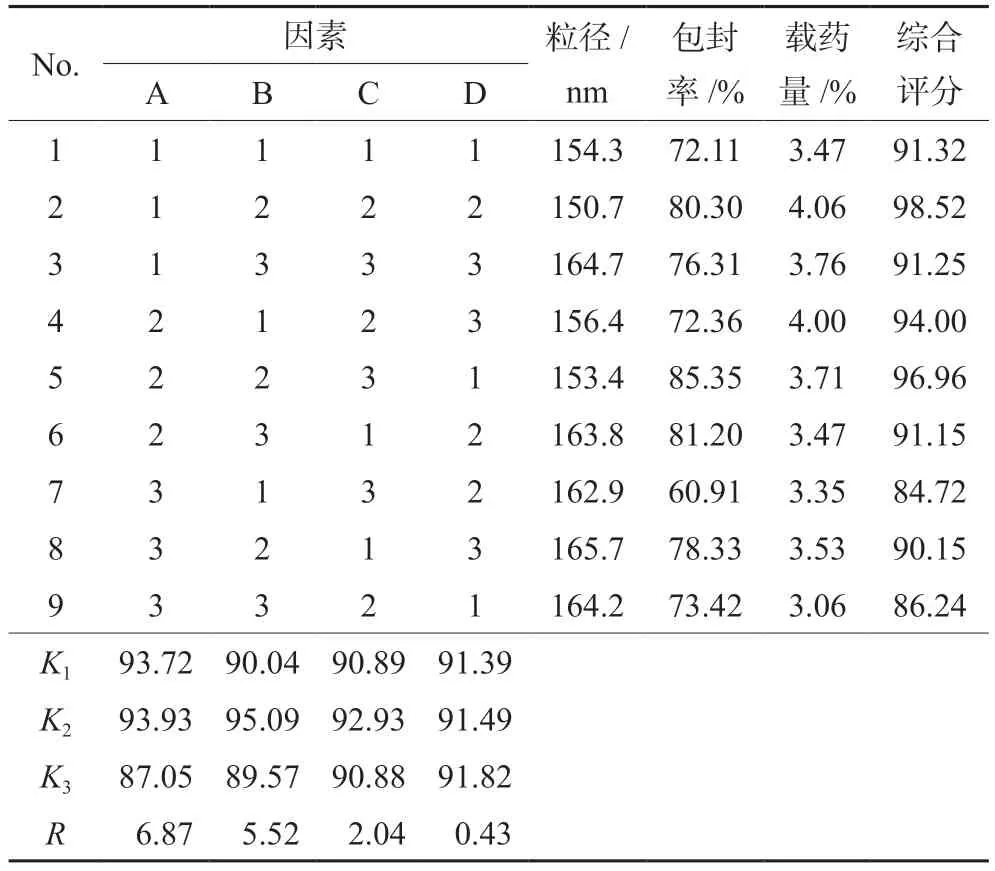
表2 正交实验设计及结果(n=3)Tab 2 Orthogonal test design and results (n=3)
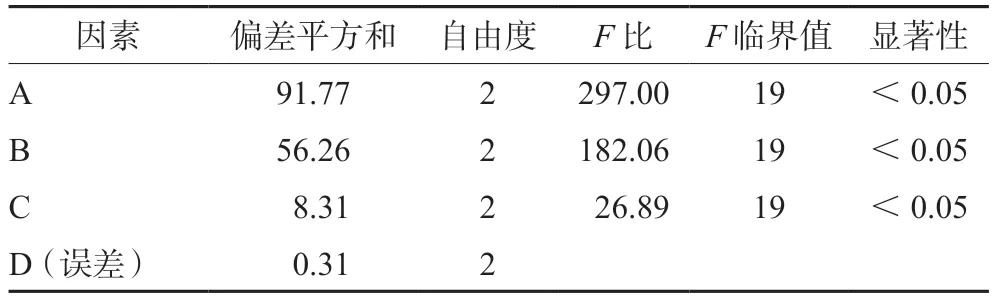
表3 方差分析结果Tab 3 Variance analysis
2.5.3 处方工艺验证 按照优选工艺制备条件进行3批验证实验,结果图1A显示CUR/DOX micelle的粒径为150.0 nm,PDI为0.0573±0.02,CUR载药量为6.80%,包封率为85.21%,DOX载药量为1.28%,包封率为82.92%。透射电镜(TEM)观察CUR/DOX micelle的形态特征,取少量CUR/DOX micelle滴至水化后的铜网上,静置后滤纸吸干,2%的磷钨酸负染,自然挥干,测定。TEM结果显示CUR/DOX micelle为球形,大小均一,结果见图1B。
2.6 CUR/DOX micelle稳定性考察
将CUR/DOX micelle按体积比1∶1分别分散在去离子水和含10%胎牛血清的水溶液中,于0、2、4、6、8、12、24、36、48、72 h分别测定其粒径,考察其稳定性,见图1C。结果显示在水溶液中纳米粒的粒径稳定在(151.19±1.23)nm,72 h内粒径RSD为0.81%;在含10%胎牛血清的水溶液中,纳米粒的粒径稳定在(151.47±1.73)nm,72 h内粒径RSD为1.1%,表明在水溶液及含10%胎牛血清的水溶液中CUR/DOX micelle均具有较好的稳定性。

图1 CUR/DOX micelle的粒径分布(A)、TEM(B)及稳定性(C)Fig 1 Particle size(A),TEM photograph(B)and stability(C)of CUR/DOX micelle
2.7 CUR/DOX micelle的体外释药行为考察
采用透析法考察胶束的体外释药行为,为模拟正常体液环境和肿瘤细胞内环境,选择pH 7.4和pH 5.0的磷酸缓冲液(PBS)作为释放介质,为保障疏水药物CUR和DOX的释放介质加入0.1%的吐温80作为表面活性剂。分别取一定量CUR/DOX micelle置于预处理的透析袋中,两端封口,浸于装有释放介质的装置中,释放温度为37℃,摇床转速为120 r·min-1。定时取样(1、2、4、8、10、12、24、36、48、72、96 h),取样量为1 mL,取样后补加相应的PBS 1 mL。样品按“2.2”项下方法分别测定,计算累积释放率(n=3)。以时间为横坐标,累积释放率为纵坐标绘制体外释药曲线,结果见图2。由体外释药曲线可知,CUR/DOX micelle表现出较好的缓释作用,在pH 7.4的释放介质中,CUR/DOX micelle中的CUR和DOX释放速率比较慢,24 h时胶束的CUR的累积释放率为49.38%,DOX的累积释放率为40.09%,96 h 时CUR的累积释放率为64.08%,DOX的累积释放率为60.13%,而在pH 5.0的释放介质中,释放速度明显加快,96 h时CUR的累积释放率为84.60%,DOX的累积释放率为85.59%,上述结果表明,释放介质的pH值对CUR/DOX micelle影响较大,这有可能是低pH条件下胶束中脂溶性脱盐DOX和CUR,尤其是脱盐DOX在酸性条件下质子化,溶解度升高,释放加快。CUR/DOX micelle的这种pH 敏感释药行为可以减少DOX在体液循环中的释放,增加其在酸性环境如肿瘤细胞内的释放。
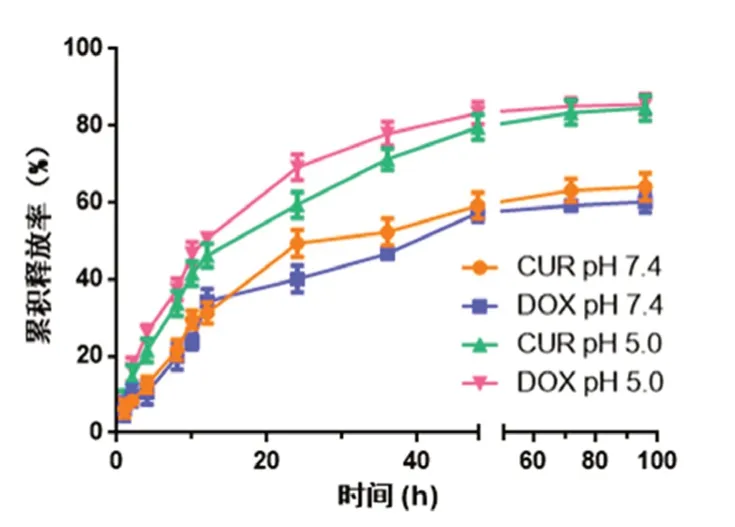
图2 CUR/DOX micelle的体外释药曲线Fig 2 Release profile of CUR/DOX micelle in vitro
2.8 细胞摄取考察
取对数生长期的MCF-7细胞,进行细胞计数并调整细胞密度,以5×104/孔的密度接种于24孔板中,进行摄取实验。实验设置分别设置CUR/DOX micelle组,游离脱盐DOX组,并设空白对照组。给药时弃去原培养基,加入含不同样品及10%胎牛血清的细胞培养基,每孔0.5 mL,确保DOX质量浓度为10 μg·mL-1。共孵育4 h,吸弃培养基,胰酶消化并离心收集细胞,冷PBS充分清洗3次,全程避光操作。最后加入PBS 0.5 mL重悬细胞,于流式细胞仪上检测,测定细胞内的荧光强度,并计算细胞摄取率,结果见图3。可以看出,与空白对照组相比,游离脱盐DOX组和CUR/DOX micelle组中的DOX均能进入细胞,游离DOX的摄取效率为73.9%,而CUR/DOX micelle组的摄取效率为82.1%,与游离脱盐DOX组相比,CUR/DOX micelle组的摄取效率明显提高,表明胶束包裹DOX后能显著提高肿瘤细胞的摄取效果。
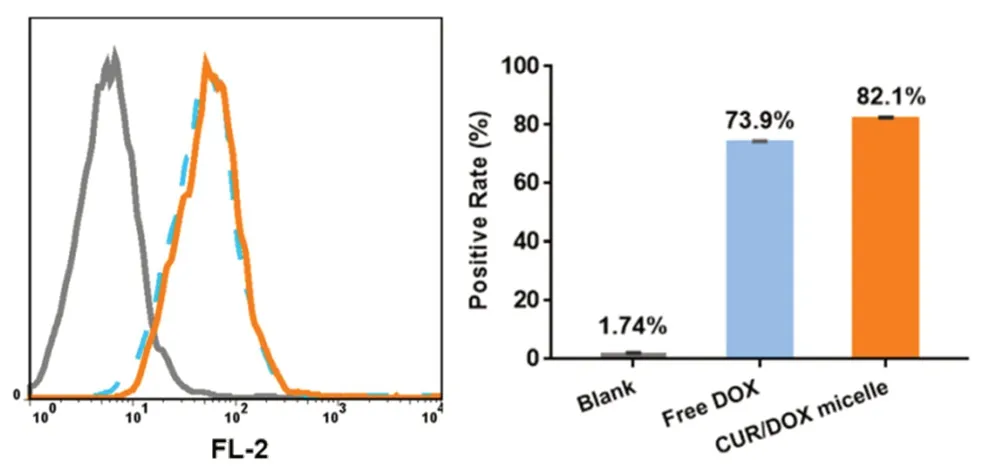
图3 CUR/DOX micelle的细胞摄取Fig 3 Cellular uptake of CUR/DOX micelle
2.9 体外抗肿瘤活性评价
取对数生长期的MCF-7细胞,消化收集并调整密度,接种于96孔板中,密度为5×103/孔,继续培养24 h后进行实验。实验设置空白对照组、空白纳米粒组、游离CUR组、游离DOX组、单载CUR micelle组、单载DOX micelle组和CUR/DOX micelle组,CUR最终质量浓度为:0、0.52、1.04、2.08、3.12、4.16、5.20、6.24、8.32、10.40 μg·mL-1,DOX最终质量浓度为:0.1、0.2、0.4、0.6、0.8、1.0、1.2、1.6、2.0 μg·mL-1,空白纳米粒组采用培养基按给药组相同体积比例进行稀释(n=6)。继续培养48 h后,加入5 mg·mL-1的MTT溶液20 μL继续孵育4 h,弃去培养液,每孔加0.2 mL二甲基亚砜,震荡仪震荡1 min后,酶标仪490 nm下测定吸光度值(OD),按以下公式计算细胞存活率:
细胞存活率(%)=(实验组平均OD值-空白纳米粒组平均OD值)/(空白对照组平均OD值-空白纳米粒组平均OD值)×100%。
实验结果见图4,空白纳米粒组在相应的浓度下对MCF-7细胞的生长无明显毒性及抑制作用,可见载体PCL-PEG-PCL生物相容性较好。游离CUR组、游离DOX组、单载CUR micelle组、单载DOX micelle组和CUR/DOX micelle组均有不同程度的抑制肿瘤细胞生长作用,相较于游离DOX组、单载DOX micelle组和CUR/DOX micelle组,游离CUR组和单载CUR micelle组在相应的给药质量浓度下(0.52~10.40 μg·mL-1)肿瘤细胞生长抑制作用较弱。通过拟合计算可知,游离DOX组的IC50为1.24 μg·mL-1,单载DOX micelle组的IC50为1.02 μg·mL-1,CUR/DOX micelle的IC50为0.79 μg·mL-1(以DOX给药量浓度进行拟合计算),这表明联合应用CUR和DOX增强了药物的抗肿瘤作用。
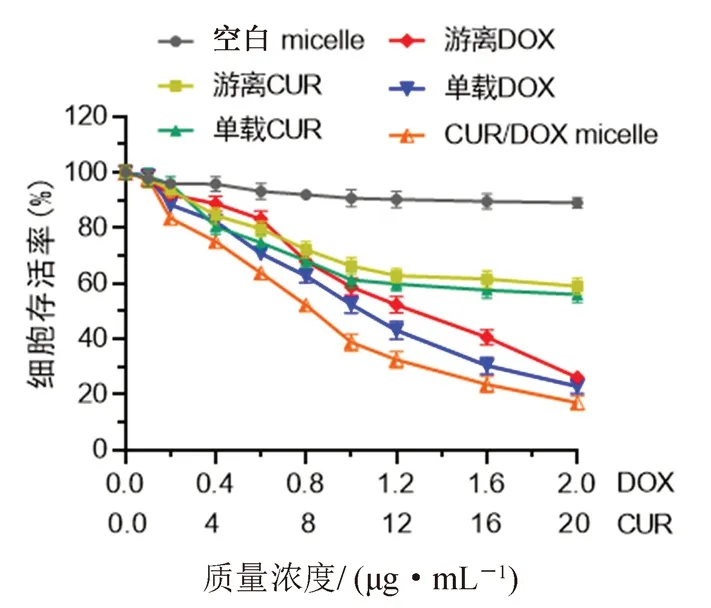
图4 CUR/DOX micelle的细胞毒性Fig 4 Cytotoxicity test of CUR/DOX micelle
根据人乳腺癌MCF-7细胞在不同浓度的游离CUR、游离DOX和CUR/DOX micelle条件下的存活率,采用CompuSyn软件分析联合药物指数(CI),结果见表4。从CompuSyn结果可知,抑制作用(Fa)为50%时CI值、75%CI值、90%CI值及95%CI值均小于1,表明CUR和DOX联用具有协同作用。当CUR质量浓度大于5.2 μg·mL-1,DOX质量浓度大于1 μg·mL-1时,随着药物浓度和抑制率的增加,CI值逐渐降低,这表明CUR和DOX协同作用逐渐增强。

表4 姜黄素和阿霉素的联合药物指数Tab 4 Combination index of curcumin and doxorubicin
2.10 统计学分析
采用GraphPad Prism 9统计软件进行分析,计量数据用均数±标准差(±s)表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
3 讨论
联合用药是目前肿瘤治疗的新方向,中药活性成分与化疗药物的作用靶点不同,两者联用,从机制的互补、作用的协同、不良反应的减轻等方面发挥协同效应,提高治疗效果。纳米制剂的主要优势在于其能够包裹溶解性差、稳定性差的药物并将药物传输至体内不同部位,降低药物的毒副作用。采用纳米技术共载化疗药物和中药活性成分,能为中药联合化疗药物治疗肿瘤提供新的思路。
本研究以PCL-PEG-PCL为载体,通过薄膜-水化-超声法成功制备了CUR/DOX micelle,提高了CUR和DOX的有效利用度;有文献报道,以PCL-PEG-PCL制备胶束时,PEG的分子量大小对纳米胶束的载药量、包封率和稳定性影响比较大,相较于其他分子量的PEG(如PEG4000、PEG2000和PEG1000),PEG6000可以提供更加适宜的亲水疏水比例,制备的胶束载药量、包封率较高且稳定性好[26-28],故本研究选择PEG6000作为亲水端。在前期研究中,采用单因素实验对PCLPEG-PCL分子量、药物与PCL-PEG-PCL的比例、有机溶剂的比例、水化温度、超声功率、超声时间等因素进行考察。在对PCL-PEG-PCL分子量的单因素实验中分别考察了PCL4500-PEG6000-PCL4500、PCL10000-PEG6000-PCL10000和PCL8000-PEG6000-PCL8000,发现PCL8000-PEG6000-PCL8000制备的胶束最为合适;在正交实验中,选择对胶束制备影响较大的因素:药物与PCL-PEG-PCL的比例、水化温度和超声时间作为考察因素进行优化,得到粒径合适,分布均匀,载药量和包封率均较为理想的胶束;本文采用最优制备工艺制得的CUR/DOX micelle的粒径为(150.0±0.6)nm,大小均一;稳定性考察结果表明,72 h内胶束在去离子水和含10%胎牛血清的水溶液中稳定性良好;体外释放考察表明CUR/DOX micelle具有缓释作用;细胞摄取结果表明,在相同浓度下相较于游离DOX,CUR/DOX micelle的入胞能力更强,这有利于更好地发挥抗肿瘤作用;体外实验结果显示,对于人乳腺癌MCF-7细胞,载体PCL-PEG-PCL无明显的生长抑制作用,CUR/DOX micelle组的抑制作用强于游离CUR组、游离DOX组、单载CUR组和单载DOX组,这可能是CUR和DOX联用共同发挥了抗肿瘤作用,并且制成胶束后有效地提高了药物的入胞能力。采用CompuSyn 软件分析联合药物指数,当CUR质量浓度大于5.2 μg·mL-1,DOX质量浓度大于1 μg·mL-1时,CUR和DOX联用具有协同作用。在后续的工作中,将进一步研究CUR/DOX micelle的活性及抗肿瘤作用机制,为后续研究奠定基础。
