克班宁对肝癌细胞增殖和凋亡的影响
2023-04-01谭佳杰向玉玲熊远果张洪武汉大学人民医院药学部武汉430060
谭佳杰,向玉玲,熊远果,张洪(武汉大学人民医院药学部,武汉 430060)
肝细胞癌(hepatocellular carcinoma,HCC)作为世界上最常见的癌症之一,常由包括慢性乙型和丙型肝炎病毒感染、过量饮酒、非酒精性脂肪肝在内的各种风险因素导致[1-2]。其常见的治疗方法包括手术切除、肝移植、局部消融和经导管动脉化疗栓塞术,其中晚期肝癌患者的临床疗效和预后非常差,迫切需要更有效的治疗药物[3-4]。
克班宁(crebanine)作为一种阿朴啡类异喹啉生物碱,存在于防己科千金藤属(Stephania Lour)植物中,多来自其中的千金藤亚属(Subgen. Stephania)和山乌龟亚属(Subgen. Tuberiphania)[5]。研究发现,在云南地不容中,阿朴啡型和原小檗碱型生物碱最多,其中克班宁是含量最高的阿朴啡型化合物之一[6]。迄今为止,对于克班宁的性质结构已有了一定的探索结果[7-9],且发现它具有抗心律失常等多种药理活性[10-13]。同时,已有多个研究证明克班宁能有效抑制白血病、纤维肉瘤、宫颈癌、乳腺癌、肺癌和卵巢癌等肿瘤细胞的活性[14-17]。Yodkeeree等[18]发现克班宁能通过下调侵袭迁移相关因子的表达来抑制肺癌的迁移和侵袭,另外Wongsirisin等[19]还发现克班宁作用于HL-60细胞后,能通过调控凋亡相关蛋白来介导细胞凋亡。
但关于克班宁对肝癌的生物学影响,目前还未见更深入的报道,因此,本研究的目的在于探索克班宁对肝癌生物学方面的影响,从而为未来开发克班宁在肝癌方向的治疗作用提供一定的参考,并奠定相应的研究基础。
1 材料
1.1 试药
克班宁(分子式:C20H21NO4,纯度≥ 98%,规格:20 mg,批号:RFS-K02811812016,成都瑞芬思生物科技有限公司,化学结构如图1);DMEM高糖培养基(批号:8120360)、胎牛血清(批号:20012050)(美国Gibco公司);CCK-8试剂盒(批号:C0038,上海碧云天生物技术有限公司);Hoechst 33258染色试剂盒(批号:G1011)、PBS(批号:G4202)(武汉赛维尔生物科技有限公司);Annexin V-FITC细胞凋亡试剂盒(批号:8086787,美国BD公司);FoxO3a抗体(批号:10849-1-AP)、p-AKT抗体(批号:28731-1-AP)、p-FoxO3a抗体(批号:28755-1-AP)(武汉三鹰生物技术有限公司);BAX抗体(批号:5023S)、Bcl-2抗体(批号:3498S)、PARP抗体(批号:9532S)、AKT抗体(批号:9272S)、β-actin抗体(批号:4970S)、二抗antirabbit IgG(H+L)(批号:5151S)(美国CST公司)。
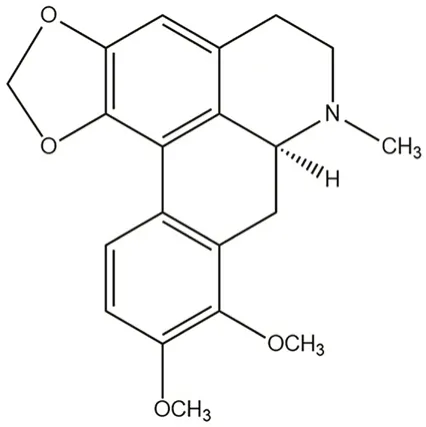
图1 克班宁的化学结构Fig 1 Chemical structure of crebanine
1.2 仪器
HERAcell 160i二氧化碳培养箱(美国Thermo);TC20细胞计数仪(美国BIO-RAD);EnSight酶标仪(美国Perkin Elmer);CytoFlex流式细胞仪(美国Beckman Coulter);IX73倒置荧光显微镜(日本Olympus);DYY-7C蛋白电泳仪(北京六一生物科技有限公司);Odyssey双色红外激光成像系统(美国Li-COR)。
1.3 细胞和培养
人肝癌细胞系Huh7(中国科学院上海细胞生物研究所),采用含10%胎牛血清、1%青霉素-链霉素双抗的完全DMEM培养基,在37℃、5% CO2条件下的细胞培养箱中培养,每2~3 d换液传代。
2 方法
2.1 CCK-8法检测细胞存活率
将Huh7细胞以每孔1×104个接种至96孔板中,培养24 h后,按照0(对照组)、12、36、48、60、96 μg·mL-1的分组分别给予克班宁,每个质量浓度6个复孔,然后继续在相同条件下培养,待24、48和72 h后,在每孔中加入10 μL CCK-8工作液,在 450 nm波长下测定各孔的吸光度值。细胞存活率(%)=(给药组吸光度-空白组吸光度)/(对照组吸光度-空白组吸光度)×100%。
2.2 细胞形态学观察
取对数生长期的Huh7细胞,以每孔4×106个接种于6孔板中,待培养24 h后给予不同质量浓度的克班宁[0(对照组)、36、48、60 μg·mL-1],继续培养24 h后弃去培养基,用PBS清洗2次,加入1 mL DMEM后在倒置显微镜下观察肝癌细胞的生长状态和形态变化,并拍照记录。
2.3 克隆形成实验
将Huh7细胞以每孔4×103个接种到6孔板中,放入培养箱培养24 h,给予克班宁,在24 h后弃去培养基,重新加入新鲜培养基,待14 d后用PBS清洗2次,并以4%多聚甲醛固定20 min,之后用0.5%结晶紫染色,30 min后清洗并晾干,同时拍照记录。细胞数>30个为一个集落,克隆形成率(%)=每组的克隆形成数/接种细胞数×100%。
2.4 Hoechst 33258实验
细胞收集、种板、给药方法同“2.2”项下,给药24 h后用PBS清洗2次,再用4%多聚甲醛固定20 min,加入Hoechst 33258工作液避光孵育30 min,用荧光倒置显微镜观察拍照。
2.5 流式细胞术检测细胞凋亡
细胞收集、种板、给药方法同“2.2”项下,给药24 h后,收集培养基,PBS清洗2次,用无EDTA胰酶消化,1000×g离心5 min,再次用PBS清洗2次,每组加入100 μL缓冲液、5 μL AnnexinⅤ-FITC及5 μL PI,避光孵育25 min后用流式细胞仪检测细胞凋亡情况。
2.6 Western blot实验
将对数生长期的Huh7细胞以每孔7×106个接种于100 mm的培养皿中,培养24 h后给予克班宁,再孵育24 h后,提取蛋白,以BCA法测定蛋白浓度。将蛋白上样后进行SDS-PAGE凝胶电泳,2 h后恒流进行电转,之后用5%的BSA封闭1.5 h,加TBST清洗,然后用相应一抗在4℃条件下孵育过夜;再次用TBST清洗,之后加入HRP标记的二抗(1∶10 000)孵育2 h,同样用TBST清洗,最后用Odyssey双色红外激光成像系统扫描目的条带。扫描结果用Image J软件测定灰度值,最后目的蛋白的相对表达量=目的蛋白的灰度值/内参的灰度值。
2.7 统计学处理
采用GraphPad Prism软件进行统计分析和图片制作,数据以x±s表示,3组及以上数据组间差异评估采用单因素方差分析(One-way ANOVA),P<0.05为差异有统计学意义。各实验至少重复3次。
3 结果
3.1 克班宁对肝癌Huh7细胞增殖能力的影响
CCK-8实验结果见图2,与对照组相比,随着给药浓度增加(0、12、36、48、60、96 μg·mL-1)Huh7细胞的增殖活性逐渐降低,且细胞的存活率随着时间的增长(24、48、72 h)也显著降低(P<0.01),总体呈现出良好的剂量和时间依赖性;根据GraphPad软件计算得出IC50值:24 h为(45.05±1.48)μg·mL-1,48 h为(24.47±0.52)μg·mL-1,72 h为(15.90±0.40)μg·mL-1。克隆形成实验结果见图3,给药剂量越大,克隆形成的数量越少,密度越小,克班宁的质量浓度对肝癌细胞长期增殖能力的影响较大,具有浓度依赖性(P<0.01)。

图2 不同浓度克班宁作用不同时间对肝癌Huh7细胞活力的影响(n=6)Fig 2 Effect of different concentrations of crebanine on the viability of Huh7 cells at different time(n=6)
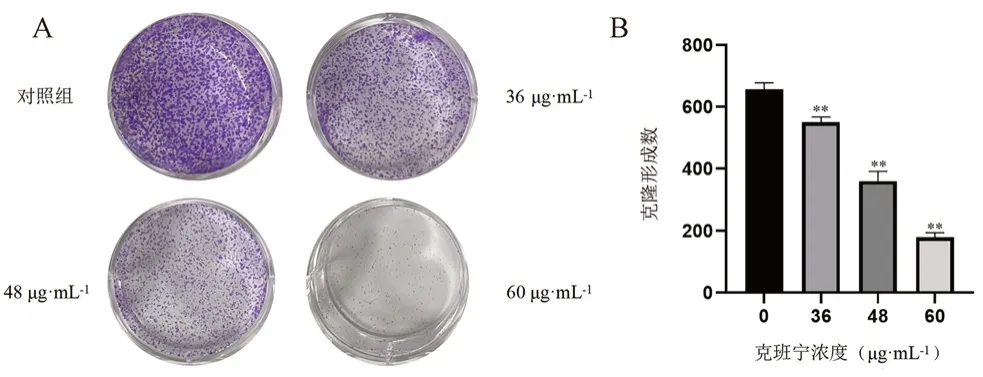
图3 不同浓度克班宁对肝癌Huh7细胞活力的影响Fig 3 Effect of different concentrations of crebanine on the viability of Huh7 cells
3.2 克班宁对肝癌Huh7细胞形态学的影响
从图4可观察到克班宁对Huh7肝癌细胞形态上的影响较为明显,对照组肝癌细胞生长状态良好,Huh7细胞紧密贴壁,且细胞形状多保持完整,呈现不规则多边形,多为梭形;而随着克班宁给药剂量的增加,细胞生长状态不断下降的同时密度也降低,且逐渐出现大量的空泡,当给药剂量达到60 μg·mL-1时,大量肝癌细胞缩小变圆,无法保持基本的癌细胞形态。这表明克班宁有较好的抑制肝癌Huh7细胞的作用。

图4 不同浓度克班宁对肝癌Huh7细胞形态的影响Fig 4 Effect of different concentrations of crebanine on the morphology of Huh7 cells
3.3 克班宁对肝癌Huh7细胞的促凋亡作用
从图5A可以看出,相比于对照组在荧光倒置显微镜下呈现出的均匀染色,细胞核形状完整的状态,给予了一定剂量的克班宁的肝癌细胞则逐渐皱缩,破碎,细胞核也大多形态异常,并且这种状况随着剂量的加大而变得更加严重;由流式细胞术的检测结果可知(见图5B),克班宁作用于Huh7细胞24 h后,细胞凋亡率随着浓度的升高而增加,晚期凋亡细胞数量从对照组的5.13%上升至38.2%,可见克班宁对肝癌Huh7细胞的促凋亡作用有剂量依赖性。
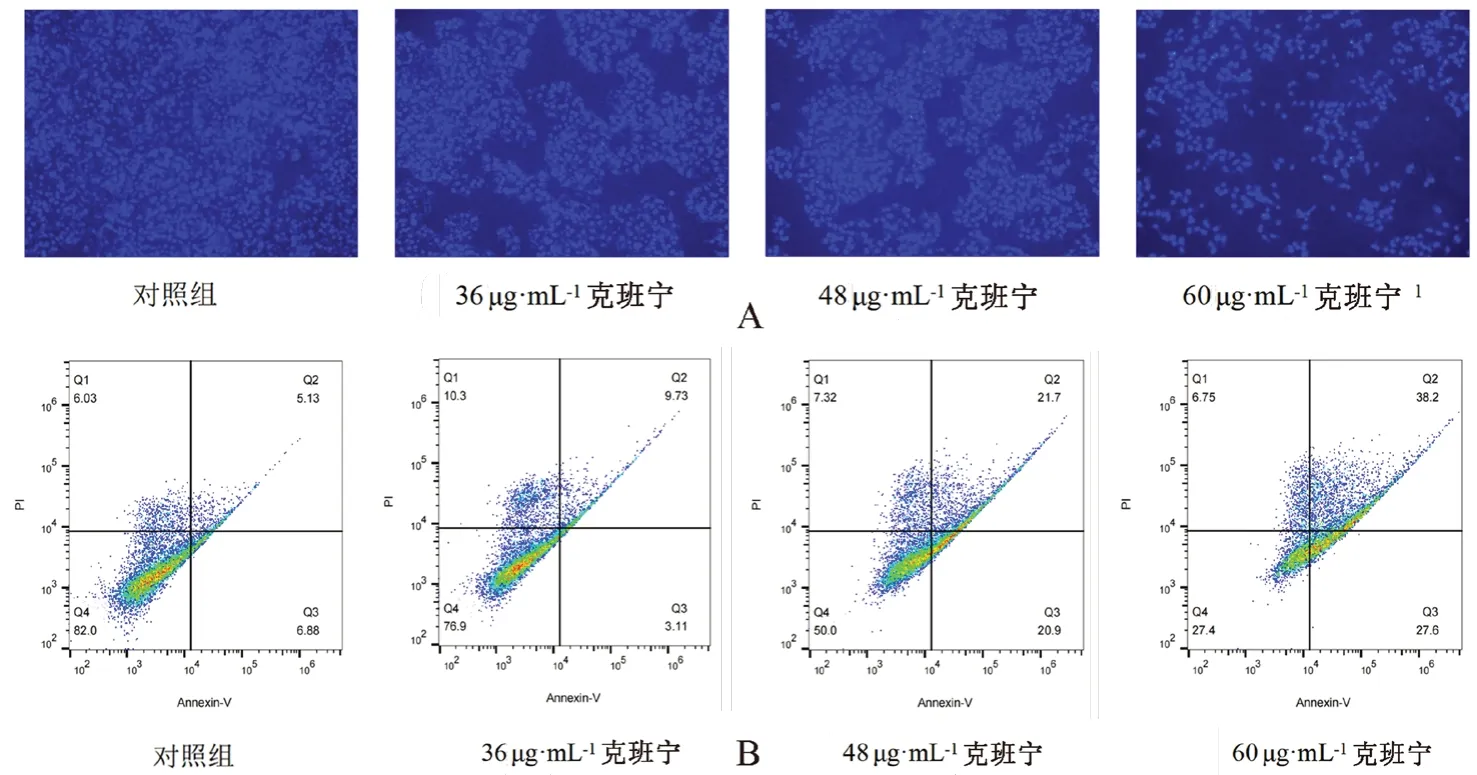
图5 不同浓度克班宁对肝癌Huh7细胞凋亡的影响Fig 5 Effect of different concentrations of crebanine on the apoptosis of Huh7 cells
3.4 克班宁对肝癌Huh7细胞凋亡相关蛋白的表达影响
Western blot检测凋亡相关蛋白的检测结果如图6A所示,与对照组相比,克班宁给药组肝癌细胞中BAX、Cleaved-PARP 蛋白表达均显著增加,Bcl-2 蛋白表达则显著降低;各个凋亡蛋白的相对表达量见图6B,克班宁的浓度越高,BAX蛋白表达水平越高,相对的Bcl-2 蛋白表达越低。为了研究克班宁对Huh7细胞凋亡和增殖的影响是否与Akt/FoxO3a信号通路有关,本研究采用Western blot检测不同浓度克班宁处理的Huh7细胞中相关蛋白(AKT、p-AKT、FoxO3a和p-FoxO3a)的表达水平。根据图7A结果所示,AKT和FoxO3a的表达水平几乎保持不变,而p-AKT和p-FoxO3a的表达水平随着克班宁浓度的增加而下降。综合图7B的结果来看,中、高浓度克班宁显能著抑制AKT/FoxO3a信号通路蛋白的表达(P<0.01)。

图6 不同浓度克班宁对肝癌Huh7细胞凋亡蛋白表达的影响Fig 6 Effect of different concentrations of crebanine on the expression of apoptosis protein in Huh7 cells
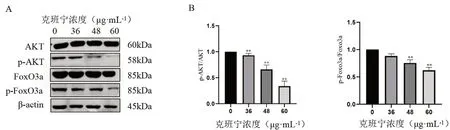
图7 不同浓度克班宁对肝癌Huh7细胞不同蛋白表达的影响Fig 7 Effect of different concentrations of crebanine on the expression of different proteins in Huh7 cells
4 讨论
HCC有着起病隐匿,恶性程度高,早期诊断困难,预后差等特点;且研究发现HCC患者的平均年生存率低于10%[20],在晚期肝癌患者全身治疗药物有限,对传统化疗药物极为不敏感的情况下[21],即使有类似索拉非尼、乐伐替尼、纳武单抗等靶点药物的出现,也仍有大部分患者因为价格昂贵或者不良反应的原因而无法长期使用[22],而现在,从天然化合物中提取出有效成分,研究其抑制癌症的功能并开发成抗肿瘤药物,已经逐渐成为热点[23-24]。越来越多的证据表明,天然化合物可以通过抑制HCC的增殖、迁移、侵袭、凋亡、自噬等功能来发挥抗肿瘤作用[25]。
本研究在CCK-8法和克隆形成实验中观察到,克班宁在体外显著抑制肝癌Huh7细胞系的生长,这种抑制能力长期存在;且通过显微镜发现肝癌细胞形态异常,随着药物剂量增大出现空泡化和皱缩,表明其有可能被诱导凋亡,而Hoechst 33258和流式细胞实验结果则同时证明了克班宁有促进肝癌凋亡的能力,Western blot检测到凋亡相关蛋白BAX和Cleaved-PARP的过表达,Bcl-2的低表达,再次证实了这一猜想。
另外,本实验还初步探索了克班宁对PI3K/AKT信号通路的影响,过去的研究发现PI3K/AKT信号通路在多种人类癌症中异常激活,如肝癌、胰腺癌、结肠癌、乳腺癌、卵巢癌等[26]。研究表明激活的PI3K可以磷酸化并激活AKT,而AKT是PI3K/AKT信号通路中的关键调节因子,被激活的AKT调节多种效应分子促进肿瘤的发展,其中FoxO3a是AKT的重要靶点之一[27]。在PI3K/AKT信号通路被异常激活后,AKT对FoxO3a的磷酸化触发了FoxO3a蛋白,使其从细胞核到细胞质的快速重新定位,激活或抑制FoxO3a相关信号分子;其中,受FoxO3a调控的Bim、PUMA、14-3-3、FasL和TRAIL都是与凋亡相关的蛋白[28-29]。而Hagenbuchner等[30]在研究中证明了FoxO3a不仅影响线粒体功能及相关凋亡因子的表达,还通过诱导线粒体活性氧(ROS)的积累和Bcl-2蛋白家族的表达来控制细胞凋亡的进程。另外,Yan等[31]的研究结果也表明了库潘尼西(copanlisib)通过AKT/FoxO3a/PUMA轴对结直肠癌有细胞毒性和促凋亡作用。还有研究表明,扁蒴藤素(pristimerin)可以直接调控PI3K/AKT/FoxO3a途径引发葡萄膜黑色素瘤的细胞死亡[32]。而在本实验中发现克班宁可显著抑制AKT磷酸化,同时减少FoxO3a的磷酸化,证明克班宁可以干扰AKT/FoxO3a信号的表达,从而对肝癌产生细胞毒性,致使细胞死亡。
综上所述,克班宁对肝癌Huh7细胞增殖有明显的抑制作用,同时促进了肝癌细胞的凋亡,能显著促进或抑制凋亡相关蛋白的表达,而早在之前的研究中就已经证实AKT/FoxO3a是调节细胞凋亡的关键通路之一[33-34];因此,初步推测克班宁的促凋亡作用可能是通过抑制AKT/FoxO3a信号通路产生的。当然,两者之间的关系需要进一步的实验验证,而本课题组也只是对克班宁抗肝癌作用进行了初步研究,其对肝癌迁移、侵袭和其他功能的影响未来仍需更为深入的探讨。
