芹菜素纳米胶束的制备工艺优化及质量评价
2023-04-01刘雄英周韵秋于恩江典成阳冉梦楠典灵辉广东医科大学药学院广东东莞523808
刘雄英,周韵秋,于恩江,典成阳,冉梦楠,典灵辉(广东医科大学药学院,广东 东莞 523808)
芹菜素(apigenin,API,4',5,7-三羟基黄酮)是一种天然存在的黄酮类化合物,无毒,具有抗氧化、抗炎、神经保护、抗肿瘤等药理作用[1-2],能抑制乳腺癌、肺癌、肝癌等多种类型肿瘤细胞的增殖,促进细胞凋亡,发挥抗肿瘤作用[3-4]。然而芹菜素属于生物药剂学分类系统Ⅱ类药物(即低溶解性和高渗透性),它在pH 1.0、6.8和7.5下的溶解度分别为1.43、1.56和2.16 μg·mL-1,其水溶性较差、肠道吸收少,生物利用度较低[5],这影响了其在体内发挥活性,限制了临床应用。
提高芹菜素的溶解度和口服生物利用度的方法有很多,比如制备成纳米颗粒、脂质体、纳米乳剂等,但作用效果不显著[6]。而纳米胶束作为一种新型的纳米药物递送系统,具有载药范围广、组织渗透性好等优点,且能提高难溶性药物的溶解度和控制药物释放,具有更好的应用前景[7-9]。聚乙烯己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物(Soluplus)是一种两亲性非离子型共聚物,其两亲性结构可在溶液中自组装形成纳米胶束,可以将难溶性药物溶于疏水核心,提高难溶性药物的溶解度[10-11],具有较低的临界胶束浓度(6.44×10-8mol·L-1),在水中易形成稳定的胶束。Soluplus的疏水结构具有羰基,能与具有羟基的化合物形成氢键,增强纳米胶束的稳定性[12]。D-α生育酚聚乙二醇1000琥珀酸酯(TPGS)是一种非离子表面活性剂、增溶剂、吸收促进剂,能显著促进难溶性药物的溶解度及其在体内的吸收[13]。TPGS常与其他材料制备混合胶束或纳米粒,增强单一胶束的稳定性,并能形成功能化纳米胶束,促进药物的吸收,增强药物治疗效果[14]。
因此,本试验以Soluplus为纳米载体材料,采用薄膜分散法制备芹菜素纳米胶束(apigeninloaded soluplus nanomicelles,API-PMs),用响应面法对其制备工艺进行优化,并考察其体外释放特性,为进一步开发利用芹菜素奠定基础。
1 材料
1.1 仪器
UM-4T磁力搅拌器(北京忧晟联合科技有限公司),KQ5200DB型数控超声波清洗器(昆明市超声仪器有限公司),SZ-100纳米粒度分析仪(日本HORIBA公司),UV-650型紫外可见分光光度计(上海美谱达仪器有限公司),WQF-510A型傅里叶变换红外光谱仪(北京瑞利分析仪器有限公司),RE52CS旋转蒸发仪(上海亚荣生化仪器厂)。
1.2 试药
芹菜素(批号:CAS 520-36-5,质量分数≥98%)、D-α生育酚聚乙二醇1000琥珀酸酯(TPGS,批号:CAS 9002-96-4)(美国Sigma公司),聚乙烯己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物(Soluplus,批号:84414368E0,德国BASF公司),Tween80(化学纯,天津市富宇精细化工有限公司),甲醇、无水乙醇(分析纯,天津市大茂化学试剂厂)水为超纯水。
2 方法与结果
2.1 芹菜素含量测定
2.1.1 芹菜素紫外检测波长的确定 取适量芹菜素配制芹菜素乙醇溶液,用紫外分光光度计在200~600 nm内扫描,确定芹菜素的检测波长为336 nm,且各辅料对芹菜素的测定无干扰。
2.1.2 线性关系和方法学考察 分别配制质量浓度为 1、2、5、10、20、30、40、50 μg·mL-1的芹菜素乙醇溶液,测定吸光度(A),以芹菜素质量浓度(C,μg·mL-1)为横坐标,A为纵坐标进行线性回归,得标准曲线A=0.0766C+0.0102,r=0.9999,线性范围为1~50 μg·mL-1。低、中、高浓度(5、20、50 μg·mL-1)的芹菜素乙醇溶液日内精密度的RSD分别为 1.1%、0.79%、1.6%(n=3),日间精密度的RSD分别为1.8%、0.56%、1.5%(n=3),平均回收率分别为105.2%、103.4%、100.8%,RSD分别为1.8%、0.40%、1.5%(n=3),表明本方法的仪器精密度和回收率良好。
2.2 API-PMs的制备及处方工艺的优化
2.2.1 API-PMs的制备 采用薄膜分散法制备,称取适量芹菜素和Soluplus于茄形瓶中,加适量无水乙醇完全溶解,于50℃减压旋转蒸发挥去有机溶剂,使其在瓶壁上形成一层均匀的含药薄膜;再将一定量的TPGS水溶液加入茄形瓶中,涡旋,磁力搅拌一定时间,经过0.22 μm微孔滤膜,得淡黄色透明乳光的API-PMs溶液。
2.2.2 单因素试验 其他条件不变,分别对芹菜素投药量(1.0、1.5、2.0、2.5、3 mg)、TPGS浓度(0.1、0.2、0.3、0.4、0.5 mg·mL-1)、磁力搅拌时间(1.0、1.5、2.0、2.5、3.0 h)、磁力搅拌速度(400、500、600、700、800 r·min-1)进行单因素试验,采用紫外分光光度计和纳米粒度分析仪测定胶束的包封率和粒径的变化。
结果如图1所示,芹菜素投药量对纳米胶束粒径影响较大,随着投药量的增加,粒径逐渐增大,而包封率缓慢减小;当投药量在1.5 mg时具有最大包封率。随着TPGS浓度的增加,粒径无明显变化,包封率则缓慢增大;当TPGS浓度为0.4 mg·mL-1时,包封率最大。随着磁力搅拌时间的增加,粒径无明显变化,包封率在搅拌时间为3 h时最大。随着磁力搅拌速度的增大,粒径无明显变化,当磁力搅拌速度为700 r·min-1时,包封率最大。
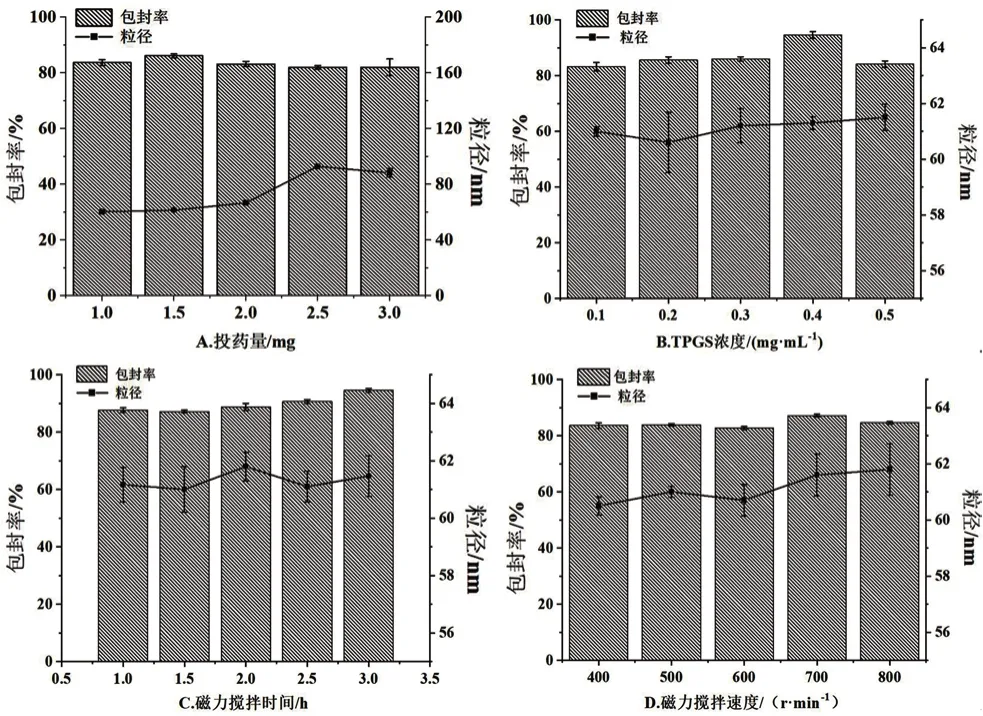
图1 单因素对纳米胶束包封率和粒径的影响Fig 1 Effect of single factor on the encapsulation efficiency and particle size of API-PMs
2.2.3 Box-Behnken设计(BBD)-响应面试验优化纳米胶束的制备工艺
① BBD 试验设计与结果:根据单因素试验结果,采用BBD响应面法来进行制备工艺优化,以投药量(A)、TPGS浓度(B)、磁力搅拌速度(C)和磁力搅拌时间(D)为因素,并以包封率、载药量和粒径为响应值进行试验,试验数据运用软件Design-Expert 8.0.6分析处理,因素与水平见表1。
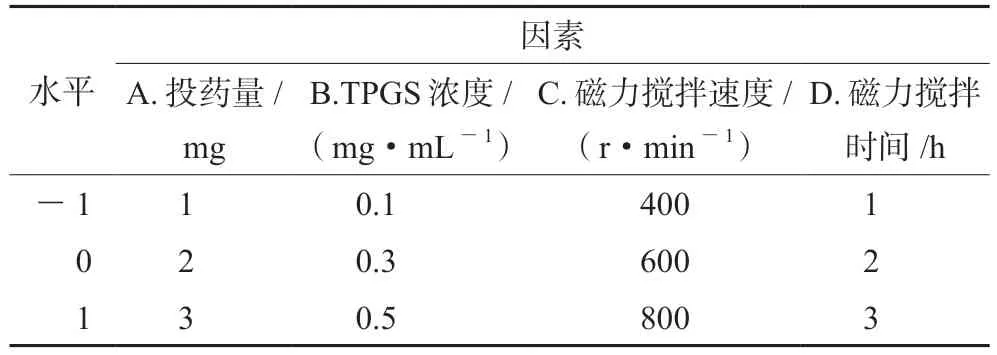
表1 因素与水平Tab 1 Factor and level
由于试验设计包括包封率、载药量和粒径三个指标评价,因此可采用多指标数据总评归一值(overall desirability,OD)法,对取值越小越好的指标(粒径)和取值越大越好的指标(包封率和载药量),采用Hassan 方法,通过计算各个实验指标“归一值”的几何平均值,得到综合评价的“归一值”[15]。故以OD为响应变量(Y),结果见表2。

表2 BBD响应面实验设计与结果Tab 2 BBD response surface experiment design and results
② 模型拟合及方差分析: 以OD值为响应值,利用Design Expert 8.0.6软件分别对各因素多元线性回归和二项式拟合,得到OD值对A、B、C、D四个因素的二项式回归方程:
OD=0.92-0.31A+0.035B-1.944×10-3C+0.018D+0.11AB-0.016AC+0.022AD+7.34110-3BC+0.018BD-1.657×10-3CD-0.5A2+0.063B2-0.019C2-8.526×10-3D2
响应面模型对OD值的方差分析结果如表3所示,模型P值小于0.0001,表明该模型是显著的;失拟项P值大于0.05,不显著,说明模型方程拟合程度好,可以用此模型对制备工艺进行分析和预测;并且模型中参数A、AB、A2和B2都是显著的,对比所有因素的F值大小,得出影响制备工艺的因素强弱排序为投药量>TPGS浓度>磁力搅拌时间>磁力搅拌速度。
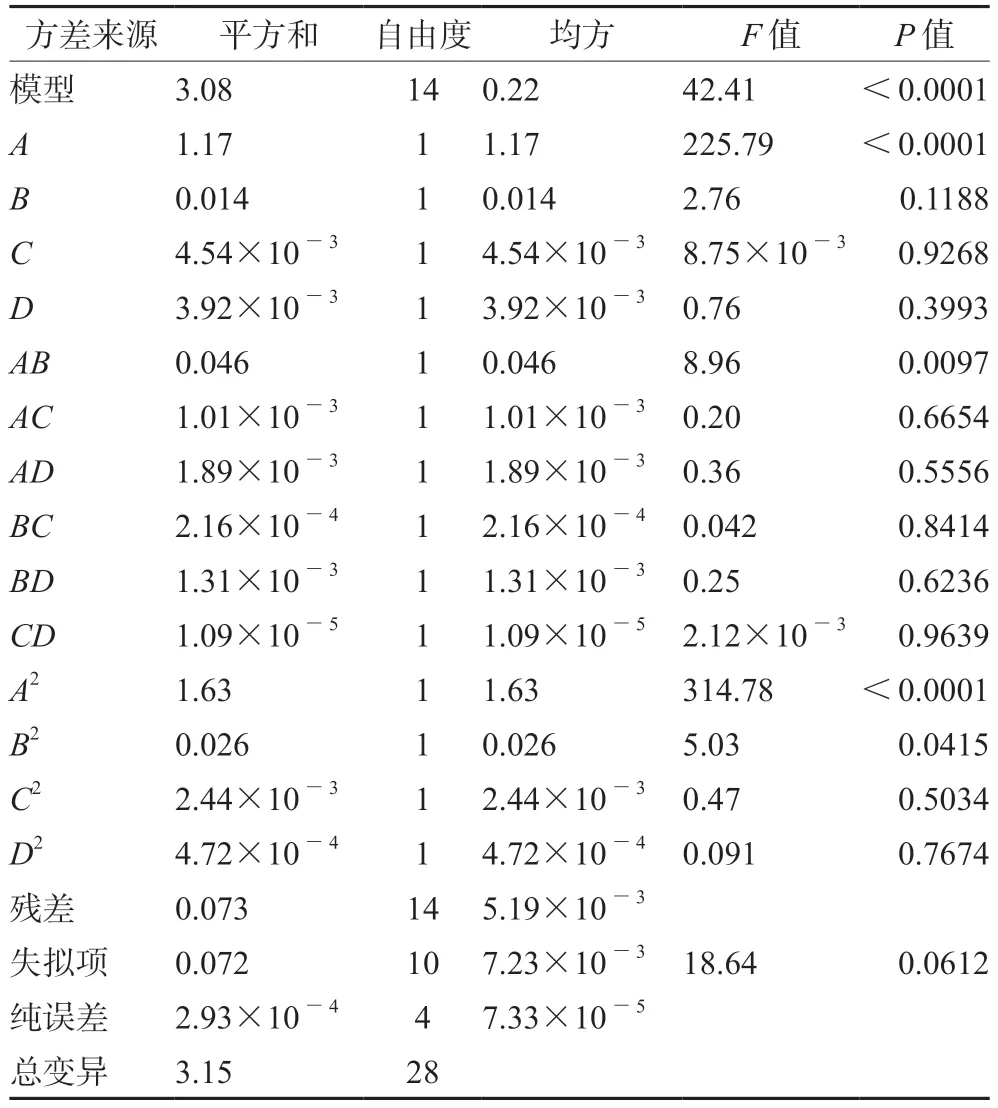
表3 响应面模型对OD值的方差分析结果Tab 3 Variance analysis of response surface model on OD value
③ 响应面交互作用结果分析与预测:为了进一步研究不同因素之间交互作用以及确定最优工艺处方参数,通过Design-Expert 8.0.6软件绘制出OD值随着不同因素交互作用变化的三维响应面图。结果见图2,可知,OD存在最大值,经软件分析筛选,得到最优工艺处方参数为投药量1.89 mg,TPGS浓度为0.49 mg·mL-1,磁力搅拌速度为662.97 r·min-1,磁力搅拌时间为2.26 h,预测粒径为57.1 nm,包封率为99.35%,OD为1.04。
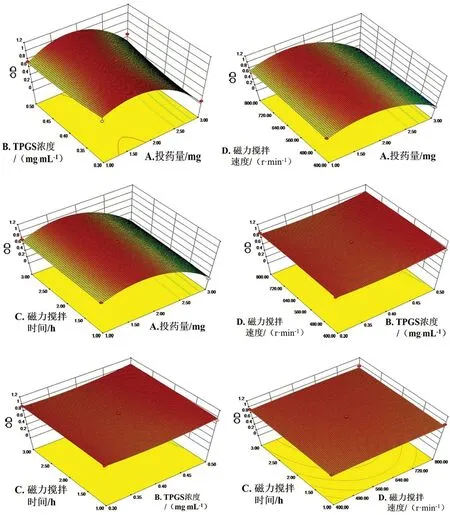
图2 四个因素相互作用的三维响应面图Fig 2 Three-dimensional response surface of interaction of 4 factors
④ 最优制备工艺处方的验证:综合实际情况,确定芹菜素投药量2 mg,TPGS质量浓度为0.5 mg·mL-1,磁力搅拌速度为700 r·min-1,磁力搅拌时间为2.5 h,平行3次试验,测定包封率、载药量和粒径。结果见表4,实际测得OD值与预测OD值基本接近,RSD为1.0%,表明该方法预测的最优工艺处方参数可靠,可用于该制备处方工艺优化。
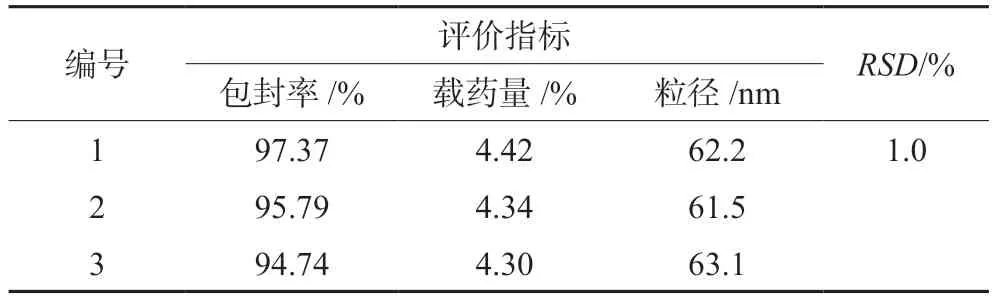
表4 制备工艺验证结果Tab 4 Verification of preparation process
2.3 API-PMs的质量评价
2.3.1 包封率和载药量测定 精密吸取50 μL纳米胶束溶液,加无水乙醇破乳并稀释至5 mL,按“2.1”项下方法测定药物的含量,平行测定3次。计算包封率和载药量:包封率(%)=(包封的药物质量/加入的药物质量)×100%,载药量(%)=(包封的药物质量/胶束和药物总质量)×100%。计算得出胶束中芹菜素的包封率和载药量分别为(93.49±1.28)%和(4.45±0.06)%。
2.3.2 粒径测定 取API-PMs溶液适量,加水稀释后用纳米粒度分析仪测量粒径大小,平行测定3组,结果如图3所示,测得的API-PMs粒径为(62.8±1.1)nm,表明制备的纳米胶束粒径小且分布均匀。

图3 API-PMs的粒径分布图Fig 3 Particle size distribution of API-PMs
2.3.3 稳定性试验 将API-PMs溶液置于室温,分别在第0、7、14、21、28日测定胶束的包封率和粒径,结果包封率和粒径RSD分别为1.5%和1.8%,表明纳米胶束在室温条件下28 d内是比较稳定的。
2.3.4 傅里叶变换红外光谱法(FTIR) 将芹菜素原料药(API)、空白纳米胶束冻干样品(PMs)、芹菜素原料药与空白纳米胶束的物理混合物冻干样品、芹菜素纳米胶束(API-PMs)冻干样品,分别与一定量的溴化钾混合均匀,压片,测定400~4000 cm-1内样品的红外光谱图,如图4所示,芹菜素原料药的O-H特征吸收峰(3278 cm-1)和C=O特征吸收峰(1654 cm-1,1608 cm-1),芹菜素原料药与空白纳米胶束的物理混合物的红外光谱中,既有空白纳米胶束的特征吸收峰,也有芹菜素原料药的特征吸收峰;芹菜素纳米胶束出现的C=O特征吸收峰(1735 cm-1,1631 cm-1)相比空白纳米胶束出现C=O的特征吸收峰(1737 cm-1,1639 cm-1),位移发生了改变,这表明在芹菜素纳米胶束中,芹菜素分子中的羟基与纳米胶束疏水结构中的羰基之间形成了氢键。
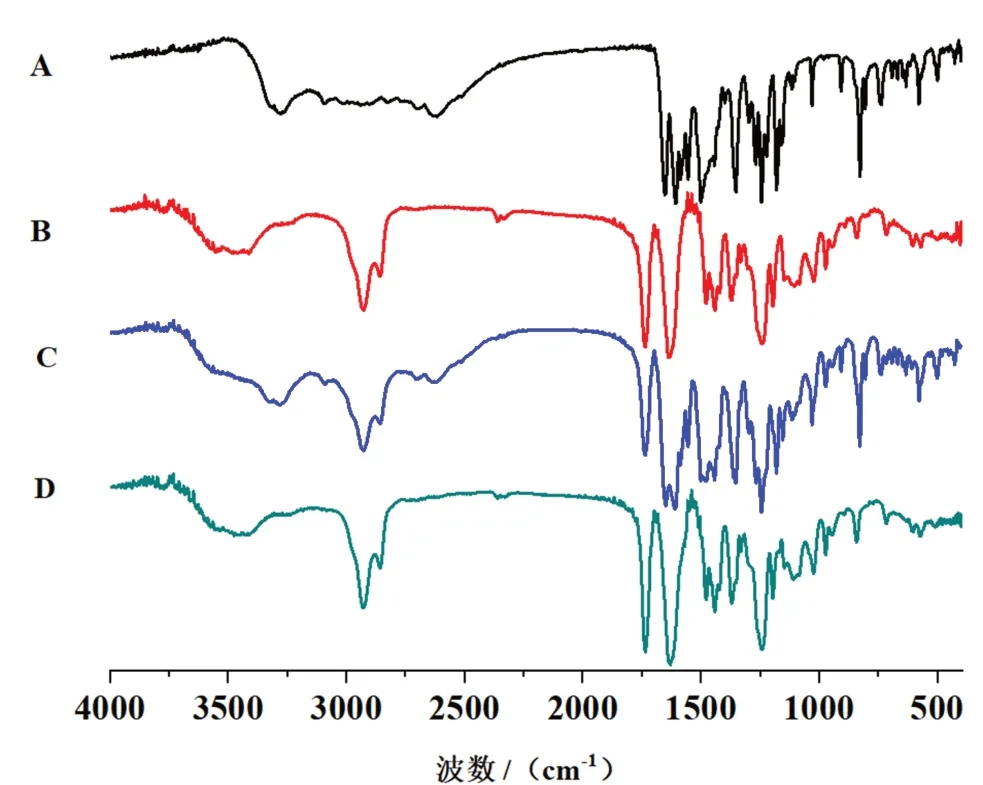
图4 纳米胶束的红外光谱图Fig 4 Infrared spectra of nanomicelles
2.3.5 体外释放试验 在参考文献[16]和预试验的基础上,采用动态透析袋法考察API-PMs中芹菜素的释放行为。分别取1 mL API溶液和1 mL API-PMs溶液,置透析袋(截留分子量为10000 Da),两端扎紧,在满足漏槽条件的前提下,放入磷酸盐缓冲液(pH 7.4,0.5% Tween 80)20 mL释放介质中。在37℃、100 r·min-1条件下振摇,分别于0.5、1、2、3、4、5、6、8、10、12、24、36、48、72 h时取出全部释放介质(同时补入同温等量的新鲜释放介质),平行3组。按“2.1”项下方法测定释放介质中芹菜素的含量,计算累积释放率(Q),绘制释放曲线。结果如图5所示,API在72 h内仅释放出30.04%,API-PMs在72 h内持续缓慢释放出43.63%,具有明显的缓释作用。采用Higuchi方程对胶束的体外释放数据进行拟合,显示其体外释放符合Higuchi方程,所得回归方程Q=5.326t1/2,r=0.9991,表明其体外释放以扩散为主,药物从胶束的疏水内核中慢慢扩散到释放介质中。
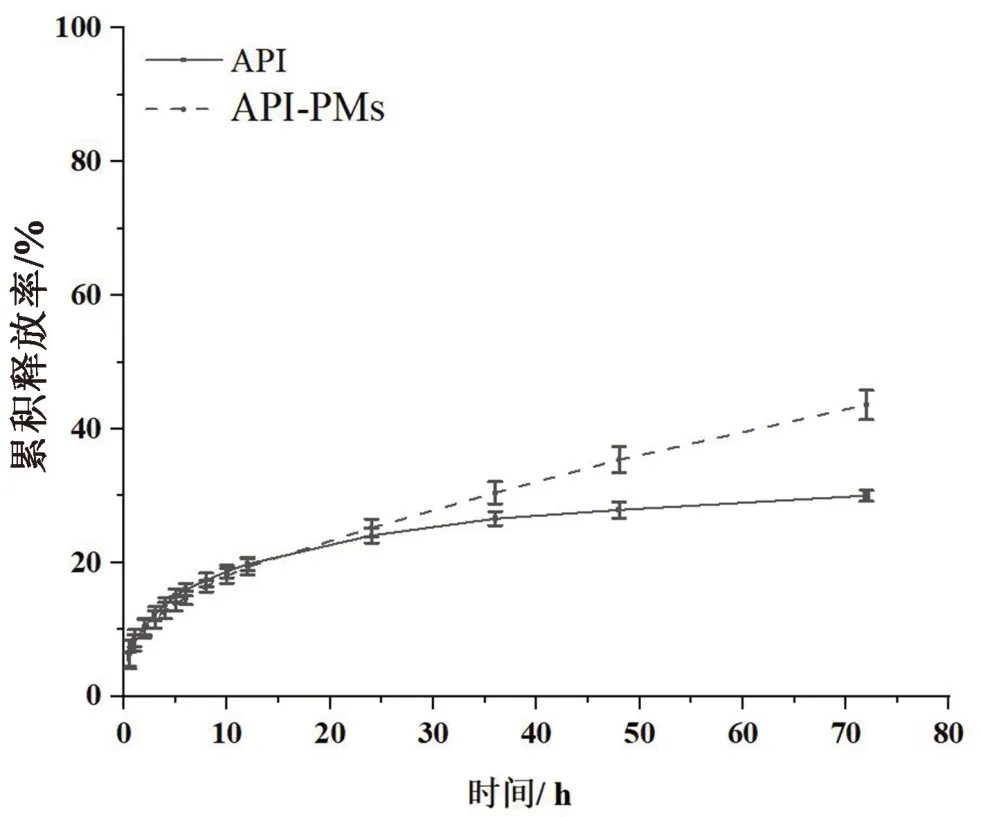
图5 API和API-PMs的累积释放曲线(n=3)Fig 5 Cumulative release profile of API and API-PMs(n=3)
3 讨论
本试验通过单因素试验和Box-Behnken设计-响应面法,优化API-PMs的制备工艺,验证试验显示实测值与预测值偏差较小,表明Box-Behnken设计-响应面法具有较好的预测性,可用于API-PMs的制备工艺的优化设计。
对于纳米胶束输送系统,更高的包封率和载药量意味着同等给药剂量下进入患者体内的载体材料和辅料更少,毒性和免疫原性风险更低。本试验中的API-PMs具有较高的包封率和载药量,表明药物包封与载体载药性能良好。其粒径约62 nm,小于100 nm,符合口服吸收的粒径范围[17]。稳定性试验结果显示,API-PMs在常温条件下贮存28 d后,其包封率和粒径没有显著变化,表明纳米胶束性质稳定,药物不易析出且贮存方便。从FTIR分析可以得出,芹菜素与载体之间形成的氢键提高了纳米胶束的稳定性,使得载药量和包封率增加,减少药物泄漏[18]。
体外释放试验中,在满足漏槽条件的前提下,选择磷酸盐缓冲液(pH 7.4,0.5% Tween 80)为其释放介质,结果显示,芹菜素原料药水溶性差,快速在透析袋中沉淀,不再释放,而API-PMs具有明显的缓慢扩散作用,达到了缓释、长循环的目的。本试验制备的API-PMs中加入TPGS吸收促进剂,有利于胃肠道对纳米胶束的吸收,而纳米胶束能否促进芹菜素吸收,有待进一步研究。
