基于miRNA高通量测序探讨芪玄抑甲宁改善格雷夫斯病小鼠甲状腺功能亢进的作用机制
2023-04-01高长久卢芳柳长凤于栋华丁崧刘树民黑龙江中医药大学研究生院哈尔滨50040黑龙江中医药大学中医药研究院哈尔滨50040
高长久,卢芳,柳长凤,于栋华,丁崧,刘树民*(. 黑龙江中医药大学研究生院,哈尔滨 50040;.黑龙江中医药大学中医药研究院,哈尔滨 50040)
格雷夫斯病(Graves disease,GD)是一种发生于甲状腺的自身免疫性疾病,以促甲状腺激素(TSH)受体刺激抗体(TRAb)的发现为特征,主要表现为弥漫性甲状腺肿、甲状腺毒症和眼病。在所有甲状腺功能亢进(以下简称甲亢)患者中,有80%左右的病例被诊断出患有GD。当前,治疗GD主要有放射性碘、抗甲状腺药物和甲状腺切除术三种方式[1-2],但这些方式存在复发率高、易伴发甲状腺功能减退等问题[3]。
MicroRNA(miRNA)是内源性、单链的非编码微小RNA,长度一般为19~25个核苷酸。miRNA可以通过抑制mRNA翻译或促进靶RNA降解来下调编码蛋白基因的表达[4],广泛参与炎性介质的释放、免疫反应的调控、血管的形成等诸多重要生物学事件[5]。近年来,越来越多的研究表明miRNA在GD的发生发展中起着重要作用[6-8]。
GD属于中医“瘿病”范畴,初期多为气机郁滞,继而津凝痰聚,痰气搏结颈前;进而肝气郁结,日久化火,火热内盛,耗气伤阴,导致气阴两虚之候[9]。基于上述认识,刘树民教授通过多年临床经验总结并创建了补气滋阴、清肝降火、化痰散结之验方——芪玄抑甲宁,广泛应用于临床,并取得了良好的疗效。前期药效学研究已证实芪玄抑甲宁对GD有显著改善作用,本研究旨在通过miRNA测序技术,从表观遗传学角度探索其在GD模型小鼠甲状腺组织中的作用靶点及改善GD甲亢的作用机制。
1 材料
1.1 试药
芪玄抑甲宁组方五味中药黄芪-玄参-牡蛎-浙贝母-夏枯草配伍比例为3∶2∶2∶2∶1(黑龙江修生堂药业有限公司,批号分别为20190401、20190401、20200601、20191101、20190701),经黑龙江中医药大学药学院中药资源与开发教研室王振月教授鉴定为正品饮片,符合2020年版《中国药典》饮片性状规定,按照最优工艺进行提取[10],制备成冻干粉;甲巯咪唑片(Merck KGaA,批号:C10002097)。
Ad-TSHR289重组腺病毒(赛业生物科技有限公司,滴度3.13×1011PFU·mL-1);小鼠三碘甲腺原氨酸(T3)、甲状腺素(T4)、促甲状腺激素(TSH)ELISA试剂盒(江苏晶美生物科技有限公司,批号分别为202112、202112、202201);VAHTSTM Small RNA Library Prep Kit for Illumina、VAHTSTM DNA Clean Beads试剂盒(南京诺唯赞生物科技股份有限公司,批号分别为NR801-02、N411-03);TransScriptⅡ All-in-One First-Strand cDNA Synthesis SuperMix for Qpcr/One-Step gDNA Removal、TransStart Top Green qPCR SuperMix试剂盒(北京全式金生物技术股份有限公司,批号分别为AH341、AQ131)。
1.2 仪器
Eclipse E100正置光学显微镜(日本Nikon公司);M200pro型酶标仪、Nanodrop 2000超微量紫外分光光度计(美国Thermo公司);NovaSeq 6000测序仪(美国Illumina公司);LabChip GX大分子分析仪(美国PerkinElmer公司);CFX96 qRT-PCR仪(美国Bio-Rad公司)。
1.3 动物
6周龄SPF级雌性BALB/c小鼠,体质量18~22 g [北京维通利华实验动物技术有限公司,许可证号SCXK(京)2021-0006]。小鼠在温度20~24℃、湿度40%~50%条件下适应性饲养1周,自由进食饮水。动物实验在黑龙江中医药大学中医药研究院完成,动物使用许可证号:SYXK(黑)2018-007。本研究经黑龙江中医药大学实验动物福利与伦理委员会批准(批准文号:2021030605)。
2 方法
2.1 动物模型的制备与分组给药
促甲状腺激素受体(TSHR)是具有7个跨膜结构的G蛋白偶联受体,包括A(细胞表面)、B(跨膜)两个亚单位,A亚单位主要参与促甲状腺激素(TSH)受体特异性刺激性自身抗体(TRAb)结合。通过构建TSHR-A亚单位的腺病毒(Ad-TSHR289)可成功诱导GD动物模型。在众多造模方法中,雌性BALB/c小鼠通过Ad-TSHR289重组腺病毒免疫诱导所建立的GD模型,与人GD的发生机制类似,成模率最高(可达86%),且具有高度可重复性,此动物模型现被广泛应用[11]。前期实验结果表明,芪玄抑甲宁各剂量组对GD模型小鼠的外观行为、甲状腺组织病理形态具有改善作用,并对血清中T4、TRAb有回调作用,且高剂量组最显著[12],故本研究以前期实验的高剂量组作为给药组。
取雌性BALB/c小鼠50只,随机分为对照组(10只)、造模组(40只)。造模组应用经PBS稀释的重组腺病毒(Ad-TSHR289)于小鼠胫前肌内注射免疫造模,每次免疫剂量为1.878×109PFU/60 μL,对照组给予等剂量的PBS,于第1、4、7周共免疫3次。第10周将检测造模成功的小鼠分为模型组、甲巯咪唑组、芪玄抑甲宁组,每组8只。芪玄抑甲宁组灌胃芪玄抑甲宁50 g生药/(kg·d)(质量浓度2.5 g 生药·mL-1,20 mL·kg-1),甲巯咪唑组灌胃甲巯咪唑片3.75 mg/(kg·d),对照组、模型组灌胃给予20 mL/(kg·d)的饮用水,连续4周。
2.2 芪玄抑甲宁对GD小鼠甲状腺功能的影响
给药前和给药4周后,将各组小鼠腹腔注射0.3%戊巴比妥钠(40 mg·kg-1)麻醉,于小鼠颌下静脉丛采静脉血,离心取上清,ELISA法检测小鼠血清中T3、T4和TSH水平,具体操作按试剂盒说明书进行,并经酶标仪检测450 nm波长时的光密度值,比较各组间的差异并分析。
2.3 芪玄抑甲宁对GD小鼠甲状腺组织病理形态的影响
给药结束后,颈椎脱位法处死小鼠,取甲状腺组织,用4%多聚甲醛固定,经石蜡包埋切片,脱蜡至水,苏木素和伊红染色,脱水,中性树胶封片后,在正置光学显微镜下观察和拍照。
2.4 各组小鼠甲状腺组织差异表达miRNA的分析
2.4.1 甲状腺组织RNA的提取与检测 从对照组、模型组和芪玄抑甲宁组每组随机选取6只小鼠的甲状腺组织,使用TRIzol法提取组织样本的总RNA,使用生物大分子分析仪LabChip GX对RNA的完整性进行检测,使用超微量紫外分光光度计Nanodrop2000对RNA进行浓度检测。
2.4.2 文库构建与高通量测序 使用VAHTSTM Small RNA Library Prep Kit for Illumina构建单端测序文库,通过VAHTSTM DNA Clean Beads纯化产物合成cDNA文库,生成的文库通过Qsep400方法进行质检,在NovaSeq 6000平台上进行测序。
2.4.3 基因鉴定与表达分析 将每个具有miRNA序列的样品读长与已有miRNA数据库和新miRNA的预测结果进行比较,对各样本中miRNA进行表达量分析,并使用TPM算法对表达量进行归一化。以差异倍数(Fold Change,FC)>1.5 或<0.67,P<0.05作为筛选标准,使用edgeR软件进行差异表达分析,获得两组样本之间的差异表达miRNA。
2.5 差异表达miRNA的qRT-PCR验证
选择miR-128-3p、miR-144-3p、miR-363-3p、miR-215-5p、miR-30a-5p这5个差异表达miRNA进行qRT-PCR验证。取各组小鼠甲状腺组织miRNA,使用TransScript Ⅱ All-in-One First-Strand cDNA Synthesis SuperMix for qPCR(One-Step gDNA Removal)反转录试剂盒反转录成cDNA。根据TransStart Top Green qPCR SuperMix试剂盒说明书进行qRT-PCR分析。结果以差异倍数(FC)进行表示并绘制柱状图。引物序列见表1。

表1 miRNA引物序列Tab 1 miRNA primer sequences
2.6 差异表达miRNA靶基因的预测与网络的构建
将差异表达的miRNA通过miRDB(http://mirdb.org)、TargetScan(https://www.targetscan.org)、Starbase(https://starbase.sysu.edu.cn)3个数据库预测靶基因并取交集,获得差异表达miRNA的靶基因。运用Cytoscape 3.8.2软件构建“差异表达miRNA-靶基因”网络图。
2.7 miRNA靶基因的GO功能富集分析和KEGG通路富集分析
通过Metascape数据库(https://metascape.org)对差异表达miRNA的靶基因进行富集分析,包括基因本体(GO)功能富集分析和京都基因与基因组百科全书(KEGG)通路富集分析。
2.8 统计学分析
甲功三项(TSH、T3、T4)结果采用IBM SPSS Statistics 24软件进行数据分析,数据以(x±s)表示,组间比较采用单因素方差分析,组内治疗前后比较采用配对样本t检验;差异表达miRNA的qRT-PCR和miRNA测序结果数据比较分析采用独立样本t检验,应用GraphPad Prism 7软件进行分组柱状图的绘制。以P<0.05为差异有统计学意义。
3 结果
3.1 芪玄抑甲宁对GD小鼠甲状腺功能的影响
给药前与对照组比较,模型组小鼠T3、T4显著升高(P<0.01),TSH显著降低(P<0.01)。给药4周后,与模型组比较,芪玄抑甲宁组小鼠T3、T4降低(P<0.05,P<0.01),TSH升高(P<0.05);与给药前比较,芪玄抑甲宁组T3、T4降低(P<0.05,P<0.01),TSH升高(P<0.01)(见表2)。
表2 芪玄抑甲宁对GD小鼠甲状腺功能的影响(x±s,n=8)Tab 2 Effect of Qixuan Yijianing on the thyroid function in GD mice ( ±s,n=8)

表2 芪玄抑甲宁对GD小鼠甲状腺功能的影响(x±s,n=8)Tab 2 Effect of Qixuan Yijianing on the thyroid function in GD mice ( ±s,n=8)
注:与同组给药前比较,*P<0.05,**P<0.01;与同时间对照组比较,##P<0.01;与同时间模型组比较,△P<0.05,△△P<0.01.Note:Compared with the same group before the administration,*P<0.05,**P<0.01;compared with the control group at the same time,##P<0.01;compared with the model group at the same time,△P<0.05,△△P<0.01.
组别甲功三项给药前给药后对照组TSH/(mU·L-1)12.93±1.2412.62±1.25 T3/(ng·mL-1)2.79±0.312.81±0.20 T4/(ng·mL-1)61.64±5.4660.21±5.67模型组TSH/(mU·L-1)10.58±0.75##10.99±0.78##T3/(ng·mL-1)3.91±0.39##4.06±0.38##T4/(ng·mL-1)87.04±9.38##85.42±10.29##甲巯咪唑组TSH/(mU·L-1)10.59±0.95##12.57±1.00** △△T3/(ng·mL-1)4.03±0.38##3.05±0.37**△△T4/(ng·mL-1)90.34±7.63##64.70±5.20**△△芪玄抑甲宁组TSH/(mU·L-1)10.79±0.95##12.38±1.13**△T3/(ng·mL-1)4.06±0.17##3.63±0.39*△T4/(ng·mL-1)91.20±5.01##67.14±5.08**△△
3.2 芪玄抑甲宁对GD小鼠甲状腺组织病理形态的影响
对照组甲状腺组织中的滤泡大小形状相对比较均一,滤泡细胞排列较为疏松,甲状腺上皮细胞呈椭圆状、无增生,滤泡中胶质含量较丰富。模型组甲状腺组织中的滤泡细胞大小不一,增生肥大,呈立方状或高柱状,部分滤泡腔中胶质缺失,存在空泡情况等病理特征。与模型组相比,芪玄抑甲宁组甲状腺组织病理形态有一定的恢复,与对照组较为接近(见图1)。

图1 芪玄抑甲宁对GD小鼠甲状腺组织病理形态的影响(HE染色,×400)Fig 1 Effect of Qixuan Yijianing on the pathological morphology of thyroid in GD mice(HE staining,×400)
3.3 三组小鼠甲状腺组织差异表达miRNA
与对照组比较,模型组共筛选出171个差异表达的miRNA,其中99个miRNA下调、72个miRNA上调,差异最大的miRNA为miR-18b-5p;与模型组比较,芪玄抑甲宁组共筛选出127个差异表达的miRNA,其中61个miRNA下调、66个miRNA上调,差异最大的miRNA为miR-1197-3p。其中miR-128-3p、miR-144-3p和miR-363-3p在模型组表达下调,而在芪玄抑甲宁组表达上调(见图2和表3)。

图2 甲状腺组织差异表达miRNA的火山图Fig 2 Volcano plot of differentially expressed miRNAs in the thyroid tissue

表3 各组小鼠甲状腺组织差异表达的miRNATab 3 Differentially expressed miRNAs in the thyroid tissue of mice in each group
3.4 差异表达miRNA的qRT-PCR验证
三组小鼠甲状腺组织miR-128-3p、miR-144-3p、miR-363-3p、miR-215-5p和miR-30a-5p mRNA相对表达量与miRNA测序结果基本一致(见图3)。
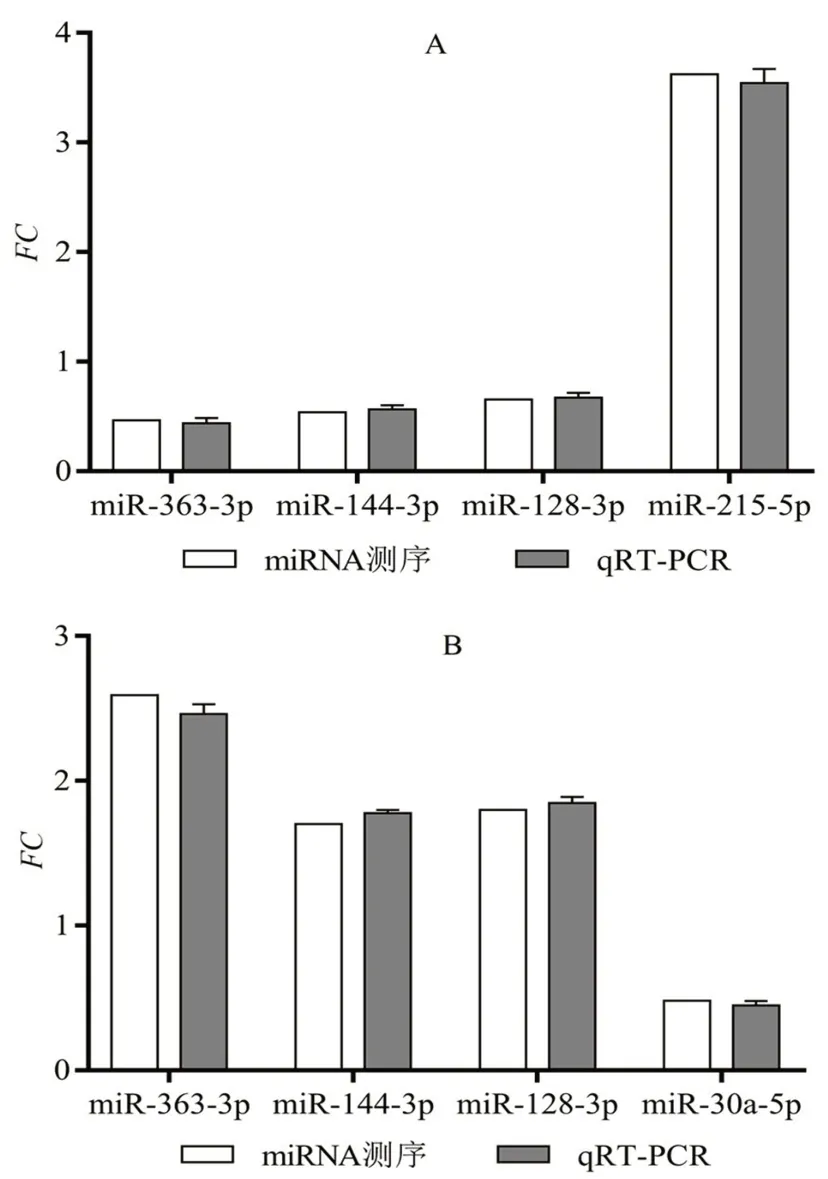
图3 差异表达miRNA的qRT-PCR验证Fig 3 qRT-PCR validation of differentially expressed miRNAs
3.5 差异表达miRNA与靶基因网络图
构建了模型组与对照组、芪玄抑甲宁组与模型组“差异表达miRNA与靶基因”的网络图(见图4),以确定miRNA-mRNA间的功能性相互作用,为探讨芪玄抑甲宁改善GD甲亢的作用机制提供依据。

图4 差异表达miRNA-靶基因网络图Fig 4 Differentially expressed miRNA-target genes network diagram
3.6 差异表达miRNA靶基因的功能分析
GO功能分析包括生物过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecular function,MF)3个部分。模型组与对照组比较,差异表达miRNA的靶基因主要富集在管形态发生、激酶活性的调节、蛋白质丝氨酸/苏氨酸激酶活性的调节、脉管系统发育、染色质、转录调节复合物、mRNA结合、染色质结合、DNA转录因子结合等条目。芪玄抑甲宁组与模型组相比,差异表达miRNA的靶基因主要富集在对生长因子的反应、细胞对生长因子刺激的反应、染色质、神经元细胞体、轴突、突触后膜的内在成分、转录因子结合、染色质结合、DNA转录因子结合等条目(见图5)。

图5 差异表达miRNA靶基因的GO功能富集分析(前10)Fig 5 GO functional enrichment analysis of differentially expressed miRNA target genes(top 10)
KEGG富集分析结果显示,模型组与对照组比较,差异表达miRNA的靶基因主要富集在丝裂原活化蛋白激酶(MAPK)、人叉头框蛋白O(FoxO)、磷脂酰肌醇3激酶/蛋白激酶B(PI3K/Akt)、神经营养因子、T细胞受体、血管内皮生长因子(VEGF)等信号通路。芪玄抑甲宁组与模型组比较,差异表达miRNA的靶基因主要富集在FoxO、MAPK、转化生长因子β(TGF-β)、Notch、生长激素的合成、分泌和作用、T细胞受体等信号通路(见图6)。

图6 差异表达miRNA靶基因的KEGG通路富集分析(前30)Fig 6 KEGG pathway enrichment analysis of differentially expressed miRNA target genes(top 30)
4 讨论
GD由于TRAb过度刺激甲状腺细胞而导致甲亢,出现心悸、出汗、进食和便次增多及体重减轻等症状[13]。本课题组前期研究结果表明,芪玄抑甲宁各剂量组能显著降低尾静脉注射小肠结肠炎耶尔森氏菌免疫甲亢大鼠模型血清中T3、T4的水平并提高TSH的水平,可明显改善甲亢大鼠的外观行为、体质量、甲状腺组织病理样变化,可显著降低血清中白细胞介素-17(IL-17)、白细胞介素-6(IL-6)和TGF-β的水平,回调甲亢大鼠甲状腺组织中IL-17、IL-17R的mRNA和蛋白表达水平[14-15];对胫前肌内注射重组腺病毒(Ad-TSHR289)免疫的GD小鼠模型的外观行为、甲状腺组织病理形态具有改善作用,并对血清中对T4、TRAb有回调作用[12]。GD患者的甲状腺组织中有miRNA异常表达的现象,本研究利用miRNA高通量测序技术,从表观遗传学角度探讨GD的可能发病机制及芪玄抑甲宁治疗GD的作用机制。
miRNA测序结果发现,模型组与对照组比较,171个miRNA存在差异表达情况,其中99个表达下调、72个表达上调,并且miR-363-3p、miR-128-3p和miR-144-3p表达在miRNA测序和qRT-PCR验证中均下调。T辅助细胞17(Th17)介导的炎症与多种自身免疫性疾病相关,miR-363-3p可以结合到活化T细胞核因子5(Nfat5)和维A酸相关孤核受体a(Rora)的3’-UTR上;使体外小鼠原代CD4+淋巴细胞中miR-363-3p下调,能提高Rora、IL-17a和IL-17f的表达,并增加Th17的分化和IL-17的分泌[16]。miR-128-3p的表达下调,其靶基因Wnt1诱导信号通路蛋白1(WISP1)上调,可激活PI3K/Akt信号通路,抑制软骨细胞的增殖,诱导细胞凋亡、软骨细胞基质降解和促炎细胞因子的产生[17];GD甲状腺新血管生的增加,可使甲状腺体积增大,甲状腺激素合成和释放增多,miR-128-3p的表达下调,其靶基因VEGFC上调,从而促进血管生成[18]。GD患者血浆中循环miR-144-3p的表达显著降低,可作为GD的潜在生物标志物,但其在GD中的作用机制尚不明确[7];有研究表明miR-144-3p在多种肿瘤组织中下调,与血管生成密切相关[19]。本研究发现,经芪玄抑甲宁干预后,GD模型小鼠miR-363-3p、miR-128-3p和miR-144-3p表达水平均显著上调,提示其可能为芪玄抑甲宁改善GD甲亢症状的作用靶点。
GO富集分析结果显示,与GD甲亢相关条目主要集中在对生长因子的反应、细胞对生长因子刺激的反应、染色质、神经元细胞体、细胞质核周区、转录调节复合物、转录因子结合、染色质结合、DNA转录因子结合、RNA聚合酶Ⅱ结合等方面,提示由于GD引起甲状腺激素合成和释放的增加,使染色质、细胞质和神经元细胞等成分变化,影响机体DNA、转录因子、RNA聚合酶Ⅱ结合等转录过程,导致机体生长发育和神经系统异常。KEGG通路分析显示,模型组差异表达miRNA的靶基因主要富集于MAPK、FoxO、PI3K/Akt、T细胞受体、TGF-β、VEGF、甲状腺激素信号通路等。甲状腺是高度血管化的内分泌器官,在GD的发病过程中血管过度生成,使甲状腺血流增加,导致甲状腺体积增大、甲状腺激素水平增高[20]。VEGFA是血管生成的关键调节因子,它通过与包括血管内皮生长因子受体2(VEGFR2)在内的受体结合发挥作用,并且VEGF和VEGFR2多态性与GD难治性相关,VEGFA在GD伴格雷夫斯眼病(GO)患者的甲状腺和眼眶脂肪组织中显著上调,并能观察到血管过度生成[21],较高的VEGFA水平可能会增加GD患者甲状腺血管生成并导致甲状腺肿大[22]。FOXO1主要与调节VEGFA表达并促进血管生成有关[23]。综合芪玄抑甲宁组差异表达miRNA靶基因的KEGG通路富集分析结果[24],推测芪玄抑甲宁可能通过调节差异miRNA的表达,调控上述相关信号通路,从而发挥减轻GD甲亢和眼病症状的作用。
综上所述,本研究通过对对照组、模型组和芪玄抑甲宁组小鼠甲状腺组织进行miRNA测序,构建“模型组与对照组”“芪玄抑甲宁组与模型组”差异miRNA的表达谱,应用生物信息学技术预测差异miRNA的靶基因并进行靶基因的富集分析,筛选出与芪玄抑甲宁干预GD甲亢密切相关的miRNA靶点及调控通路。基于本研究,将选取相关miRNA、靶基因和信号通路进行细胞和动物实验验证,以期从表观遗传学角度阐明芪玄抑甲宁治疗GD甲亢的作用机制。
