TCR基因多样性评估肝细胞癌患者免疫力的临床研究
2023-03-30刘星王磊石李鲁平吴威权冬梅吕呈段明郁朱梓兆宋冠男王岩
刘星 王磊石 李鲁平 吴威 权冬梅 吕呈 段明郁 朱梓兆 宋冠男 王岩★
免疫力是人体的自身防御机制,能够识别外来侵入的异物以及体内损伤、变性、突变的细胞等,以维护身体健康的能力[1]。工作劳累、心理压力、缺乏锻炼等因素都会导致免疫力的下降,进而可能导致疾病的爆发[2]。T 淋巴细胞是获得性免疫系统中最为重要的一类细胞,能通过其表面的特异性T 细胞受体(T cell receptor,TCR)识别抗原肽激活人类获得性免疫应答[3]。在慢性感染或癌症中,CD8+T 细胞持续暴露于抗原和炎症信号中,导致T 细胞功能的恶化,称之为“衰竭”。衰竭的T 细胞对抗原刺激呈现低增殖反应、效应器功能也逐渐丧失[4]。然而,TCR互补决定区3(complementarity determining region3,CDR3)受体库却在T 细胞的发育、分化、增殖成熟过程中发挥着重要作用,并广泛应用于T 细胞与肿瘤、自身免疫病等相关理论和实践的研究中[5]。T 细胞抗原识别受体的多样性决定了宿主的免疫反应和疾病的预后[3]。根据这一原理,本研究采用高通量测序的方法通过检测TCR基因的多样性来评估原发性肝细胞癌患者免疫力。
1 对象与方法
1.1 对象
纳入4 例肝穿刺病理活检明确诊断为原发性肝细胞癌的男性患者,平均年龄(51.3±1.7)岁。均有长期吸烟史及肝动脉化疗栓塞术治疗史,肿瘤分期介于ⅡB 期~ⅢB 期之间,肝功能child-pugh 评分[6]均为5 分A 级。纳入标准:年龄大于18 岁,处于治疗阶段或治疗后的原发性肝癌患者。排除标准:有精神病史的患者以及妊娠或哺乳期患者。本研究经院伦理委员会批准(编号:2020-10-001-01)。患者均签署知情同意书。
1.2 方法
患者A、B、C 均采用HX008 联合贝伐珠单抗方案,患者D 采用HX008 联合仑伐替尼方案(Ⅱ期临床研究方案编号:HX008-II-HCC-01)。
患者抽取外周血5 mL,用TRIzol 处理血液样本,提取总RNA 反转录成cDNA,扩增重排TCRCDR3 区域。纯化产物后采用Agilent 2100 生物分析仪和Qubit 4 荧光计进行定量。将PCR 产物在Ion GeneStudio S5 系列的平台上进行高通量测序,利用开放存取数据库IgBLAST 对包含TCRβ 可变区序列的Fasta 文件进行分析(https://www.ncbi.nlm.nih.gov/igblast/)。对每个样本的TCRβ 可变区序列集中随机选取30 000 个序列,明确不同的DNA 序列、氨基酸序列和V-J 组合的表达情况,并计算每个克隆的表达水平。根据辛普森多样性指数和香农-威纳指数计算TCR的多样性。
本研究还分别采用迈瑞5390 血细胞分析仪、希森美康CA-7000 血凝仪,罗氏E601 化学发光仪、强生cobas 8000 生化分析仪以及东软512层全景多模式CT 对患者治疗前、后进行血常规、凝血系列、肝功、肾功、离子、血糖、甲胎蛋白(alpha fetoprotein,AFP)、心肌酶谱以及CT 检查,并监测不良事件的发生。所有血液检测采用罗氏试剂盒。
2 结果
2.1 两例患者治疗后出现免疫力升高
患者A 治疗前、后的免疫力健康值分别为0.029767(差)和0.044906(差),最大TCR克隆占比分别为29.76%和1.62%;血小板始终低于正常,但并未影响凝血功能;肝功谷氨酰转肽酶和总胆红素水平在治疗后出现好转,AFP 由10 770 ng/mL降至1 538 ng/mL。患者B 治疗前、后的免疫力健康值分别为0.126303(良)和0.132530(良),最大TCR克隆占比分别为9.85%和2.63%,AFP 由1 081 ng/mL 降至4.68 ng/mL。2 例患者治疗前、后其他各项生化指标检查均无明显变化,见表1。治疗后肿瘤靶病灶评估均为稳定,无不良反应事件发生。患者在治疗后均出现诸多T 细胞受体β 可变区基因的重新取用。见图1A、B。
2.2 两例患者治疗后出现免疫力降低
患者C 治疗前、后的免疫力健康值分别为0.107826(良)和0.067897(中),最大TCR克隆占比分别为3.48%和5.15%;CT 检查双肺转移灶较治疗前进展,肿瘤靶病灶评估为进展,同时出现甲功减退以及免疫性肺炎。患者D 治疗前、后的免疫力健康值分别为0.178684(优)和0.169535(优),最大TCR克隆占比分别为2.72%和3.56%,虽然CT 检查未发现肿瘤进展,但却出现血压控制不稳定这一不良反应事件。2 例患者治疗前、后AFP 及其他各项生化指标检查均无明显变化,见表1,V-J 组合基因使用频率结果见图1C、D。
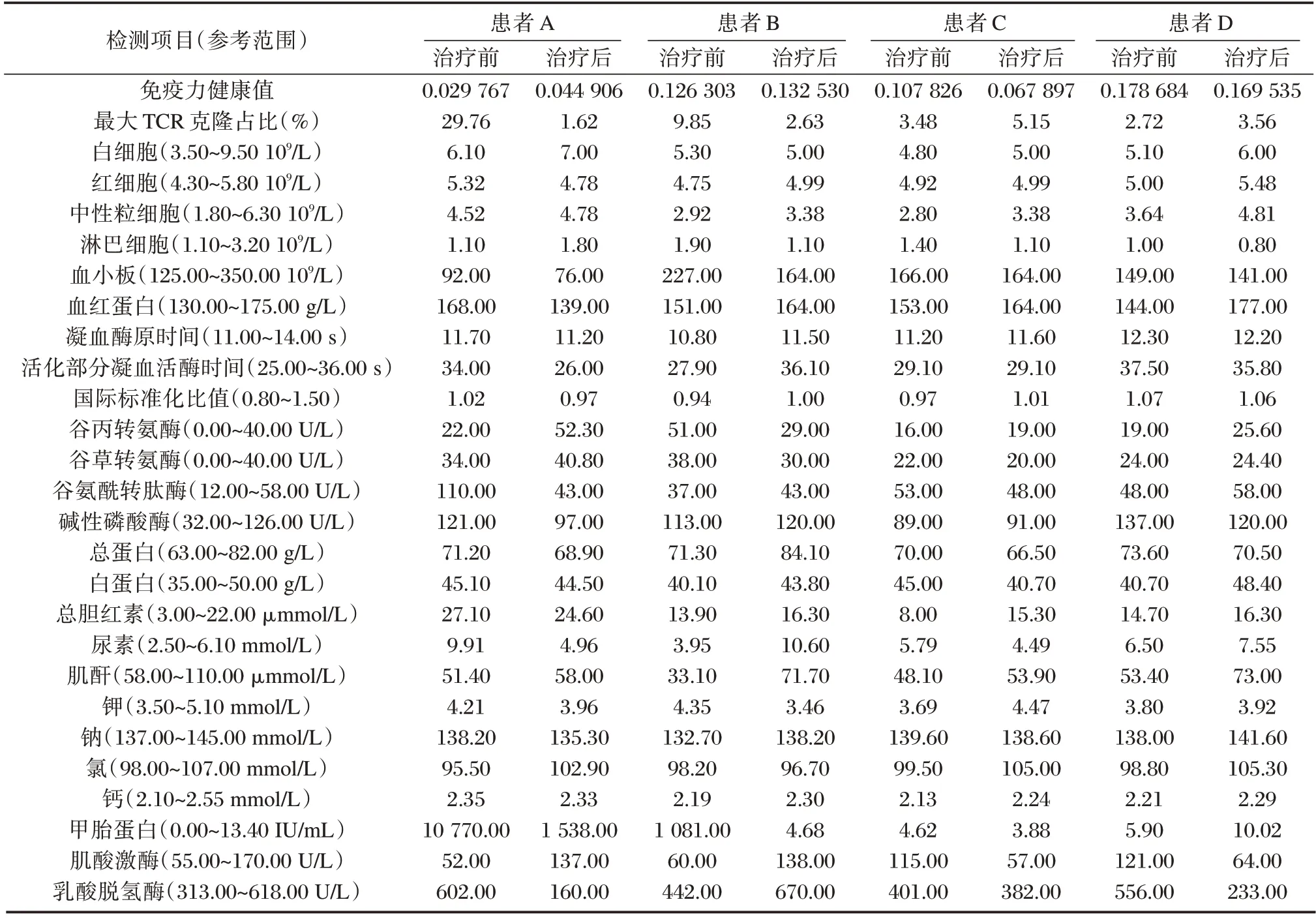
表1 患者A、B、C、D 治疗前、后检查结果Table 1 Examination results of patients A,B,C and D before and after treatment

图1 患者A、B、C、D 治疗前、后V-J 组合基因使用频率分布图Figure 1 Frequency distribution of V-J combination gene in patients A,B,C and D before and after treatment
3 讨论
每个人的TCR基因是由不同的Vβ、Dβ和Jβ基因通过重组产生的。不同抗原的刺激会激活带有不同TCR的T 细胞。随着年龄的增加或疾病刺激,不同的TCR基因数量会发生选择性变化[7]。本研究中免疫力优良的人Vβ和Jβ基因组合使用频率更均衡,若出现明显的单一性,则是免疫力降低。正常情况下,任何一种TCR克隆占比均较低。如果其明显增高(>10%),则提示体内有异常T 细胞克隆增生,可能与潜在疾病或亚健康状态相关。
本研究免疫力升高的2 例患者,通过对治疗前后的对比我们可以初步推断,患者的免疫力水平与肿瘤的控制情况密切相关,免疫力水平增高,肿瘤进展的风险以及不良反应事件也会随之降低,且在免疫力升高的过程中,最先发生的是V-J 组合基因使用频率及TCR克隆占比的改变,随后才是免疫力健康值的改变。2 例患者在治疗后V-J 组合基因的使用频率均较治疗前更加均衡,即使免疫力健康值处于较低等级,病情也能受到良好控制。
患者C 在治疗后免疫力健康值,Vβ和Jβ基因组合的频度均出现下降,最大TCR克隆占比出现升高,提示患者治疗后免疫力开始降低。病情进展、甲功减退及免疫性肺炎的出现,进一步说明患者免疫力水平的降低与疾病进展密切相关。有研究显示,甲状腺在淋巴细胞发展成熟过程中发挥着重要作用,给予甲状腺素的侏儒小鼠可以改善体液免疫反应[8];甲功减退时淋巴细胞功能出现下降,甲功恢复时淋巴细胞的功能也会改善[9]。由此,考虑患者C 出现的免疫力下降可能与其发生甲功减退有一定关系。虽不能除外是由于应用免疫抑制剂所致,但TCR基因多样性的减少势必会进一步降低患者的免疫力,甚至反过来促进病情进展,加重甲功减退和免疫性肺炎发生。
患者D 在治疗后免疫力健康值出现较小程度的降低,最大TCR克隆占比也仅出现轻微升高,这可能是患者疾病暂未发生进展而仅出现血压不稳定的原因。患者出现免疫力下降,首先表现为不良反应事件的发生,如免疫力持续降低,可能还会诱发其他不良反应事件,甚至导致疾病进展。当然,由于患者在应用了抗血管生成药物仑伐替尼,可能会引发高血压,但其他3 例患者也均应用了抗血管生成药物贝伐珠单抗,且没有出现血压增高,所以并不能完全归因于是药物所致。已有证据表明,T 细胞可以通过多种机制作用于高血压,包括细胞因子的产生、激活肾血管和中枢神经系统[8]。T 细胞能够分泌肿瘤坏死因子-α,激活钠潴留导致高血压[10-11]。一些研究指出调节性T 细胞(Regulatory cells,Treg)是免疫反应的整体调节者,也是高血压的调节者[12]。过继转运缺乏Treg的T 细胞则能够加剧血管紧张素II 诱导的微血管内皮功能障碍、氧化应激和炎症[13]。活化的巨噬细胞是高血压的重要驱动因素,虽然TCR在T 细胞激活巨噬细胞引发炎症反应的过程中并非必要[14],但TCR多样性的减少说明患者或是出现了T 细胞种类配比的变化,或是T 淋巴细胞功能出现了降低,因此患者D 也并不能除外是由于淋巴细胞中Treg 减少所致的血压升高,然而这一推断还有待进一步研究证实。
4 例患者外周血T 细胞TCR互补决定区3 组库均在治疗前、后表现出个体化的多样性和特征性改变,TCR基因多样性的降低,可能与治疗过程中不良反应事件和机体抗肿瘤免疫有关。监测CDR3 组库的动态变化以及TCR基因的多样性可以客观准确地评估原发性肝癌患者的免疫状态、机体对疾病与治疗的反应,为开发新的免疫治疗靶点以及预后监测指标提供实验基础及研究依据。
