基线脑脊液神经丝蛋白轻链水平与GBS患者预后的相关性
2023-03-30王莉李冬英周嘉鑫陆文瑜
王莉 李冬英 周嘉鑫 陆文瑜
吉兰-巴雷综合征(Guillain- Barré syndrome,GBS)是一种急性单相免疫介导的多发性神经根神经病,最常见的初始症状是肢体感觉异常,轻度客观感觉丧失,反射力减退或反射不足,若救治不及时,在随后2~4 周内可发展为急性神经肌肉无力和瘫痪[1-2]。尽管进行及时救治,但一项荟萃分析显示,治疗后的患者预后仍存在显著差异,部分患者出现预后不良,严重影响患者生活质量[3]。因此,早期有效识别GBS 预后不良的高危因素,并调整治疗方案是防治GBS 患者预后不良的主要手段。既往已有大量学者建立基于临床和流行病学特征的预后模型,但GBS 临床和流行病学特征差异较大,导致其预测效能欠佳[4]。近年来,伴随单分子阵列(SiMoA)等超灵敏技术的引入发现神经丝蛋白轻链(neurofilament light chain,NfL)在GBS 患者中水平升高[5],Körtvelyessy 等[6]发现脑脊液中NfH 的水平增加可加重周边神经病变,表明NfL 神经参与了GBS 疾病进展过程。在一项短期回顾性研究中指出高基线NfL 水平与较差的短期预后相关[7],但其基线水平是否与患者长期预后相关,现临床上鲜有研究报道。本研究纳入128 例GBS 患者,并进行1年的随访,探讨基线脑脊液NfL与患者长期预后的相关性。
1 资料和方法
1.1 临床资料
经医院伦理委员批准后选取2012年2月至2019年6月于江苏省苏州市张家港市第五人民医院住院治疗的128 例GBS 患者,其中男78 例,女50 例,平均年龄(53.41±9.12)岁。纳入标准:①符合GBS 的诊断标准的患者[8];②布莱顿标准Ⅰ~Ⅱ级的患者[9];③首次发病,且入院前未进行相关治疗;④患者或家属签署知情同意书。排除标准:①合并多发性硬化症、其他神经退行性疾病,中风、癫痫、脑和脊髓创伤,脑和脊髓肿瘤及先天性神经系统疾病;②合并严重肝肾功能障碍及心血管系统疾病;③依从性差,不配合随访者。本研究经医院伦理委员会批准。
1.2 方法
①所有入组患者均接受GBS 的治疗方案进行治疗。②基线脑脊液NfL 水平检测:采集患者入院脑脊液,使用SIMOA Nf-light 试剂盒在SR-X 免疫分析仪SIMOA(Quanterix Corp,Boston,Massachusetts,USA)中,通过运行超灵敏顺磁珠基酶联免疫吸附分析法进行基线脑脊液NfL 水平的测量。
1.3 观察指标
于患者入院时收集患者临床资料,包括年龄、性别、BMI、发病天数,前驱事件,初始症状,电生理检查结果,治疗方案等。②实验室检查资料:基线脑脊液NfL 水平,生化指标、脑脊液检查等;③量表评分:GBS 残疾量表评分(GBS Disability Score,GDS)[10],总分1~5 分,分值越高患者功能障碍越严重;④随访:治疗后每3 个月进行一次随访(电话或门诊随访),随访1年,记录患者预后。患者预后根据休斯功能评分(Hughes functional grading scale,HFS)[11]进行评价:总分为0~6 分,0 分(正常健康),1 分(轻微神经症状或体征,能够跑步),2 分(能够行走至少5 m,但无法跑步),3 分(能够在有助行器或支撑物的情况下行走5 m),4 分(卧床),5 分(需机械通气辅助通气),6 分(死亡)。评分≥3 分为预后不良,评分<3分为预后良好。
1.4 统计学处理
采用SPSS 20.0 统计软件对数据进行分析,计量资料以()表示,采用t检验;计数资料采用n(%)表示,采用χ2检验,等级资料使用秩和检验;多因素分析采用Logistic 回归方程分析,绘制工作特征曲线(ROC)评估基线NfL 水平预测GBS 患者预后的预测价值,以P<0.05 表示差异有统计学意义。
2 结果
2.1 随访结果
截止末次随访日期2020年9月13日,128 例患者共计失访13 例,最终纳入95 例GBS 患者,其中40 例患者预后不良为预后不良组,75 例预后良好为预后良好组。
2.2 两组患者一般资料比较
预后不良组基线GDS 评分高于预后良好组,白蛋白水平低于预后良好组,差异有统计学意义(P<0.05),其余资料比较差异无统计学意义(P>0.05)。见表1。
表1 两组患者一般资料比较[(±s),n(%)]Table 1 Comparison of general information of the two groups of patients[(±s),n(%)]

表1 两组患者一般资料比较[(±s),n(%)]Table 1 Comparison of general information of the two groups of patients[(±s),n(%)]
因素年龄(岁)性别(男/女)58/37发病时间至接受治疗时间≥3 d<3 d基线GDS 评分(分)前驱事件有无初始症状无力感觉异常无力+感觉异常双上肢近端肌力降低双上肢远端肌力降低双侧面瘫颅神经麻痹延髓麻痹排便/尿功能障碍电生理检查神经传导阻滞F 波异常治疗方案免疫球蛋白激素+免疫球蛋白激素+免疫球蛋白+血浆置换脑脊液蛋白(g/L)生化指标白蛋白(g/L)球蛋白(g/L)肌酐(μmol/L)尿素氮(mmol/L)预后不良组(n=40)55.78±9.74 28/12 26(65.00)14(35.00)2.86±0.74 24(60.00)16(40.00)12(30.00)10(25.00)11(55.00)12(30.00)14(35.00)6(15.00)6(15.00)8(20.00)8(20.00)2(5.00)18(45.00)12(30.00)22(55.00)6(15.00)0.83±0.21 39.98±4.27 29.83±5.74 70.53±10.25 5.83±1.05预后良好组(n=75)51.24±10.33 44/31 35(46.67)40(53.33)2.31±0.62 53(70.67)22(29.33)21(28.00)23(30.67)38(50.66)20(26.67)23(30.66)8(10.67)7(9.33)10(13.33)12(16.00)8(10.67)43(57.33)21(28.00)42(56.00)12(16.00)0.78±0.25 45.34±4.33 27.34±5.63 71.22±13.29 5.70±1.19 Z/t/χ2值1.828 1.431 3.520 2.496 1.342 0.051 0.409 0.196 0.144 0.224 0.458 0.835 0.878 0.291 1.055 1.593 0.212 0.907 4.548 1.731 0.250 0.478 P 值0.077 0.232 0.061 0.019 0.247 0.821 0.522 0.658 0.704 0.636 0.498 0.361 0.349 0.590 0.304 0.207 0.832 0.371<0.001 0.094 0.804 0.636
2.3 两组患者基线脑脊液NfL 水平比较
基线脑脊液NfL 水平预后不良组为(87.70±8.36)ng/L 高于预后良好组(69.79±8.29)ng/L,差异有统计学意义(P<0.05)。
2.4 GBS 患者预后风险的预测因素分析
多因素分析显示基线GDS 评分(OR=1.190)、基线脑脊液NfL 水平(OR=1.246)是GBS 患不良预后的独立独立因素。见表2。
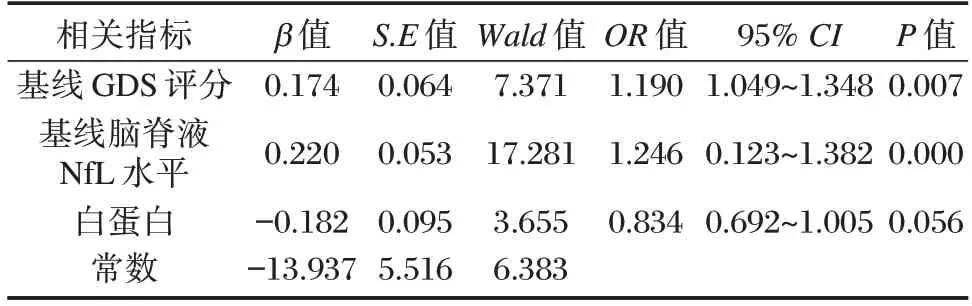
表2 多因素Logistic 分析结果Table 2 Multi-factor Logistic analysis results
2.5 NfL 预测GBS 患者不良预后的效能
基线脑脊液NfL 水平预测GBS 患者预后的效能高于基线GDS 评分(P<0.05)。见表3、图1。
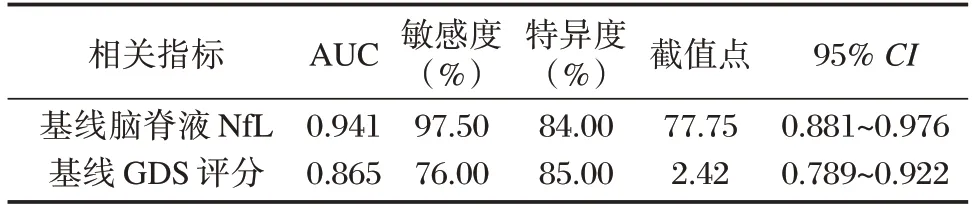
表3 NfL 预测GBS 患者预后的效能Table 3 The efficacy of NfL in predicting the prognosis of GBS patients
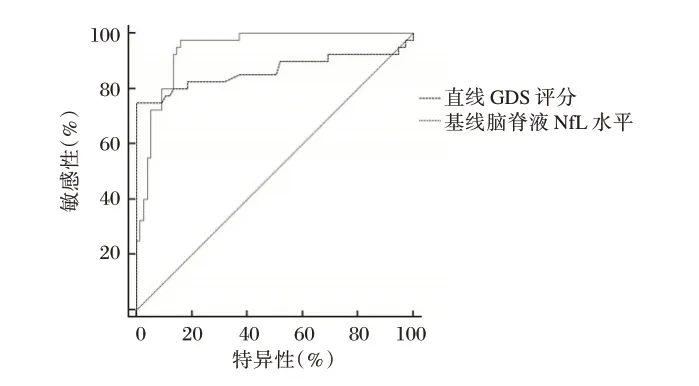
图1 基线脑脊液NfL 水平预测GBS 患者预后的ROC 曲线Figure 1 ROC curve of NfL predicting the prognosis of GBS patients
3 讨论
大部分GBS 患者预后较差,尽管随着医疗技术的进步进行了免疫疗法,但治疗后仍有约20%的患者出现严重残疾,约5%的患者死于GBS 的严重并发症[12]。有研究显示,血浆置换、补体抑制剂等治疗可缩短神经系统恢复时间[13],Illes 等[14]研究中指出早期进行血浆置换、补体抑制剂等治疗可获得最高疗效,可改善患者预后。但血浆置换、补体抑制剂等治疗策略取决于早期对GBS 患者预后不良的高危因素的识别。由于GBS 表型差异较大,使传统基于临床表现的预测模型难以有效预测GBS 患者预后。因此,寻找新型高效预测GBS预后的因素成为临床亟待解决的问题。伴随检验技术的发展生物学相关指标NfL 在GBS 疾病的发生发展中引起了广泛关注,发现GBS 可引起细胞破坏导致轴突细胞骨架蛋白家族NfL 释放到脑脊液和血清中[15]。Martín 等[16]指出NfL 水平与GBS发病相关,Verde 等[17]的进一步研究发现基线NfL水平与GBS 疾病的严重程度呈正相关。表明NfL参与了GBS 疾病的发生发展过程。
本研究表明高基线脑脊液NfL、基线GDS 与GBS患者不良预后相关。NfL 是神经轴突损伤的标志物,可作为多种神经病变性疾病预后的生物标志物。NfL 广泛分布于轴突中,起结构支撑、抵抗外界压力,维持轴突直径,间接调节传导速度,并充当细胞器和其他蛋白质的附件的作用[18]。当神经系统轴突受损,NfL 被大量释放,表现为脑脊液和血液中NfL 升高。因此,NfL 代表着轴突损伤和神经元死亡的迹象。可在多种中枢和外周神经系统神经轴突损伤的疾病中发现NfL 水平升高。Khalil等[19]发现在纯粹的神经退行性疾病中,NfL 既可以作为衰退的预后标志,也可以作为实验治疗的疗效生物标志物。在阿尔茨海默病、额颞叶和肌萎缩侧索硬化的荟萃分析中,与对照组相比,患者血浆NfL 水平升高,并可用于区分神经退行性疾病和非神经退行性疾病。而GBS 为典型急性多发性神经病,涉及中枢神经鞘内结构的损伤、神经根水肿,神经肌肉交界处周围神经轴突损伤,CYTO-白蛋白解离以及神经根的血液神经屏障受损等。患者上述轴突损伤、神经元死亡程度越高,患者神经功能受损越严重,脑功能障碍越明显,患者基线GDS 越高。因此,高基线脑脊液NfL 水平及基线GDS 评分,表明患者具更严重的神经功能损伤,神经功能受损越严重,患者恢复难度越高,预后不良风险越高。
综上所述,高基线脑脊液NfL、基线GDS 水平与与GBS患者不良预后具相关性。基线脑脊液NfL 水平、基线GDS 评分可用于GBS 预后不良的预测中。本研究的不足之处:首先纳入的样本量较小;其次未对患者脑脊液NfL 进行动态分析,也未根据不同基线脑脊液NfL 水平进行分类探讨;最后在GBS 疾病进展过程中炎症反应其重要作用,但本研究未进行相关探讨,研究结果可能存在偏倚,后期需加大样本量,根据患者基线脑脊液NfL 水平进行分类探讨,并动态监测脑脊液NfL 水平,纳入炎症反应指标对本研究结论做进一步验证。
