木霉菌对向日葵幼苗生理特性及菌核病防治效果的影响
2023-03-29陈玉蓉李润哲马光恕
廉 华,陈玉蓉,李 梅,李润哲,张 渟,马光恕
(1.黑龙江八一农垦大学园艺园林学院,黑龙江 大庆 163319;2.中国农业科学院植物保护研究所,北京 100081)
向日葵(HelianthusannuusL.)属于菊科菊亚科向日葵属植物,其耐盐碱、耐干旱、耐瘠薄、适应性强,在世界范围内广泛种植[1]。向日葵是在我国栽培面积仅次于大豆、油菜和花生的油料作物,也是我国华北北部、东北地区和西北地区具有地区特色和优势的重要经济作物[2]。联合国粮食及农业组织对世界各国向日葵年度种植面积的数据统计结果显示,2019年世界向日葵年度种植面积2 736.88万 hm2,总产量5 607.27万 t,中国向日葵种植面积和总产量分别为85.00万 hm2和242.00万 t[3],居世界第6位,可见我国对世界向日葵产业的发展贡献很大。随着各国人民的生活水平逐渐提高,对向日葵籽粒及其副产品的需求也不断增加,向日葵种植面积逐年加大。
向日葵菌核病是由病原真菌核盘菌(Sclerotiniasclerotiorum)引起的,该病害在全球各向日葵种植地区几乎都有发生[4]。在中国东北、内蒙古等产区,向日葵菌核病平均发病率为40%~60%,最高可达90%以上[5],严重影响向日葵产量和品质,制约向日葵产业的可持续发展。目前,对向日葵菌核病的防治主要采用农业防治、选育抗病品种、化学防治和生物防治等措施,但是农业防治和筛选抗病品种周期长,耗时耗力[6];化学防治虽然效果显著,但常伴随病菌抗药性增强、农药残留、食品安全和环境污染等问题[7]。生物防治是当前提倡的防控向日葵菌核病的重要措施[8],木霉(Trichodermaspp.)是目前研究和应用最为广泛的生防真菌类型之一。
木霉菌是属于真菌界、双核菌门、半知菌亚门、丝孢纲丛、梗孢目、丛梗孢科、木霉属的一种真菌[9],Ahmad等[10]研究表明,木霉菌通过分泌植物生长激素等物质促进植物生长。利用木霉防治向日葵菌核病的研究已有少量报道,Mathews等[11]研究发现哈茨木霉在减少向日葵菌核形成方面具有较大潜力;曹翠玲等[12]通过对峙培养研究发现,康氏木霉(Trichodermakoningii)对向日葵菌核病菌具有较强的拮抗作用,对病原菌的抑制率达41.4%;于秀英等[13]通过温室盆栽试验研究发现,拮抗菌对向日葵幼苗期菌核病有明显防效,成苗率达到75%,而对照只有34%;王春等[14]研究发现,木霉菌株M1M2发酵液对向日葵菌核病菌菌丝抑制率为82.6%,盆栽防效为73.8%,田间防效为60.0%。但这些研究具有局限性,或只研究了木霉菌对核盘菌菌丝的抑制作用,或只进行了温室盆栽的防效试验,研究结果不够系统。本研究拟采用平板对峙试验筛选出对向日葵菌核病有显著防治效果的木霉菌株,系统研究木霉菌不同施用方式对向日葵幼苗生长、生理特性及对向日葵菌核病防治效果的影响,为木霉菌剂研发和推广提供技术支持。
1 材料与方法
1.1 供试材料
1.1.1 供试向日葵品种 供试品种为‘丰葵杂1号’,由中国农业科学院植物保护研究所廊坊试验基地提供。
1.1.2 供试培养基 马铃薯葡萄糖琼脂固体培养基(PDA):马铃薯200 g,葡萄糖20 g,琼脂粉20 g,蒸馏水1 000 ml,pH 7.0~7.2,121℃高压蒸汽灭菌30 min,冷却后备用。
马铃薯葡萄糖液体培养基(PD):马铃薯200 g,葡萄糖20 g,蒸馏水1 000 ml,pH自然,121℃高压蒸汽灭菌30 min,冷却后备用。
1.1.3 供试菌株 供试菌株编号及其名称见表1,木霉菌菌株均由中国农业科学院植物保护研究所木霉菌研究组提供。
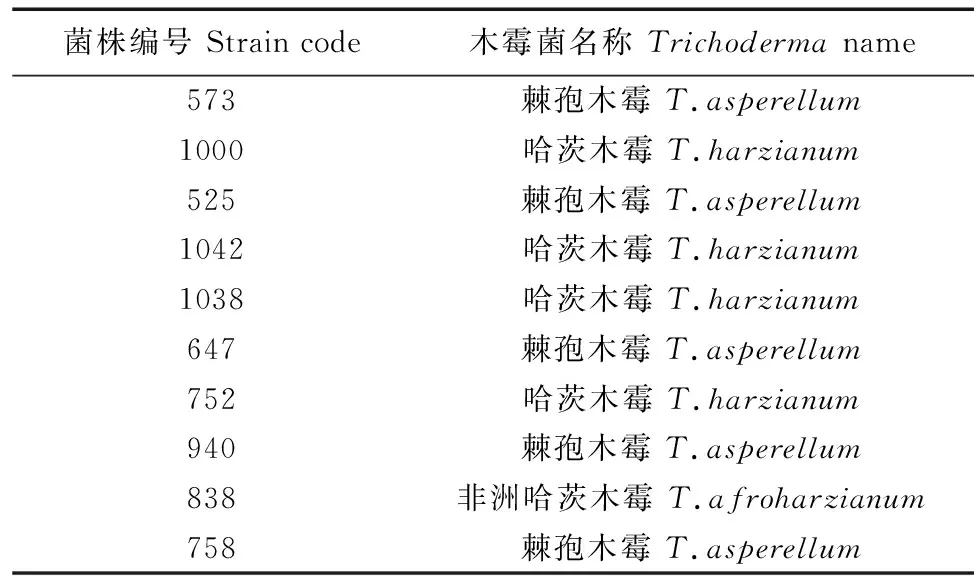
表1 供试木霉菌菌株Table 1 Test strains of Trichoderma spp.
向日葵菌核病病原菌:核盘菌(Sclerotiniasclerotiorum(Lib.)de Bary),由中国农业科学院植物保护研究所土传病害生物防治研究组提供。
1.1.4 供试土壤 将营养土和蛭石按照4∶1均匀混合。营养土壤基本理化性状为:全氮183.41 mg·kg-1,碱解氮137.785 mg·kg-1,全磷13.29 mg·kg-1,速效钾198.63 mg·kg-1,有机质56.32 g·kg-1,pH值7.31。
1.2 防治菌核病木霉菌筛选
将木霉菌株接种于PDA平板,28℃培养3 d;将向日葵菌核病菌接种于PDA平板,28℃培养5 d。用6 mm打孔器分别打取培养好的木霉菌和向日葵菌核病菌菌落边缘菌块接种于PDA平板,距平板边缘 1 cm处相对放置,28℃培养;以单独接种向日葵菌核病原菌为对照,5次重复。培养5 d后测量病原菌生长半径和对峙培养菌核病菌落生长半径,参照马文旭等[15]的方法,计算抑制率。
抑制率(%)=(对照组菌落半径-处理组菌落半径)/对照组菌落半径×100
1.3 木霉发酵液和病原菌孢子悬浮液的制备
1.3.1 木霉发酵液的制备 将木霉菌在PDA培养基上28℃黑暗条件培养3 d,从菌落边缘取直径5 mm的菌饼5块,接种在含有100 mL马铃薯葡萄糖液体培养基(PD)的250 mL的三角瓶中,在摇床28℃黑暗条件下振荡(250 r·min-1)培养7 d,制成木霉发酵液。用血球记数板测定孢子数,并将木霉发酵液的孢子数调整为1.2×107个·mL-1备用。
1.3.2 核盘菌菌丝悬浮液的制备 将向日葵病原菌在PDA培养基上28℃黑暗条件培养3 d,从菌落边缘取直径5 mm 的菌饼5块,接种在含有100 mL PD的250 mL三角瓶中,28℃、250 r·min-1振荡培养3 d,用双层纱布滤出菌丝团,将菌丝搅碎,用无菌水调整浓度为1.2×107CFU·mL-1的菌丝悬浮液,备用。
1.4 木霉菌对向日葵生理特性影响和菌核病防治试验
1.4.1 试验方法 试验于2021年5—8月在中国农业科学院植物保护研究所温室内开展。采用盆栽方式,将营养土和蛭石按照4∶1比例均匀混合,装入塑料材质的育苗盆(11.0 cm×11.5 cm×11.5 cm)中,每盆土重300 g。向日葵种子催芽后,每盆播种2粒,出苗后每盆保留1棵,置于阳光充足的地方,每隔1 d每盆浇无菌水100 mL。待植株长出4片真叶(即播种后20 d),利用向日葵菌核病病原菌菌丝悬浮液灌根,每盆20 mL。利用1.2中方法筛选出的抑制率较高的5种木霉菌进行处理。
试验共设5个处理:(1)播种前5 d用100 mL·盆-1木霉菌悬浮液拌土+接种菌核病菌前2 d用100 mL·盆-1木霉菌悬浮液灌根,设为T1;(2)播种前5 d用200 mL·盆-1木霉菌悬浮液拌土,设为T2;(3)接种菌核病菌前2 d用200 mL·盆-1木霉菌悬浮液灌根,设为T3;(4)单独用向日葵菌核病菌灌根且不施用木霉菌悬浮液,设为CK1;(5)单独用无菌水灌根且不施用向日葵菌核病菌和木霉菌悬浮液,设为CK2。每个处理设60盆,随机区组设计,3次重复。
1.4.2 测定指标与方法 接种后15 d即播种后35 d,每个处理选取15株植株(每个重复5株),用于测定向日葵幼苗形态指标和物质积累量指标,计算根冠比;同时期每个处理另取30株(每个重复10株),用于测定向日葵生理指标和抗病性指标。
(1)形态指标:株高为植株的茎基部到生长点之间的距离,用直尺测定;茎粗为植株子叶节下1 cm处粗度,用游标卡尺测定。
(2)物质积累量指标:清水反复冲洗植株后,用吸水纸吸干,将地上部(包括叶片、叶柄和茎)与地下部即根系部分分开后,分别测其鲜重并计算全株鲜重和根冠比。
根冠比=地下部鲜重/地上部鲜重
(3)生理指标:包括丙二醛(MDA)含量、质膜透性、可溶性糖含量、可溶性蛋白含量、脯氨酸(Pro)含量、叶绿素含量。丙二醛(MDA)含量采用硫代巴比妥酸法[16]测定;质膜透性参照张志良等[17]的方法,用DDS-11A型电导率仪测定,用细胞膜相对透性表示:取0.5 g新鲜的向日葵叶片组织,用无菌蒸馏水冲洗干净,滤纸吸干叶片表面水分,将叶片剪碎后置入50 mL小烧杯,加入30 mL蒸馏水,使叶片完全浸没,静置24 h,混匀后用电导仪测量烧杯内液体的电导率,记为L1,读取数值后,将烧杯内水分煮沸5 min,冷却至室温,混匀后再测量电导率,记为L2,细胞膜相对透性(%)=L1/L2×100;可溶性糖含量采用蒽酮比色法[18]测定;可溶性蛋白含量采用考马斯亮兰G-250染色法[19]测定;脯氨酸(Pro)含量参照闫蕾等[20]的方法,即酸性茚三酮显色法测定;叶绿素含量采用丙酮乙醇法[21]测定。
(4)抗病性指标:包括植株发病率、病情指数、防治效果。接种病原菌后第6 d开始调查植株发病情况,以后每隔1 d调查1次,连续调查5次。向日葵菌核病分级标准参照陈娴等[22]的方法,分为5级:0级表示无病;1级表示病斑面积占全叶10%以下;2级表示病斑面积占全叶10%~30%;3级表示病斑面积占全叶31%~50%;4级表示病斑面积占全叶51%以上。病情指数参照宗兆锋等[23]的计算方法。
植株发病率为接种后15 d各处理发病株数占调查总株数的百分比。
病情指数= [∑(病级株数×代表级数)/(植株总数×最高代表级值)]×100
防治效果(%)=(对照病情指数-处理病情指数)/对照病情指数×100
1.5 数据统计与分析
利用Microsoft Excel 2010软件进行图表制作,试验数据取5次重复的平均值和标准差,利用DPS 7.05(data processing system)进行差异显著性分析。
2 结果与分析
2.1 防治菌核病木霉菌筛选
如表2所示,平板对峙拮抗筛选法试验获得2株抑制率在90%以上的菌株,其中非洲哈茨木霉T.afroharzianum838抑制率最高,为91.86%;其次是棘孢木霉T.asperellum573,抑制率为91.23%。T.afroharzianum838和T.asperellum573之间差异不显著但二者均显著高于其他菌种,分别比哈茨木霉T.harzianum752、棘孢木霉T.asperellum940、棘孢木霉T.asperellum758、哈茨木霉T.harzianum1000、棘孢木霉T.asperellum647、哈茨木霉T.harzianum1042、棘孢木霉T.asperellum525、哈茨木霉T.harzianum1038高5.82%、7.61%、9.37%、15.68%、15.93%、23.17%、33.23%、33.83%和5.09%、6.88%、8.62%、14.88%、15.13%、22.33%、32.31%、32.91%。试验由此筛选出非洲哈茨木霉T.afroharzianum838和棘孢木霉T.asperellum573这2个木霉菌株进行木霉菌对向日葵促生和防效影响的进一步研究。
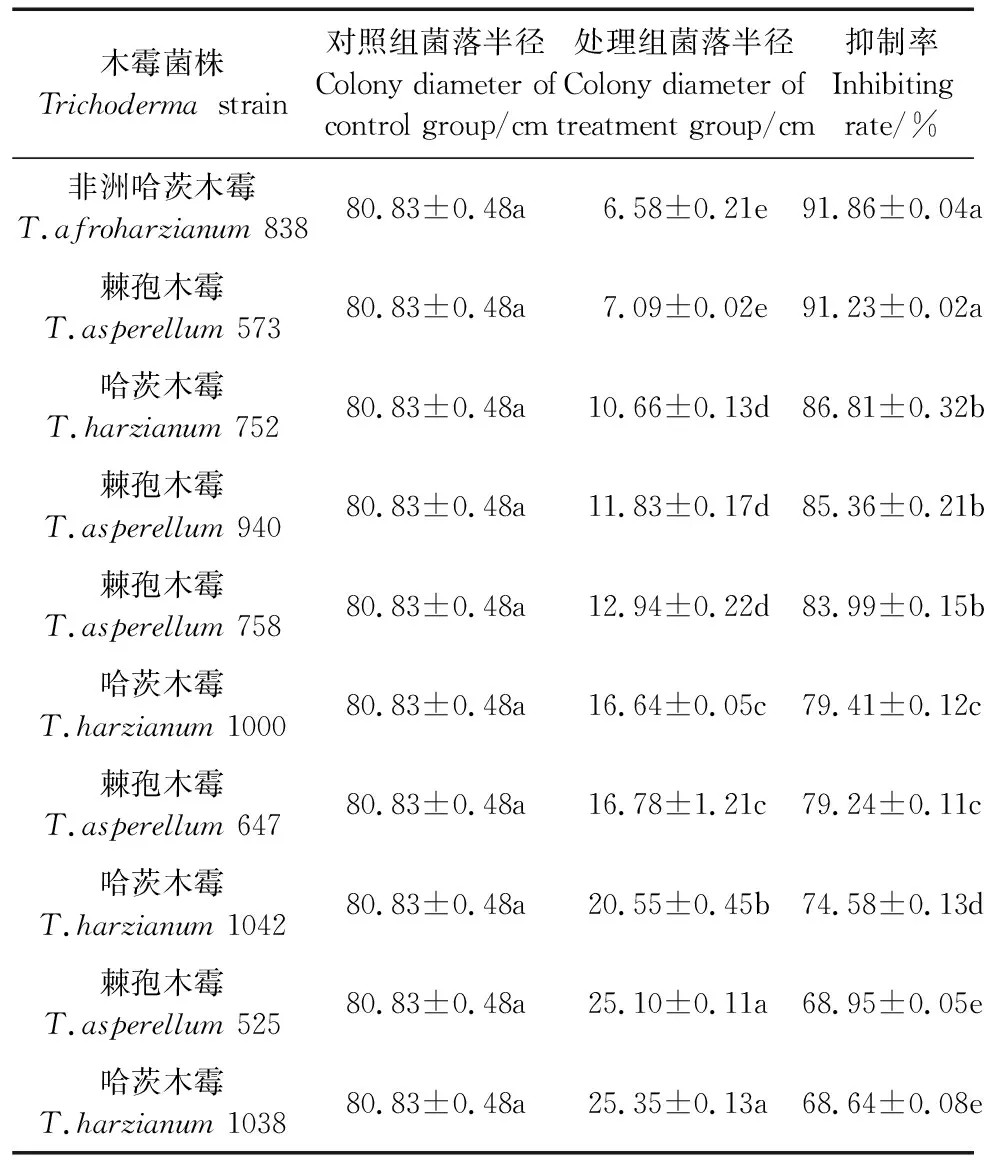
表2 木霉菌菌株筛选Table 2 Screening of Trichoderma strains
2.2 木霉菌对向日葵幼苗形态建成和物质积累的影响
向日葵播种后35 d,非洲哈茨木霉T.afroharzianum838和棘孢木霉T.asperellum573对幼苗株高和茎粗影响如图1所示。图1A为T.afroharzianum838不同施用方式下向日葵幼苗株高和茎粗的表现,T1(播种前5 d用100 mL·盆-1木霉菌悬浮液拌土+接种菌核病菌前2 d用100 mL·盆-1木霉菌悬浮液灌根)的株高和茎粗最高,分别为18.9 cm和0.86 cm。T1与T2(播种前5 d用200 mL·盆-1木霉菌悬浮液拌土)、T2与T3(接种菌核病菌前2 d用200 mL·盆-1木霉菌悬浮液灌根)之间的株高差异均不显著,但T1、T2、T3显著高于CK1(单独用向日葵菌核病菌灌根且不施用木霉悬浮液)和CK2(单独用无菌水灌根且不施用向日葵菌核病菌和木霉悬浮液),分别高58.82%、47.90%、38.66%和36.96%、27.54%、19.57%;CK2株高显著高于CK1,增幅为15.97%。T1茎粗显著高于T2、T3、CK2、CK1,分别高14.67%、26.47%、86.96%、177.42%,处理之间差异均达显著水平。图1B为T.asperellum573不同施用方式下向日葵幼苗株高和茎粗的表现,T1的株高和茎粗最高,分别为17.6 cm和0.72 cm。T1与T2、T2与T3株高之间差异均不显著,但T1、T2、T3均显著高于CK1和CK2,分别高47.90%、37.82%、28.57%和27.54%、18.84%、10.87%;CK2株高显著高于CK1,增幅为15.97%。T1茎粗显著高于T2、T3、CK2、CK1,分别高14.29%、24.14%、56.52%、132.26%;T2与T3、T3与CK2之间差异均不显著。CK1株高和茎粗最低,分别为11.9 cm和0.31 cm。说明同一木霉菌不同施用方式对向日葵幼苗株高和茎粗的作用效果也有差异。
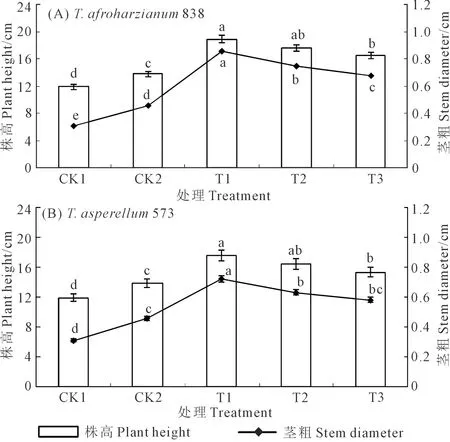
注:图中正负误差线表示标准差大小。不同小写字母表示在同一时期各处理之间差异显著(P<0.05)。下同。Note:Values in the chart are standard error. Different lowercase letters in the same period indicate significant difference(P<0.05)among different treatments. The same below.图1 非洲哈茨木霉T. afroharzianum 838(A)和棘孢木霉 T. asperellum 573(B)对向日葵幼苗株高和茎粗的影响Fig.1 Effects of T. afroharzianum 838(A) and T. asperellum 573(B)on plant height and stem diameter of sunflower seedlings
相同施用方式下,非洲哈茨木霉T.afroharzianum838的T1、T2、T3的株高和茎粗均高于棘孢木霉T.asperellum573对应处理方式,分别高7.39%、7.32%、7.84%和19.44%、19.05%、17.24%。
向日葵播种后35 d,T.afroharzianum838和T.asperellum573对幼苗全株鲜重和根冠比影响如图2所示。图2A为T.afroharzianum838不同施用方式下向日葵幼苗全株鲜重和根冠比的表现,T1全株鲜重和根冠比最高,分别为6.87 g和0.17。T1与T2、T2与T3之间的全株鲜重差异均不显著,但T1、T2、T3均显著高于CK1和CK2,分别高95.17%、78.98%、66.19%和63.57%、50.00%、39.29%;CK2全株鲜重显著高于CK1,增幅为19.32%。T1根冠比显著高于T2、T3、CK2、CK1,分别高13.33%、21.43%、30.77%、41.67%;T2、T3与CK2差异不显著,但显著高于CK1,分别高25.00%、16.67%;CK2、CK1之间差异不显著。图2B为T.asperellum573不同施用方式下向日葵幼苗全株鲜重和根冠比的表现,T1的幼苗全株鲜重和根冠比最高,分别为5.84 g和0.18。T1全株鲜重显著高于T2、T3、CK2、CK1,分别高12.74%、19.92%、39.05%、65.91%;T2和T3之间差异不显著,但二者均显著高于CK2、CK1,分别高23.33%、47.16%和15.95%、38.35%;CK2全株鲜重显著高于CK1,增幅为19.32%。T1根冠比显著高于T2、T3、CK2、CK1,分别高12.50%、20.00%、38.46%、50.00%;T2与T3之间差异不显著但二者均显著高于CK1、CK2,分别高33.33%、23.08%和25.00%、15.38%;CK1与CK2根冠比之间差异不显著。CK1全株鲜重和根冠比最低,分别为3.52 g和0.12。
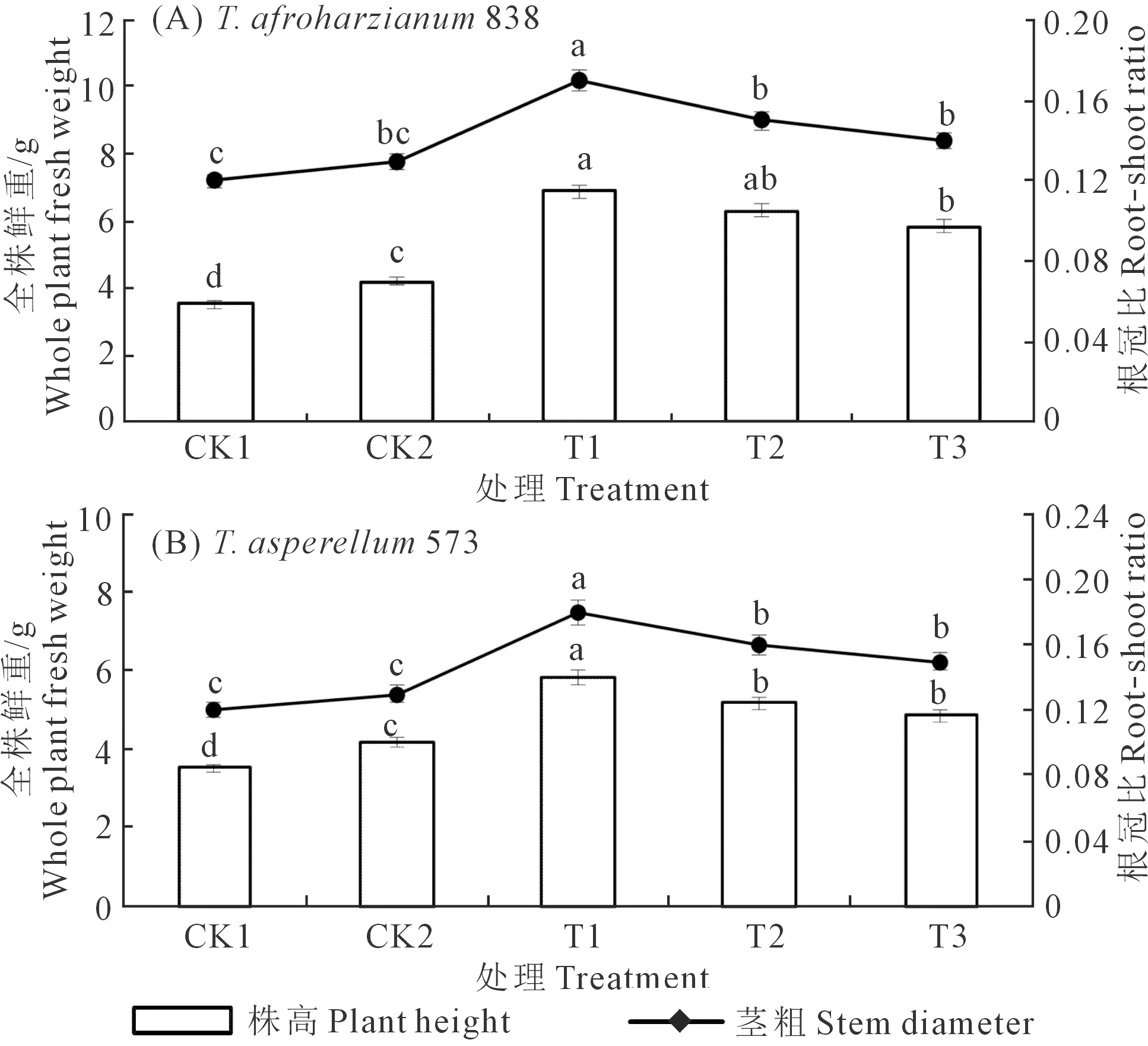
图2 非洲哈茨木霉T. afroharzianum 838(A)和棘孢木霉 T. asperellum 573(B)对向日葵幼苗全株鲜重和根冠比的影响Fig.2 Effects of T. afroharzianum 838(A) and T. asperellum 573(B) on whole plant fresh weight and root shoot ratio of sunflower seedlings
相同施用方式下,非洲哈茨木霉T.afroharzianum838的T1、T2、T3的全株鲜重均高于棘孢木霉T.asperellum573对应处理方式,分别高17.64%、21.62%、20.12%;但二者之间根冠比差异很小。
综上可知,木霉不同施用方式对向日葵幼苗株高、茎粗、全株鲜重和根冠比的作用效果有所不同,非洲哈茨木霉T.afroharzianum838的T1处理对向日葵幼苗形态建成和物质积累促进效果最强,为提高向日葵幼苗抗逆性提供了基础保证。
2.3 木霉菌对向日葵幼苗叶片生理特性的影响
2.3.1 木霉菌对向日葵幼苗叶片丙二醛含量的影响T.afroharzianum838和T.asperellum573对向日葵幼苗叶片丙二醛含量影响如图3所示,向日葵播种后35 d,2个木霉菌均以CK1叶片丙二醛含量最高,为9.31 μmol·g-1。T.afroharzianum838和T.asperellum573处理下CK1显著高于CK2、T1、T2、T3,分别高79.38%、49.44%、30.21%、24.80%和79.38%、37.72%、27.36%、19.05%;T2和T3显著高于CK2、T1,T.afroharzianum838处理下分别高37.76%、14.77%和43.74%、19.74%,T.asperellum573处理下分别高40.85%、8.14%和50.67%、15.68%;T.afroharzianum838和T.asperellum573处理下T1显著高于CK2,分别高20.04%和30.25%;CK2丙二醛含量最低,为5.19 μmol·g-1。T.afroharzianum838的T1、T2、T3处理下丙二醛含量均低于T.asperellum573下的对应处理,分别降低7.84%、2.19%、4.60%。
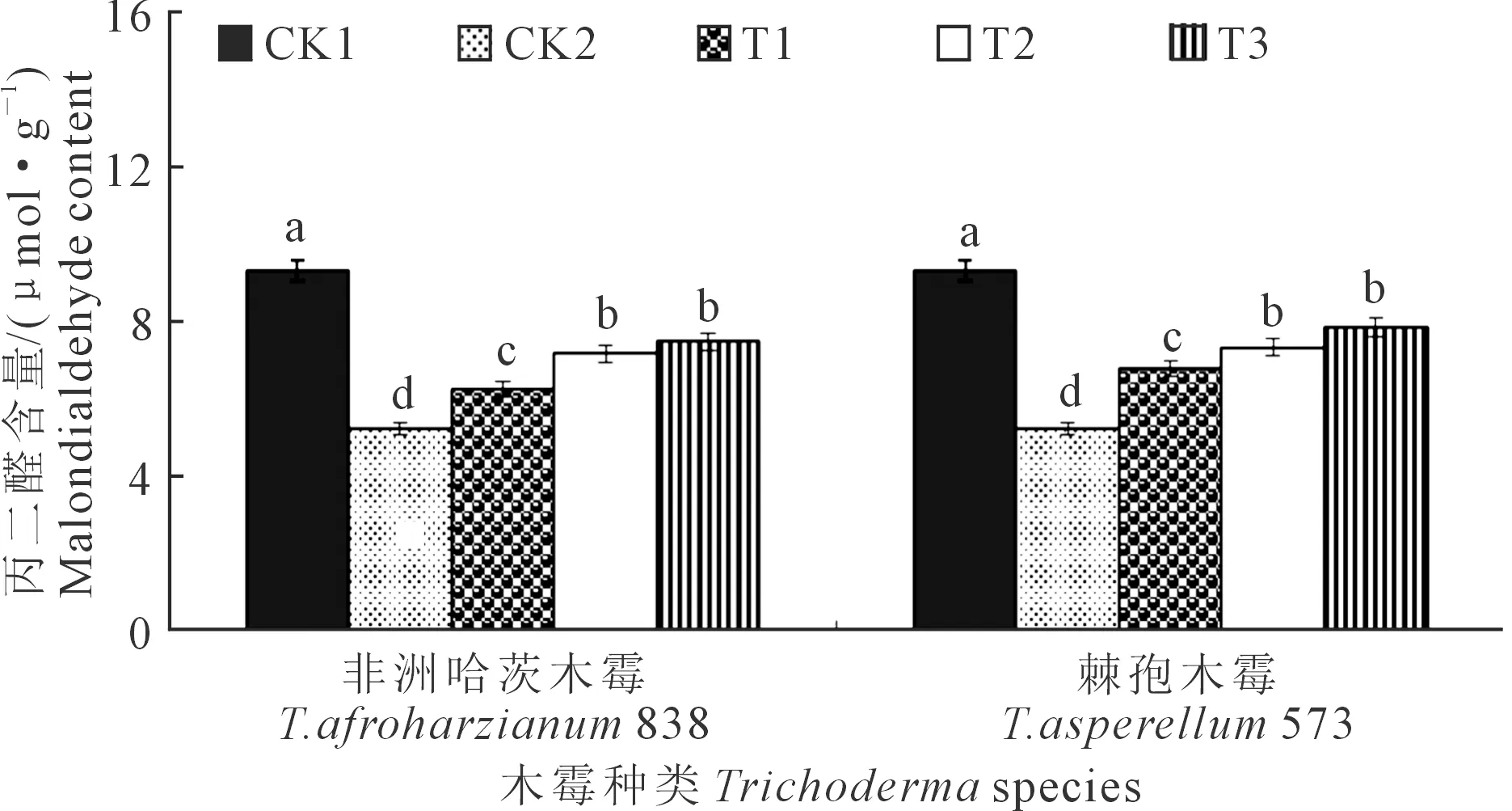
图3 木霉菌对向日葵幼苗叶片丙二醛含量的影响Fig.3 Effects of Trichoderma on malondialdehyde content of sunflower seedlings leaf
2.3.2 木霉菌对向日葵幼苗叶片细胞膜相对透性的影响T.afroharzianum838和T.asperellum573对向日葵幼苗叶片细胞膜相对透性影响如图4所示,向日葵播种后35 d,2个木霉菌均以CK1叶片细胞膜相对透性最高,为82.31%。T.afroharzianum838和T.asperellum573处理下CK1显著高于CK2、T1、T2、T3,分别高88.57%、53.22%、43.35%、30.11%和88.57%、46.75%、40.08%、25.88%。T.afroharzianum838的T3显著高于T1和CK2,分别高17.76%、44.93%;T2与T1之间差异不显著,二者均显著高于CK2,分别高31.55%和23.07%。T.asperellum573的T3显著高于T2、T1、CK2,分别高11.28%、16.58%、49.81%;T2与T1之间差异不显著,均显著高于CK2,分别高34.62%、28.50%;CK2叶片细胞膜相对透性最低,为43.65%。T.afroharzianum838的T1、T2、T3处理下叶片细胞膜相对透性均低于T.asperellum573下的对应处理,分别降低4.23%、2.28%、3.26%。
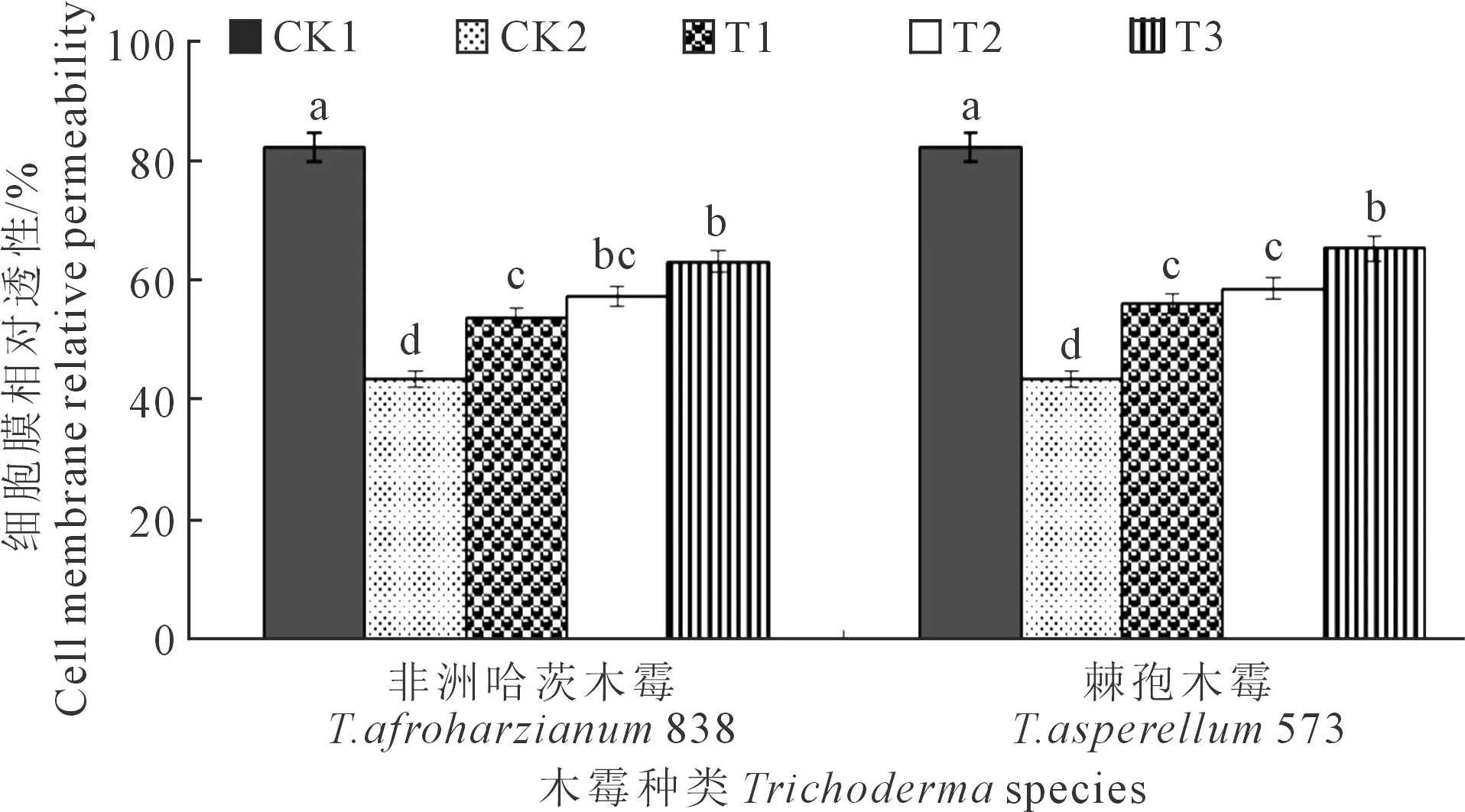
图4 木霉菌对向日葵幼苗叶片细胞膜相对透性的影响Fig.4 Effects of Trichoderma on cell membrane relative permeability of sunflower seedlings leaf
2.3.3 木霉菌对向日葵幼苗叶片可溶性糖含量的影响T.afroharzianum838和T.asperellum573对向日葵幼苗叶片可溶性糖含量的影响如图5所示,向日葵播种后35 d,2个木霉菌均以T1叶片可溶性糖含量最高,分别为42.07 mg·g-1和39.60 mg·g-1。T.afroharzianum838和T.asperellum573处理下T1均显著高于CK1、CK2、T2、T3,分别高179.91%、123.06%、14.23%、37.80%和163.47%、109.97%、20.99%、39.44%;T2、T3、CK2、CK1之间均呈显著性差异,CK1叶片可溶性糖含量最低,为15.03 mg·g-1。T.afroharzianum838的T1、T2、T3处理下叶片可溶性糖含量均高于T.asperellum573下的对应处理,分别高6.24%、12.53%、7.50%。
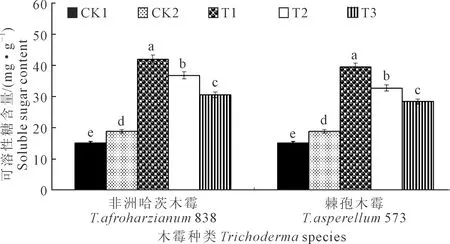
图5 木霉菌对向日葵幼苗叶片可溶性糖含量的影响Fig.5 Effects of Trichoderma on soluble sugar content of sunflower seedlings leaf
2.3.4 木霉菌对向日葵幼苗叶片可溶性蛋白含量的影响T.afroharzianum838和T.asperellum573对向日葵幼苗叶片可溶性蛋白含量的影响如图6所示,向日葵播种后35 d,2个木霉菌均以T1叶片可溶性蛋白含量最高,分别为70.35 μg·g-1和65.44 μg·g-1。
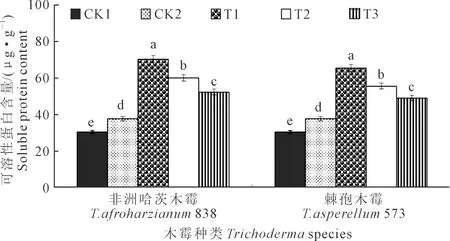
图6 木霉菌对向日葵幼苗叶片可溶性蛋白含量的影响Fig.6 Effects of Trichoderma on soluble protein content of sunflower seedlings leaf
T.afroharzianum838和T.asperellum573处理下T1均显著高于CK1、CK2、T2、T3,分别高132.10%、87.05%、17.02%、34.41%和115.90%、74.00%、17.82%、33.41%;T2、T3、CK2、CK1之间均呈显著性差异,CK1叶片可溶性蛋白含量最低,为30.31 μg·g-1。T.afroharzianum838的T1、T2、T3处理下叶片可溶性蛋白含量均高于T.asperellum573下的对应处理,分别高7.50%、8.25%、6.71%。
2.3.5 木霉菌对向日葵幼苗叶片脯氨酸含量的影响T.afroharzianum838和T.asperellum573对向日葵幼苗叶片脯氨酸含量的影响如图7所示,向日葵播种后35 d,2个木霉菌均以T1叶片脯氨酸含量最高,分别为142.67 μg·g-1和131.85 μg·g-1。T.afroharzianum838和T.asperellum573处理下T1均显著高于CK1、CK2、T2、T3,分别高98.68%、66.63%、16.76%、35.70%和83.61%、53.99%、18.21%、35.02%;T2、T3、CK2、CK1之间均呈显著性差异,CK1叶片脯氨酸含量最低,为71.81 μg·g-1。T.afroharzianum838的T1、T2、T3处理下叶片脯氨酸含量均高于T.asperellum573下的对应处理,分别高8.21%、9.55%、7.67%。
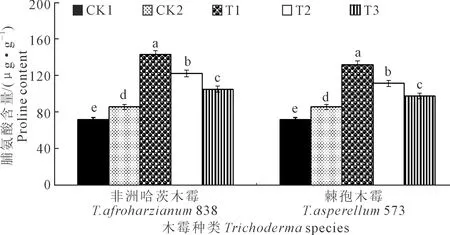
图7 木霉菌对向日葵幼苗叶片脯氨酸含量的影响Fig.7 Effects of Trichoderma on proline content of sunflower seedlings leaf
2.3.6 木霉菌对向日葵幼苗叶片叶绿素含量的影响T.afroharzianum838和T.asperellum573对向日葵幼苗叶片叶绿素含量的影响如图8所示,向日葵播种后35 d,2个木霉菌均以T1的叶片叶绿素最高,分别为3.76 mg·g-1和3.52 mg·g-1。T.afroharzianum838和T.asperellum573处理下T1均显著高于CK1、CK2、T2、T3,分别高129.27%、62.07%、10.59%、23.68%和114.63%、51.72%、8.64%、27.54%;T2、T3、CK2、CK1之间均呈显著性差异,CK1的叶片叶绿素含量最低,为1.64 mg·g-1。T.afroharzianum838的T1、T2、T3处理下叶片叶绿素含量均高于T.asperellum573下的对应处理,分别高6.82%、4.94%、10.14%。
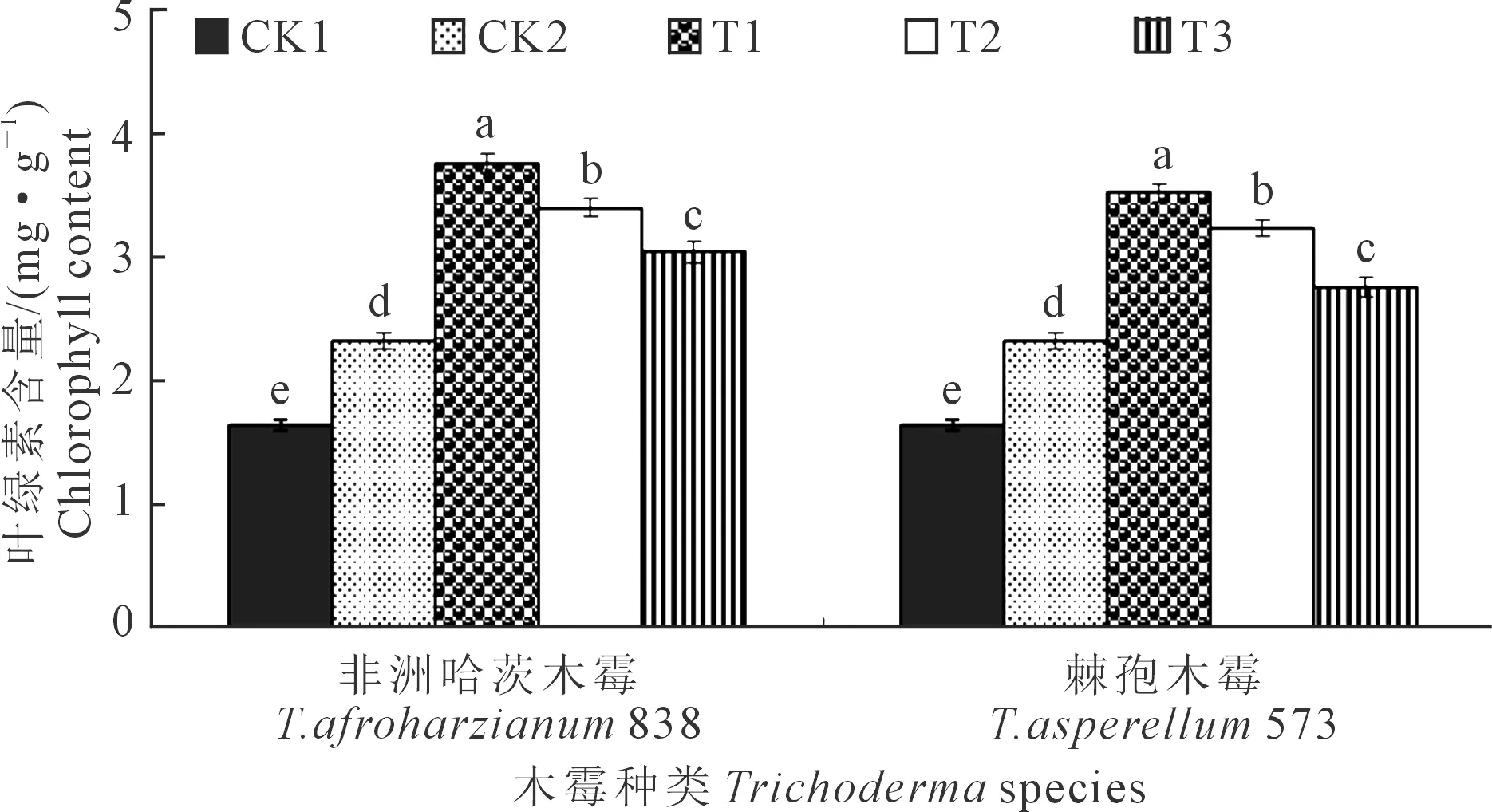
图8 木霉菌对向日葵幼苗叶片叶绿素含量的影响Fig.8 Effects of Trichoderma on chlorophyll content of sunflower seedlings leaf
综上可知,木霉不同施用方式对向日葵幼苗叶片细胞膜相对透性以及丙二醛、可溶性糖、可溶性蛋白、脯氨酸和叶绿素含量的作用效果有差异,非洲哈茨木霉T.afroharzianum838的T1处理通过降低向日葵幼苗叶片中的丙二醛和细胞膜相对透性,提高可溶性糖、可溶性蛋白、脯氨酸和叶绿素含量,增强了抗氧化系统的功能和生理活性,提高了对菌核病的防治效果。
2.4 木霉菌对盆栽向日葵菌核病防治效果的影响
向日葵播种后35 d,调查各处理菌核病的发病率,计算病情指数和防治效果,结果如表3所示。各处理发病率以CK1最高,为97.58%;以T.afroharzianum838的T1处理发病率最低,为2.56%。病情指数与发病率的规律一致,也以CK1最高,为57.50;以T.afroharzianum838的T1处理最低,为0.83。木霉菌对菌核病的防治效果以T.afroharzianum388的T1处理最高,为98.55%;T.afroharzianum838的T1处理与T.asperellum573的T1处理之间差异不显著,但二者均显著高于T.afroharzianum838的T2、T3处理、T.asperellum573的T2、T3处理以及CK2,分别高3.03%、4.62%、6.25%、7.94%、41.67%和1.52%、3.08%、4.69%、6.35%、39.58%;T.afroharzianum838的T2和T3处理之间差异不显著,二者均显著高于T.asperellum573的T2、T3处理以及CK2,分别高3.13%、4.76%、37.50%和1.56%、3.17%、35.42%;T.asperellum573的T2、T3处理之间差异不显著但二者均显著高于CK2,分别高33.33%和31.25%;CK2的防治效果最低,为69.57%。说明木霉种类和施用方式均对向日葵菌核病的防治效果有一定影响,生产上选择适宜的木霉施用方式对提高菌核病防效具有一定积极作用。
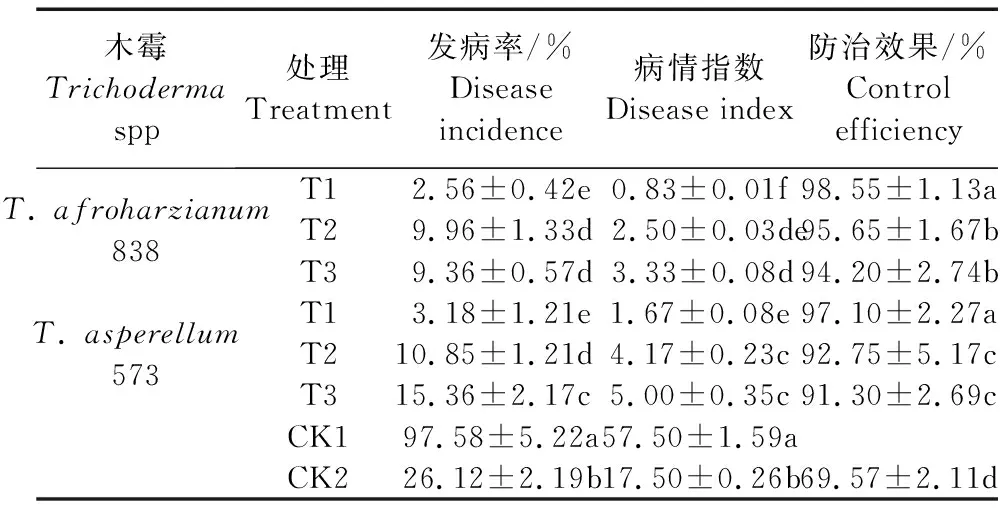
表3 木霉菌对向日葵菌核病防效的影响Table 3 Effects of the control efficiency of Trichoderma against Sclerotinia sclerotiorun of sunflower
3 讨 论
由核盘菌引起的菌核病是造成向日葵产业经济损失的主要病害之一,该病害在世界各地向日葵种植区均有发生[24]。长期使用化学杀菌剂不仅会造成农药残留污染,还会危害果实及其加工产品的质量安全[25],甚至会诱导致病菌产生抗药性,影响向日葵的使用价值和商品价值。生物防治已成为向日葵菌核病防治的主要方法。如朱林等[26]利用平板对峙试验筛选出对向日葵核盘菌有抑制作用的NM63、JQ134、J7、Z9、J33和ZX6共6种菌株,拮抗菌Z9和ZX6鉴定为链霉菌属(Streptomyces),拮抗菌NM63、JQ134、J7和J33鉴定为芽孢杆菌属(Bacillus);盆栽试验表明菌株NM63、JQ134、J7、Z9、J33和ZX6单菌剂的防治效果分别为79.06%、74.10%、70.72%、67.83%、65.11%和57.11%,复合发酵菌剂Ⅰ(Z9∶NM63∶JQ134∶J7=1∶1∶1∶1)和复合发酵菌剂Ⅱ(Z9∶NM63∶JQ134∶J7=1∶2∶2∶1)的防治效果分别为81.43%和85.88%,防效优于单菌剂。而本试验中筛选出的T.afroharzianum838和T.asperellum573木霉菌株,其3种不同施用方式对盆栽向日葵菌核病的防效均在93.84%以上,高于文献报道,说明本研究筛选的木霉菌株具有一定的市场开发前景。
木霉不仅能直接拮抗植物病原微生物,还具有促进幼苗生长、提高植株生理代谢水平的作用[27]。Zhao 等[28]研究发现,TrichodermaafroharzianumTM2-4具有产生生物活性物质和促进番茄种子萌发的作用,其培养滤液经100倍稀释处理后,番茄下胚轴长度、根长和活力指数分别提高了28.7%、19.4%和62.1%;Yani等[29]研究发现,利用木霉(Trichodermaspp)处理的大蒜株高、根长和块茎重量分别较对照增加0.8%、9.0%~23.0%、21.0%~51.0%,使用木霉生物制剂可以提高大蒜产量。本研究显示,与CK1相比,T.afroharzianum838和T.asperellum573的3种处理方式均降低了向日葵幼苗叶片丙二醛和细胞膜相对透性,降低幅度分别为19.05%~49.44%、25.88%~53.22%;提高了叶片可溶性糖、可溶性蛋白、脯氨酸和叶绿素含量,提高幅度分别为88.96%~179.91%、61.83%~132.10%、35.98%~98.68%、68.29%~129.27%。同时,T.afroharzianum838和T.asperellum573的3种处理方式均提高了向日葵幼苗株高、茎粗、全株鲜重、根冠比,提高幅度分别为28.57%~58.82%、87.10%~177.42%、38.35%~95.17%、16.67%~50.00%。这是因为木霉通过调节植物生理生化代谢过程,影响了幼苗的生长状态[30],从而促进了植株生长[31]。
4 结 论
非洲哈茨木霉T.afroharzianum838和棘孢木霉T.asperellum573不同施用方式通过提高向日葵幼苗生理特性,促进了其形态建成和物质积累,增强了向日葵对菌核病的抗性。其中以非洲哈茨木霉T.afroharzianum838的T1处理(播种前5 d用100 mL·盆-1木霉菌悬浮液拌土+接种菌核病菌前2 d用100 mL·盆-1木霉菌悬浮液灌根)应用效果最好,向日葵播种后35 d,该处理植株叶片中的可溶性糖、可溶性蛋白、脯氨酸和叶绿素含量分别比CK1提高179.91%、132.10%、98.68%、129.27%,MDA含量、细胞膜相对透性分别比CK1降低49.44%、53.22%;幼苗株高、茎粗、全株鲜重、根冠比分别比CK1提高58.82%、177.42%、595.17%、41.67%;其对向日葵菌核病的防效达到98.58%。
