北方白菜型冬油菜的春化率、抗寒性和遗传多样性分析
2023-03-29路晓明武军艳王新发徐爱遐李学才刘丽君蒲媛媛牛早霞王会文朱明川范军强孙万仓
路晓明,武军艳,王新发,徐爱遐,李学才,刘丽君,马 骊,蒲媛媛,牛早霞,王会文,朱明川,范军强,孙万仓
(1.甘肃农业大学农学院/甘肃省油菜工程技术研究中心/甘肃省作物遗传改良与种质创新重点实验室/省部共建干旱生境作物学国家重点实验室,甘肃 兰州 730070; 2.中国农业科学院油料作物研究所,北京 100000; 3.西北农林科技大学农学院,陕西 杨凌 712100)
我国油菜生产依据播种季节,划分为冬油菜与春油菜两大产区[1],以甘肃省的天水附近为分界线[2]。由于强抗寒品种的育成及其在北方地区的推广应用,我国冬油菜的种植区域扩大,初步形成了北方冬油菜产区。这个区域冬油菜分布范围广,西起新疆阿勒泰,东至河北、北京等北方多个省市区,生态条件复杂,品种生态型丰富。由于冬油菜含油率高、产量高,而且可利用冬闲田生产,在冬春季具有优异的地表覆盖、保土、保水、保肥功能,对我国食用植物油生产及环境保护具有重要意义。
北方冬油菜生产的首要问题是如何选择和应用抗寒品种,确保安全越冬。有关白菜型油菜种质的抗寒性评价已有研究,赵彩霞[3]研究结果表明,SOD活性、气孔密度、单位面积气孔总长度、叶片组织结构的栅/海比和叶片组织细胞结构疏松度等均可作为油菜抗寒性鉴定指标。陈奇[4]研究表明越冬率是评价冬油菜抗寒性最可靠直观的依据。许耀照等[5-6]研究表明,白菜型冬油菜抗寒性与冬前低温下叶片光合特性以及干物质积累有关,并提出采用准确的、无伤害的叶绿素荧光技术鉴定冬油菜的抗寒性。杨宁宁[7]研究指出根据春播条件下春化率高低可以判断油菜品种的冬性强弱。不同品种经相同春化时间处理后,其现蕾率和开花率表现不同[8],说明不同品种之间春化率存在差异。春化率是油菜抗寒性强弱的直观体现,且影响其种植范围和经济价值。目前,在北方冬油菜产区,生产上应用的品种繁杂,抗寒性和亲缘关系不明,对育种研究及品种利用造成了一定影响。因此本研究基于春播条件下的春化率、半致死温度结合分子标记技术评价白菜型冬油菜抗寒性及遗传多样性。
简单重复序列(Simple sequence repeat, SSR)是以PCR扩增技术为基础的共显性分子标记,具有多态性丰富和扩增结果重现性高的优点[9-10],在植物中用于鉴别其资源的遗传多样性。SRAP(Sequence-related amplified polymorphism)相关序列扩增多态性标记,是针对芸薹属开发的一种标记,主要以扩增开放阅读框(ORF)为主。基于全基因组重测序开发的插入/缺失[Insertion/Deletion(InDel)]标记在类群划分、品种纯度鉴定、亲缘关系鉴定方面广泛应用[11]。
本研究基于春播条件下的春化率结合半致死温度的测定、SRAP、SSR和InDel 3种标记及冬前植物学性状特性鉴定,对目前生产上应用的北方白菜型冬油菜种质资源进行抗寒性评价及遗传多样性分析,以探究不同抗寒性材料之间的差异,为北方白菜型冬油菜抗寒性鉴定及强抗寒品种选育和品种选择提供理论依据。
1 材料与方法
1.1 参试材料
本研究选取北方各地种植面积较大的26个白菜型冬油菜品种(系)为试验材料,分别来自甘肃天水、甘肃庆阳、甘肃兰州和陕西洛川四地,详情见表1。
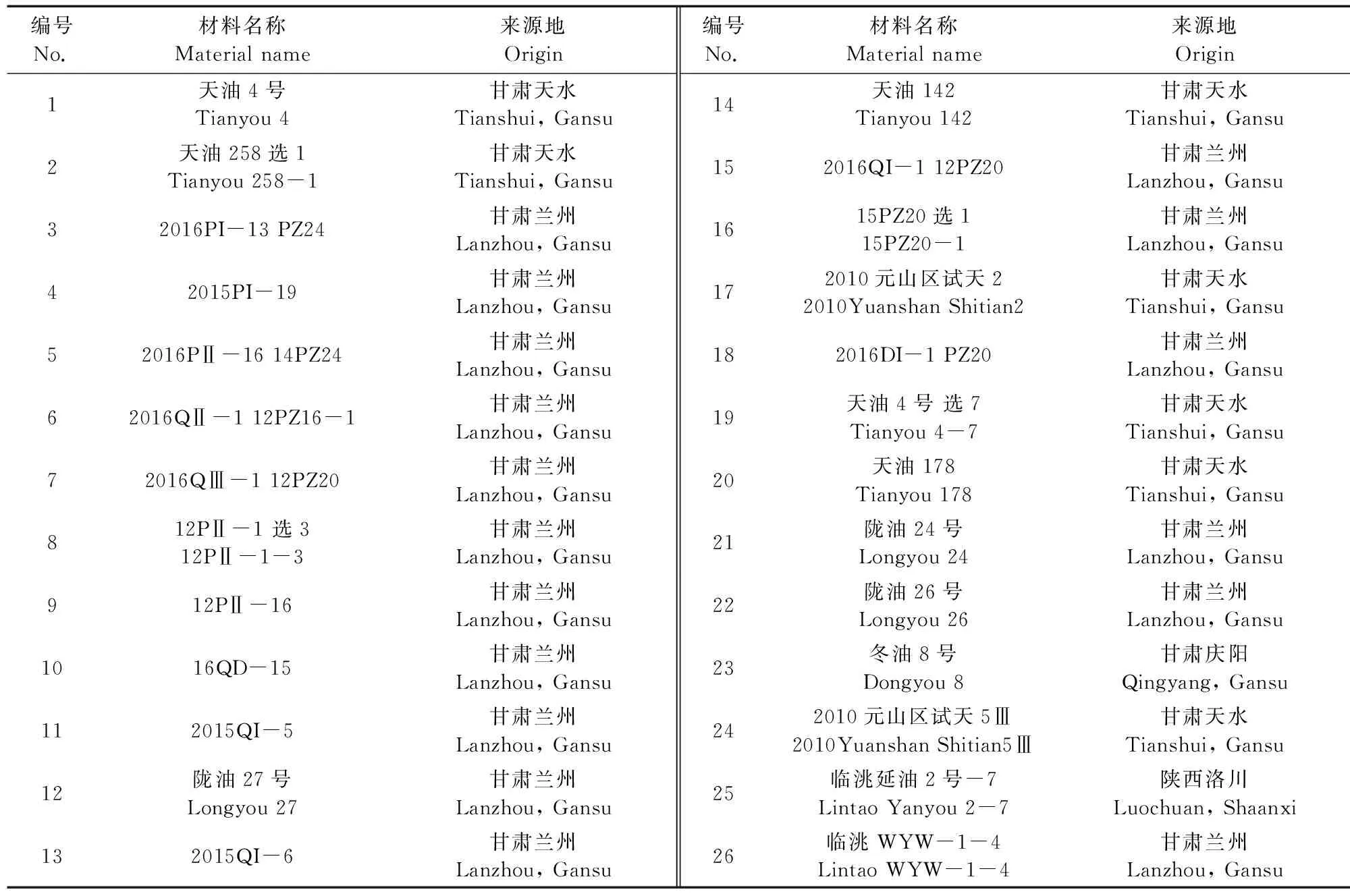
表1 参试材料Table 1 Test materials
1.2 试验方法
1.2.1 春化率测定 春播试验于2018年4月20日在兰州市永登县上川镇播种,小区面积10m2,3次重复,随机区组设计。于9月10日统计每个品种各生长阶段(未现蕾、现蕾、开花、结角、成熟)的植株数,现蕾及现蕾后开花、结角、成熟的植株即为通过春化植株数,计算春化率,春化率=通过春化植株数/总植株数×100%。
1.2.2 冬前植物学性状测定 秋播试验于2019年8月22日在永登县上川镇进行播种,10月21日进行冬前苗期植物学性状的记载统计。小区面积为1 m2,3次重复。依据《北方旱寒区白菜型冬油菜品种试验记载规范》(NY/T2912-2016)进行[12],主要观测记载油菜生长习性、心叶色泽、刺毛、叶色、叶脉色泽和叶缘共6个非数值型性状(表2),以及叶柄长度、叶片宽度、叶片长度和裂叶对数共4个数值型性状。

表2 白菜型冬油菜非数值型性状及其赋值Table 2 Code designed for qualitative traits in winter rapeseed (Brassica rapa L.)
1.2.3 半致死温度测定与计算 盆栽试验于2020年5月28日开始,播种后将盆栽置于培养箱中培养,取五叶期的盆栽苗叶片作为试验材料,使用打孔器取各材料相同大小的小圆片3片,置于10 mL离心管中并加入200 μL去离子水,以空白去离子水为对照。于低温循环仪中设置6个温度梯度(0、-4、-8、-12、-16、-20℃),每个温度处理设置4次重复,温度降至所设温度处理保持30 min后取出,用去离子水定容至10 mL,摇床上振荡2 h后,使用电导率仪测定其初电导率(S1)及对照电导率(Lck),测定完成后煮沸30 min,摇床上振荡冷却后,测定其最终电导率值(S2),求得相对电导率;利用相对电导率和温度得到Logistic线性方程[13]并进行半致死温度(LT50)的计算。
相对电导率(REC)=(S1-Lck)/(S2-Lck)×100%
1.2.4 油菜基因组DNA提取及检测 取盆栽苗五叶期的冬油菜叶片,采用CTAB法进行基因组DNA的提取,利用1%琼脂糖凝胶进行电泳检测,并用核酸测定仪测定浓度,将提取得到的DNA母液稀释成50 ng·μL-1于-20℃环境下保存备用。
1.2.5 PCR扩增及引物初筛 参照臧珊等[14]结果及芸薹属数据库(http://brassicadb.org/brad/),选用均匀分布在10条染色体上的30对InDel引物、20对SSR引物和48对SRAP引物进行初筛,每对引物3次生物学重复,依据引物多态性和可重复性,总共筛选到27对核心引物。SSR和InDel引物名称及序列见表3,SRAP引物及序列见表4,上游引物和下游引物随机组合,其中筛选到4对SRAP引物组合分别为Em4/Me8、Em5/Me8、Em12/Me8和EM12/Me18。SSR和InDel标记总反应体系为10 μL,其中2×Taq PCR Master Mix为5 μL、10 μmol·L-1的引物各0.5 μL、50 ng·μL-1的DNA模板2 μL、灭菌双蒸水2 μL。SRAP-PCR反应体系为10 μL,2×Taq PCR Master Mix为5 μL、上下游引物各0.6 μL,50 ng·μL-1的DNA模板2 μL,灭菌双蒸水1.8 μL。扩增产物通过8%非变性聚丙烯酰胺凝胶电泳进行分离,电泳结束后采用硝酸银进行银染。
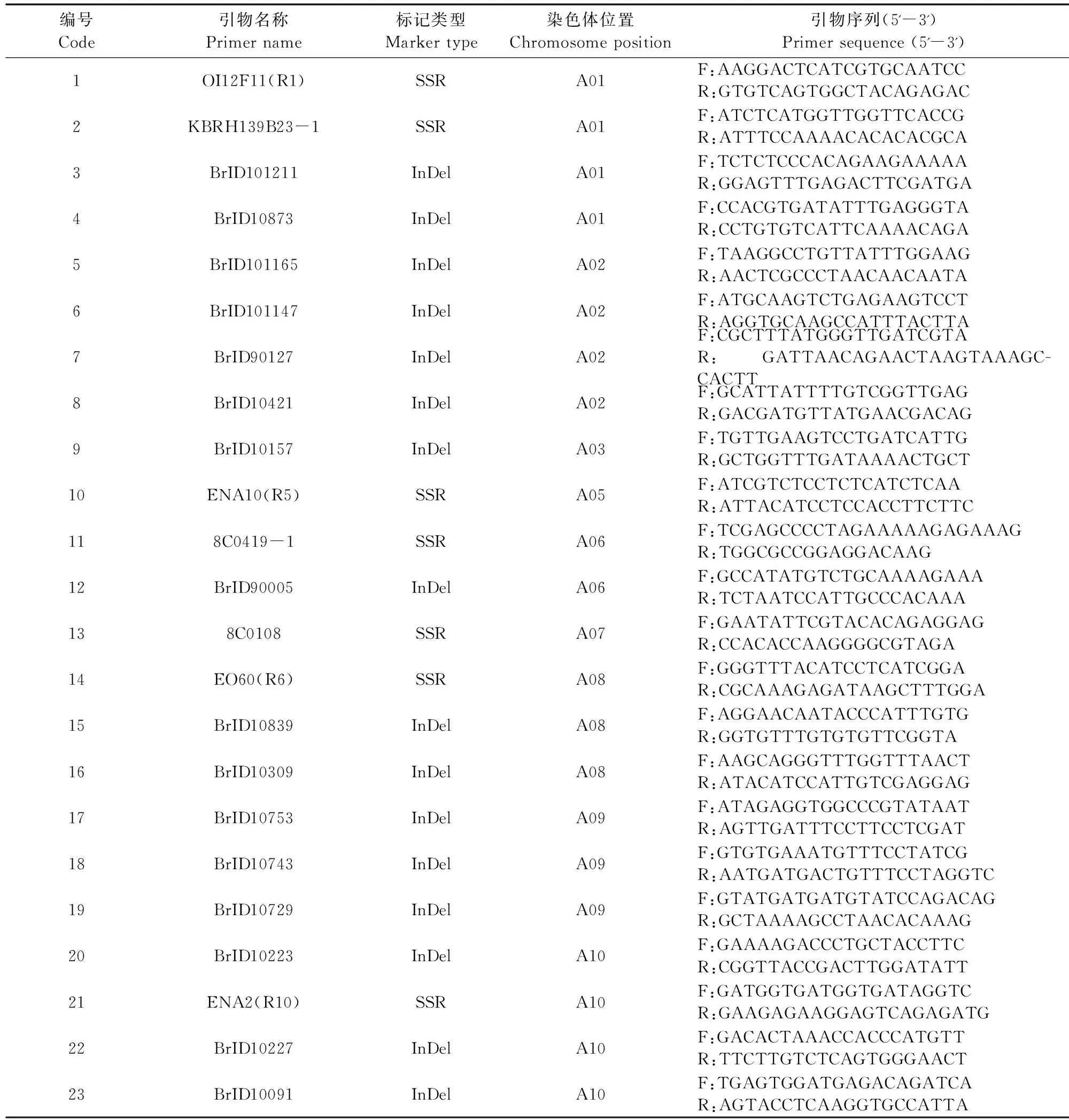
表3 标记名称与序列Table 3 Marker names and sequences
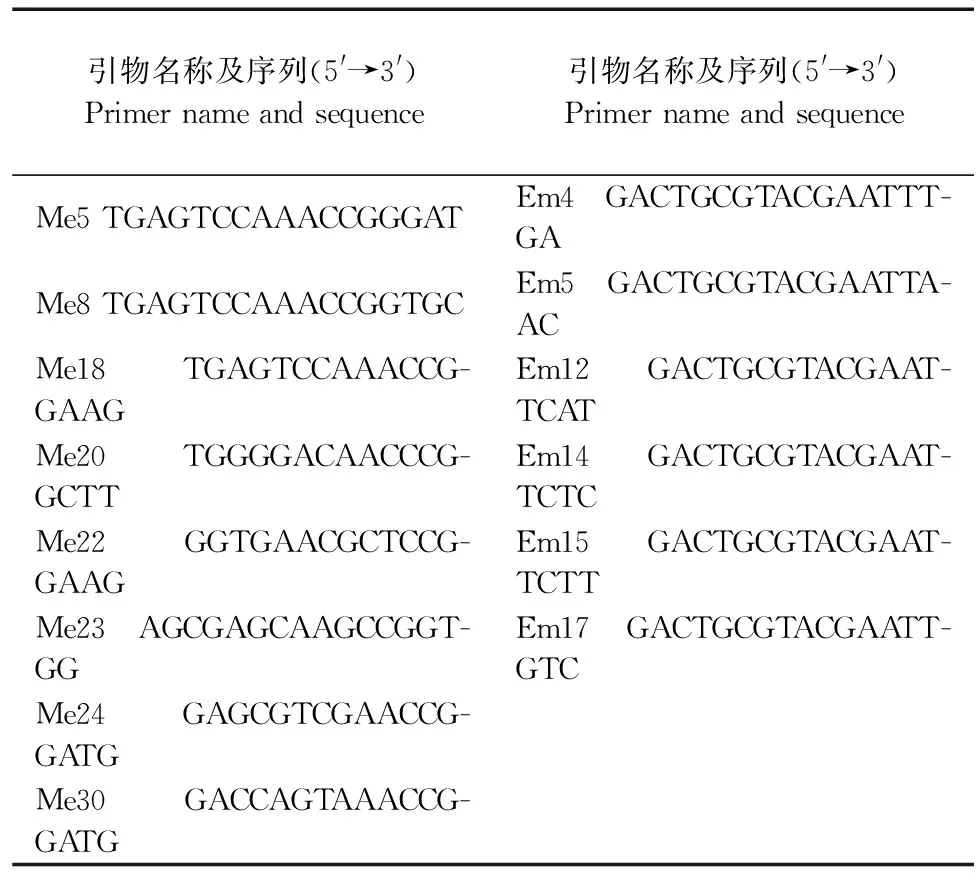
表4 SRAP引物序列Table 4 SRAP primer sequences
1.3 数据统计与分析
对26份北方白菜型冬油菜的6个非数值型性状进行数值转化处理(表2),4个数值型性状进行分级处理[15],计算各植物学性状的变异范围、极差、平均数、变异系数、Simpson指数和Shannon-weaver指数,具体参考Pielou[16]的计算方法。
Simpson指数:
式中,Pi为某性状第i级别内材料份数占总份数的百分比,ln为自然对数。
基于Excel和SPSS 22.0软件对春化率、半致死温度和植物学性状进行统计及系统聚类。通过人工计数的方式识别26份白菜型冬油菜品种的凝胶电泳条带,形成0/1矩阵,通过Dataformer软件转化成各软件所需格式[17]。使用Popgen 32软件计算各遗传参数,PowerMarker V3.25软件计算PIC和品种间的遗传距离,得到非加权组平均法(UPGMA,unweighted pair-group method with arithmetic means)聚类结果。用iTOL对聚类结果进行修饰得到系统发生树[18]。NTSYS-pc2.10e软件基于遗传距离矩阵,进行主坐标分析[19]。
2 结果与分析
2.1 不同北方白菜型冬油菜春播后的春化率差异
北方冬油菜感温性强,但品种间有较大差异,不同品种感温性差异可表现为其对春播条件下气温的适应性不同,主要表现为不同感温性材料的田间春化率的不同,因此根据田间春化率的高低可以鉴别冬油菜抗寒性的强弱[7]。本研究的参试材料春播后,群体中各单株表现出不同的生长发育状态,主要有未现蕾、现蕾、开花、结角、全结角和成熟共6种发育状态(图1,见9页;表5)。根据田间生长发育状态表型的统计结果,各材料春化率为6.59%~69.88%,临洮WYW-1-4和16QD-15的春化率最低,分别为6.59%和6.94%,处于营养生长阶段植株占群体总株数的比例分别为93.41%和93.06%;天油4号的春化率最高,为69.88%,其中现蕾期植株占群体总株数 26.51%。此外,天油258选1、2016PI-13 PZ24、天油142、2010元山区试天2、天油178、冬油8号、2010元山区试天5Ⅲ、临洮延油2号-7共8份材料均表现出较高的春化率。

图1 参试材料春播后的田间表现Fig.1 Field performance of materials after spring sowing
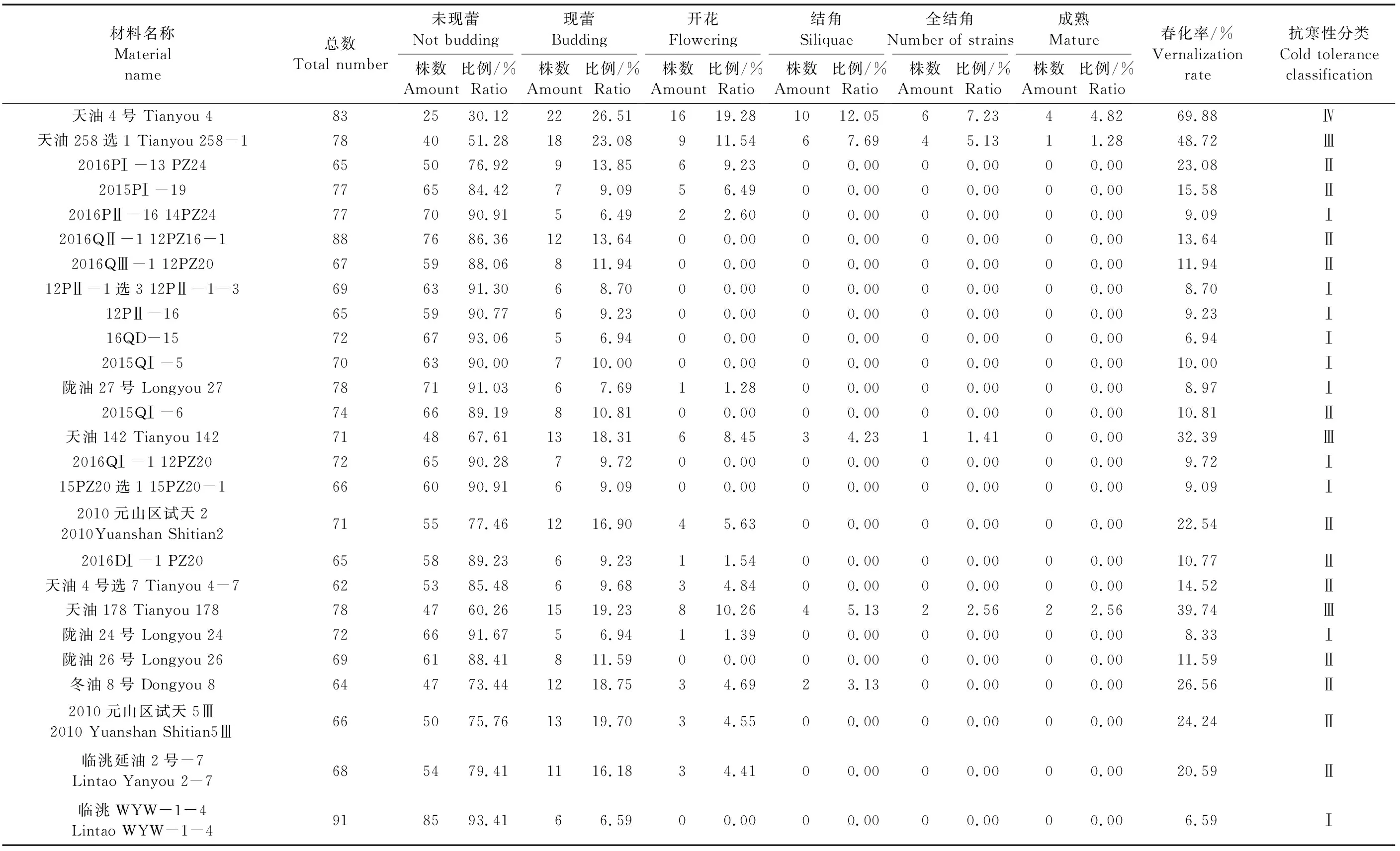
表5 供试材料春播后不同生长发育阶段的植株数及所占比例Table 5 The number and proportion of plants at different growth and development stages after spring sowing
2.2 不同北方白菜型冬油菜抗寒性差异
低温半致死温度是评价植物抗寒性的常用指标,一般运用相对电导率结合Logistic方程计算,其高低反映抗寒性强弱。本研究根据叶片相对电导率拟合的Logistic方程的拟合度(R2)介于0.8344~0.9971,说明Logistic方程拟合度较好。26份参试材料的低温半致死温度变化范围为-3.52~-9.93℃(表6),说明北方白菜型冬油菜各参试材料之间抗寒性差异较大,其中临洮WYW-1-4的低温半致死温度最低,为-9.93℃;天油258选1的低温半致死温度最高,为-3.52℃。天水市农业科学研究所选育的材料包括天油4号、天油258、天油142等品种(系)抗寒性弱于陇油27号、临洮WYW-1-4、陇油26号等白菜型冬油菜品种(系)。
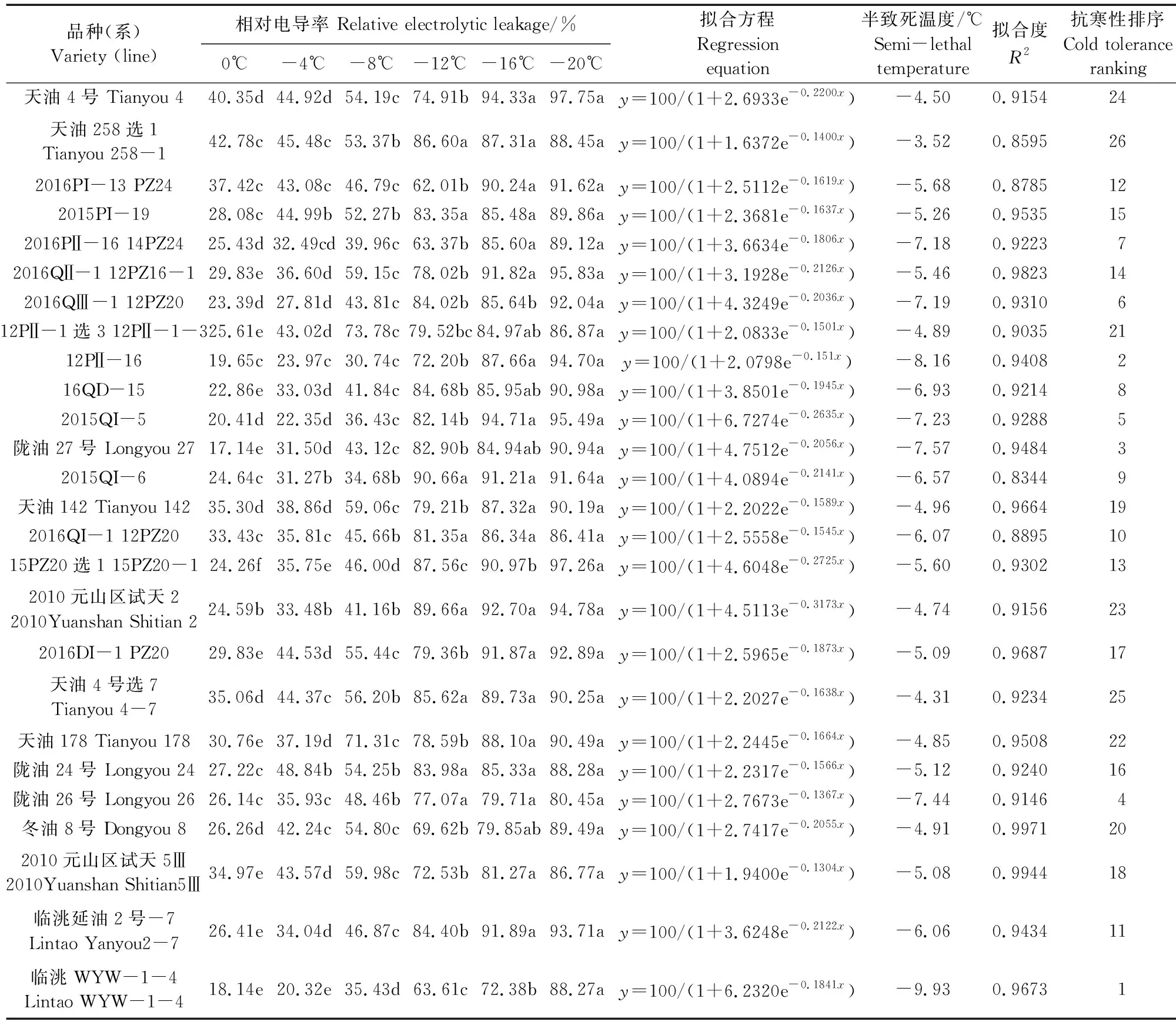
表6 26份冬油菜品种(系)的低温半致死温度Table 6 Semi-lethal low temperature of 26 winter rapeseed varieties (lines)
2.3 植物学性状变化及其与抗寒性的相关性分析
通过对26份参试材料的植物学性状观测发现,各参试材料的生长习性有匍匐与半直立生长两种类型,心叶色为淡绿或紫色,真叶颜色深绿居多,叶脉色多为白色,叶缘形状多为锯齿状,真叶刺毛数量存在差异。对参试材料苗期4个数值型性状(表7)及6个非数值型性状(表8)分析结果表明,2016PⅡ-16 14PZ24叶柄长度和裂叶对数值最大,分别是12.30 cm和5.25对。叶片长度值最大的是2010元山区试天2(10.61 cm),最小的是临洮延油2号-7(6.88 cm);叶片宽度值最大的是2010元山区试天5Ⅲ(9.04 cm),最小的是15PZ20选1(6.05 cm)。数值型性状的变异系数平均值为25.39%,叶片宽度变异系数最小(21.59%),裂叶对数变异系数最大(32.00%);非数值型性状真叶刺毛数量的变异系数最大(55.42%),生长习性的变异系数最小(7.54%),平均值为37.76%。数值型性状的平均变异小于非数值型,说明其遗传相对稳定。10个植物学性状遗传多样性指数Simpson(D)的变化范围为0.011~0.847,Shannon-weaver(H)的变化范围为0.035~2.046。数值型性状的遗传多样性指数D与H的平均值分别为0.826、1.917,说明参试材料的遗传变异丰富。叶柄长度的遗传多样性指数最大,D、H值分别为0.847、2.046;裂叶对数的遗传多样性指数最小。非数值型性状的遗传多样性指数D、H的平均值分别为0.395、0.627,说明数值型性状的遗传多样性高于非数值型性状,其中生长习性的遗传多样性指数最小。
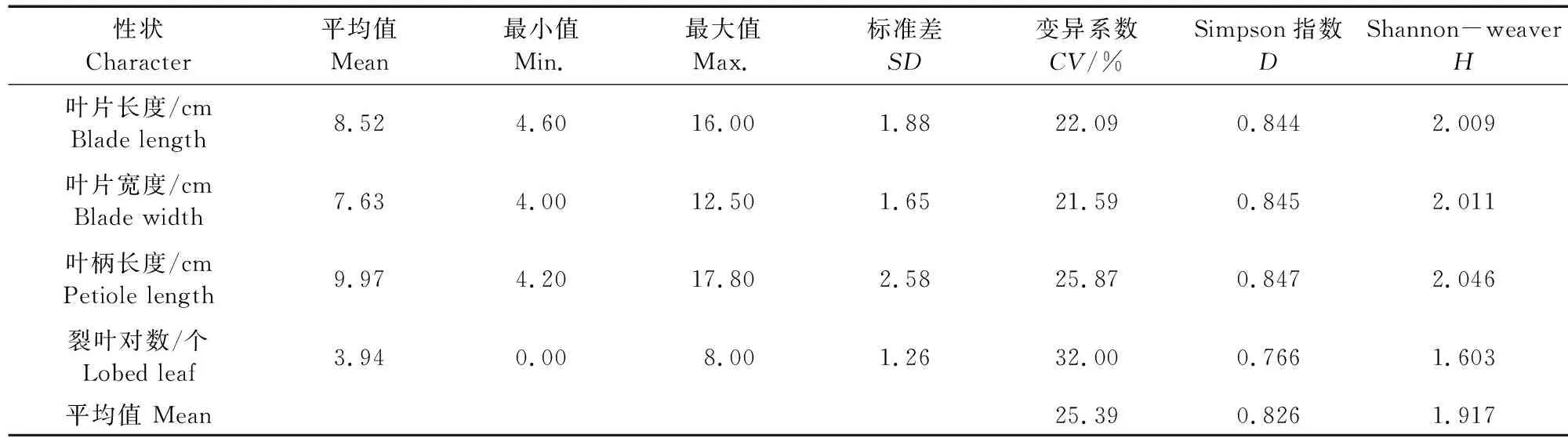
表7 26份参试材料数值型性状的平均值、标准差、极差、变异系数及遗传多样性分析Table 7 Mean, standard deviation, extreme value, coefficient of variation and genetic diversity for numeric traits on 26 tested materials
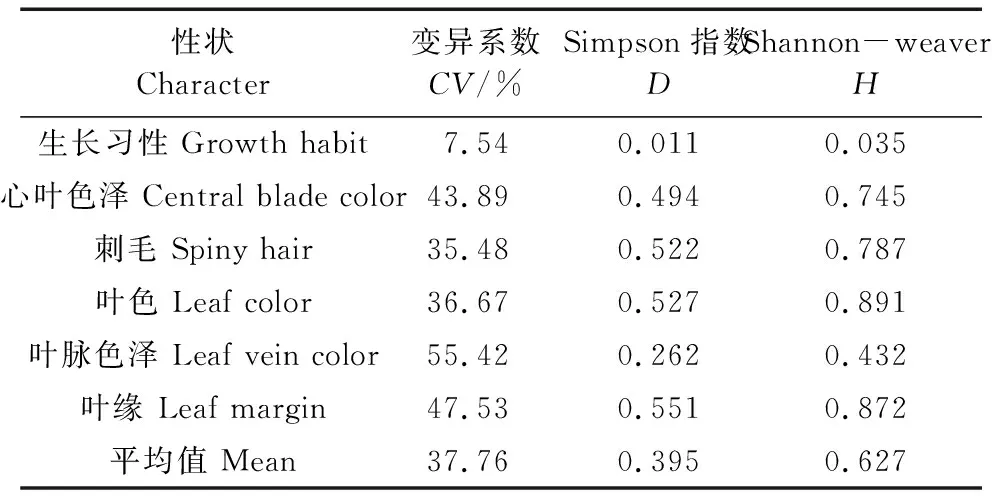
表8 26份参试材料非数值型性状的变异系数及遗传多样性分析Table 8 The variation parameter and genetic diversity of qualitative traits on 26 tested materials
基于植物学性状对26份参试材料进行聚类结果表明(图2),参试材料以欧氏距离5为界限,被分为4大类,第Ⅰ类包括2016QⅡ-1 12PZ16-1、陇油27号、2015PI-19、2016DI-1 PZ20、陇油24号、12PⅡ-16和2015QI-6共7份材料,占所有材料的26.92%;该类群的植株生长势中等,匍匐生长,叶色为深绿,叶脉色以白色居多,真叶刺毛较多,叶柄长度、叶片长度和宽度及裂叶对数居中。第Ⅱ类包括12PⅡ-1 选3、陇油26号、2016QI-1 12PZ20、2015QI-5、16QD-15、2016PI-13 PZ24、15PZ20 选1、天油178、2016QⅢ-1 12PZ20、临洮WYW-1-4和临洮延油2号-7共11份材料,占所有材料的42.31%;该类群的特点是叶柄长度相对较短,心叶色以紫色居多。第Ⅲ类包括2010元山区试天5Ⅲ、2010元山区试天2、冬油8号、天油4号、天油258选1、天油142和2016PⅡ-16 14PZ24共7份材料,占所有材料的26.92%;该类群的特点是生长旺盛,叶片长度、宽度高于另外3个组群,生长势相对较强,是甘肃天水的主要栽培品种。第Ⅳ类包括1份参试材料天油4号选7,仅占参试材料的3.85%,该组叶柄长度最长,叶片长度、宽度、裂叶对数明显小于其他3个类群。
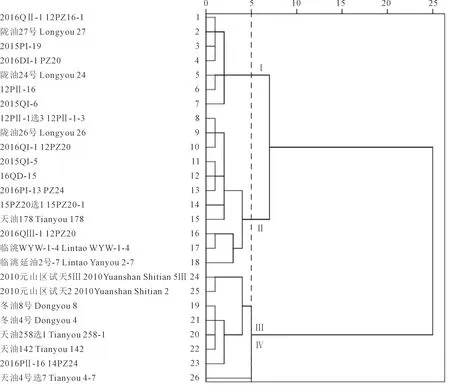
图2 基于各参试材料植物学性状的系统聚类图Fig.2 Systematic cluster diagram of the tested materials based on botanical characters
春化率与其余的11个植物学性状的相关性分析表明(图3,见9页),叶色与半致死温度呈极显著负相关(P≤0.01),叶柄长度与半致死温度呈极显著正相关(P≤0.01),说明白菜型冬油菜叶色越深、叶柄长度相对较短,其半致死温度就越低。春化率与生长习性呈显著正相关(P≤0.05),与半致死温度呈极显著正相关(P≤0.01),与叶色呈极显著负相关(P≤0.001);半直立生长,其生长势越强,地上部分生物量越大,不利于其越冬,该品种的抗寒性就越弱,春播时,其春化率就越高。叶色与低温半致死温度、春化率呈极显著负相关,即叶色越深,多为深绿,其抗寒性越强,通过春化的植株所占比例越低。
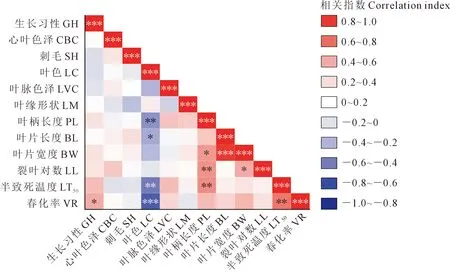
注:* P≤0.05;** P≤0.01;*** P≤0.001;Note: * P≤0.05; ** P≤0.01; *** P≤0.001; GH: Growth habit; CBC: Central blade color; SH: Spiny hair; LC: Leaf color; LVC: Leaf vein color; LM: Leaf margin; PL: Petiole length; BL: Blade length; BW: Blade width; LL: Lobed leaf; LT50: Semi-lethal temperature; VR: Vernalization rate.图3 植物学性状与抗寒性的相关性分析Fig.3 Correlation analysis between botanical characters and cold resistance
2.4 基于SRAP、SSR和InDel标记的遗传多样性及聚类分析
2.4.1 参试材料遗传多样性 利用27对引物对26份白菜型冬油菜种质的遗传多样性参数进行分析(表9),26份白菜型冬油菜的27对引物数据共检测总等位基因数130个,其中引物基因座主要分布在A01、A02、A10这3条染色体。每条染色体的观测等位基因数变化范围为2~17,平均值为4.81,A01和A10染色体的观测等位基因数最多。有效等位基因数(Ne)的变化范围为1.26~6.81,平均值为3.14;观测杂合度(Ho)的变化范围为0.1238~0.7919;期望杂合度(He)的最小值是0.2081,最大值是0.8762;香农指数(I)和Nei’s基因多样性指数(H)的平均值分别为1.2073和0.6168;多态性信息含量(PIC)的变化范围是0.1833~0.8378,平均值为0.5681。其中SRAP标记的PIC值最高,以及PIC>0.5的位点有19个,占全部标记的70.37%,说明本研究所选的标记具有较高的多态性,可以有效地反映参试材料的遗传多样性信息。
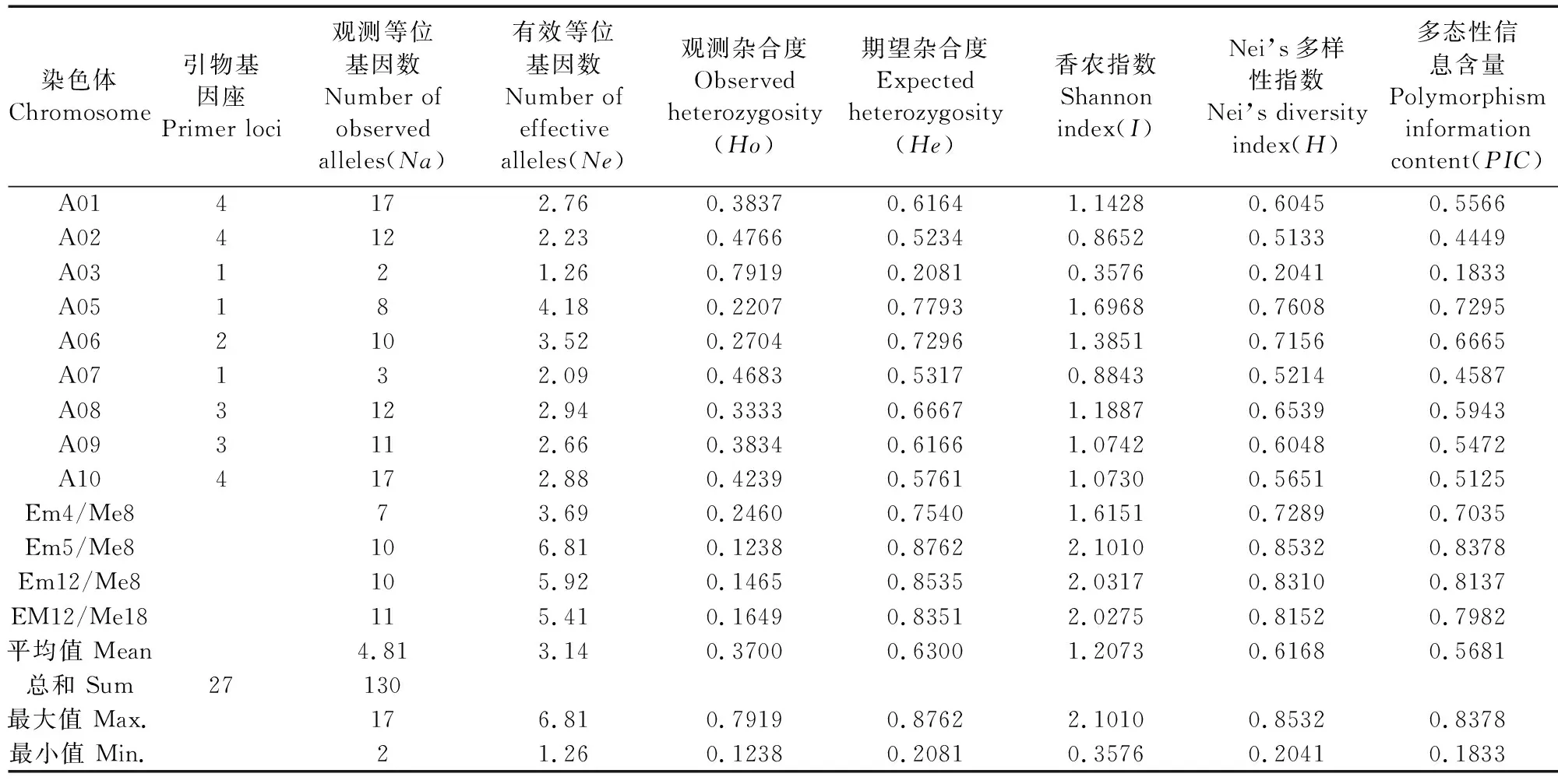
表9 26份冬油菜种质遗传多样性参数Table 9 Genetic diversity parameters of 26 winter rapeseed germplasms
2.4.2 基于遗传相似系数的聚类分析 如图4所示,26份参试材料分为6大类,第I类主要包括2010元山区试天5Ⅲ、2010元山区试天2、冬油8号、临洮延油2号-7、2016PI-13 PZ24、2016QI-1 12PZ20和天油4号选7共7份材料;第Ⅱ类包括天油258选1、天油178、天油4号、天油142、2016DI-1 PZ20和陇油26号共6份材料;类群I和类群Ⅱ主要包括的是甘肃天水育成的材料。第Ⅲ类包括1份材料2015QI-6;第Ⅳ类包括2份材料15PZ20选1和12PⅡ-1选3;第Ⅴ类包括2015QI-5、16QD-15、陇油24号、2016QⅢ-1 12PZ20、2015PI-19和12PⅡ-16共6份材料;第Ⅵ类包括2016QⅡ-1 12PZ16-1、2016PⅡ-16 14PZ24、临洮WYW-1-4和陇油27号共4份材料;类群Ⅲ、Ⅳ、Ⅴ和Ⅵ主要包括的是甘肃兰州育成的材料。
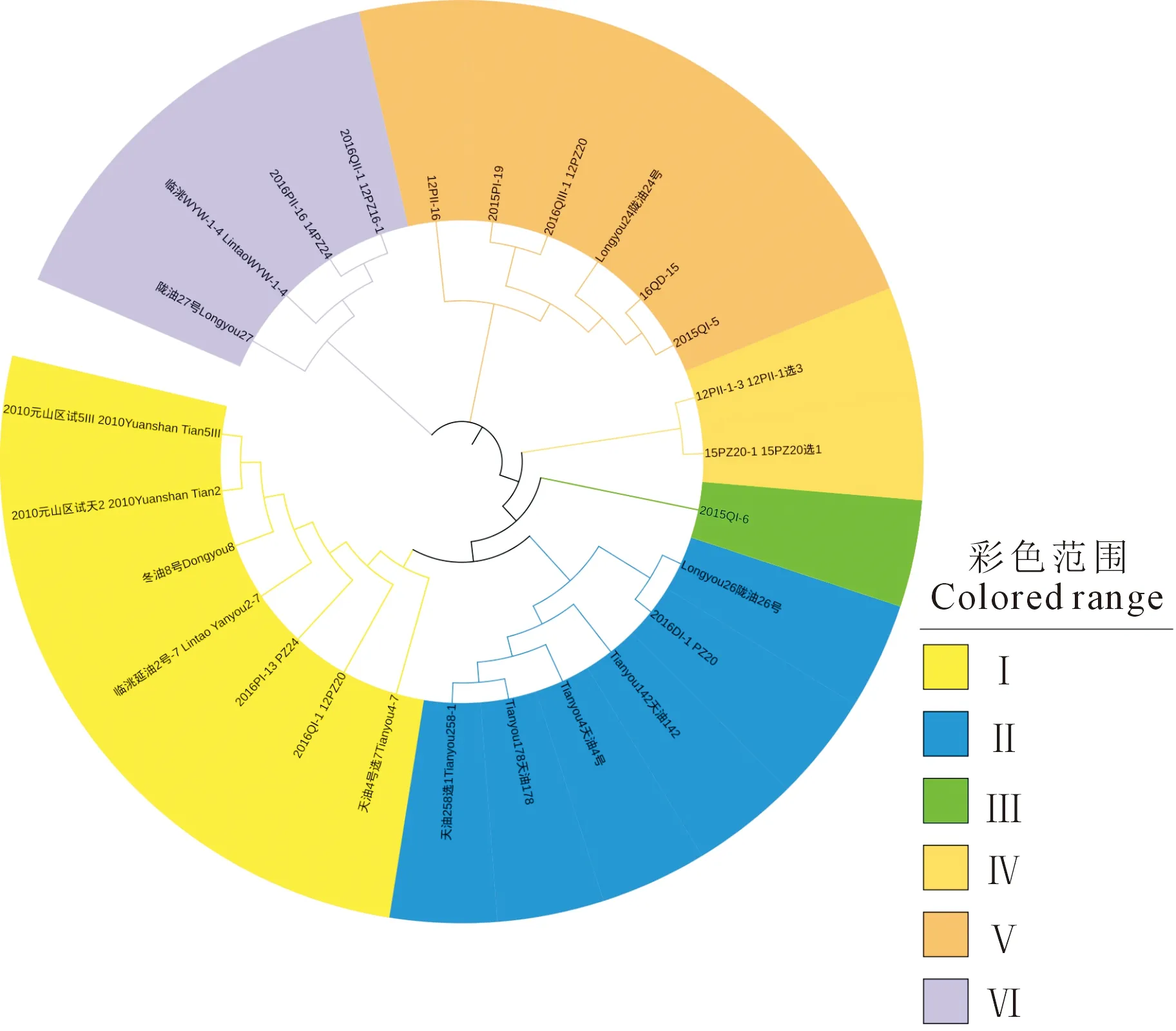
图4 基于SSR、SRAP和InDel标记聚类26份冬油菜种质Fig.4 Clustering of 26 winter rapeseed germplasm based on SSR, SRAP and InDel markers
2.4.3 依据SRAP、SSR和InDel标记的26份参试材料的主坐标分析 依据遗传相似系数,对26份白菜型冬油菜品种进行主坐标分析,前3个主坐标的方差贡献率分别为24.4%、13.7%和9.5%。对26个参试材料分别做第1、2主坐标二维图的排序(图5)。第1、2主坐标总的贡献率是38.2%,参试材料被分为6类,其中第I类包括2016PI-13 PZ24、2010元山区试天2、2010元山区试天5Ⅲ、临洮延油2号-7和冬油8号共5份材料。第Ⅱ类包括陇油26号、天油4号、天油258选1和天油178共4份材料。第Ⅲ类包括天油142、天油4号选7和2016DI-1 PZ20共3份材料。第Ⅳ类包括2015QI-6、15PZ20选1、12PⅡ-1选3、12PⅡ-16共4份材料。第Ⅴ类包括2015PI-19、2016QⅢ-1 12PZ20、陇油27号、2016PⅡ-16 14PZ24、临洮WYW-1-4、2016QⅡ-1 12PZ16-1、2015QI-5、陇油24号共8份材料。第Ⅵ类包括2016QI-1 12PZ20和16QD-15共2份材料。
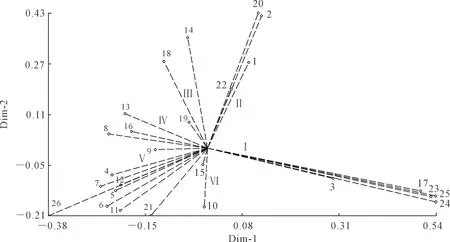
注:1~26代表品种(系)名称,见表1。Note: 1~26 represent the names of the varieties (lines), as shown in Table 1.图5 依据SRAP、SSR和InDel标记进行主坐标分析的第1、2主坐标散点图Fig.5 Scatter diagram of the first and second principal coordinates of the principal coordinates analysis based on SRAP, SSR and InDel markers
3 讨论与结论
感温性是指作物由营养生长转向生殖生长过程中对温度条件的反应特性[7]。植物感温性的田间直观表现是春播条件下的春化率[20]。杨宁宁[7]和徐春梅等[20]研究都表明,感温性不同的白菜型冬油菜完成春化阶段所需的时间不同,随着冬性由强到弱,春化所需时间由长到短,春化率由低到高。感温性与抗寒性也存在内在关系。
本研究依据表型植物学性状分析,将参试材料划分为4个类群,类群I和类群Ⅱ主要是在兰州育成的材料,其在生长习性、真叶刺毛、叶色等农艺性状方面差异不大,表现出较低的春化率和半致死温度,表明该类群可作为选育抗寒品种的优异种质资源。类群Ⅲ和类群Ⅳ表现出较好的生长势,在叶柄长度、叶片长度、叶片宽度和裂叶对数等方面优于类群I和类群Ⅱ,表现出较高的春化率和半致死温度,因此,该类群可用于冬季覆盖作物材料的筛选。
通过对26份北方白菜型冬油菜品种(系)进行表型性状多样性分析,发现其数值型性状平均多样性指数高达1.917,高于非数值型性状平均多样性指数(0.627),说明北方白菜型冬油菜品种(系)表型性状具有丰富变异,同李梦寒等[21]的研究结果比较相符。本研究发现,白菜型冬油菜非数值型性状苗期生长习性的遗传多样性相对较低,真叶刺毛的遗传多样性指数相对较高,其主要原因是白菜型冬油菜苗期生长习性以匍匐生长为主,而真叶刺毛的多少受品种的影响,表现不同。
表型性状容易受到环境因素的影响,因此,本研究在表型性状的基础上,采用分子标记技术从DNA水平上揭示品种之间的亲缘关系。基于SRAP、SSR和InDel标记分析,将参试材料划分为6个类群,类群I和类群Ⅱ主要是天水育成材料,其整体生长势较强,春化率较高,主要是由于天水的地理位置、气候等因素的影响,使该地选育成的品种(系)抗寒性弱于陇油27号、临洮WYW-1-4、陇油26号等其他区域的白菜型冬油菜品种(系);类群Ⅲ、Ⅳ、Ⅴ和Ⅵ主要是在兰州育成的材料,其表现出较低的春化率和较强的抗寒性;抗寒性划分水平与植物学特征特性一致,强抗寒参试材料具有叶色深绿、叶柄相对较短的特征,而弱抗寒的类型具有叶色较浅、生长势较强的特征。
