丹参酮ⅡA 联合还原型谷胱甘肽治疗抗肿瘤药 致急性肝损伤的临床效果
2023-03-29皇甫晨瑶郝艺伟贾晓琼
皇甫晨瑶,侯 坤,高 雁,郝艺伟,贾晓琼
(1.内蒙古自治区肿瘤医院药剂科;2.内蒙古自治区肿瘤医院肿瘤内科,内蒙古 呼和浩特 010102)
随着临床医疗技术的不断发展,包括生物免疫制剂及营养支持干预的不断完善,化疗、靶向治疗及骨髓移植等治疗方式的广泛使用,肿瘤患者的生活质量得到进一步提升,生存时间延长[1]。但是患者治疗过程中会发生不良反应,且存在个体差异,例如,化疗会对患者的肝细胞造成损伤,不仅会影响整体的临床治疗效果,还对患者的生命安全造成影响,对于肝损伤较为严重的患者,甚至不能进行巩固化疗,进而导致疾病复发甚至恶化[2]。所以需要对患者进行良好的保肝治疗。临床研究显示,针对肿瘤药致急性肝损伤患者,采用丹参酮ⅡA 联合还原型谷胱甘肽的治疗效果较为理想,可以达到较好的保肝效果[3]。因此,本研究分析丹参酮Ⅱ A 与还原型谷胱甘肽治疗抗肿瘤药致急性肝损伤的效果,现报道如下。
1 资料与方法
1.1 一般资料回顾性分析内蒙古自治区肿瘤医院2020 年5 月至2022 年3 月收治的84 例抗肿瘤药致急性肝损伤患者的临床资料,根据不同的疗法分为观察组和对照组,各42 例。观察组患者中男性22 例,女性20 例;年龄21~74 岁,平均年龄(52.21±1.33)岁;体质量49~93 kg,平均体质量(73.44±6.31)kg。对照组患者中男性23 例,女性19 例;年龄20~75 岁,平均年龄(52.37±1.65)岁;体质量50~92 kg,平均体质量(73.39±6.42)kg。两组患者一般资料比较,差异无统计学意义(P>0.05),有可比性。本研究经内蒙古自治区肿瘤医院伦理委员会批准。纳入标准:①符合抗肿瘤药致急性肝损伤的诊断标准[4];②经临床生化检验确诊;③年龄18~75 岁;④患者预计生存时间在3 个月以上;⑤临床资料完整。排除标准:①合并其他系统性疾病者;②存在精神疾病,不可自主沟通者;③对本研究药物过敏者;④治疗前存在病毒性肝炎、肝硬化及原发性肝癌者;⑤妊娠期或哺乳期患者。
1.2 治疗方法所有患者入院后均进行肝功能、肾功能、心电图及血常规等检查,密切监测患者生命体征指标,配合药物干预,缓解患者负性情绪,确保患者的治疗安全。必要时另进行针对性治疗:根据患者的基础疾病,选择合理的药物治疗,如对于存在高血压的患者,采用降压药物治疗,对于治疗期间存在恶心呕吐的患者,需要进行止吐处理等。对照组患者采用还原型谷胱甘肽治疗,将1.2 g 还原型谷胱甘肽(上海复旦复华药业,国药准字H20031265,规格:0.6 g/支)和100 mL生理盐水混合进行静脉滴注,15 min 内完成滴注,1 次/d。观察组患者在对照组基础上加用丹参酮ⅡA,还原型谷胱甘肽的用法用量与对照组相同,将20 mL 丹参酮ⅡA(上海上药第一生化药业,国药准字H31022558,规格:2 mL∶10 mg)和250 mL 葡萄糖混合行静脉滴注,滴注速率40 滴/min,1 次/d。患者均于治疗15 d 后进行疗效评价。
1.3 观察指标①比较两组患者疗效。分为以下几个等级,显效:患者的临床体征及肝损伤症状消失,肝功能恢复至正常范围;有效:患者的临床体征及肝损伤症状有所缓解,肝功能逐渐趋向正常水平;无效:患者的临床体征及肝损伤症状无缓解甚至更严重,肝功能无恢复[5]。总有效率=(总例数-无效例数)/总例数×100%。②比较两组患者肝功能指标水平。抽取患者治疗前后5 mL 空腹肘静脉血,离心(3 000 r/min,10 min),取血清,放置±s表示计量资料,组间和组内比较分别采用独立样本在-20 ℃的环境中待检。采用全自动生化分析仪(迈瑞Mindray,型号:BS-350)对患者肝功能相关指标[碱性磷酸酶(ALP)、谷丙转氨酶(ALT)、谷草转氨酶(AST)及总胆红素(TBIL)]水平进行检测。③比较两组患者外周血T 淋巴细胞水平。采血方式同②,检测T 淋巴细胞水平(包括 CD3+、CD4+、CD8+T 淋巴细胞),计算CD4+/CD8+比值,仪器选用流式细胞检测仪(贝克曼库尔特,型号: CytoFLEX)。
1.4 统计学分析数据纳入SPSS 25.0 系统进行分析。以和配对样本t检验;以[例(%)]表示计数资料,组间比较行χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者疗效比较观察组患者的总有效率高于对照组,差异有统计学意义(P<0.05),见表1。
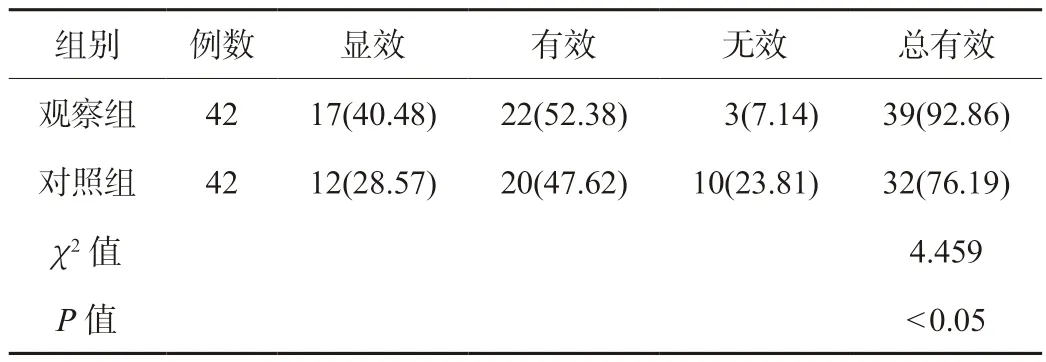
表1 两组患者疗效比较 [例(%)]
2.2 两组患者肝功能指标水平比较治疗前,两组患者肝功能指标(ALP、ALT、AST 及TBIL)水平比较,差异无统计学意义(P>0.05);治疗后,两组患者肝功能指标水平低于治疗前,观察组上述肝功能指标低于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组患者肝功能指标水平比较(±s)
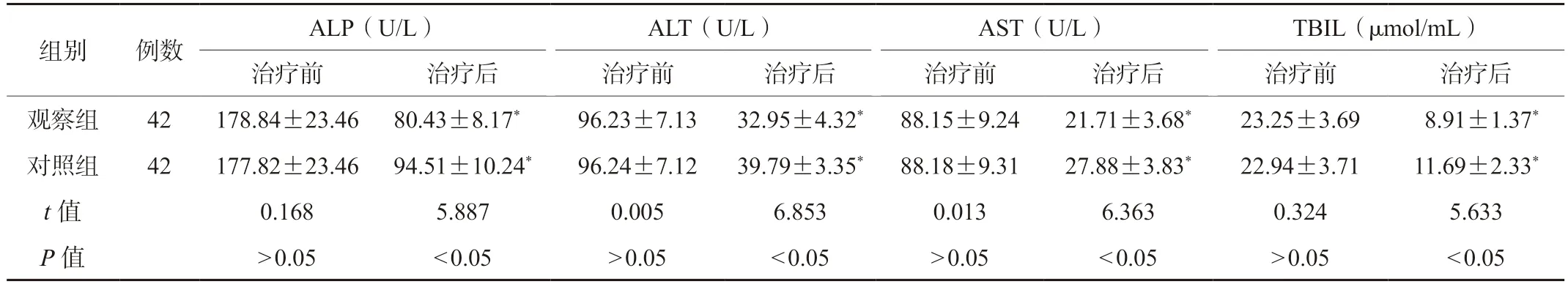
表2 两组患者肝功能指标水平比较(±s)
注:与同组治疗前比较,*P<0.05。ALP:碱性磷酸酶;ALT:谷丙转氨酶;AST:谷草转氨酶;TBIL:总胆红素。
组别 例数 ALP(U/L) ALT(U/L) AST(U/L) TBIL(μmol/mL)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后观察组 42 178.84±23.46 80.43±8.17* 96.23±7.13 32.95±4.32* 88.15±9.24 21.71±3.68* 23.25±3.69 8.91±1.37*对照组 42 177.82±23.46 94.51±10.24* 96.24±7.12 39.79±3.35* 88.18±9.31 27.88±3.83* 22.94±3.71 11.69±2.33*t 值 0.168 5.887 0.005 6.853 0.013 6.363 0.324 5.633 P 值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.3 两组患者外周血T 淋巴细胞百分比比较治疗前,两组患者外周血T 淋巴细胞水平比较,差异无统计学意义(P>0.05);治疗后,两组患者外周血CD3+、CD4+T 淋巴细胞百分比及CD4+/CD8+比值高于治疗前,CD8+T 淋巴细胞百分比低于治疗前,观察组上述免疫指标均优于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组患者外周血T 淋巴细胞水平比较(±s)
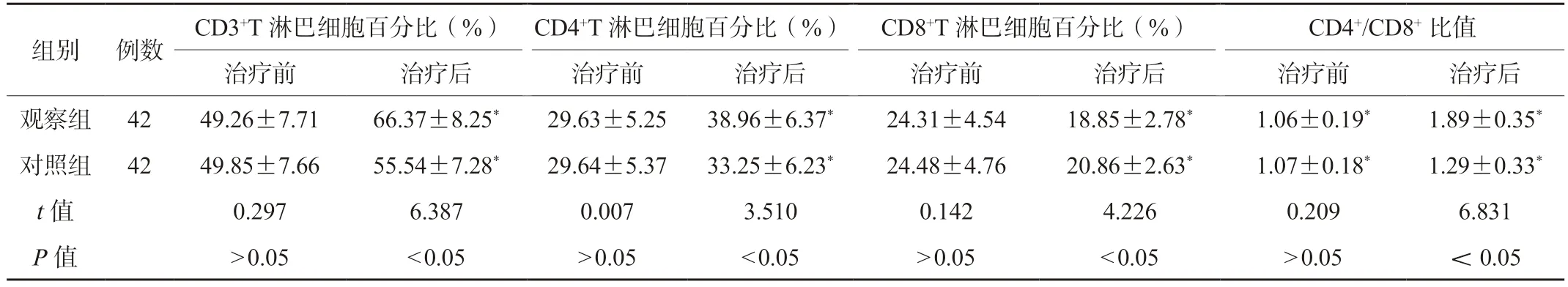
表3 两组患者外周血T 淋巴细胞水平比较(±s)
注:与同组治疗前比较,*P<0.05。
组别 例数 CD3+T 淋巴细胞百分比(%) CD4+T 淋巴细胞百分比(%) CD8+T 淋巴细胞百分比(%) CD4+/CD8+比值治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后观察组 42 49.26±7.71 66.37±8.25* 29.63±5.25 38.96±6.37* 24.31±4.54 18.85±2.78* 1.06±0.19* 1.89±0.35*对照组 42 49.85±7.66 55.54±7.28* 29.64±5.37 33.25±6.23* 24.48±4.76 20.86±2.63* 1.07±0.18* 1.29±0.33*t 值 0.297 6.387 0.007 3.510 0.142 4.226 0.209 6.831 P 值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
3 讨论
临床在抗肿瘤治疗的过程中,对患者进行合理的保肝方案,是确保治疗顺利安全完成的重要措施[6]。在众多的临床药物中,还原型谷胱甘肽是较为常用的一种药物,该药物是由半胱氨酸、谷氨酸及甘氨酸组成,含活性巯基的三肽药物[7-8],在用药后其药物的活性巯基与肿瘤的自由基等毒性物质进行结合[9],进而发挥较高的解毒作用,同时还可以将患者体内游离胆红素载入微粒体,将多余的葡萄糖醛酸酶排出体外[10]。而丹参酮ⅡA 磺酸钠属于心脑血管病中较为常见的一种治疗药物,目前临床治疗中,发现该药物针对肝纤维化及肝损伤也有较好的效果,在进入人体后,可以通过抑制γ 干扰素(IFN-γ)等炎症细胞因子,进而增加T 淋巴细胞的分泌水平,可抑制肝损伤的发生,同时还可提高外周血T 细胞的比例,调节整体的细胞免疫功能[11-12]。因此,丹参酮ⅡA 和还原型谷胱甘肽药物相互作用,共同发挥保肝效果,相对于单一作用下,联合用药的效果更佳[13-14]。
本研究显示,观察组患者的疗效优于对照组;两组患者的ALP、ALT、AST 及 TBIL 水平均低于治疗前,且观察组低于对照组;两组患者的各项免疫指标均优于治疗前,且观察组优于对照组。上述结果充分证实,对于抗肿瘤药致急性肝损伤的患者,采用丹参酮ⅡA 联合还原型谷胱甘肽治疗效果较为理想,可以有效改善患者的肝功能,并有助于改善外周血T 淋巴细胞比例失衡,切实保证患者的健康。但是本研究研究时间较短,患者例数较少,因此还需要进一步的研究。
综上所述,对于抗肿瘤药致急性肝损伤的患者,采用丹参酮Ⅱ A 联合还原型谷胱甘肽治疗效果较为理想,值得临床应用。
