基于微小RNA-142-3p 与细胞毒性T 淋巴细胞相关蛋白4 的 相互作用探讨细胞因子在原因不明反复性流产的作用
2023-03-29刘细红谭素萍张金瑞李辉珍
刘细红,李 丽,谭素萍,张金瑞,李辉珍,李 琪
[中国科学院大学深圳医院(光明)妇科,广东 深圳 518107]
原因不明反复性流产(unexplained recurrent spontaneous abortion,URSA)是指女性与同一性伴侣连续两次及以上发生自然流产,且与染色体、解剖结构、内分泌、自身免疫异常和生殖道疾病等因素无关,是临床上育龄女性常见的妊娠疾病之一[1]。目前在临床上URSA 仍属难治性不孕症,给男女双方造成极大的痛苦,已成为国内外专家共同关注的医学难题。近期,生殖免疫学观点认为,正常胚胎不被母体排斥有赖于母胎界面的免疫耐受,而一旦这种格局被打破将导致URSA 的发生[2]。研究发现,在体内抑制细胞毒性T 淋巴细胞相关蛋白4(CTLA-4)可以解除调节性T 细胞(Treg)介导的移植排斥反应的保护作用,表明CTLA-4 的表达可调节Treg 细胞的功能[3]。另外,微小RNA-142-3p(miR-142-3p)是一种长19~24 核苷酸的短链非编码小RNA,调控树突状细胞及巨噬细胞功能,并与T 细胞异常激活、维持Treg 细胞稳态及免疫抑制功能有关[4]。因此,本研究通过结合临床样本,探究免疫功能失调与URSA 的发病机制相关性,并初步探讨其发病的潜在机制,为临床预防与治疗提供理论参考依据。
1 资料与方法
1.1 一般资料选取2016 年9 月至2017 年12 月中国科学院大学深圳医院(光明)收治的45 例URSA 患者纳入流产组,另选取同期于中国科学院大学深圳医院(光明)进行检查的40 例健康早孕者作为对照组进行回顾性研究。流产组研究对象年龄24~36 岁,平均年龄(29.15±4.29)岁;身高158.39~170.21 cm,平均身高(166.14±5.24)cm;体质量45.83~70.51 kg,平均体质量(64.82±5.76)kg;身体质量指数(BMI)18~25 kg/m2,平均BMI(23.54±2.40)kg/m2;腰围57.38~78.51 cm,平均腰围(63.02±1.77)cm;臀围84.27~108.73 cm,平均臀围(92.43±4.24)cm;腰臀比0.55~0.73,平均腰臀比0.68±0.04。对照组研究对象年龄23~37 岁,平均年龄(28.28±4.75)岁;身高157.46~168.46 cm,平均身高(165.79±8.06)cm;体质量45.27~70.88 kg,平均体质量(62.9±6.61)kg;BMI 18~25 kg/m2,平均BMI(23.04±3.35)kg/m2;腰围55.86~76.33 cm,平均腰围(63.4±1.69)cm;臀围82.75~105.41 cm,平均臀围(92.74±4.37)cm;腰臀比0.57~0.76,平均腰臀比0.69±0.04。本研究经中国科学院大学深圳医院(光明)医学伦理委员会批准。流产组产妇纳入标准:①符合《复发性流产诊治的专家共识》[5]中原因不明反复性流产的诊断标准;②流产在妊娠3 个月内;③自然流产2 次以上;④患者双方无遗传性疾病;⑤内分泌正常、无代谢性疾病;⑥封闭抗体、血小板聚集等生化检测正常;⑦无过敏史。排除标准:①有分泌系统疾病者;②有梅毒等病原微生物生殖道感染者;③临床诊断资料缺失者;④患者出现明显病情变化。对照组产妇纳入标准:①未经任何临床治疗的自然妊娠孕妇;②封闭抗体、血小板聚集、血常规、肝功能等生化检测正常。排除标准:①合并脏器疾病、生殖道感染、生殖道畸形者;②临床诊断资料缺失者;③研究对象出现明显病情变化。
1.2 检测方法
1.2.1 一般临床指标检测 在流产组治疗期间及对照组产检期间,通过询问、测量等手段,对人口学相关资料进行记录登记。
1.2.2 流式细胞术检测外周血CD4+CD25+Treg 细胞 分别采集研究对象清晨空腹静脉血于肝素抗凝管中,加入红细胞裂解液离心、PBS 缓冲液洗涤;严格按照说明书操作,对照管加入FITC 标记山羊抗兔IgG(FITC-IgG)和PE 标记小鼠抗山羊IgG(PE-IgG);实验管加入FITC 标记小鼠抗人CD4(CD4-FITC)和PE 标记小鼠抗人CD25(CD25-PE)(美国R&D 公司),室温避光孵育后,离心(3 500 r/min 转速,时间10 min),取上清液;加入细胞染色缓冲液,采用流式细胞仪(美国BD 公司,型号:BD Accuri C6)检测。
1.2.3 酶联免疫吸附法(ELISA)检测Th1/Th2 型细胞因子 抽取研究对象外周静脉血,离心取上清液。检测γ 干扰素(IFN-γ)、白细胞介素-2(IL-2)、白细胞介素-4(IL-4)、白细胞介素-10(IL-10)水平,按照ELISA 试剂盒说明书进行操作。使用多功能酶标仪(美国Bio-Tek 公司,型号:Synergy H1)测定各孔的吸光值,进一步推断计算各个标本中IFN-γ、IL-2、IL-4、IL-10 的浓度。
1.2.4 荧光素酶检测 培养293T 细胞,取质粒2 µg,野生型(Wild type,WT)/突变型(Mutant type,Mut)psi CHECK2报告载体:miR-142-3p 拟似物(miR-142-3p minic)/miR-142-3p 抑制剂(miR-142-3p inhibitor)=1∶1,与0.5 mL 减血清培养基(opti-MEM)混匀;取5 µL 脂质体200 转染试剂与0.5 mL opti-MEM 混匀;将质粒混合物与转染试剂混合物混匀,静置。将上述混合物均匀滴加到标记好的六孔板中,恒温培养。将培养基吸除,加裂解缓冲液裂解细胞,移入96 孔板;加荧光素酶测定试剂Ⅱ检测荧光值。BLAST 生信分析,在Targetscan 官方网站上(https://www.targetscan.org/vert_80/)基因名称输入CTLA-4,microRNA 名称内输入miR-142-3p,点击提交。检索到603 个保守位点的转录本,搜索到对应CTLA-4 对应的信息,找到miR-142-3p 与CTLA-4 潜在结合的信息。
1.3 观察指标①分析两组研究对象外周血中CD4+CD25+Treg 细胞百分比。②分析两组研究对象外周血中IFN-γ、IL-2、IL-4 及IL-10 细胞因子水平。③分析miR-142-3p 与CTLA-4 的相互作用。④通过BLAST 生信分析检索结果,找到CTLA-4 转录本,明确miR-142-3p与CTLA-4 结合具体信息。
1.4 统计学分析采用SPSS 20.0 统计学软件处理数据。计量资料以±s表示,多组间比较采用单因素方差分析,两两比较采用Dunnett-t法或S-N-K 法。以P<0.05 为差异有统计学意义。
2 结果
2.1 比较两组研究对象外周血中CD4+CD25+Treg 细胞百分比流产组研究对象外周血中CD4+CD25+Treg 细胞百分比[(4.06±1.53)%]显著低于对照组[(7.95±1.13)%],差异有统计学意义(P<0.05),见图1、图2、图3。
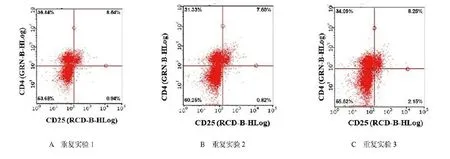
图1 对照组研究对象CD4+CD25+Treg 细胞流式细胞仪检测图

图2 流产组研究对象CD4+CD25+Treg 细胞流式细胞仪检测图
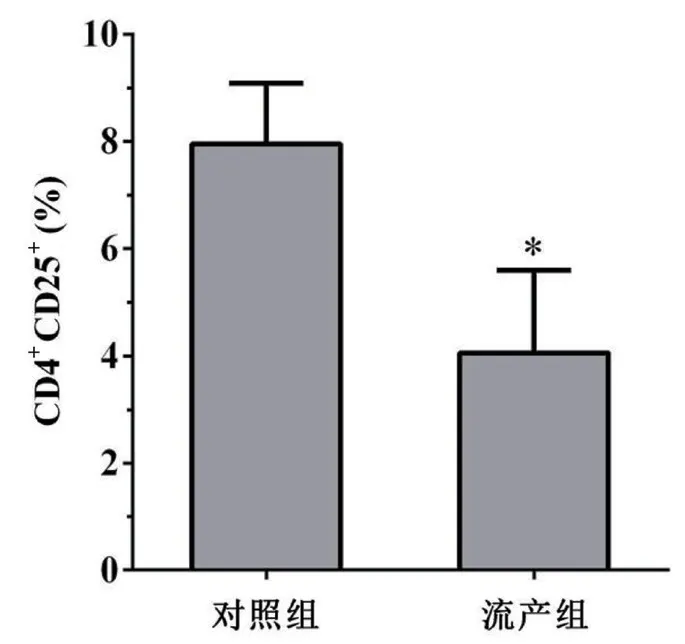
图3 两组研究对象CD4+CD25+Treg 细胞百分比比较
2.2 两组研究对象外周血中IFN-γ、IL-2、IL-4 及IL-10 水平比较流产组研究对象外周血中IL-10 和IL-4 的表达水平低于对照组,而IL-2 和IFN-γ 的表达水平高于对照组,差异有统计学意义(P<0.05);同时,流产组研究对象的IL-2/IL-10、IFN-γ/IL-4 比值分别为(0.96±0.19)和(0.89±0.21),高于对照组(0.43±0.18、0.41±0.15),差异有统计学意义(P<0.05),见表1。
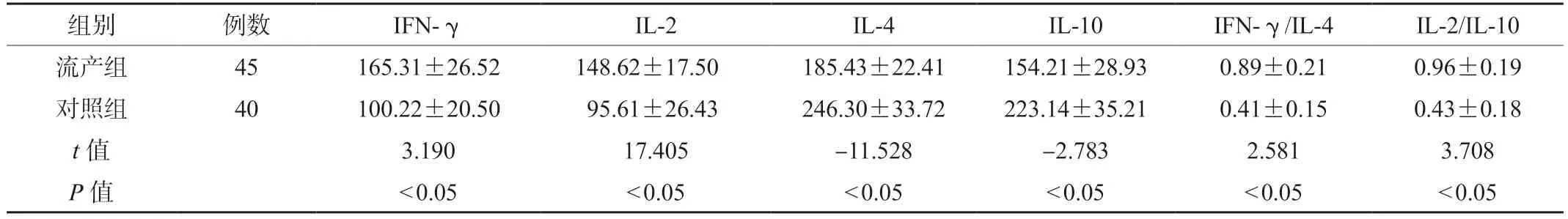
表1 两组研究对象外周血IFN-γ、IL-2、IL-4 及IL-10 水平比较(pg/mL,x)
2.3 miR-142-3 与CTLA-4 相互作用检测通过BLAST生信分析,明确miR-142-3p 与CTLA-4 潜在的结合位点,发现两者有较好的结合能力。同时,进一步通过荧光素酶报告基因检测,结果显示miR-142-3p 与CTLA-4 有较强的结合能力,表明miR-142-3p 对CTLA-4 的表达具有潜在的抑制作用,见图4。
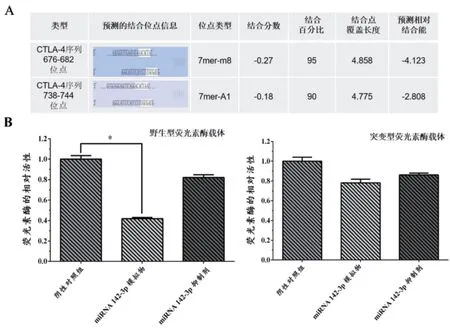
图4 miR-142-3p 与CTLA-4 结合位点和结合能力分析
3 讨论
近年来,随着机体免疫学研究的不断深入,发现URSA与异常的母体系统免疫反应有关,其具体的发病机制尚待进一步研究[6-7]。有研究显示,与正常未孕妇女及URSA 患者相比,正常早孕妇女外周血CD4+CD25+Treg 细胞水平显著升高,表明CD4+CD25+Treg 细胞在维持正常妊娠中扮演重要角色,可能对母胎免疫耐受具有调节作用[8]。研究表明,CD4+CD25+Treg 细胞在细胞免疫功能中发挥极其重要的作用[9]。在器官移植的免疫排斥反应中,CD4+CD25+Treg细胞数量减少,CD4+CD25+T 细胞被激活产生细胞毒性,引起免疫损伤,并协助B 细胞参与抗原-抗体联合反应。在T 细胞受体激活后,Tregs 可抑制CD4+和CD8+T 淋巴细胞细胞中IL-2 基因的转录和表达,以抑制T 细胞的增殖和激活,从而调节免疫耐受[10]。本研究发现,流产组研究对象外周血CD4+CD25+Treg 细胞显著高于对照组,与上述研究结果类似。另外,与正常妊娠组相比,URSA 患者体内Th1 型细胞因子呈递增趋势,而Th2 型细胞因子呈下降趋势,从而导致流产发生,故调节Th1/Th2 的平衡有助于降低URSA 的发生率[11]。本研究结果显示,URSA 患者的外周血细胞因子IL-10 和IL-4 的表达水平均显著低于对照组,而细胞因子IL-2 和IFN-γ 的表达水平高于对照组。
CTLA-4 已被证明是T 细胞功能的负调控因子,参与Th1/Th2 细胞的发育和Treg 细胞的功能,在维持免疫系统内稳态方面的关键作用[12]。研究显示,抗CTLA-4 抗体可增强Th1 型免疫和抑制Treg 细胞活性[13]。同时,许多微小RNA(miRNA)在多种病理病例中直接或间接调节CTLA-4和程序性死亡受体-1/程序性死亡配体-1(PD-1/PD-L1)的表达[14]。
综上所述,miR-142-3p 与CTLA-4 具有较强的结合能力,表明miR-142-3p 对CTLA-4P 的表达具有潜在的抑制作用,这可能是导致URSA 发生的可能机制之一。
