紫甘薯源花青素的抗氧化活性及模拟消化稳定性研究
2023-03-27覃新云农可懿刘智能张海文
■房 鑫 覃新云 农可懿 刘智能 张海文
(海南大学动物科技学院,海南海口 570228)
花青素(anthocyanin)别名花色素,其在植物体中普遍存在,具有水溶性,属于多酚类中的类黄酮类化合物,依据其花色基元2-苯基苯并吡喃母核上羟基化及甲氧基化的键合位置差异可以分为20多种不同类型的花青素,在植物中常见的花青素主要有天竺葵色素、飞燕草色素及牵牛花色素等[1]。在自然条件下,花青素以游离状态存在的情况极少,通常是通过糖苷键与糖类物质结合形成花色苷,或是与芳香酸、脂肪酸等通过酯键以酰基化的形式存在[2]。甘薯又名地瓜,是旋花科植物番薯的地下块根,是一种药食同源的食物,具有白、黄、紫、橘红等多种肉色,紫甘薯因其果肉中花青素含量较多,因而呈紫色。近年国内外学者在紫甘薯中鉴定出的花色苷总数多达37种[3-5]。紫甘薯中花青素种类繁多的原因主要是天竺葵色素、矢车菊色素及芍药色素这三种花青素母体可以通过与葡萄糖等糖类形成花色苷,而部分形成的花色苷又能与香豆酸等芳香族有机酸酰基化[6]。
动物机体在生理代谢时会产生活性氧,正常的情况下,机体自身对氧化与抗氧化的平衡具有一定的维持能力,一旦环境因素的影响超过机体所能调节的最大阈值时,该平衡状态将会被破坏,从而会诱导机体发生氧化应激,进而会对生物膜及蛋白质等造成氧化损伤,最终可使机体产生炎症、衰老、免疫力下降等多种症状[7-8]。通常,外源性补充抗氧化物质可在一定程度上提高机体的抗氧化能力,研究证实,花青素具有多种生物学功能,如抗氧化、抗突变、预防心血管疾病及抗衰老等,在众多的生物学功能中尤其以抗氧化功能最为突出,有研究资料证实花青素的抗氧化效果是维生素C(Vitamin C,VC)的20 倍,是维生素E(Vitamin E,VE)的50倍[9]。紫甘薯是花青素的重要来源之一,当前关于紫甘薯花青素的抗氧化研究主要集中于体外抗氧化指标的测定,而对于消化后的紫甘薯花青素抗氧化活性相关研究资料较少。鉴于此,本研究通过使用胃液和小肠液对紫甘薯源花青素进行体外模拟消化,通过测定模拟胃肠道消化前后花青素的抗氧化活性,研究其在胃肠道消化前后抗氧化活性的变化,并分析其变化原因,以期丰富紫甘薯源花青素抗氧化相关的研究资料,并为与紫甘薯源花青素相关的食品、药品的开发及应用提供一定的理论参考依据。
1 材料与方法
1.1 主要材料与仪器
紫甘薯源花青素(青岛鹏远康华天然产物有限公司);1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl, DPPH)自由基检测试剂盒、2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)[2, 2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS]自由基检测试剂盒、羟自由基(·OH)检测试剂盒(北京索莱宝科技有限公司);铁离子总抗氧化能力(ferric ion reducing antioxidant powor,FRAP)检测试剂盒(碧云天生物技术有限公司);乙酸钠(CH3COONa)、VC(上海麦克林生化科技有限公司);氯化钾(KCl)、碳酸氢钠(NaHCO3)(西陇科学股份有限公司);盐酸(HCl)(国药集团化学试剂有限公司)。
THZ-103B 恒温培养摇床(上海一恒科学仪器有限公司);FlexA-200 酶联免疫分析仪(杭州奥盛仪器有限公司);UV-5100紫外可见分光光度计(上海元析仪器有限公司);5418 R 高速离心机(德国艾本德股份公司);PR223ZHE 电子天平(奥豪斯仪器常州有限公司)。
1.2 总花青素含量测定
1.2.1 缓冲液的制备
分别制备pH为1.0和4.5的缓冲液各100 mL。
pH为1.0的缓冲液:准确称量1.49 g KCl,用去离子水定容至100 mL;使用量筒准确量取1.7 mL HCl溶液,用去离子水定容至100 mL;将制备好的KCl 和HCl溶液以25∶67的比例依次混合,最后滴加KCl溶液调节溶液的pH,使溶液的最终pH为(1.0±0.1)。
pH为4.5的缓冲液:准确称量1.64 g的CH3COONa,用去离子水定容至100 mL,用1.0 mol/L 的HCl 溶液调节CH3COONa溶液的pH调至(4.5±0.1)。
1.2.2 分光光度比色法测定总花青素含量
依据Silva 等[7]中采用的pH 示差法测定紫甘薯源花青素中花青素的含量。准确量取0.100 g紫甘薯源花青素干粉,分别溶于200、300、400 mL去离子水中,振荡、充分溶解并避光冷藏保存。提前20 min预热分光光度计,取0.5 mL紫甘薯源花青素溶液加入至避光的2 mL EP 管中,再分别加入1 mL 不同pH 的缓冲液,充分振荡溶解,22 ℃环境下静置110 min,分别于波长530 nm 及700 nm 处测定溶液吸光度值,并使用去离子水进行调零。计算花青素含量。
式中:A——样本吸光度值;
c——花青素含量(mg/g);
V——提取液体积(mL);
DF——稀释倍数;
M——矢车菊-3-葡萄糖苷分子量(449.2);
ε——矢车菊-3-葡萄糖苷消光系数[26 900 L/(mol·cm)];
m——样品质量(0.100 g);
L——1 cm。
1.2.3 微量比色法测定总花青素含量
依据Rochette 等[8]中采用的pH 示差法测定紫甘薯源花青素中花青素的含量。准确量取0.100 g紫甘薯源花青素干粉,分别溶于300、400、500 mL 去离子水中,振荡充分溶解并避光冷藏保存。取100 μL紫甘薯源花青素溶液添加至96孔板中,再分别加入100 μL不同pH的缓冲液,充分混匀,22 ℃下避光静置60 min后分别用酶标仪在530 nm 和700 nm 处测定吸光度值。计算花青素含量。
式中:Mr——矢车菊-3-葡萄糖苷分子量(449.2 u);
D——稀释倍数(未稀释为1);
V——样本提取液体积(1 mL);
W——样本质量(g);
V1——加样体积(0.1 mL);
V2——检测样品的总体积(2×10-4L)。
1.3 色价测定
色价是指单位质量原料提取物浓度为1%时,透过1 cm 厚比色皿,在其最大吸收峰处的吸光度值。依据肖伟等[9]中的方法测定紫甘薯源花青素中花青素的色价,配制1%的紫甘薯源花青素溶液,添加去离子水进行适量稀释,稀释完成后在370 nm 处测定吸光度值,最后依据公式计算其色价。
式中:E1%1cm——色除值。
A——紫甘薯源花青素的吸光度值;
“那是心理社社员常玩的游戏。”短发女生说,“仔细观察一个人的外表、谈吐、行为举止等等,判断他性格上的特征和心理状态。”
w——紫甘薯源花青素样品的质量;
n——样品稀释的倍数。
1.4 紫甘薯源花青素抗氧化活性测定
1.4.1 DPPH自由基清除能力
依据试剂盒使用说明书,以样本提取液为溶剂配制1、2、3、4 mg/mL 的紫甘薯源花青素溶液,分别在96 孔板中准确加入10 μL不同浓度的花青素溶液,再加入190 μL 的DPPH 工作液,为试验测定组;将DPPH工作液替换成等量的无水乙醇,为对照组;同时将花青素溶液替换成等量样本提取液,为空白组。快速涡旋混匀,在室温下静置30 min,于515 nm处测定样品吸光度值,分别记为A测定、A对照、A空白;等浓度的VC作为阳性对照。计算DPPH自由基清除率。
清除率(%)=[1-(A测定-A对照)/A空白]×100
1.4.2 ABTS自由基清除能力
依据试剂盒使用说明书,以样本提取液为溶剂配制1、2、3、4 mg/mL 的紫甘薯源花青素溶液,分别在96 孔板中准确加入10 μL 不同浓度的紫甘薯源花青素溶液和190 μL ABTS 工作液,充分涡旋混匀,室温下静置6 min,在405 nm 波长测定样品吸光度值,结果记为A测定;用去离子水代替紫甘薯源花青素测吸光度值,结果记为A空白;测定紫甘薯源花青素本身的吸光度值,结果记为A对照。等浓度的VC 作为阳性对照。每组样品重复测定3 次,取平均值。计算ABTS自由基的清除率。
清除率(%)=[1-(A测定-A对照)/A空白]×100
1.4.3·OH清除能力测定
依据试剂盒使用说明书,使用去离子水分别配制1、2、3、4 mg/mL 浓度的紫甘薯源花青素溶液。在2 mL离心管中依次加入250 μL的·OH工作液、50 μL不同浓度的紫甘薯源花青素溶液和50 μL的H2O2,测定吸光度值,结果记为A测定;用去离子水代替紫甘薯源花青素测吸光度值,结果记为A对照;用去离子水代替紫甘薯源花青素和H2O2测吸光度值,结果记为A空白。等浓度的VC作为阳性对照。每组样品重复测定3次,取平均值,计算·OH的清除能力。
清除率(%)=(A测定-A对照)/(A空白-A对照)×100
1.4.4 FRAP总抗氧化能力的测定
依据试剂盒使用说明书,在96 孔板中准确加入180 μL 的FRAP 工作液,检测孔中分别加入5 μL 不同浓度(0.15、0.3、0.6、0.9、1.2 mmol/L)的硫酸亚铁(FeSO4)标准溶液和不同浓度的紫甘薯源花青素溶液,充分吹打混匀,37 ℃下孵育5 min,在593 nm处测定吸光度值。根据不同浓度FeSO4的吸光度建立标准曲线,等浓度的VC作为阳性对照,每组样品重复测定3次,取平均值,用FeSO4的浓度表示样品的总抗氧化能力。
1.5 紫甘薯源花青素体外模拟消化试验及指标测定
称取适量紫甘薯源花青素干粉,充分溶解于20 mL胃液中,涡旋混匀,使花青素终浓度分别为0.4 mg/mL和4 mg/mL(根据前期抗氧化活性检测结果确定消化试验花青素浓度),避光保存。将离心管置于装有37 ℃温水的烧杯中固定,在37 ℃恒温摇床(150 r/min)中进行孵育模拟胃部消化。孵育2 h后通过向胃液混合物中滴加0.5 mol/L 的碳酸氢钠(NaHCO3)溶液将pH 调至6.62 左右,取10 mL 胃液混合物,加入10 mL小肠液充分混匀,继续水浴振荡孵育2 h。分别在孵育0.5、1、2、3、4 h 时取样,进行-20 ℃10 min 及4 ℃20 min冷却灭活处理。所有样品在4 ℃下1 500 r/min离心5 min,收集上清液并于4 ℃保存。每个浓度样品平行处理3次。
依据Rochette 等[8]中的pH示差微量法,对体外模拟胃肠道消化后的紫甘薯源花青素含量进行测定。同时测定0.4 mg/mL 紫甘薯源花青素消化后的FRAP总抗氧化能力和4 mg/mL消化后的·OH清除能力。
1.6 数据分析
试验所得数据的分析及呈现均基于Excel 2010及Graph Pad Prism 8.0.2,P<0.05 以*表示,含义为差异显著,P<0.01以**表示,含义为差异极显著,试验结果均表示为“平均值±标准差”。
2 结果与分析
2.1 紫甘薯源花青素的总花青素含量及色价
通过比色法测定紫甘薯源花青素中的总花青素含量,结果为187.21 mg/g;通过微量法测定紫甘薯源花青素中的总花青素含量,结果为184.29 mg/g。由于微量法误差较小,后续试验以微量法测定所得结果作为标准。测定并计算紫甘薯源花青素的色价,结果为51.16。
2.2 紫甘薯源花青素的DPPH自由基清除能力
DPPH 自由基清除率见图1,在试验所选取的浓度范围内,紫甘薯源花青素的DPPH自由基清除能力与浓度有关,花青素的浓度越大,相应的清除率也越高。与VC 组相比,其整体清除能力略微优于VC,仅有浓度为2.0 mg/mL 的紫甘薯源花青素的DPPH自由基清除能力显著强于等浓度的VC(P<0.05),而其他浓度的紫甘薯源花青素与VC间DPPH自由基清除能力差异不显著(P>0.05)。经Graph Pad Prism 8.0.2软件统计分析,得出紫甘薯源花青素清除DPPH自由基的半抑制浓度(half maximal inhibitory concentration,IC50)数值为0.73 mg/mL。

图1 紫甘薯源花青素的DPPH自由基清除能力
2.3 紫甘薯源花青素的ABTS自由基清除能力
ABTS自由基清除率见图2,在试验所选取的浓度范围内,紫甘薯源花青素的ABTS 自由基清除能力与浓度有关,浓度越大清除率越高,与VC 组相比,其总体ABTS 自由基清除能力优于同浓度的VC 溶液,其中0.1、0.2、0.4、0.8 mg/mL 的紫甘薯源花青素的ABTS自由基清除能力极显著强于对应等浓度的VC(P<0.01),而0.6 mg/mL的紫甘薯源花青素的ABTS自由基清除能力则极显著强于对应等浓度的VC(P<0.01)。经Graph Pad Prism 8.0.2软件统计分析得出,紫甘薯源花青素清除ABTS自由基的IC50数值为0.16 mg/mL。
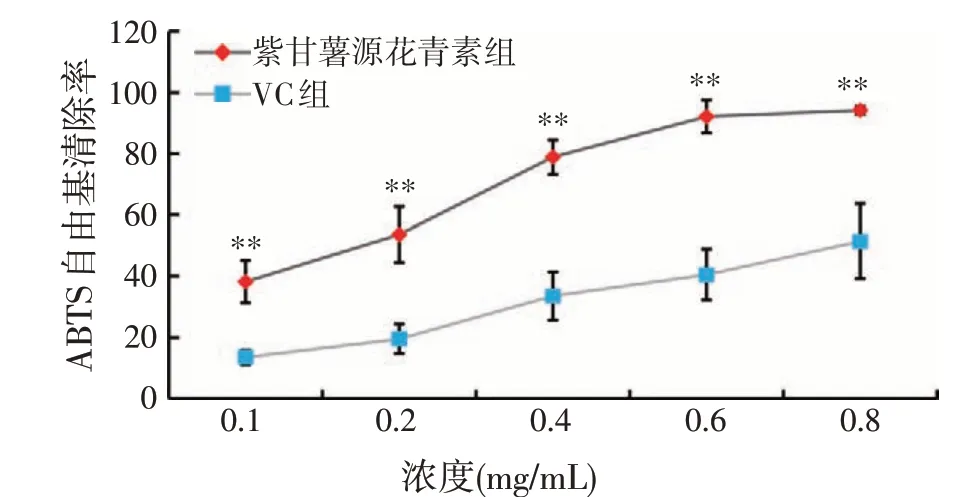
图2 紫甘薯源花青素的ABTS自由基清除能力
2.4 紫甘薯源花青素的·OH清除能力
·OH 清除率见图3,在试验所选取的范围内,紫甘薯源花青素的·OH 清除能力与浓度具有明显的正相关关系,紫甘薯源花青素浓度越大,对应的·OH 清除能力也越强。本试验中花青素浓度为4 mg/mL时,·OH清除率最高为139.01%。而VC组的·OH清除能力与浓度无明显相关性,清除率一直处于较低的水平。浓度为1 mg/mL时,VC组的·OH清除能力极显著强于紫甘薯源花青素(P<0.01),当浓度为2、3 mg/mL时,紫甘薯源花青素的·OH 清除能力则极显著强于等浓度的VC(P<0.01),浓度为4 mg/mL 时,紫甘薯源花青素的·OH 清除能力极显著强于等浓度的VC(P<0.01)。通过Graph Pad Prism 8.0.2 软件计算得出,紫甘薯源花青素清除·OH的IC50为2.47 mg/mL。
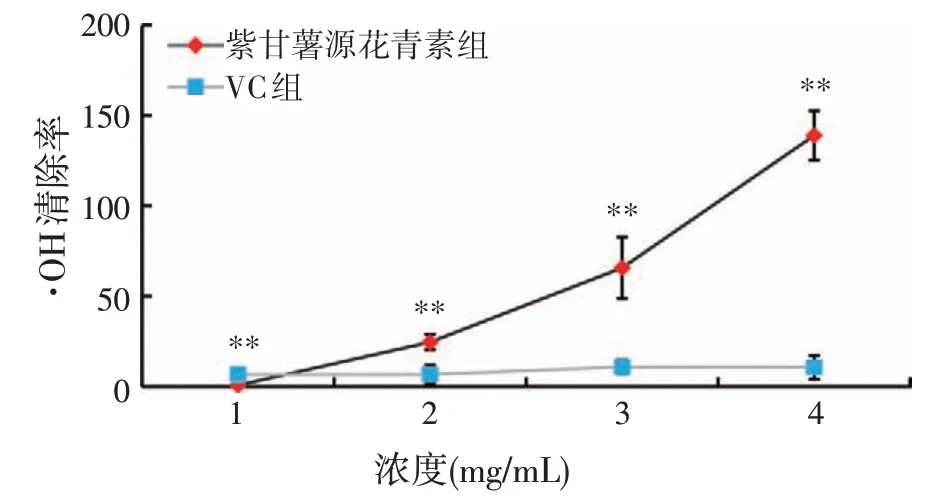
图3 紫甘薯源花青素的·OH清除能力
2.5 紫甘薯源花青素的FRAP总抗氧化能力
FRAP 总抗氧化能力见图4,紫甘薯源花青素的FRAP总抗氧化能力的趋势与VC相似,两种物质的总抗氧化能力与浓度具有一定的线性关系,即浓度越高总抗氧化能力也越强。在本试验所选取的浓度范围内,紫甘薯源花青素的FRAP 总抗氧化能力均极显著强于等浓度的阳性对照VC(P<0.01)。通过Graph Pad Prism 8.0.2软件计算得出,紫甘薯源花青素FRAP总抗氧化能力的IC50为0.11 mg/mL。

图4 紫甘薯源花青素的FRAP总抗氧化能力
2.6 紫甘薯源花青素模拟胃肠道消化稳定性
2.6.1 紫甘薯源花青素模拟消化后的总花青素含量用pH示差法测定消化后紫甘薯源总花青素的含量,结果见图5。消化0.5~1.0 h紫甘薯源总花青素含量相较于消化前极显著增高(P<0.01),消化0.5 h 总花青素含量最高,为233.99 mg/g,极显著高于消化前的185.10 mg/g(P<0.01),消化2.0 h 总花青素含量显著高于消化前(P<0.05)。消化2.0~4.0 h 总花青素含量逐渐降低,在消化4.0 h时,总花青素含量显著低于消化前(P<0.05),为145.17 mg/g。
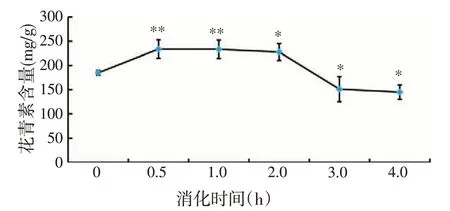
图5 紫甘薯源花青素模拟消化后的总花青素含量
2.6.2 紫甘薯源花青素模拟胃肠道消化后的·OH 清除能力
消化后的紫甘薯源花青素·OH 清除能力测定结果见图6,消化后花青素的·OH 清除能力与总花青素含量变化趋势相似。在模拟消化前4 mg/mL 的紫甘薯源花青素的平均自由基清除率为139.01%,在消化0.5 h,花青素·OH 清除能力出现峰值,清除率为318.85%,极显著高于消化前花青素的·OH 清除能力(P<0.01)。在消化0.5~2.0 h,花青素的·OH清除能力均极显著高于消化前的·OH清除能力(P<0.01),然而在消化2.0~3.0 h 花青素的·OH 清除能力迅速减弱,3.0~4.0 h 花青素的·OH 清除能力极显著低于未模拟消化时的·OH清除能力(P<0.01)。

图6 紫甘薯源花青素模拟消化后的·OH清除能力
2.6.3 紫甘薯源花青素模拟胃肠道消化后的FRAP总抗氧化能力
消化后的紫甘薯源花青素FRAP 总抗氧化能力测定结果见图7,消化0~2.0 h,0.4 mg/mL 的紫甘薯源花青素在模拟胃肠道消化前后FRAP 总抗氧化能力无显著差异。消化0 h 时FRAP 抗氧化能力为1.20 mmol/L FeSO4,消化2.0 h花青素的FRAP 抗氧化能力出现最高值为1.23 mmol/L FeSO4。与花青素模拟消化后·OH清除能力的变化趋势相似,在消化2.0~3.0 h,花青素的FRAP 抗氧化能力迅速减弱,消化3.0~4.0 h 花青素的FRAP 抗氧化能力极显著低于模拟消化前(P<0.01)。

图7 紫甘薯源花青素模拟胃肠道消化后的FRAP总抗氧化能力
3 讨论
3.1 紫甘薯源花青素的抗氧化活性
本试验证实了紫甘薯源花青素具有较强的清除·OH、ABTS、DPPH自由基的能力以及FRAP总抗氧化能力,且与浓度成正比。DPPH、ABTS和FRAP的自由基清除原理是基于单电子转移,并且由于花青素及花色苷的特殊结构,花青素重要的抗氧化机制之一是电子转移[10]。本试验中紫甘薯源花青素显示的高FRAP总抗氧化能力也表明了花青素有较强的提供电子的能力。
总体而言,紫甘薯源花青素的抗氧化活性优于等浓度的VC,且通过·OH清除能力试验可知,紫甘薯源花青素的抗氧化性能更全面,其原因极有可能是因为紫甘薯源花青素本身为混合物,花青素通常以糖苷形式存在于植物中,形式结构多种多样,因而使其具有更加全面的抗氧化活性[11]。以上结果与姜平平[12]研究紫甘薯源花青素抗氧化能力得出的结论(紫甘薯源花青素具有较好的还原能力及·OH清除能力,且其抗氧化活性与浓度呈正相关)及卢柏山等[13]研究鲜食玉米中花青素的抗氧化活性时得出的结果一致。
3.2 体外模拟胃肠道消化后紫甘薯源花青素的抗氧化能力
为了解胃肠道消化对紫甘薯源花青素抗氧化活性的影响,通过体外模拟胃肠道消化试验测定不同消化时间紫甘薯源总花青素含量,同时选取了花青素类物质两种具有代表性的抗氧化活性指标——·OH 清除能力及FRAP 总抗氧化能力对消化后花青素的抗氧化活性进行检测。结果显示,经模拟胃肠道消化后的紫甘薯源总花青素含量先增高后降低,且在模拟消化0.5~2.0 h,紫甘薯源花青素的含量均显著高于消化前,随着消化时间的增加含量逐渐降低。消化后紫甘薯源花青素的·OH 清除能力和FRAP 总抗氧化能力变化趋势与紫甘薯源花青素在不同检测点的含量有相似的趋势。这一结果表明在胃消化阶段,花青素稳定性较高,并且可能在胃消化阶段部分花青素被消化降解生成更具有生物活性的小分子,从而引起抗氧化活性的增强。相比之下在肠消化阶段,紫薯源花青素稳定性显著降低,可能是由于花青素进一步被消化分解,并且肠液较高的pH 环境对花青素结构产生了一定影响。
众多研究证实,在模拟胃肠道消化后,物质中的总酚(TPC)及总黄酮(TFC)含量会上升,如Chan 等[14]研究发现,在胃肠道pH 条件下红薯粉中的TPC 含量升高了2 倍,而TFC 则升高了10 倍;李贻等[15]研究发现,刺梨在模拟胃肠道消化后其多酚、黄酮化合物含量及其DPPH 自由基清除能力等均有明显的上升趋势,表明模拟胃肠道消化能促进刺梨中抗氧化成分的释放并使其抗氧化活性提升;Liyana-Pathirana 等[16]在研究受胃pH条件影响下的商品软硬小麦的抗氧化活性时也得出类似的结果。Correa-Betanzo 等[17]发现蓝莓提取物总花青素含量不受胃消化影响,肠道消化后只有83%。胃肠道不同部位的pH变化引起的结构和功能特性的改变,可能会影响酚类物质的作用,从而影响生物功效[14]。而花青素归属于酚类化合物中的类黄酮化合物,其极有可能在模拟胃肠道消化的过程中,随着环境条件的改变引起了部分花青素结构的改变。研究表明,花青素在肠道消化过程中,可能会被消化降解为更具有生物活性、分子量更小的代谢物[18]。此外,抗氧化剂通常可分为两类,一类是一级抗氧化剂,其在抗氧化过程中起主要作用,因而又称主抗氧化剂;另一类是二级抗氧化剂,其在抗氧化的过程中起次要作用,所以又称辅助抗氧化剂。然而在众多的抗氧化剂中,多酚类化合物极其特殊,其可以在发挥抗氧化作用的过程中同时扮演两种角色,来发挥其抗氧化效果[14,19]。因此,本研究中模拟胃肠道消化后总花青素含量提高及·OH清除能力显著提升的原因极有可能是部分花青素在模拟的胃肠道环境中结构发生了变化,进而对·OH清除能力产生了影响,但随着模拟消化时间的延长,花青素也进一步被分解代谢,最终的结果是花青素的抗氧化活性随消化时间的延长而逐渐降低,具体的机制仍有待进一步探究。
4 结论
综上所述,紫甘薯源花青素呈现出较好的抗氧化活性,在模拟胃肠消化试验中具有一定的稳定性。在胃消化过程中(0~2.0 h)总花青素含量和抗氧化活性显著增加,随着消化时间延长,在肠消化过程中(2.0~4.0 h),花青素进一步被消化分解,总花青素含量和抗氧化活性相比消化前显著降低。本研究结果为紫甘薯源花青素的抗氧化活性和消化稳定性提供了一定的理论依据,但具体的机制仍有待后续进一步探究。
