一个水稻脆秆突变体bc21的鉴定和基因定位
2023-03-23戴文慧张小芳吕沈阳项显波陈宇杰朱世华丁沃娜
戴文慧 朱 琪 张小芳 吕沈阳 项显波 马 涛 陈宇杰 朱世华 丁沃娜,*
研究简报
一个水稻脆秆突变体的鉴定和基因定位
戴文慧1,2朱 琪1,2张小芳1,2吕沈阳1项显波3马 涛1陈宇杰1朱世华1丁沃娜1,*
1宁波大学科学技术学院, 浙江宁波 315212;2宁波大学海洋学院, 浙江宁波 315211;3平阳县市场监督管理局, 浙江温州 325400
利用甲基磺酸乙酯(EMS)诱变籼稻Kasalath获得一个脆秆突变体。表型分析发现, 该突变体的茎秆及叶片均易折断, 且该脆性表型在苗期开始表现, 至成熟期时最显著。茎秆机械强度分析表明,茎秆的抗折力、拉伸力显著下降。树脂切片及扫描电镜观察发现,茎秆的厚壁组织细胞空隙增多, 细胞壁明显变薄。茎秆细胞壁组分含量分析表明, 与野生型相比,的纤维素含量降低36.60%, 半纤维素和木质素含量分别升高23.08%和26.06%。经遗传分析得出,的脆性性状由隐性单基因控制。利用SSR标记和自行设计的STS标记将基因定位于水稻第6号染色体STS标记STS2和STS3之间约52.9 kb的范围内, 该区间内没有已报道的水稻脆性相关基因, 表明可能是1个新的水稻脆秆基因, 为进一步揭示水稻茎秆机械强度的调控机制提供了材料支撑。
水稻; 脆秆突变体; 细胞壁; 纤维素; 基因定位
茎秆的机械强度是决定植株抗倒伏能力的首要因素, 水稻生长发育期间发生倒伏不仅影响产量还会降低稻谷品质, 甚至引起植株死亡[1]。水稻中常会发生脆性突变引起茎秆的机械强度降低, 发生突变的植株一方面表现出茎秆厚壁组织细胞壁变薄, 另一方面植株细胞壁中的成分占比会发生改变[2]。挖掘和鉴定新的脆性突变体, 不仅有助于更深层次地解析茎秆强度的调控机制, 还能为培育抗倒伏植株方面的相关研究提供材料支撑。
目前, 已发现20个以bc (brittle culm)命名的水稻脆性突变体:~、~、, 其中12个基因已被克隆。、、、、都编码植物纤维素合酶催化亚基, 直接参与细胞壁合成。、和为等位基因, 位于9号染色体上, 编码纤维素合成酶催化亚基OsCesA9[3-5]。和为等位基因, 位于第1染色体上, 编码纤维素合成酶催化亚基OsCesA4[6-7]。、、、、、和间接参与细胞壁合成。其中位于3号染色体, 编码类COBRA蛋白, 其在根、茎、叶中均有表达, 调控细胞壁纤维素的沉积[8]。位于2号染色体, 编码1个动力蛋白OsDRP2B, 该蛋白对次级细胞壁合成至关重要[9]。位于5号染色体, 编码II型膜蛋白, 该蛋白定位于高尔基体中, 作为一种糖基转移酶参与纤维素的合成[10]。位于9号染色体, 编码一种与细胞周期相关的驱动蛋白,突变导致茎秆的细胞数量减少, 厚壁组织结构改变[11]。位于2号染色体, 编码核糖转运蛋白OsNST1, 参与细胞壁多糖的合成[12]。位于9号染色体, 编码膜相关的类几丁质酶蛋白, 介导纤维素的生物合成[13]。位于5号染色体, 编码氧-乙酰化转移酶, 使蛋白正确定位到细胞膜和细胞壁上[14]。
本实验室利用甲基磺酸乙酯(EMS)诱变籼稻Kasalath,筛选其后代表型, 发现一个茎秆和叶片均易折断的突变体。一方面对突变体茎秆进行机械强度测定、细胞学观察及细胞壁组分含量测定, 分析茎秆产生的原因; 另一方面对突变体进行遗传分析和基因定位, 为进一步克隆基因和揭示水稻茎秆机械强度调控的遗传机制提供理论依据。
1 材料与方法
1.1 试验材料
以EMS诱变籼稻Kasalath, 获得一个脆秆突变体, 将其连续多代自交得到纯合体。将纯合体与粳稻Nipponbare杂交, 根据F1和F2代群体表型进行遗传分析, 并构建F2代群体用于基因定位。
1.2 表型观察
选择谷粒饱满的籼稻Kasalath及突变体的种子, 经0.6%稀硝酸溶液避光过夜处理后, 放进37℃恒温箱中萌发。先根据种子数量制作相应大小的尼龙网纱板, 再配制水稻培养液, 调pH至5.5左右, 将尼龙网纱板置于水稻培养液上, 用镊子夹取露白的种子于尼龙网纱上。人工气候室设置参数为: 白天30℃、夜间22℃、光照12 h。观察水稻全生育期表型, 在成熟期, 利用手工折断法观察野生型及突变体同一部位茎秆与叶片的折断情况, 并照相记录。
1.3 茎秆机械强度测定
1.3.1 茎秆抗折力的测定 在成熟期, 剪取第2节间的野生型及突变体茎秆, 剪成10 cm, 放置在相距7.5 cm的支架上, 测量时将茎秆与地面平行, 将数显式推拉力计置于茎秆中部位置, 垂直向下移动至茎秆折断, 读取施压力的峰值, 测定3次重复[15]。
1.3.2 茎秆拉伸力的测定 取成熟期突变体和野生型的第2节间茎秆各10个, 长度统一剪成10 cm, 茎秆垂直于地面, 用万能力学试验机夹住茎秆两端, 设置参数为:= 0.05 g m–2、夹距 = 50 mm、速度= 10 mm min–1、断裂值= 255 (0.1 N), 在显示器上读取数值, 记录数据[16]。
1.4 细胞学观察
1.4.1 树脂切片观察 在成熟期, 剪取突变体茎秆, 同一节间的野生型茎秆作为对照, 用刀片垂直切成3~5 mm的小段, 快速夹进2.5%戊二醛(0.2 mol L–1磷酸缓冲液配制)中固定, 4℃中放置48 h后, 再将样品浸入1%锇酸(0.2 mol L–1磷酸缓冲液配制)固定12~16 h。将固定后的样品取出, 用0.08 mol L–1磷酸缓冲液(pH 7.2)漂洗3次, 每次置于摇床上摇15 min。充分漂洗后用10%、20%、40%、60%和80%的乙醇梯度各处理30 min脱水, 再用100%乙醇处理2次各30 min, 100%丙酮处理2次各5 min, 均在摇床上完成。脱水后的样品用丙酮树脂体积比为2∶1、1∶1和1∶2依次进行渗透, 再用纯树脂渗透过夜, 最后将各个样品包埋于PCR管中, 70℃恒温箱中聚合。用半超薄切片机对组织进行切片, 样片置于0.1%硼沙甲苯胺蓝染液中染色, 蒸馏水清洗掉样片表面浮色后, 置于烤片机上烘干水分, 最后在显微镜下观察照相[10]。
1.4.2 扫描电镜观察 样品固定及脱水步骤同树脂切片, 脱水后的茎段经烘干后垂直放置于贴有导电胶的样品台上, 将样品台放进离子溅射仪中喷金60 s, 使茎秆横切面均匀喷上金粉, 最后用扫描电镜观察照相[17]。
1.5 细胞壁组分含量测定
取田间栽培成熟期的野生型及突变体茎秆, 剪下相同节间, 将叶鞘剥离, 放入干净的封口袋中, 每个材料测定3次重复。将样品寄送苏州格锐思生物科技有限公司, 测定茎秆细胞壁中纤维素、半纤维素及木质素的含量, 并进行结果分析。
1.6 遗传分析与定位群体的构建
将纯合体与粳稻Nipponbare进行人工杂交, 在成熟期用人工折断的方式判断F1代植株脆性, 分析基因显隐性。将F1代个体自交获得F2代群体, 鉴定F2代群体表型, 选择具有脆性表型的群体用于基因定位。在F2代长到成熟阶段, 分别记录下野生型和突变体表型个体的数量, 并对其进行连续性卡方分析, 以判断脆秆表型是否由单基因控制, 最终确定其遗传模式。
1.7 突变基因的定位分析
按照突变体表型筛选出30个F2代脆秆突变体, 分别提取基因组DNA, 等量混合成1管, 作为突变基因池。用SSR (simple sequence repeat)标记同时对突变基因池、亲本(Nipponbare和Kasalath)和F1的DNA进行PCR扩增, PCR产物进行聚丙烯酰胺凝胶电泳, 进一步确定连锁关系。在粗定位的基础上, 扩大样品数, 并将每3株突变体打包处理, 混合抽提DNA。在定位区间内通过Nipponbare和籼稻9311全基因组序列比对, 在有差异的两侧发展新标记, 筛选出亲本条带间有差异的STS (sequence-tagged site)标记进行的进一步定位。通过水稻基因组注释网站(http://rice.plantbiology.msu.edu/)分析该区间内的候选基因。
2 结果与分析
2.1 bc21的表型特征
在成熟期通过手工折断野生型与突变体相同位置的茎秆与叶片发现, 野生型水稻的茎秆和叶片只有折痕而没有断裂, 而突变体的茎秆与叶片均易被折断, 且断裂口清晰, 说明突变体的茎秆与叶片的脆性大于野生型, 其机械强度发生改变(图1)。
2.2 bc21茎秆机械强度分析
在成熟期测定野生型及突变体茎秆的抗折力和拉伸力。结果表明,茎秆第2节间的抗折力为0.61 N, 与野生型同一节间的抗折力相比有显著性差异,茎秆抗折力仅为野生型的31.44%, 这与两者茎秆手工折断的结果相符(图2-A)。相似的是, 第2节间突变体的拉伸力相对于野生型也降低了81.44%, 达到极显著水平(图2-B)。因此, 脆性突变显著降低了的机械强度。

图1 成熟期野生型与突变体bc21茎秆及叶片的折断表型
A: 茎秆折断表型; B: 叶片折断表型。
A: the broken phenotypes of stems; B: the broken phenotypes of leaves. WT: Kasalath;:.
2.3 bc21的细胞学观察
植物机械强度的降低通常是由于细胞壁结构的改变所致, 因此利用光学显微镜和扫描电镜观察了野生型和茎秆的细胞壁结构。在光学显微镜下,的厚壁组织的细胞空隙增多, 细胞壁厚度明显变薄(图3-A, B); 在扫描电镜下,的厚壁组织呈中空的网状结构, 且厚壁组织的细胞壁厚度相对于野生型也明显变薄(图3-C, D)。
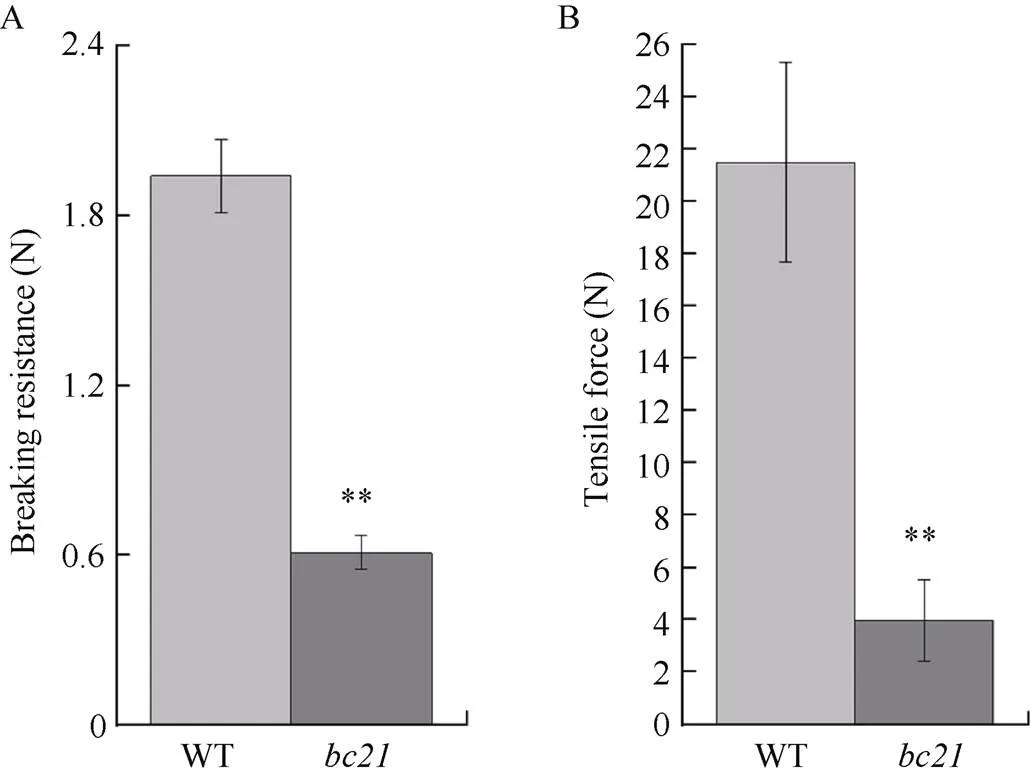
图2 野生型与突变体bc21茎秆第2节间抗折力(A)与拉伸力(B)分析
*表示显著差异(< 0.05); **表示极显著差异(< 0.01)。
* represents significant difference at the 0.05 probability level; **represents significant differences at the 0.01 probability level. WT:Kasalath;:.
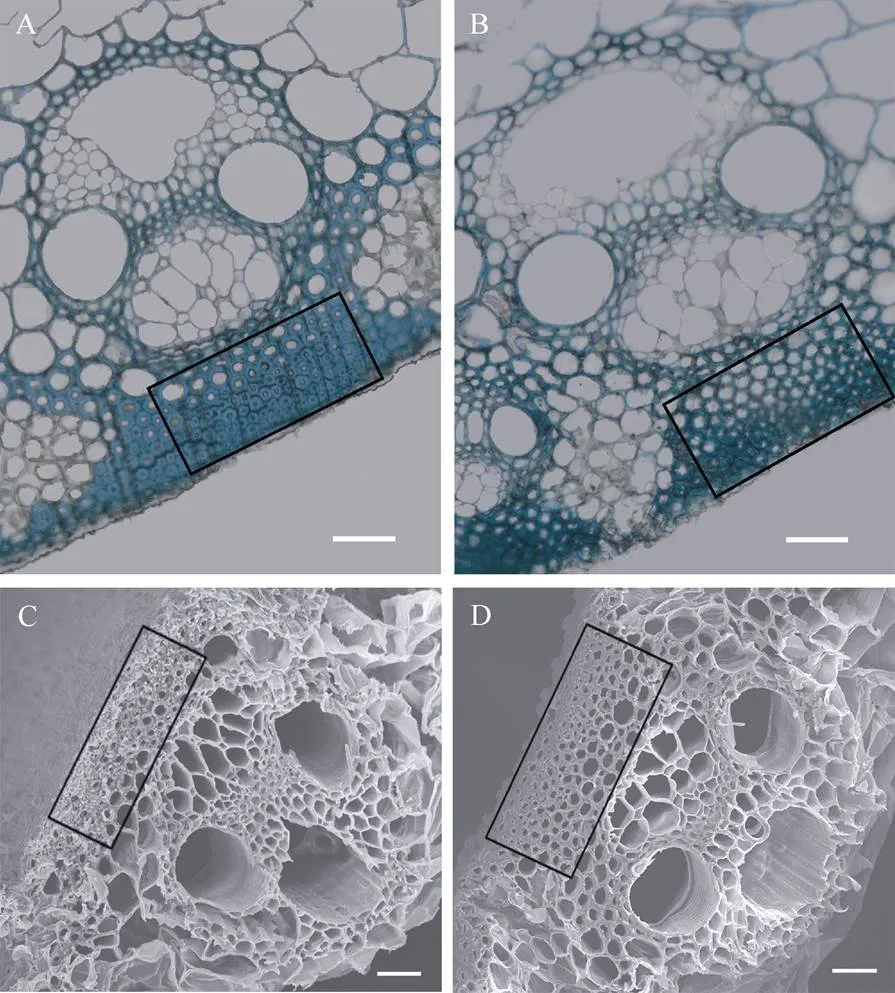
图3 野生型与突变体bc21的茎秆横截面观察
A: 野生型茎秆横切面树脂切片观察; B:茎秆横切面树脂切片观察; C: 野生型茎秆横切面扫描电镜观察; D:茎秆横切面扫描电镜观察; 标尺: 100mm (A和B)、20mm (C和D)。
A: the observation on resin slices of wild type stem cross section (bar:100mm); B: the observation on resin slices ofstem cross section (bar: 100mm); C: the scanning electron microscope observation of wild type stem cross section (bar: 20mm); D: the scanning electron microscope observation ofstem cross section (bar: 20mm).
2.4 bc21细胞壁组分含量分析
为了分析茎秆细胞壁变薄的原因, 测定了野生型和茎秆的细胞壁中主要成分的含量。结果表明,每克茎秆中含有纤维素73.56 mg, 野生型含115.96 mg, 相比野生型,降低了36.56%, 达到显著水平, 而的半纤维素与木质素含量分别升高了23.08%和26.06% (图4)。
2.5 突变体bc21的遗传分析
将脆秆突变体与粳稻Nipponbare正反交得到F1, F1代表型正常, 说明脆秆表型受隐性核基因控制。209株F2个体出现表型分离, 正常表型为169株, 脆秆表型为40株, 呈现典型的3∶1的分离比, 表明的脆秆特性符合1对隐性基因控制的遗传方式。
2.6 BC21的基因定位
对基因进行定位, 便于解析突变体表型的分子机制。先利用均匀分布在水稻12条染色体上的98对具多态性的SSR标记进行初步定位, 将基因定位到第6号染色体上的RM6734和RM253之间。之后扩大群体并发展新标记(表1), 最终将基因锁定在STS2和STS3之间的一个52.9 kb区域(图5)。在该定位区间内有8个预测基因(表2), 其中没有已报道的水稻脆性相关基因, 因此推测该基因为一个新的水稻脆秆基因。
3 讨论
在已发现的水稻脆秆突变体中, 多数都表现为全生育期整株脆性, 少数在抽穗后才出现脆性或只有茎秆节点才表现脆性, Aohara等[18]检测了水稻植株不同部位由突变引起的脆性表型, 发现只在茎秆节点上表现脆性且在抽穗后脆性表型更显著。Wang等[19]也发现一种仅茎秆节点有脆性的突变体(), 并且脆性节点表型在抽穗后出现, 随着植株的成熟更加明显。本研究发现的脆秆突变体是全生育期都呈现脆性, 其茎秆及叶片均易折断, 且该脆性表型在苗期开始表现, 至成熟期时最显著。并且与野生型相比,茎秆第2间的抗折力和拉伸力分别减小了68.56%和81.44%, 说明脆性性状极大地降低了它的机械强度。
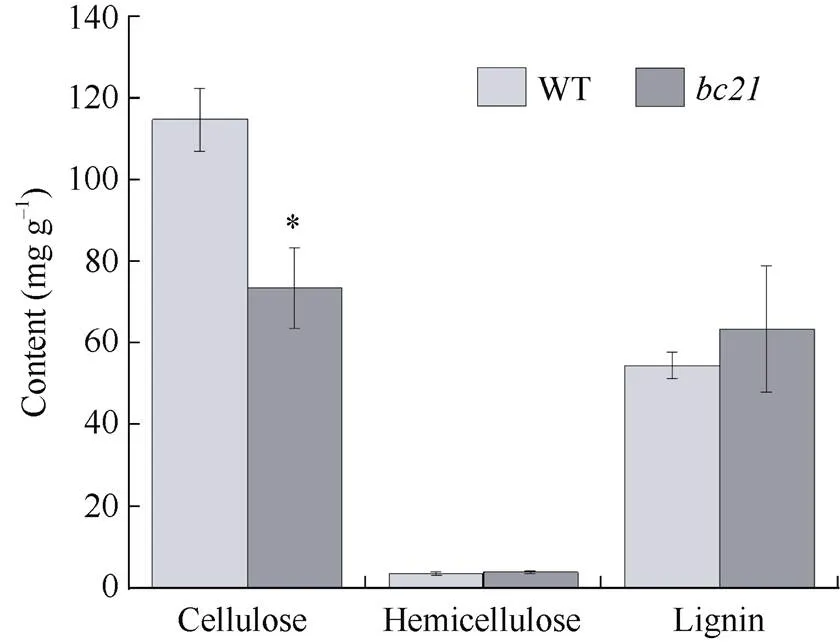
图4 野生型与突变体bc21茎秆纤维素、半纤维素和木质素含量
*表示显著差异(< 0.05)。
* represents significant differences at the 0.05 probability level.
WT: Kasalath;:.
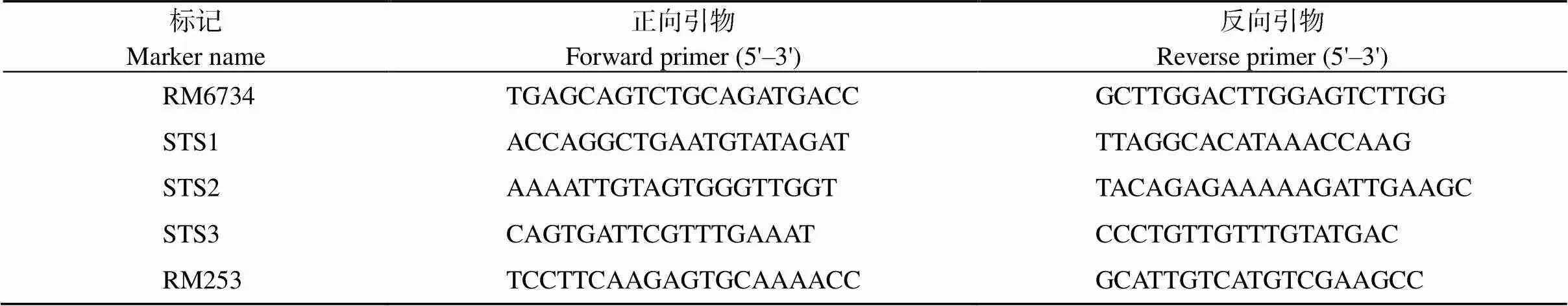
表1 用于定位的SSR及STS标记
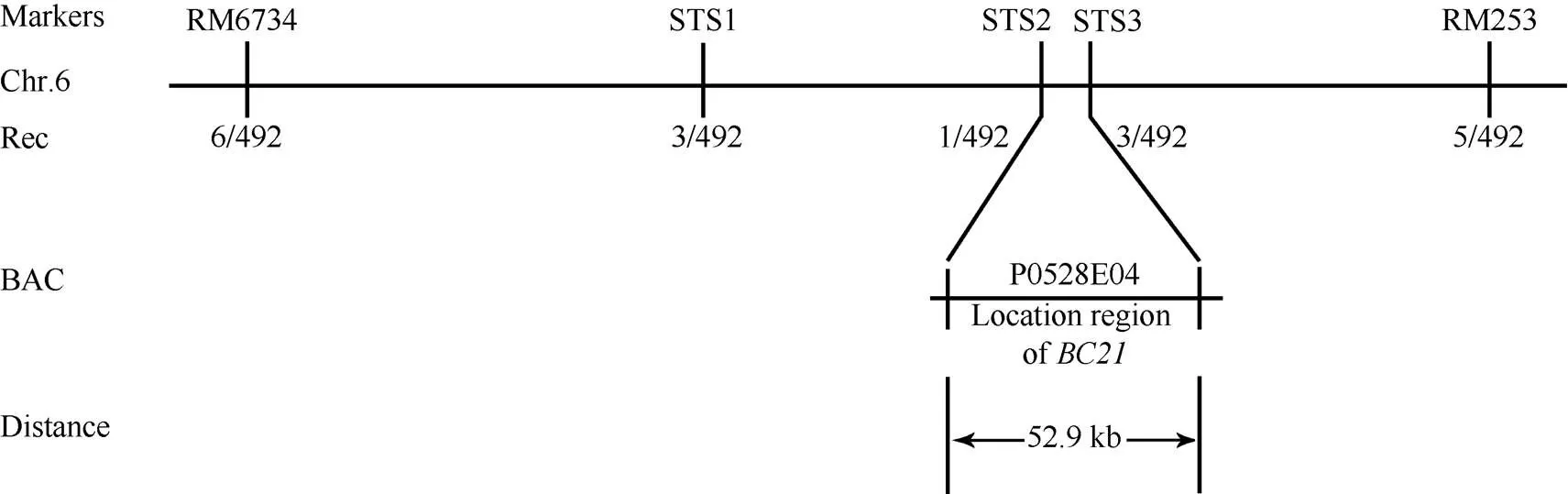
图5 BC21基因在6号染色体上的精细定位
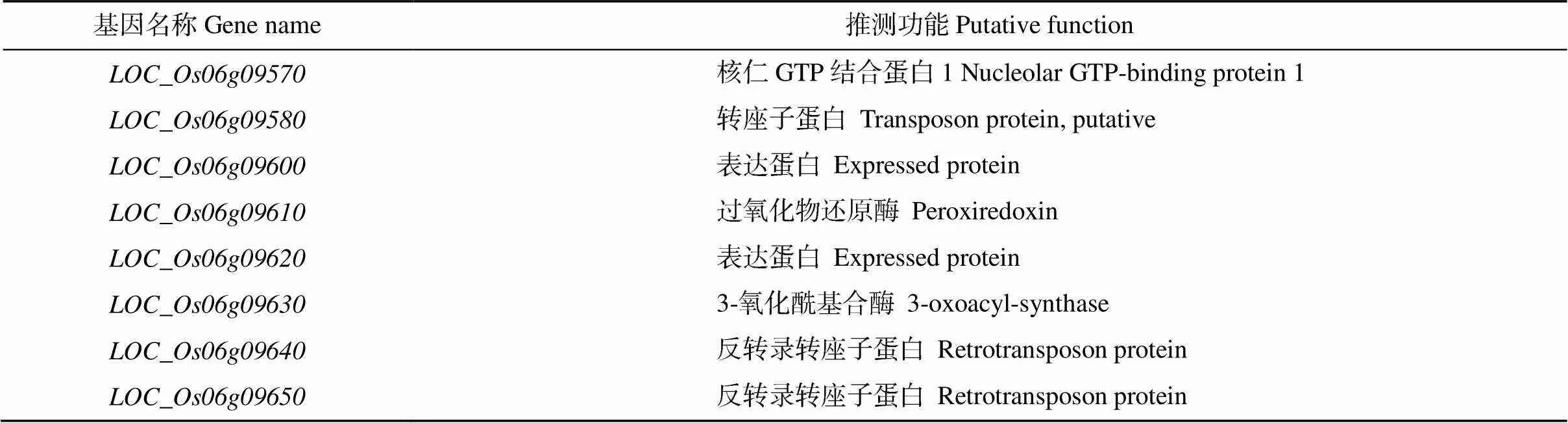
表2 定位区间内基因及其推测功能
细胞壁决定植株的机械强度, 当细胞壁的关键成分改变后植株的机械强度就会发生变化, 同时细胞壁次生加厚形成的厚壁组织在支撑植株方面也具有关键作用[20-22]。有研究表明, 脆性突变体的茎秆细胞壁组成占比和厚壁组织细胞壁结构与野生型不同, 如姜鸿瑞等[23]发现的脆秆突变体, 与野生型相比, 其茎秆的纤维素含量降低22.70%, 半纤维素含量升高45.76%, 厚壁组织细胞数目减少, 细胞壁明显变薄。Ye等[24]发现脆秆突变体茎秆第2节间的纤维素含量比野生型降低了30%, 而半纤维素组分如果胶糖及木糖的含量显著升高, 厚壁组织细胞壁厚度减小。与其他表型类似的脆秆突变体的研究结果相符, 在本研究中,茎秆的纤维素含量降低了36.56%,半纤维素含量升高了23.08%。并且利用树脂切片和扫描电镜技术分析了野生型和茎秆的细胞壁结构, 发现茎秆的厚壁组织细胞空隙增多, 细胞壁明显变薄, 这表明基因可能在茎秆厚壁组织细胞壁的形成中发挥作用。
水稻脆秆突变体中的纤维素占比减小, 更易消化, 可回收利用作为动物饲料。Su等[25]对一个水稻脆秆突变体植株进行了化学组分分析, 研究发现植株秸秆中的粗蛋白, 半纤维素和酸性不溶性灰分含量显著升高, 说明脆性突变可以提高稻草的营养价值。此外, 有研究显示脆秆突变植株的纤维素含量较低, 稻秆脆化, 经微生物作用后容易降解, 释放营养物质, 提高土壤养分, 有助于解决稻秆还田的难题[26]。因此,的脆性突变能为谷秆两用型水稻品种的选育提供材料, 进一步促进农业绿色发展。
[1] 王庭杰. 水稻茎组织构建与木质素代谢对抗倒伏的影响. 河南师范大学硕士学位论文, 河南新乡, 2015.
Wang T J. Effects of Stalk Tissue and Lignin Metabolism on the Lodging Resistance of Rice. MS Thesis of Henan Normal University, Xinxiang, Henan, China, 2015 (in Chinese with English abstract).
[2] Zhang R, Hu H Z, Wang Y M, Hu Z, Ren S F, Li J Y, He B Y, Wang Y T, Xia T, Chen P, Xie G S, Peng L C. A novel ricemutant encodes a UDP-glucose epimerase that affects cell wall properties and photosynthesis., 2020, 71: 2956–2969.
[3] Kotake T, Aohara T, Hirano K, Sato A, Kaneko Y, Tsumuraya Y, Takatsuji H, Kawasaki S. Riceencodes a dominant negative form of CesA protein that perturbs cellulose synthesis in secondary cell walls., 2011, 62: 2053–2062.
[4] Song X Q, Liu L F, Jiang Y J, Zhang B C, Gao Y P, Liu X L, Lin Q S, Ling H Q, Zhou Y H. Disruption of secondary wall cellulose biosynthesis alters cadmium translocation and tolerance in rice plants., 2013, 3: 768–780.
[5] 李晓静, 徐多多, 徐益敏, 翟开恩, 杨窑龙, 潘建伟, 饶玉春. 水稻纤维素合酶催化亚基的编码基因的表达分析. 中国水稻科学, 2015, 29: 126–134.
Li X J, Xu D D, Xu Y M, Cui K N, Yang Y L, Pan J W, Rao Y C. Expression of, a rice cellulose synthase catalytic subunit gene., 2015, 29: 126–134 (in Chinese with English abstract).
[6] Yan C J, Yan S, Zeng X H, Zhang Z Q, Gu M H. Fine mapping and isolation of(), allelic to., 2007, 34: 1019–1027.
[7] Zhang B C, Deng L W, Qian Q, Xiong G Y, Zeng D L, Li R, Guo L B, Li J Y, Zhou Y H. A missense mutation in the transmembrane domain of CESA4 affects protein abundance in the plasma membrane and results in abnormal cell wall biosynthesis in rice., 2009, 71: 509–524.
[8] Li Y H, Qian Q, Zhou Y H, Yan M X, Sun L, Zhang M, Fu Z M, Wang Y H, Han B, Pang X M, Chen M S, Li J Y., which encodes a COBRA-like protein, affects the mechanical properties of rice plants., 2003, 15: 2020–2031.
[9] Hirano K, Kotake T, Kamihara K, Tsuna K, Aohara T, Kaneko Y, Takatsuji H, Tsumuraya Y, Kawasaki S. Rice() encodes a classical dynamin OsDRP2B essential for proper secondary cell wall synthesis., 2010, 232: 95–108.
[10] Zhou Y H, Li S B, Qian Q, Zeng D L, Zhang M, Guo L B, Liu X L, Zhang B C, Deng L W, Liu X F, Luo G Z, Wang X J, Li J Y. BC10, a DUF266-containing and Golgi-located type II membrane protein, is required for cell-wall biosynthesis in rice (L.)., 2009, 57: 446–462.
[11] Zhang M, Zhang B C, Qian Q, Yu Y C, Li R, Zhang J W, Liu X L, Zeng D L, Li J Y, Zhou Y H. Brittle Culm 12, a dual-targeting kinesin-4 protein, controls cell-cycle progression and wall properties in rice., 2010, 63: 312–328.
[12] Zhang B C, Liu X L, Qian Q, Liu L F, Dong G J, Xiong G Y, Zeng D L, Zhou Y H. Golgi nucleotide sugar transporter modulates cell wall biosynthesis and plant growth in rice., 2011, 108: 5110–5115.
[13] Wu B, Zhang B C, Dai Y, Zhang L, Shang-Guan K K, Peng Y G, Zhou Y H, Zhu Z.encodes a membrane- associated chitinase-like protein required for cellulose biosynthesis in rice., 2012, 159: 1440–1452.
[14] 许作鹏. 水稻茎秆强度相关性状QTL分析及基因克隆. 扬州大学博士学位论文, 江苏扬州, 2017.
Xu Z P. Mapping of QTLs and Cloning of Genes Related to the Culm Mechanical Strength in Rice (L.). PhD Dissertation of Yangzhou University, Yangzhou, Jiangsu, China, 2017 (in Chinese with English abstract).
[15] 靳振明, 平宝哲, 沈浩珺, 杜淮清, 李瑞乾, 朱璐, 张大兵, 袁政. 水稻脆秆突变体的表型分析和基因定位. 植物学报, 2016, 51: 167–174.
Jin Z M, Ping B Z, Shen H J, Du H Q, Li R Q, Zhu L, Zhang D B, Yuan Z. Phenotypic analysis and gene mapping of rice brittle culm mutant., 2016, 51: 167–174 (in Chinese with English abstract).
[16] 王川丽, 王令强, 牟同敏. 水稻脆性突变体()的主要特性和脆性基因的初步定位. 华中农业大学学报, 2012, 31(2): 159–164.
Wang C L, Wang L Q, Mou T M. Main characteristics of rice brittle mutant() and preliminary localization of brittle genes., 2012, 31(2): 159–164 (in Chinese with English abstract).
[17] Li P, Liu Y R, Tan W Q, Chen J, Zhu M J, Lyu Y, Liu Y S, Yu S C, Zhang W J, Cai H W.encodes a COBRA-Like protein involved in secondary cell wall cellulose biosynthesis in sorghum., 2019, 60: 788–801.
[18] Aohara T, Kotake T, Kaneko Y, Takatsuji H, Tsumuraya Y, Kawasaki S. Rice() is involved in secondary cell wall formation in the sclerenchyma tissue of nodes., 2009, 50: 1886–1897.
[19] Wang Y, Ren Y L, Chen S H, Xu Y, Zhou K N, Zhang L, Ming M, Wu F Q, Lin Q B, Wang J L, Guo X P, Zhang X, Lei C L, Cheng Z J, Wan J M.() is required for the formation of secondary cell walls in rice nodes., 2017, 16: 1286–1293.
[20] De L G, Ferrari S, Giovannoni M, Mattei B, Cervone F. Cell wall traits that influence plant development, immunity, and bioconversion., 2019, 97: 134–147.
[21] Li F C, Zhang M L, Guo K, Hu Z, Zhang R, Feng Y Q, Yi X Y, Zou W H, Wang L Q, Wu C Y, Tian J S, Lu T G, Xie G S, Peng L C. High-level hemicellulosic arabinose predominately affects lignocellulose crystallinity for genetically enhancing both plant lodging resistance and biomass enzymatic digestibility in rice mutants., 2015, 13: 514–525.
[22] 赵小红, 白羿雄, 姚有华, 安立昆, 吴昆仑. 禾谷类作物茎秆特性与茎倒伏关系的研究. 植物生理学报, 2021, 57: 257–264.
Zhao X H, Bai Y X, Yao Y H, An L K, Wu K L. Research progress on the relationship between stem characteristics and crop stem lodging., 2021, 57: 257–264 (in Chinese with English abstract).
[23] 姜鸿瑞, 叶亚峰, 何丹, 任艳, 杨阳, 谢建, 程维民, 陶亮之, 周利斌, 吴跃进, 刘斌美. 一个新的水稻脆秆突变体的鉴定及基因定位. 作物学报, 2021, 47: 71–79.
Jiang H R, Ye Y F, He D, Ren Y, Yang Y, Xie J, Cheng W M, Tao L Z, Zhou L B, Wu Y J, Liu B M. Identification and gene localization of a novel rice brittle culm mutant, 2021, 47: 71–79 (in Chinese with English abstract).
[24] Ye Y F, Wang S X, Wu K, Ren Y, Jiang H R, Chen J F, Tao L Z, Fu X D, Liu B M, Wu Y J. A semi-dominant mutation in OsCESA9 improves salt tolerance and favors field straw decay traits by altering cell wall properties in rice., 2021, 14: 19.
[25] Su Y J, Zhao G Q, Wei Z W, Yan C J, Liu S J. Mutation of cellulose synthase gene improves the nutritive value of rice straw., 2012, 25: 800–805.
[26] 陆荷微, 刘斌美, 陶亮之, 叶亚峰, 吴振宇, 范爽, 吴跃进, 王钰. 水稻脆茎突变体的主要性状比较研究. 杂交水稻, 2017, 32(5): 51–55.
Lu H W, Liu B M, Tao L Z, Ye Y F, Wu Z Y, Fan S, Wu Y J, Wang Y. Comparative studies of major characteristics of rice brittle culm mutants., 2017, 32(5): 51–55 (in Chinese with English abstract).
Identification and gene mapping of brittle culm mutantin rice
DAI Wen-Hui1,2, ZHU Qi1,2, ZHANG Xiao-Fang1,2, LYU Shen-Yang1, XIANG Xian-Bo3, MA Tao1, CHEN Yu-Jie1, ZHU Shi-Hua1, and DING Wo-Na1,*
1College of Science and Technology, Ningbo University, Ningbo 315212, Zhejiang, China;2School of Marine Science,Ningbo University, Ningbo 315211, Zhejiang, China;3Pingyang Administration for Market Regulation, Wenzhou 325400, Zhejiang, China
A brittle culm mutantwasobtained by mutagenesis of indica rice Kasalath with ethyl methanesulfonate (EMS). Phenotypic analysis revealed that the mutant displayed both brittle culm and leaf phenotypes, which began to manifest at seedling stage and were most pronounced at mature stage. The mechanical strength analysis showed that the breaking resistance and tensile force ofstems decreased significantly. Resin sections and scanning electron microscope observation showed that the sclerenchyma cells ofculms had increased voids and thinner cell walls. Compared with the wild type, the cell wall component of stems revealed that the cellulose content ofdecreased by 36.60%, and the hemicellulose and lignin contents increased by 23.08% and 26.06%, respectively. Genetic analysis indicated that the brittle trait ofwas controlled by a single recessive gene. Using SSR markers and self-designed STS markers,was located in a 52.9 kb region between the markers STS2 and STS3 on chromosome 6, and there was no previously reported rice brittleness-related gene within this region, indicating thatmight be a new brittle culm gene in rice. This study will provide material support for further dissection of the regulation mechanism of mechanical strength of rice stems.
rice; brittle culm mutant; cell wall; cellulose; gene mapping
10.3724/SP.J.1006.2023.22025
本研究由国家自然科学基金项目(32071981)和宁波市自然科学基金重点项目(202003N4016)资助。
This study was supported by the National Natural Science Foundation of China (32071981) and the Key Project of Ningbo Natural Science Foundation (202003N4016).
丁沃娜, E-mail: dwn@zju.edu.cn
E-mail: daiwenhui1114@163.com
2022-04-27;
2022-07-22;
2022-08-12.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20220811.1955.006.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
