硅素穗肥优化滨海盐碱地水稻矿质元素吸收分配提高耐盐性
2023-03-23韦海敏陶伟科闫飞宇李伟玮丁艳锋刘正辉李刚华
韦海敏 陶伟科 周 燕 闫飞宇 李伟玮 丁艳锋 刘正辉 李刚华,*
硅素穗肥优化滨海盐碱地水稻矿质元素吸收分配提高耐盐性
韦海敏1,2陶伟科1,2周 燕1,2闫飞宇1,2李伟玮1,2丁艳锋1,2刘正辉1,2李刚华1,2,*
1南京农业大学农业农村部作物生理生态与生产管理重点实验室, 江苏南京 210095;2南京农业大学江苏省现代作物生产协同创新中心, 江苏南京 210095
本研究旨在阐明硅素穗肥调控盐碱地水稻抽穗期矿质元素分配的作用机制。以常规粳稻淮稻5号为材料, 于2019年和2020年在江苏沿海大丰盐碱地(盐分3.4 g kg–1, pH 8.3)开展大田试验, 设置3个硅肥用量(0、60和100 kg hm–2), 于幼穗分化期随穗肥施入。结果表明: (1) 硅素穗肥促进抽穗期植株养分吸收, 提高成熟期干物质量和产量, 与Si0相比, Si60平均增产4.3%, Si100平均增产8.6%; (2) 硅素穗肥优化了水稻不同部位K+、Na+分配, 提高水稻叶片、上部叶鞘、中下部茎秆K+含量, 降低穗、上部叶片、叶鞘、茎秆Na+含量, 提高各部位的K+/Na+, 进而提高离子稳态; (3) 硅素穗肥促进叶片大量元素N、P、Ca、Mg和微量元素Fe、Mn的积累, 与Si0相比, 硅素穗肥显著提高了16.5%的P含量、18.5%的Mg含量、22.4%的Ca含量、19.8%的Fe含量, 缓解盐碱胁迫对水稻叶片的不利影响。综上所述, 硅素穗肥优化了盐碱胁迫下水稻矿质元素的吸收分配, 减轻幼嫩器官盐胁迫程度, 促进叶片多种有益元素积累, 促进水稻养分吸收, 且100 kg hm–2效果最佳。
水稻; 盐碱地; 硅肥; 矿质营养; 产量
据FAO预测, 到2050年世界人口将增长到90亿,为全球人口提供粮食将是一个巨大的挑战, 而盐碱胁迫是严重威胁粮食生产的因素之一[1-2], 水稻是盐碱地改良的重要粮食作物, 受盐碱胁迫制约严重,因此, 沿海滩涂水稻生产备受关注[3-4]。水稻受到盐碱胁迫后, 出现叶片黄化、株高降低和干物质累积量下降等现象[5]。在生殖生长阶段, 盐胁迫不仅延迟了水稻的开花, 还导致水稻花粉、柱头、外稃中钠的含量显著增加, 导致水稻败育或灌浆不良, 导致粒重显著降低, 这些因素都导致水稻在盐碱胁迫下产量显著下降[6-7]。盐胁迫下, 大量Na+的存在阻碍了水稻对K+的吸收, 导致Na+/K+增大, 破坏离子稳态[8]。此外, 土壤中高浓度的盐分会降低土壤水势、阻碍根系的正常生长和蒸腾作用的正常进行, 进而降低了根系对养分的吸收有效性[9]。土壤中过量的Na+会竞争抑制植物对K、Ca、Mg等必须阳离子的吸收, 盐碱地土壤高pH值会降低必需微量元素Fe、Mn、Zn和Cu的有效性。这些因素都会导致植物养分失衡[9-10]。
水稻是喜硅植物, 硅素对水稻盐胁迫的缓解作用已有广泛报道。硅可以提高盐胁迫下水稻种子的发芽指数, 促进盐胁迫下水稻幼苗生长, 提高叶绿素含量和PSII效率(v/m), 缓解盐胁迫对水稻光合作用的抑制效应[11-12]。已有研究发现, 提高离子稳态是硅素缓解水稻盐胁迫的一个重要策略, 硅素有利于水稻根系维持较高的Na+、K+积累水平, 降低地上部Na+含量, 提高K+含量, 提高K+/Na+[8,12]。此外, 硅素通过优化胁迫条件下植物对矿质元素的吸收分配提高抗逆性。干旱胁迫下, 硅提高水稻秸秆中的Ca和P水平[13], 增加了向日葵对大量元素(P、K、Ca、Mg)和微量元素(Fe、Cu、Mn)的吸收[14]; 盐胁迫下, 硅素提高番茄根系和叶片中Ca含量[15], 改变了矿质元素在芦荟根尖和叶片中的分布[16]。生殖生长期是水稻对盐分特别敏感的时期[3,6], 同时也是水稻硅素吸收的关键期, 并且硅主要积累在地上部器官[17-18]。但以往硅素对水稻耐盐性作用的研究多集中在苗期,硅素穗肥对水稻生殖生长期的影响及其对矿质元素吸收分配的影响仍不明确。
因此, 本研究在盐碱地条件下, 通过水稻穗分化期施用硅肥, 从水稻产量、离子稳态和矿质元素分配等方面探究硅素对水稻生殖生长期盐碱胁迫的调控效应, 以期为盐胁迫条件下的水稻栽培提供技术指导和理论依据。
1 材料与方法
1.1 试验材料
供试材料为常规迟熟中粳品种淮稻5号, 全生育期150 d左右。
1.2 试验设计
于2019—2020年在江苏省大丰区中路港进行, 土壤为沙壤。2019年试验开始前取0~20 cm土壤测定基础理化性质, 基础理化性质如下: pH 8.3、有机质7.2 g kg–1、全氮0.5 g kg–1、速效氮2.8 mg kg–1、全磷0.5 g kg–1、速效磷7.6 mg kg–1、全钾17.4 g kg–1、速效钾236.1 mg kg–1、交换性钠330.8 mg kg–1、盐分3.4 g kg–1。
2019年5月29日播种, 6月18日移栽; 2020年5月31日播种, 6月21日移栽。于移栽前3~5 d灌水泡田, 用打浆机整平耙细, 之后进行泥浆沉实, 株行距25 cm × 14 cm。水分管理与当地常规管理保持一致, 一般在水稻分蘖期田间水层控制在(5±2) cm深, 够苗后排水晒田; 穗分化期后稻田保持干湿交替灌溉的方式; 抽穗期维持浅水层; 在成熟期前一周排水, 然后自然落干。各处理肥料运筹一致, 即氮肥(N) 345 kg hm–2、磷肥(P2O5) 172.5 kg hm–2、钾肥(K2O) 276 kg hm–2, 氮肥基肥∶分蘖肥∶穗肥比例为3∶3∶4, 磷肥一次基施, 钾肥基肥和穗肥比例5∶5。试验设置3个处理, 施硅量(以SiO2计)分别为0、60和100 kg hm–2, 硅肥为水溶性粉末, 主要组成为SiO2≥50%, Na2O≥25%, 各处理均设3个重复, 小区面积约667 m2。硅肥于穗分化期随穗肥施入, 其他管理措施与当地常规管理一致。
1.3 测定指标
干物质量: 于水稻穗分化期(穗肥施入当天)、抽穗期、成熟期, 调查各试验小区茎蘖数, 每小区普查连续10穴, 重复5次, 依据平均茎蘖数取3个代表穴样品, 分离植株地上部, 清理干净后, 经105℃烘箱杀青30 min, 再置于80℃烘箱烘干至恒重, 称得地上部干物质重量。
产量: 产量通过收割机(久保田PRO688Q)实收获得, 通过便携式含水率测定仪(JT-K6)测定收获的水稻籽粒平均含水率, 3次重复, 折算实际产量。
于抽穗期取3穴代表穴水稻, 按器官分为穗(Panicle)、叶片(Leaf)、叶鞘(Sheath)、茎秆(Stem), 按不同器官部位分为顶一叶(Leaf 1)、顶二叶(Leaf 2)、顶三叶(Leaf 3)、剩余绿色叶/下部叶(Leaf 4), 与叶对应的顶一鞘(Sheath 1)、顶二鞘(Sheath 2)、顶三鞘(Sheath 3)、剩余叶鞘/下部叶鞘(Sheath 4), 茎秆按伸长节数平均分为上(Stem 1)、中(Stem 2)、下(Stem 3)三部分。用去离子水清洗样品并经105℃烘箱杀青30 min, 再置于80℃烘箱烘干直至恒重并称重, 粉碎后过100目筛。称取0.2 g样品后用HNO3和HClO4(4∶1, v/v)高温消解, 使用电感耦合等离子体发射光谱仪(ICP-OES Agilent 710; Agilent Technogies, US)测定钾(K)、钠(Na)、磷(P)、钙(Ca)、镁(Mg)、铁(Fe)、锰(Mn)、锌(Zn)、铜(Cu)含量。采用凯氏定氮法测定植株氮(N)含量。
1.4 数据处理与分析
数据分析采用单因素方差分析(ANOVA)和Duncan多重比较(<0.05), 分析软件为SPSS 22.0(IMB, 美国), 使用Graphpad prism 8 (GraphPad Software, 美国)作图。
2 结果与分析
2.1 硅素穗肥对盐碱地水稻干物质积累及产量的影响
硅素穗肥的施用有利于提高盐碱地水稻干物质量, Si60提高作用大于Si100。与Si0相比, Si60在2019年和2020年成熟期干物质量分别提高了14.6%、12.5%, Si100分别提高了5.1%、7.8% (图1-A, B)。硅素穗肥的施用有利于提高盐碱地水稻产量, Si100提高作用大于Si60。与Si0相比, Si60在2019年和2020年产量分别提高了4.2%、4.4%, Si100分别提高了6.9%、10.2% (图1-C, D)。
2.2 硅素穗肥对盐碱地水稻钾离子含量的影响
K+在水稻抽穗期不同器官积累表现为茎秆>叶片>叶鞘>穗。K+在叶片各部位的分布相近, 但在叶鞘和茎秆表现为含量随器官的衰老而减少。硅素穗肥的使用有利于提高叶片、叶鞘和茎秆K+含量, Si60处理作用效果优于Si100。与Si0相比, 2个硅处理都提高了各叶片和上三叶鞘K+含量, 其中Si100对上二叶、上二鞘和上部茎秆K+含量的提高作用大于Si60, Si60对下二叶、下二鞘和中下部K+含量的提高作用大于Si100。综上所述, 硅素穗肥主要通过提高各叶片、上部叶鞘和中下部茎秆K+含量来提高水稻植株K+含量, 并且Si60作用效果优于Si100, 2019年与2020年趋势基本一致(图2)。
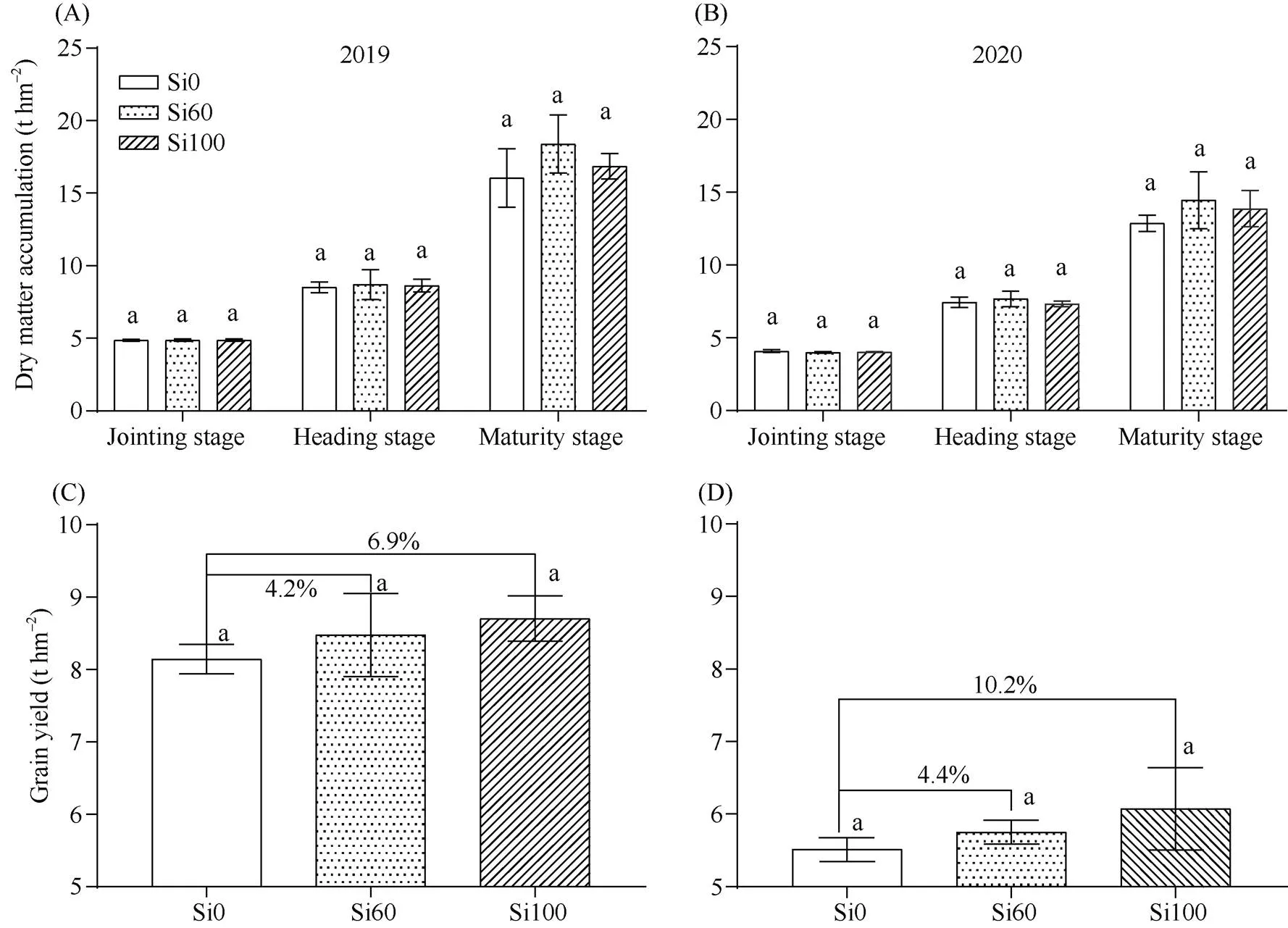
图1 硅素穗肥对盐碱地水稻干物质量和产量的影响
A、B: 干物质量; C、D: 水稻产量。数据代表平均值±标准差,= 3。不同的字母表示根据Duncan’s多重比较得出的不同处理间的差异显著(< 0.05)。
A, B: dry matter accumulation; C, D: rice yield. Data represent means ± SDs,= 3. Different letters indicate significant differences among the different treatments at< 0.05 according to Duncan’s multiple range test.
2.3 硅素穗肥对盐碱地水稻钠离子含量的影响
Na+在水稻不同器官含量表现为茎秆/叶鞘>叶片>穗, 在主要功能器官穗和叶片维持较低的Na+含量, 在不同部位表现为含量随器官的衰老而增加。硅素穗肥有利于降低水稻穗和叶鞘Na+含量, 但提高了叶片和茎秆Na+含量。进一步分析发现, 在叶片中, 硅素穗肥有利于降低上二叶Na+含量, 但显著提高了第三叶和下部叶的Na+含量, 硅素穗肥对叶片Na+降低作用表现为顶一叶>顶二叶>顶三叶>下部叶。硅素穗肥有利于降低叶鞘各部位Na+含量, 对上部叶鞘降低幅度大于下部叶鞘, 并降低了上部茎秆Na+含量, 但提高了下部茎秆Na+含量。Si100对Na+降低作用大于Si60, 2019年与2020年趋势一致(图3)。
2.4 硅素穗肥对盐碱地水稻钾钠比值的影响
盐碱地水稻抽穗期K+/Na+在不同器官表现为穗>叶片>叶鞘>茎秆。对于不同部位各器官, K+/Na+表现为随着器官的衰老而降低, 与Na+分布规律相反。硅素穗肥有利于提高K+含量, 降低Na+含量, 有利于提高各器官K+/Na+, 提高作用最显著的器官是叶鞘, 其次是穗, Si100的作用效果大于Si60。不同部位器官对硅素穗肥响应不同, 硅素穗肥有利于提高幼嫩器官的K+/Na+, Si100处理下上二叶、上二鞘和上部茎秆都达到显著水平; 随着器官的衰老, K+/Na+提高幅度逐渐下降, 硅素穗肥在第三叶和下部叶片表现为降低K+/Na+作用, 而在顶三鞘和下部茎秆与Si0无显著差异。Si100作用效果大于Si60, 2年趋势基本一致(图4)。
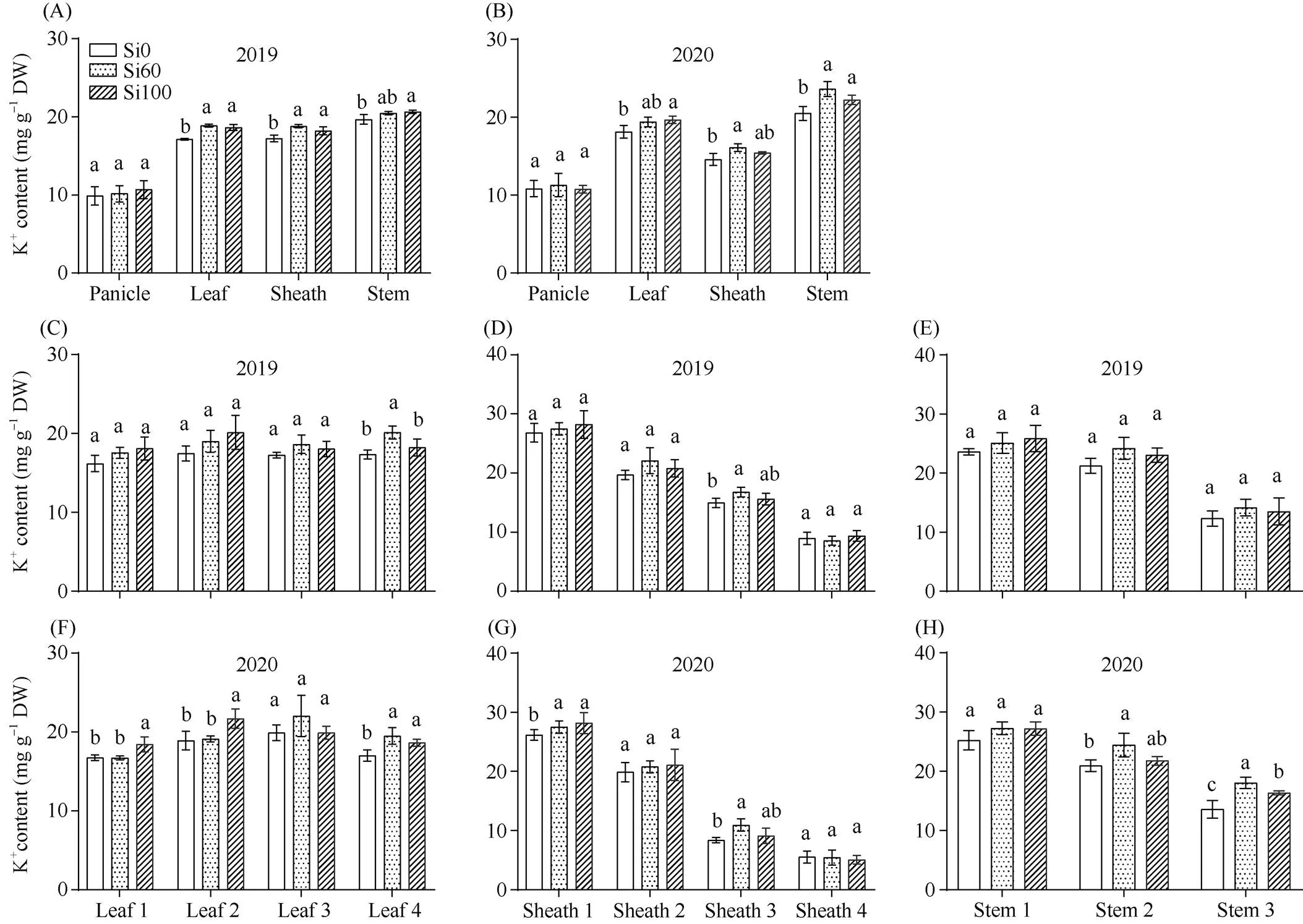
图2 硅素穗肥对盐碱地水稻不同器官钾离子含量的影响
不同器官(A、B)、叶片(C、F)、叶鞘(D、G)、茎秆(E、H)钾离子含量。数据代表平均值±标准差,= 3。在同一器官, 不同的字母表示根据Duncan’s多重比较得出的不同处理间的差异显著(< 0.05)。
K+content in different part of the organs (A, B), leaves (C, F), sheaths (D, G), and stems (E, H). Data represent means ± SDs,= 3. Different letters indicate significant differences among the different treatments at the same organ at< 0.05 according to Duncan’s multiple range test.

图3 硅素穗肥对盐碱地水稻不同器官钠离子含量的影响
处理同图2。数据代表平均值±标准差,= 3。在同一器官, 不同的字母表示根据Duncan’s多重比较得出的不同处理间的差异显著(< 0.05)。
Treatments are the same as those given in Fig. 2. Data represent means ± SDs,= 3. Different letters indicate significant differences among the different treatments at the same organ at< 0.05 according to Duncan’s multiple range test.
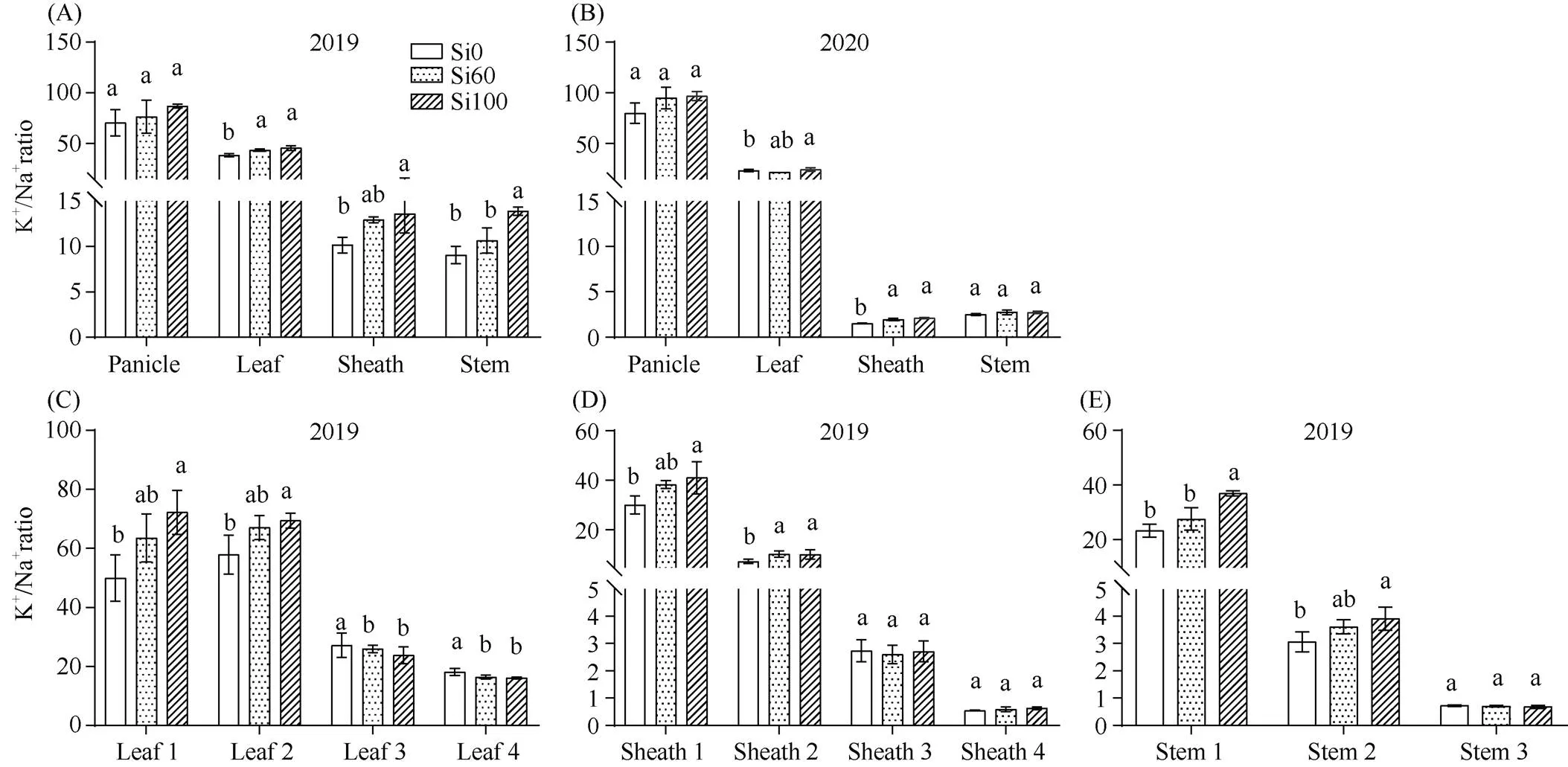
(图4)
处理同图2。数据代表平均值±标准差,= 3。在同一器官, 不同的字母表示根据Duncan’s多重比较得出的不同处理间的差异显著(< 0.05)。
Treatments are the same as those given in Fig. 2. Data represent means ± SDs,= 3. Different letters indicate significant differences among different treatments at the same organ according to Duncan’s multiple range test at< 0.05.
2.5 硅素穗肥对盐碱地水稻不同器官大量元素氮、磷、钙、镁含量的影响
N在水稻抽穗期主要集中在叶片中, 在穗、叶鞘、茎秆含量相近; P含量在水稻各器官表现为茎秆>叶鞘>叶片>穗; Ca在水稻植株各器官分布不均, 主要集中在叶片中, 约占地上部总钙含量的60%, Mg在水稻各器官的分布规律与钙相似。
硅素穗肥有利于提高水稻各器官对N的含量, 提高幅度最大的器官是叶片, Si100的作用效果大于Si60, 与Si0相比提高6.2%~8.9%。2个施肥量的硅素穗肥都有利于提高叶片、叶鞘、茎秆的P含量, 对叶片、叶鞘的提高作用大于茎秆, 与Si0相比, Si60处理下叶片P提高了14%~36%, Si100提高了16%~17%。硅素穗肥减少了Ca、Mg在水稻穗部的积累, 但显著提高了在叶片的含量, 与Si0相比, Si60处理下叶片Ca提高了9%~32%, Si100提高了8%~30%, 与Si0相比, Si60处理下叶片Mg提高了2%~16%, Si100提高了6%~22%。硅素穗肥对叶鞘和茎秆Ca含量无显著影响, 但提高了叶鞘和茎秆Mg的含量。总体而言, Si100的作用效果大于Si60, 2年趋势一致(图5)。
2.6 硅素穗肥对盐碱地水稻不同器官微量元素铁、锰、锌、铜含量的影响
硅素穗肥有利于提高叶片Fe含量, 与Si0相比, Si60处理下叶片Fe含量提高了3%~34%, Si100提高了11%~28%, 但降低了叶鞘Fe含量。硅素穗肥能够促进叶片Mn积累, 与Si0相比Si60叶片Mn提高了2%~10%, Si100提高了5%~6%, 对其他器官无显著影响。硅素穗肥提高了穗部Zn含量, 但显著降低了叶鞘和茎秆Zn含量, 对叶片无显著影响。硅素穗肥降低了叶片Cu含量, 与Si0相比, Si60处理下叶片Cu含量降低了6%~16%, Si100降低了6%~12%, 对其他器官无显著影响。综上所述, 硅素穗肥有助于叶片积累Fe和Mn, 但不利于Zn和Cu的积累, 其他器官无明显规律(图6)。
3 讨论
3.1 硅素穗肥对盐碱胁迫下水稻钠钾离子稳态的影响
已有研究表明, 硅有利于提高植物K+含量和降低Na+含量, 并通过调节Na+的吸收、运输和分配缓解盐胁迫导致的离子失衡[19]。本研究发现, 硅素穗肥主要通过介导Na+、K+在新老器官的分配缓解水稻盐胁迫。2个施肥量的硅素穗肥都有利于提高水稻植株K+含量, 降低Na+含量, 并提高K+/Na+(图4)。现有研究认为, 水稻是旁路流量大的作物, 施用硅有利于凯氏带的形成, 通过减少质外体途径向上传递Na+来减少水稻Na+积累量[20-21]。另外研究发现, 硅上调了水稻中K+吸收基因(和)和木质部装载基因()的表达, 从而提高盐胁迫下水稻的K+积累量、钾吸收指数和地上部K+分配速率[22]。
现有研究认为, 硅通过增强细胞壁物理屏障作用来减少Na+积累, 对新老器官的调节作用可能与硅积累量有关, 而硅在水稻地上部的积累呈现由形态学上端至下端减少的规律[17,23]。本研究发现, 硅素穗肥改变了Na+在新老器官中的分配, 能够减少Na+在水稻穗、上部叶鞘和幼嫩叶片中的积累, 将更多的Na+分配在衰老器官(图3-C, F)。玉米中也有相似发现, 硅处理增强木质部转运能力, 将更多Na+分配叶片中, 增加了Na+在叶片中的积累, 也增强了Na+在液泡中的隔离, 从而减少了叶绿体中Na+的积累[24]。与Na+分配规律相反, 硅素穗肥有利于提高水稻叶片、叶鞘和茎秆K+含量, 并发现硅素穗肥主要通过提高各叶片、上部叶鞘和中下部茎秆K+含量提高来水稻K+的含量(图2)。这可能与盐胁迫下衰老器官中的上调和下调相关[25]。
3.2 硅素穗肥对盐碱胁迫下水稻矿质元素分配的影响
在盐碱条件下, 盐分通过影响养分的有效性、运输和分配过程抑制植物的生长[26-27]。盐胁迫下硅素提高植物对矿质元素的吸收已有较多报道。盐胁迫下, 硅增加了芦荟和番茄叶片和根部磷、钙和镁的含量[15-16], 提高了油菜的磷和铁含量[28], 提高了马齿苋叶片和根部的钾含量, 抑制叶片的钠含量,提高耐盐性[29]。本研究发现, 硅素穗肥有利于提高盐碱地水稻地上部多种矿质元素的含量(图5和图6)。一方面, 硅促进根系吸水和蒸腾速率促进了盐胁迫下水稻对矿质元素的吸收转运和分配[12,30]; 另一方面, 硅有利于水稻Na+吸收的减少, 促进了水稻对矿质养分的吸收与分配[8,21]。本研究发现硅素穗肥降低了穗部多种矿质元素的积累, Horuz等[31]研究发现硅会降低水稻籽粒中Na+的含量, 增加K+含量, 该结果与本研究相似, 但Ca、Mg和P含量没有明显的变化趋势。本研究发现, 硅素穗肥主要提高了叶片K、N、P、Ca、Mg、Fe、Mn含量, 这些元素都参与了叶片光合作用等多种生理过程(图5和图6), Avestan等[32]的实验结果也证明了硅促进盐胁迫下草莓植株从营养液中吸收钾、磷和钙, 并有效地将营养物质转移到叶片上。可能与盐胁迫下硅处理增加叶片表皮细胞Ca、Mg含量相关, 并且进一步研究发现Ca、Mg含量分布与硅积累分布相关[30], 并认为硅是通过降低质膜对Na+的透性, 同时保持质膜对K+和Ca2+的转运能力来缓解盐胁迫[33]。本研究认为硅素通过改变Na+分配影响矿质元素在器官间的分配, 提高叶片有益元素的积累, 达到缓解水稻盐胁迫作用。
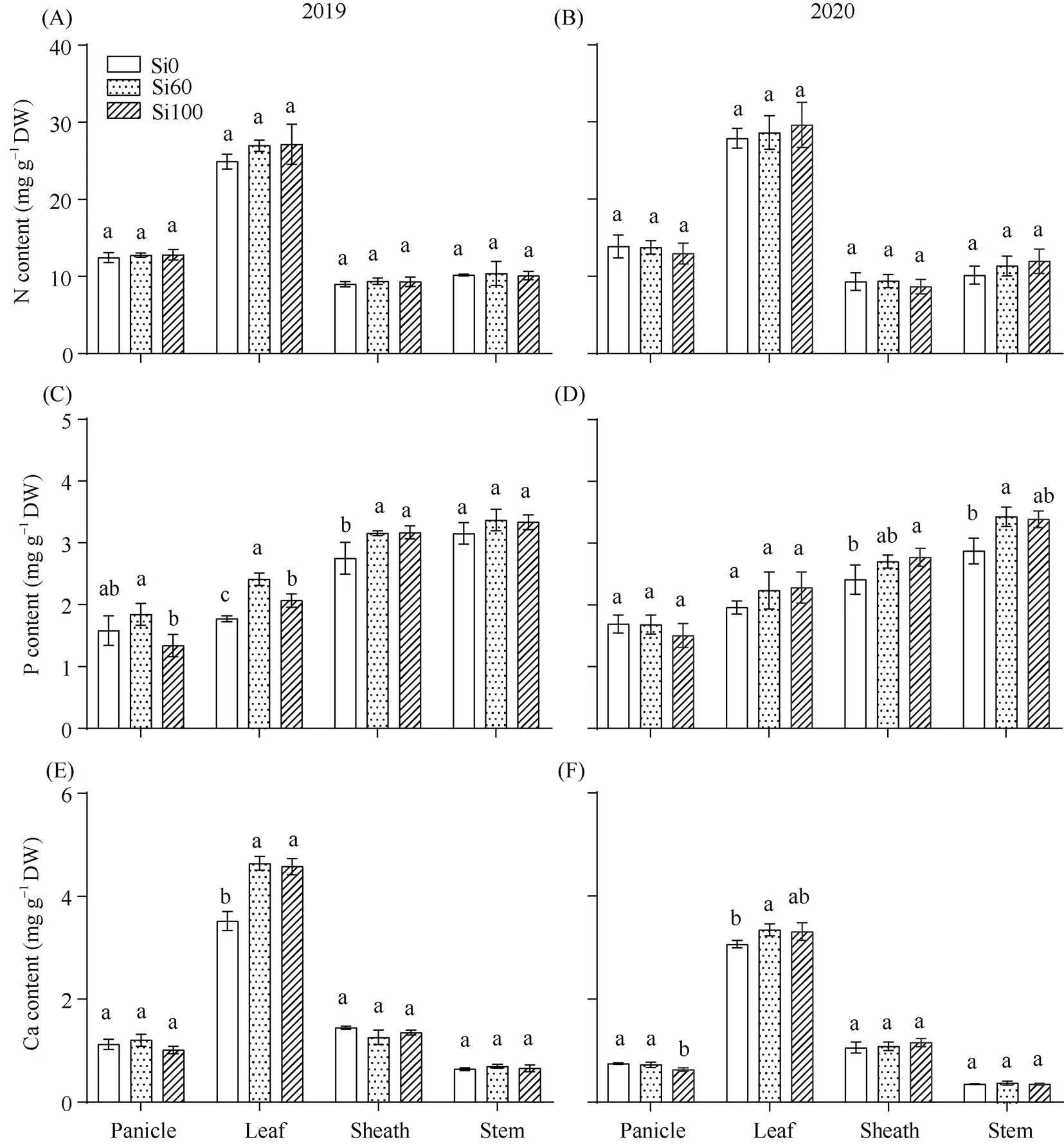
(图5)
不同器官氮含量(A、B)、磷含量(C、D)、钙含量(E、F)、镁含量(G、H)。数据代表平均值±标准差,= 3。在同一器官, 不同的字母表示根据Duncan’s多重比较得出的不同处理间的差异显著(< 0.05)。
The content of different organs in N (A, B), P (C, D), Ca (E, F), Mg (G, H). Data represent means ± SD,= 3. Different letters indicate significant differences among different treatments at the same organ at< 0.05 according to Duncan’s multiple range test.

(图6)
不同器官铁含量(A、B)、锰含量(C、D)、锌含量(E、F)、铜含量(G、H)。数据代表平均值±标准差,= 3。在同一器官, 不同的字母表示根据Duncan’s多重比较得出的不同处理间的差异显著(< 0.05)。
The content of different organs in Fe (A, B), Mn (C, D), Zn (E, F), and Cu (G, H). Data represent means ± SDs,= 3. Different letters indicate significant differences among different treatments at the same organ at< 0.05 according to Duncan’s multiple range test.
3.3 硅素穗肥影响矿质元素吸收分配促进盐碱地水稻物质积累和产量形成
矿质元素对植物的生长发育至关重要, 盐碱胁迫显著提高植物Na+含量, 抑制了K+等有益矿质元素的吸收转运, 影响正常生理代谢过程[9-10]。本研究发现, 盐碱地水稻干物质量较低, 2019年和2020年成熟期干物质量分别为16 t hm–2和13 t hm–2(图1),均显著低于常规栽培下大约19 t hm–2水稻干物质量。盐胁迫导致穗发育受阻, 抑制颖花分化、加剧颖花退化, 并降低花粉活力, 造成结实率下降和产量降低[3]。此外, 盐胁迫下水稻碳水化合物供给减少以及籽粒发育过程中淀粉合成酶活性受抑制也是导致水稻产量下降的重要原因[34], 2019年和2020年盐碱地水稻产量分别为8.1 t hm–2和5.6 t hm–2(图1), 而在长江中下游水稻种植区水稻产量约为10 t hm–2。
盐胁迫下硅显著提高叶片的蒸腾速率和光合作用, 进而促进物质积累, 这可能是由于硅有利于水稻根系的生长, 增加根系活力, 促进了水分和养分的吸收[8,35]。本研究结果表明, 硅素穗肥通过缓解功能器官盐胁迫提高干物质积累(图1)。首先硅素穗肥降低了穗部Na+的积累(图3-A, B), 有效缓解了盐胁迫对水稻穗发育的抑制作用[6], 提高了穗粒数和结实率进而获得更高的产量。其次, 硅素穗肥减轻了盐胁迫对功能器官伤害, 一方面, 硅素穗肥降低了幼嫩器官(上二叶、上部叶鞘和上部茎秆) Na+含量(图3), 减弱了功能器官盐胁迫程度; 另一方面, 硅素显著提高了叶片K、P、Ca、Mg、Fe含量, 这些元素都参与光合作用的重要过程, 有利于碳水化合物的积累(图2、图5和图6)。Yang和Zhang[36]研究发现, 大约60%~90%的籽粒灌浆同化产物是来源于抽穗后的光合作用, 所以维持抽穗后高效光合叶片的正常功能对水稻产量形成至关重要。现有研究认为叶片损伤是Na+积累所致, 硅能降低叶片Na+含量[11-12], 本研究发现硅素可以降低上部叶片Na+, 提高K+/Na+含量缓解盐胁迫对叶片的影响(图3-C, F; 图4-C, F)。此外硅素有利于提高叶片细胞壁厚度和水分含量、增加叶绿素含量和荧光来降低盐胁迫的负面影响, 提高叶片光合性能[32]。
4 结论
盐碱胁迫显著影响水稻养分吸收、物质积累及产量形成。硅素穗肥改变K+、Na+在叶片的分配比例提高叶片离子稳态, 通过提高各部位K+含量, 降低幼嫩器官Na+含量, 提高功能器官的K+/Na+稳态, 促进叶片对P、Ca、Mg、Fe的积累提高水稻耐盐性(如图7所示)。硅素穗肥促进水稻养分吸收, 优化矿质元素分配, 并促进干物质积累, 最终缓解盐碱胁迫对水稻产量的不利影响。
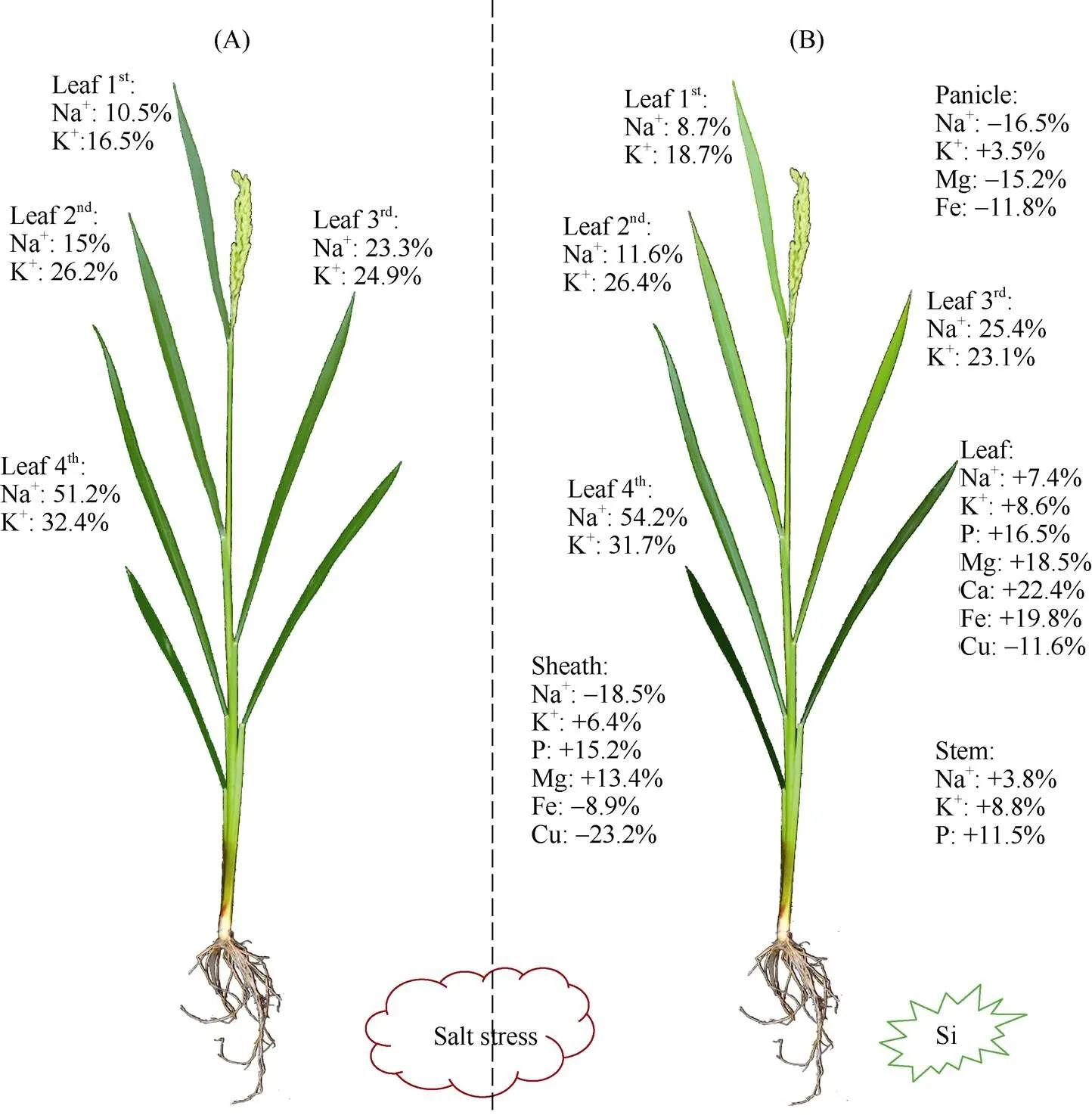
图7 硅素穗肥对盐碱地水稻矿质元素分配影响示意图
A: 盐胁迫; B: 盐胁迫+硅肥。图片展示了K+、Na+在不同叶片的分配比例, 不同器官矿质元素显著的含量变化。叶片颜色越深表示Na+含量越高, 叶片颜色越浅表示K+/Na+越高, 盐胁迫程度越低。
A: salt stress; B: salt stress + silicon. The picture shows the distribution ratio of K+and Na+in different leaves, and the change of mineral elements content in different organs. The deeper the leaf color was, the higher the Na+content was. The lighter the leaf color was, the higher the K+/Na+ratio was, and the lower the salt stress was.
[1] FAOSTAT. https://www.fao.org/faostat/en/#data, 2021-06-05.
[2] Julkowska M J M M, Testerink C T C. Tuning plant signaling and growth to survive salt., 2015, 20: 586–594.
[3] 韦还和, 张徐彬, 葛佳琳, 陈熙, 孟天瑶, 杨洋, 熊飞, 陈英龙,戴其根. 盐胁迫对水稻颖花形成及籽粒充实的影响. 作物学报, 2021, 47: 2471–2480.
Wei H H, Zhang X B, Ge J L, Chen X, Meng T Y, Yang Y, Xiong F, Chen Y L, Dai Q G. Effects of salinity stress on spikelets formation and grains filling in rice (L.)., 2021, 47: 2471–2480 (in Chinese with English abstract).
[4] 凌启鸿. 盐碱地种稻有关问题的讨论. 中国稻米, 2018, 24(4): 1–2.
Ling Q H. Discussion on the related problems of rice planting in saline-alkali soil., 2018, 24(4): 1–2 (in Chinese with English abstract).
[5] Ling F L, Su Q W, Jiang H, Cui J J, He X L, Wu Z H, Zhang Z A, Liu J, Zhao Y J. Effects of strigolactone on photosynthetic and physiological characteristics in salt-stressed rice seedlings., 2020, 10: 6183.
[6] Khatun S, Rizzo C A, Flowers T J. Genotypic variation in the effect of salinity on fertility in rice., 1995, 173: 239–250.
[7] Devidas Wankhade S, Cornejo M, Mateu-Andres I, Sanz A. Morpho-physiological variations in response to NaCl stress during vegetative and reproductive development of rice., 2013, 35: 323–333.
[8] Flam-Shepherd R, Huynh W Q, Coskun D, Hamam A M, Britto D T, Kronzucker H J. Membrane fluxes, bypass flows, and sodium stress in rice: the influence of silicon., 2018, 69: 1679–1692.
[9] Sairam R K, Tyagi A. Physiology and molecular biology of salinity stress tolerance in plants., 2004, 86: 407–421.
[10] Shelden M C, Gilbert S E, Tyerman S D. A laser ablation technique maps differences in elemental composition in roots of two barley cultivars subjected to salinity stress., 2020, 101: 1462–1473.
[11] Etesami H, Jeong B R. Silicon (Si): review and future prospects on the action mechanisms in alleviating biotic and abiotic stresses in plants., 2018, 147: 881–896.
[12] Thorne S J, Hartley S E, Maathuis F J M. Is silicon a panacea for alleviating drought and salt stress in crops?, 2020, 11: 1221.
[13] Emam M M, Khattab E H, Helal M N, Deraz E A. Effect of selenium and silicon on yield quality of rice plant grown under drought stress., 2014, 8: 596–605.
[14] Gunes A, Kadioglu Y K, Pilbeam D J, Inal A, Coban S, Aksu A. Influence of silicon on sunflower cultivars under drought stress, II: Essential and nonessential element uptake determined by polarized energy dispersive X-ray fluorescence., 2008, 39: 1904–1927.
[15] Wasti S, Manaa A, Mimouni H, Nsairi A, Ibtissem M, Gharbi E, Gautier H, Ben Ahmed H. Exogenous application of calcium silicate improves salt tolerance in two contrasting tomato () cultivars., 2017, 40: 673–684.
[16] Xu C X, Ma Y P, Liu Y L. Effects of silicon (Si) on growth, quality and ionic homeostasis of aloe under salt stress., 2015, 98: 26–36.
[17] Sun L, Wu L H, Ding T P, Tian S H. Silicon isotope fractionation in rice plants, an experimental study on rice growth under hydroponic conditions., 2008, 304: 291–300.
[18] Ma J F, Nishimura K, Takahashi E. Effect of silicon on the growth of rice plant at different growth-stages., 1989, 35: 347–356.
[19] Zhu Y X, Gong H J, Yin J L. Role of silicon in mediating salt tolerance in plants: a review.(Basel), 2019, 8: 147.
[20] Yan G, Fan X, Tan L, Yin C, Li T, Liang Y. Root silicon deposition and its resultant reduction of sodium bypass flow is modulated by OsLsi1 and OsLsi2 in rice., 2021, 158: 219–227.
[21] Gong H J, Randall D P, Flowers T J. Silicon deposition in the root reduces sodium uptake in rice (L.) seedlings by reducing bypass flow., 2006, 29: 1970–1979.
[22] Yan G C, Fan X P, Zheng W N, Gao Z X, Yin C, Li T Q, Liang Y C. Silicon alleviates salt stress-induced potassium deficiency by promoting potassium uptake and translocation in rice (L.)., 2021, 258: 153379.
[23] Coskun D, Britto D T, Huynh W Q, Kronzucker H J. The role of silicon in higher plants under salinity and drought stress., 2016, 7: 1072.
[24] Bosnic P, Bosnic D, Jasnic J, Nikolic M. Silicon mediates sodium transport and partitioning in maize under moderate salt stress., 2018, 155: 681–687.
[25] Wang H, Zhang M, Guo R, Shi D, Liu B, Lin X, Yang C. Effects of salt stress on ion balance and nitrogen metabolism of old and young leaves in rice (L.)., 2012, 12: 194.
[26] Niu X M, Bressan R A, Hasegawa P M, Pardo J M. Ion homeostasis in NaCl stress environments., 1995, 109: 735–742.
[27] Jumberi A, Yamada M, Yamada S, Fujiyama H. Salt tolerance of grain crops in relation to ionic balance and ability to absorb microelements., 2001, 47: 657–664.
[28] Farshidi M, Abdolzadeh A, Sadeghipour H R. Silicon nutrition alleviates physiological disorders imposed by salinity in hydroponically grown canola (L.) plants., 2012, 34: 1779–1788.
[29] Kafi M, Rahimi Z. Effect of salinity and silicon on root characteristics, growth, water status, proline content and ion accumulation of purslane (L.)., 2011, 57: 341–347.
[30] Javaid T, Farooq M A, Akhtar J, Saqib Z A, Anwar-Ul-Haq M. Silicon nutrition improves growth of salt-stressed wheat by modulating flows and partitioning of Na+, Cl−and mineral ions., 2019, 141: 291–299.
[31] Horuz A, Korkmaz A. The effect of silicon fertilization on reducing salt stress in rice (L.)., 2014, 20: 215–229.
[32] Avestan S, Ghasemnezhad M, Esfahani M, Barker A V. Effects of nano silicon dioxide on leaf anatomy, chlorophyll fluorescence, and mineral element composition of strawberry under salinity stress., 2021, 44: 3005–3019.
[33] Tuna A L, Kaya C, Higgs D, Murillo-Amador B, Aydemir S, Girgin A R. Silicon improves salinity tolerance in wheat plants., 2007, 62: 10–16.
[34] Abdullah Z, Khan M A, Flowers T J. Causes of sterility in seed set of rice under salinity stress., 2001, 187: 25–32.
[35] Huang Y, Zhang W, Zhao L, Cao H. Effects of Si on the index of root activity, MDA content and nutritional elements uptake of rice under salt stress., 2009, 4: 860–866.
[36] Yang J C, Zhang J H. Grain filling of cereals under soil drying., 2006, 169: 223–236.
Panicle silicon fertilizer optimizes the absorption and distribution of mineral elements in rice (L.) in coastal saline-alkali soil to improve salt tolerance
WEI Hai-Min1,2, TAO Wei-Ke1,2, ZHOU Yan1,2, YAN Fei-Yu1,2, LI Wei-Wei1,2, DING Yan-Feng1,2, LIU Zheng-Hui1,2, and LI Gang-Hua1,2,*
1Key Laboratory of Crop Physiology Ecology and Production Management, Ministry of Agriculture and Rural Affairs, Nanjing Agricultural University, Nanjing 210095, Jiangsu, China;2Jiangsu Collaborative Innovation Center for Modern Crop Production, Nanjing Agricultural University, Nanjing 210095, Jiangsu, China.
This purpose of this study is to elucidate the mechanism of silicon fertilizer on mineral element distribution at heading stage in rice. In this study, a field experiment was carried out in the coastal beach saline-alkali of Jiangsu Province (3.4 g kg–1soil salinity, pH 8.3). The conventional japonica rice (Huaidao 5) was used as the material, and three silicon fertilizer amounts (0, 60 and 100 kg hm–2) were applied with panicle fertilizer at panicle initiation stage. The results showed that: (1) Silicon panicle fertilizer promoted plant nutrient absorption at heading stage, increased dry matter accumulation at mature stage, and increased yield, Si60 increased by 4.3% on average, Si100 increased by 8.6% on average. (2) Silicon panicle fertilizer optimized the distribution of K+and Na+in rice at heading stage. Silicon increase K+content in leaves, upper sheaths and lower stems of rice, decreased Na+content in panicles, upper leaves, sheaths and stems, and increased the K+/Na+ratio in various tissues, thus improving ion homeostasis of rice. (3) Silicon panicle fertilizer promoted the accumulation of N, P, Ca, Mg, Fe, and Mn in leaves. Compare with Si0, the average increase of the two silicon treatments was 16.5% in P, 18.5% in Mg, 22.4% in Ca and 19.8% in Fe, and alleviated the adverse effects of saline-alkali stress on rice leaves. In summary, silicon panicle fertilizer optimizes the absorption and distribution of mineral elements in rice, reduced salt stress in young organs, promoted the accumulation of beneficial elements in leaves, improved nutrient absorption of rice, and the effect of 100 kg hm−2was better.
rice; saline-alkali stress; silicon; mineral elements; rice yield
10.3724/SP.J.1006.2023.22031
本研究由江苏省重点研发计划项目(BE2021361, BE2019377)资助。
This study was supported by the Key Research and Development Program of Jiangsu Province (BE2021361, BE2019377).
李刚华, E-mail: lgh@njau.edu.cn
E-mail: 2018101014@njau.edu.cn
2022-05-13;
2022-10-10;
2022-11-15.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20221114.1443.002.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
