免疫组化质量控制管理在胃肠道肿瘤病理诊断中的应用价值
2023-03-23张羽
张羽
(辽阳市中心医院 病理科,辽宁 辽阳 111000)
胃肠道肿瘤是目前国内外发病率和病死率均较高的恶性肿瘤之一,且患者通常对于放化疗并不敏感,多需通过手术治疗[1]。早期临床诊断对于治疗方案确定和预后改善具有重要意义。胃肠纤维镜和胃肠道造影等传统胃肠道疾病诊断法虽然是临床疾病诊断中常用的辅助诊断技术,但其仍属于侵入性操作,患者耐受性差,且存在一定误诊和漏诊现象[2-3]。超声诊断属于无创性辅助诊断方法,在胃肠道疾病的定位诊断中准确性良好,但在病理分型和分期等定性诊断中仍存在一定缺陷[4]。近年来,随着各类肿瘤发病率的升高,病理诊断工作逐渐引起了人们的重视。免疫组化病理诊断属于一种经典病理诊断技术,该方法在病理诊断中的应用效果已经得到了明确证实[5]。研究表明,质量控制方式的不同,容易影响病理诊断的效率及可靠性[6]。质量管理控制以提高质量为目标,为验证该方法的价值,本研究主要针对103例胃肠道肿瘤患者进行如下分析。
1 资料与方法
1.1 一般资料 选择2018年8月至2019年10月在辽阳市中心医院病理科接受病理检查的103例胃肠道肿瘤患者为研究对象。按照随机硬币抛掷法将纳入者分为对照组(51例)和控制组(52例)。对照组男28例,女23例;年龄22~71岁,平均(45.08±11.11)岁;病灶位置:胃窦部位30例,胃体5例,贲门部位5例,回盲处7例,乙状结肠2例,全胃浸润2例;病理分型:未分化癌变23例,恶性淋巴瘤17例,肿瘤来源未确定11例。控制组男29例,女23例;年龄30~74岁,平均(45.69±11.02)岁;病灶位置:胃窦部位28例,胃体8例,贲门部位5例,回盲处5例,乙状结肠4例,全胃浸润2例;病理分型:未分化癌变26例,恶性淋巴瘤15例,肿瘤来源未确定11例。两组纳入者上述人口学和疾病相关资料分布间差异无统计学意义(P>0.05)。
1.2 纳入和排除标准 纳入者经临床诊断和病理学检查确诊;临床资料完整;明确研究相关内容和目的,同意签署协议书;同时排除合并全身感染性疾病或免疫系统或血液系统疾病,依从性差,无法获取病病理组织者。本研究已获得我院伦理委员会的批准。
1.3 方法 对照组实施常规HE染色管理:①制备肿瘤标本。参照胃肠道肿瘤患者的影像学检查结果,于胃肠道肿瘤患者胸腹部适宜位置作一切口,切除肿瘤组织,以备后续病理检查。②固定。将胃肠道肿瘤组织标本置于冰箱内低温储存。进行病理诊断时,取出肿瘤组织标本,将其完全浸润于10%浓度的中性甲醛溶液中,持续固定4 h。③脱水。分别将固定后的肿瘤组织标本浸润于AF液、75%浓度乙醇溶液、80%浓度乙醇溶液及90%浓度乙醇溶液、95%浓度乙醇溶液、100%无水乙醇溶液中进行脱水处理。每个脱水环节的脱水时间控制为1 h。④染色。将脱水后的肿瘤组织标本分别浸润于二甲苯(Ⅰ)、二甲苯(Ⅱ)溶液中,分别浸泡20 min、30 min。随后于60 ℃条件下,以醋缸(Ⅰ)、醋缸(Ⅱ)分别进行浸泡(浸泡时间为1 h)。经上述处理后,将染色后的肿瘤标本置于60 ℃烤箱内,持续烤片2 h。
控制组实施免疫组化质量控制管理:①制备肿瘤标本。按照对照组方法,制备肿瘤标本。②固定。将肿瘤组织浸润于足量10%浓度中性福尔马林溶液中,持续固定8~12 h。③脱水、浸蜡。常规采用不同浓度乙醇进行脱水处理,组织脱水后,浸蜡,并进行石蜡包埋。④切片。选用LeicaRM2235型号切片机,参照4 μm厚度标准针对组织块进行连续切片处理。⑤脱蜡。采用适量二甲苯(Ⅰ)中持续脱蜡5 min;取适量二甲苯(Ⅱ)中持续脱蜡5min;浸润于无水乙醇(100%)溶液内水洗2 min;改用95%浓度乙醇持续水洗1 min;采用80%浓度乙醇水洗1 min;选用75%浓度乙醇水洗1 min;最后将经处理的组织块浸润于足量蒸馏水内,持续水洗2 min(每环节各2次,以确保水分充分吸干)。⑥染色。分别经双氧水、柠檬酸缓冲液处理切片。加热后,向量杯内切片滴加一抗,于40 ℃温度下进行孵育。经磷酸盐缓冲液再次处理后,于室温下滴加二抗并孵育15 min。利用苏木素针对切片进行染色处理,染色后以清水冲洗表面的残留苏木素。吸干水分后,利用盐酸乙醇进行分化处理(0.5 min)。将染色后的切片置于50 ℃温水中浸泡5 min后取出吸干表面水分。随后将切片置于伊红液内留置2 min。最后经常规脱水处理后[流程为:95%乙醇(Ⅰ)中脱水1 min、95%乙醇(Ⅱ)中脱水1 min、100%乙醇(Ⅰ)中脱水1 min、100%乙醇脱水1 min、二甲苯石碳酸处理1 min、二甲苯Ⅰ处理1 min、二甲苯(Ⅱ)中处理1 min],以中性树脂进行封片。
1.4 评价方法 切片质量评价标准:切片质量良好:细胞核浆对比鲜明,色彩鲜亮,染色均匀,厚薄适宜;切片质量合格:色彩较为清晰,可区别核浆,无气泡,可有少数褶皱;切片质量不合格:染色浓厚,核浆对比不明显,存在较多气泡或褶皱[7]。
1.5 统计学方法 以SPSS21.0软件统计。计数资料以[n(%)]描述,组间比较选择χ2检验;计量资料描述用(),组间比较用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组标本质量合格情况比较 控制组的标本质量总体合格率(96.15%)显著高于对照组(82.35%)(P<0.05)。见表1。
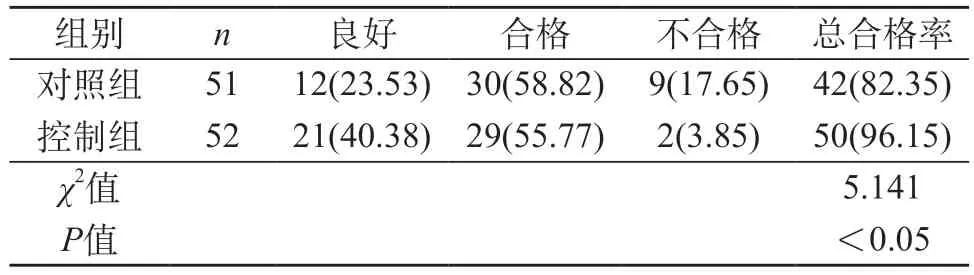
表1 两组标本质量的合格率比较[n(%)]
2.2 两组病理诊断效率比较 控制组的病理诊断耗时明显短于对照组[(12.06±2.30)hvs.(17.42±3.18)h],差异显著(P<0.05)。见表2。
表2 两组病理诊断效率的比较(h,)

表2 两组病理诊断效率的比较(h,)
3 讨论
病理诊断是一类重要的诊断技术,这种诊断方法的基本原理为:采集患者的病理组织制成标本,经标本染色处理后,置于显微镜下观察细胞形态、大小等状况,获得较为可靠的诊断结果[8]。根据既往病理诊断经验,在诊断过程中,标本处理方法及质量控制方式的选择,均会影响诊断工作效率及准确性[9]。
常规HE染色管理与免疫组化质量控制管理是目前临床诊断工作常用的两种诊断方法。常规HE染色管理方法的特征为:采用HE染色法针对组织标本进行染色,同时按照常规管理模式,确保病理诊断工作的顺利完成[10-11]。常规HE染色在乳腺癌[12]、胃癌[13]等肿瘤中的诊断价值,已经得到了明确证实。而免疫组化质量控制管理方法是将免疫组化病理检查作为中心,利用质量控制管理模式提供良好的辅助作用,以保障免疫组化病理检查价值的充分发挥。特征为:采集肿瘤组织标本后,按照固定、脱水等流程将其制成组织块,切片后,利用免疫组化技术进行处理,最后以苏木素针对处理后的组织切片进行染色[14]。在病理诊断中,免疫组化质量控制管理方法的应用,可充分保障切片处理质量[15]。
随着免疫组化病理检查方法的普及,免疫组化病理检查期间的质量控制管理工作逐渐成为人们的重点。应用优势在于:①确保切片质量。切片质量是影响病理诊断方法价值的主要因素。以常规HE染色法处理病理组织标本,并运用常规管理模式进行管理,所得切片质量尚可。但部分病理组织切片容易出现质量问题,原因在于[16]:①常规管理模式未对诊断过程中的固定时间、烤片操作等做强制要求,导致病理诊断中容易出现固定时间不足(影响固定效果)、烤片效果不佳等问题,进而影响切片质量。而引入免疫组化质量控制管理方法后,质量控制管理模式则可为免疫组化病理检查提供良好的配合,即严格按照福尔马林固定(8~10 h)、脱蜡(以二甲苯及不同浓度乙醇进行处理)、染色处理流程,制备切片。这一方法的良好质控作用,可充分保障切片质量。本研究证实:控制组标本质量总合格率96.15%,高于对照组(P<0.05)。②提高诊断效率。相对于影像学检查技术而言,病理诊断的耗时较长。采用常规HE染色管理方法处理肿瘤组织标本,容易受固定时间不足、染色不充分、染色背景浓厚等,而影响切片质量,进而影响病理诊断结果的准确性。当利用常规HE染色管理法制备的切片置于显微镜下观察时,可能因切片质量不佳,而需要重新制备切片。这一操作也会导致诊断耗时过长,从而影响病理诊断工作的效率。选用免疫组化质量控制管理方法进行诊断时,质量控制管理标准对免疫组化病理检查各环节的操作标准及时长均提出了明确的要求,按照上述要求规范开展免疫组化检查,可确保病理检查工作的顺利完成,由此可认为,该方法在提升病理诊断效率方面具有一定优势。本研究证实:控制组病理诊断耗时短于对照组(P<0.05)。
在运用免疫组化病理技术进行诊断时,需注意合理把控质量控制管理要点,具体如下:①病理组织的制备及处理。这是免疫组化病理诊断的基础环节,也是影响诊断工作效率及最终诊断结果的关键所在[7]。为保障病理组织的处理质量,需结合术前影像学检查结果,合理选择切口,并切除适宜大小的病理组织,制备病理组织标本。此外,根据既往病理检查经验,病理检查以病理组织中的细胞为观察重点,如未能合理储存病理标本或及时送检,组织细胞的形态学可能会出现一定变化,进而影响诊断结果的可靠性。对此,在运用质量控制管理方法进行干预时,应注意将采集的病理组织标本置于冰箱内储存,避免污染,并尽量于采集标本后较短时间内送检,以减少因病理组织细胞形态学改变引发的不良和后果[17]。②标本固定处理。新鲜组织标本的细胞中含有大量水解酶,随着新鲜组织标本留置时间的延长,组织中的细胞逐渐处于缺氧状态,此时,内部的水解酶会发挥水解作用,诱导细胞内的蛋白质分解,造成组织自溶[18]。为了避免出现上述状况,在质量控制管理工作中,病理组织标本制备完成后,需尽快将其浸润于中性固定液中,以抑制细胞缺氧、水解酶带来的不良影响。③合理把控染色效果。免疫组化病理检查多采用苏木素进行染色[19]。在染色处理中,需注意把控染色效果,确定切片染色成功后,方可进行后续操作。
为了充分发挥免疫组化病理技术的价值,保障病理诊断质量,在后续质量控制管理工作中,应将以下几种技术应用于实践管理工作中:①试剂管理。免疫组化病理检查中需要的试剂类型较多,如中性福尔马林溶液、二甲苯溶液、乙醇溶液等。当相关试剂出现质量问题,可能会影响免疫组化病理检查工作的效率,甚至影响诊断结果的准确性[20]。为保障免疫组化病理检查结果的可靠性,需定期检查各类试剂质量,及时更换新试剂(避免使用过期试剂)。在检查试剂时,重点检查试剂保存状况,判断有无挥发、渗漏问题,以防因试剂浓度改变而影响病理诊断结果的准确性。②脱水、脱蜡操作质量把控。脱水环节与脱蜡环节类似,均需经不同浓度乙醇处理标本。在针对切片进行脱水、脱蜡处理时,需注意严格参照不同乙醇浓度的排列顺序,依次对切片进行脱水处理、脱蜡处理,以减少切片中的水分残留,保障标本的脱蜡效果。③切片不合格原因分析。相对于常规HE染色而言,免疫组化病理检查与质量控制管理方法联用,在提升切片质量方面具有一定优势。但在实践病理诊断工作中,仍有部分切片会出现质量不合格问题。为了避免由切片质量不合格引发的不必要耗时,需结合免疫组化病理诊断经验,从多个方面,综合分析切片质量不合格的原因,以便根据切片质量不合格的原因,重新优化质量控制管理方案,以保障切片质量。④诊断结果管理。在重视切片质量的基础上,统计免疫组化病理诊断结果的准确性,将误诊、漏诊的切片作为重点,分析诊断结果与切片质量、免疫组化病理诊断流程之间的关联,明确误诊、漏诊的原因。如确定漏诊、误诊与检验过程有关,需结合相关原因,进一步优化质量控制管理方案,以提升免疫组化病理诊断结果的准确性。
综上所述,在胃肠道肿瘤免疫组化病理诊断中,宜推行免疫组化质量控制管理,以保障标本质量,减少重新制片的发生,提升病理诊断工作的效率,为疾病及早治疗和预后改善提供更为及时准确的依据。
