白藜芦醇对炎症型肠应激综合征小鼠肠上皮屏障功能的作用*
2023-03-22冯杨焜侯道荣顾正宇
冯杨焜,侯道荣,顾正宇
1 南通大学医学院 江苏南通 226001
2 南京医科大学医药实验动物中心 江苏南京 211166
3 江苏省南京市红十字医院 江苏南京 210001
胃肠感染患者会出现会肠易激综合征(Irritable bowel syndrome,IBS)症状[1-3]。IBS 是功能性胃肠疾病的一种主要形式,影响世界11.2%的人口[4],其症状是腹痛和腹胀、内脏痛过敏和肠运动异常。这种症状此后会发展为炎症后肠易激综合征(Post inflammatory irritable bowel syndrome,PI-IBS),表现为尽管明显的肠道损伤已恢复,但患者仍遭受疼痛和不适。对结肠机械刺激(平滑肌收缩、管腔接触或肠道膨胀)的超敏感是一个重要特征[5]。IBS患者除了胃肠道疾病外,心理疾病的发生率也很高。功能性消化不良、胃食管反流病与抑郁焦虑在肠易激综合征患者中普遍存在[6],这是因为受到脑-肠轴功能障碍的影响[7]。脑-肠轴的作用是监测肠道(回肠和结肠)功能,并将大脑皮层和海马体等大脑情绪中心与肠道外周功能如肠道动力和肠内分泌信号联系起来。最近的研究表明,外周超敏反应信号会影响中枢神经系统,从而引发抑郁或焦虑,进而影响内脏敏感性并引起肠道运动功能障碍[6]。目前对IBS类似症状的治疗主要集中在肠道和内脏疼痛上[8],但效果并不理想。因此,针对脑-肠轴的治疗理念越来越值得关注[9]。
肠道内稳态的维持需要完整的上皮屏障将肠壁与存在于肠腔内的有害细菌隔离。肠上皮屏障紊乱可使管腔内容物不受约束地进入粘膜,激活粘膜免疫反应[10],进而影响分泌、吸收和运动等肠道功能[11]。事实上,越来越多的证据表明肠上皮屏障破坏是一种潜在的致病机制,其与PI-IBS的发病或发展有关[12]。近年来,参与上皮屏障功能调节的介质研究引起了广泛关注。脑源性神经营养因子(BDNF)是神经营养因子的一种[13],已被证实在几个发育和成熟的外周组织中表达,包括胃肠道、多条血管和牙周组织[14]。多项研究表明,神经细胞分泌的各种可溶性因子,包括神经生长因子(NGF)、BDNF和神经胶质源性神经营养因子,可能对维持血神经屏障的完整性或通透性和改变紧密连接分子至关重[15]。
白藜芦醇(resveratrol,RES)是一种天然多酚,存在于红酒、葡萄皮和结缕草中[16]。它具有许多生物活性,包括抗炎、抗氧化、抗肿瘤和神经保护效应[17]。越来越多的证据表明,在许多疾病动物模型中发现RES的抗抑郁和抗焦虑特性与神经递质调节有关[18]。最近的研究还表明RES能够调节脑和肠道中BDNF的表达[19]。三硝基苯磺酸(TNBS)是炎症型IBS模型中常用的药物,在IBS机制研究中得到了广泛的应用[19-20]。IBS动物模型可以在很大程度上从中枢神经系统紊乱到肠动力和内脏知觉障碍模拟IBS的症状[21]。因此,本研究拟通过使用2,4,6 -三硝基苯磺酸(TNBS)诱导的炎症型小鼠肠应激综合征(PI-IBS)模型,探究RES在调节PI-IBS小鼠肠上皮屏障功能和内脏敏感性中的作用和机制。
资料与方法
1 实验动物
8w SPF级C57BL/6雄性小鼠30只,购于南京医科大学医药实验动物中心。实验动物合格证号:SCXK(苏)2016-0002。动物自由饮食并置于恒定环境[温度(22±2)℃,湿度(50±5)%,12 h昼夜循环光照 ]下饲养,实验动物伦理编号为:IACUC-2206022。
2 主要试剂
白 藜 芦 醇(货 号:R817263,Cas号:501-36-0,纯度≥99%)购自上海麦克林生物有限公司;2,4,6-三硝基苯磺酸(TNBS,P2297)购自美国Sigma公司;羧甲基纤维素钠(CMC-Na)购自上海博蕴生物科技有限公司;PKA抗体(ab76238)、BDNF抗体(ab108319,)、兔抗 ZO-1 抗体(ab221547)、Occludin抗体(ab216327),Claudin-2抗体(ab53032),羊抗兔IgG辣根过氧化物酶(HRP)偶联二抗(ab7090)和羊抗鼠HRP偶联二抗(ab97040)购自英国Abcam公司;p-CREB(06-519)和CERB抗体(06-863)购自Millipore公司;GAPDH 兔单克隆抗体(A19056)购自中国Abclonal公司。
3 主要仪器
显微镜(Bx51),日本Olympus公司;小型垂直电泳槽(1658001),美国Bio-Rad公司;电泳仪电源(DYY-6C),北京市六一仪器厂;化学发光成像系统(Chemi-Doc XRS+Molecular Imager),美国 Bio-Rad 公司。
4 方法
4.1 PI-IBS小鼠造模 参考Hughes PA等的方法建立PI-IBS小鼠模型[20]。小鼠1%戊巴比妥钠麻醉后,从肛门插入插入聚乙烯导管至3厘米处,然后单次直肠内给药TNBS 0.1 mL(溶于30%乙醇,终浓度为130 mg/mL)诱发结肠炎。小鼠结肠炎27天后恢复,28天后进行实验。
4.2 分组与干预 使用随机数字表法将30只雄性C57BL/6小鼠随机分为三组,每组10只。Control组(对照组):小鼠按体质量(0.5 mL/100 g)灌胃 0.5%CMC-Na[19];PI-IBS组(模型组):使用 TNBS进行小鼠PI-IBS造模27天后用于实验;PI-IBS+RES组(治疗组):造模后,每天1次40mg/kg白藜芦醇灌胃处理[18,22,23]。白藜芦醇溶于 0.5% CMC-Na 中,于给药当天稀释至所需浓度。
4.3 粪便排出量测定 诱导结肠炎后第28天,将小鼠单独置于代谢笼中,收集2 h粪便样本并称重。将收集的粪便样本置于干燥器中,加热6 h后称重。记录粪便总湿重和总干重。粪便含水率按以下公式计算:粪便含水率(%)=(湿粪重-干粪重)/湿粪重×100%。将粪便颗粒数记为排便次数。
4.4 腹 壁 回 撤 反 应(abdominal withdrawal reflex,AWR)评分 采用AWR评分评价小鼠内脏敏感程度。参考文献方法[20,23],具体实验过程如下:小鼠禁食不禁水24 h后,经肛门插入带气囊的导管,待适应后开始检测。达到目标压力后持续20 s,评分后压力回至零点,气囊内压力由 20 mmHg(1 mmHg=0.133 kPa)开始,每隔 5 min 分别递增至 40、60、80 mmHg,根据AWR进行评分[24]:0分,结肠扩张时无反应;1分,结肠扩张时身体静止不动,头部运动减少;2分,结肠扩张时腹部肌肉收缩,但腹肌未抬离桌面;3分,结肠扩张时腹部肌肉收缩,腹肌抬离桌面;4分,结肠扩张时骨盆抬起,身体呈弓形。
4.5 免疫组化 各组小鼠的远端结肠组织中切取4 μm厚的切片。去除抗原后,用正常山羊血清封闭切片,并用ZO-1抗体和Occludin抗体4°C孵育过夜。用PBS清洗切片,室温下二抗孵育2 h。用二氨基联苯胺作显色剂,然后用苏木精复染,在光学显微镜下观察拍照并使用 Image Pro Plus 6.0 软件定量。
4.6 透射电镜 将小鼠结肠组织剪成芝麻粒大小,在2.5%戊二醛中4℃固定48 h。随后组织在0.5%四氧化锇中后固定、脱水并浸入环氧树脂。制作组织超薄切片(厚度:90 nm),并使用透射电子显微镜(Tecnai G2 Spirit Bio TWIN;FEI Ltd.)在 120 kV 加速电压和15000放大倍数下进行检查拍照。
4.7 蛋白免疫印迹(western blot) 蛋白免疫印迹检测小鼠海马体和结肠粘膜PKA、p-CREB、CREB、BDNF和Claudin-2表达。小鼠结肠黏膜组织裂解物50 ug经十二烷基硫酸钠/聚丙烯酰胺凝胶电泳后转移到醋酸纤维素膜上。用5%脱脂牛奶封闭膜约4 h,然后用 PKA(1:500),p-CREB(1:500)、CREB(1:500)、BDNF(1:500)、和 Claudin-2(1:500)4℃孵育过夜。经TBST洗涤3次后,用HRP偶联的二抗在室温下孵育1h。GAPDH为蛋白对照。在室温下在封闭缓冲液中放置2 h,然后用Tris缓冲盐水-Tween-20(TBST)冲洗膜3次,并用ChemiDoc XRS+分子成像仪成像。所有图像均使用imagej1.42软件图像分析定量。
4.8 统计学分析 采用GraphPad Prism 8软件进行统计分析,定量资料以(±s)表示,组间比较采用单因素方差分析(One way ANOVA)和t检验。
结 果
1 RES对PI-IBS小鼠粪便含水量和颗粒数的影响
与Control组小鼠比较,PI-IBS组小鼠粪便含水量 [(49.83±2.52)%]和 粪 便 颗 粒 数(6.78±0.32)显 著 增 加(t=-9.2226,P=0.0007和t=-11.1935,P=0.0003;表1);与 PI-IBS组小鼠比较,PI-IBS+RES组小鼠粪便含水量[(38.12±1.95)%]和粪便颗粒数(4.12±0.29)显著增加(t=-3.7800,P=0.0030和t=-4.5197,P=0.0094;表1)。
表1 各组小鼠粪便含水量和颗粒数测定(±s,n=6)

表1 各组小鼠粪便含水量和颗粒数测定(±s,n=6)
注:与 Control组比较,*P< 0.05,**P< 0.05;与 PI-IBS 组比较,#P< 0.05,##P< 0.05
组别 粪便含水量/% 粪便颗粒数/个Control组 31.33±2.42 3.1±0.21 PI-IBS组 49.83±2.52* 6.78±0.32*PI-IBS+RES组 38.12±1.95*## 4.12±0.29*##
2 RES对PI-IBS小鼠内脏敏感性的影响
与 Control组 比 较,PI-IBS组 小 鼠 在 40、60、80 mmHg压力直肠扩张下AWR评分明显增高(t=-4.2758,P=0.0128,t=-5.2311,P=0.0064和t=-4.6552,P=0.0048;表2),表明实验小鼠在诱导炎症型肠应激综合征后内脏疼痛阈值下降,肠道敏感性增加;在给予RES治疗后AWR评分不同程度降低,PI-IBS+RES组在 40、60、80 mmHg 压力下均能明显逆转 PI-IBS小鼠 AWR 评分增高现象(t=-2.5731,P=0.0391,t=-2.5733,P=0.0268和t=-0.7229,P=0.0168;表2),体现RES在一定程度上具有改善IBS大鼠肠道高敏状态的作用。
表2 各组小鼠内脏敏感性测定(±s,n=6)

表2 各组小鼠内脏敏感性测定(±s,n=6)
注:与 Control组比较,*P< 0.05,**P< 0.05;与 PI-IBS 组比较,#P< 0.05,##P< 0.05
组别 20mmHg 40mmHg 60mmHg 80mmHg Control组 0.8±0.1 1.5±0.16 2.19±0.11 3.21±0.10 PI-IBS 组 1.19±0.14*1.98±0.12*2.64±0.14**3.63±0.15**PI-IBS+RES 组 1.12±0.11*1.74±0.08#2.38±0.09#3.27±0.11#
3 RES对小鼠结肠Occludin和ZO-1表达的影响
Occludin和ZO-1表达于小鼠结肠上皮袖口和隐窝中(图1A)。定量分析结果表明,与Control组比较,PI-IBS小鼠的结肠粘膜中Occludin和ZO-1的表达显著降低(t=14.2681,P=0.0001和t=-9.6747,P=0.0006;图1B);与 PI-IBS组比较,PI-IBS+RES小鼠的结肠粘膜中紧密连接蛋白Occludin和ZO-1的表达明显升高(t=16.2278,P=0.0018和t=-5.2680,P=0.0046;图1B)。
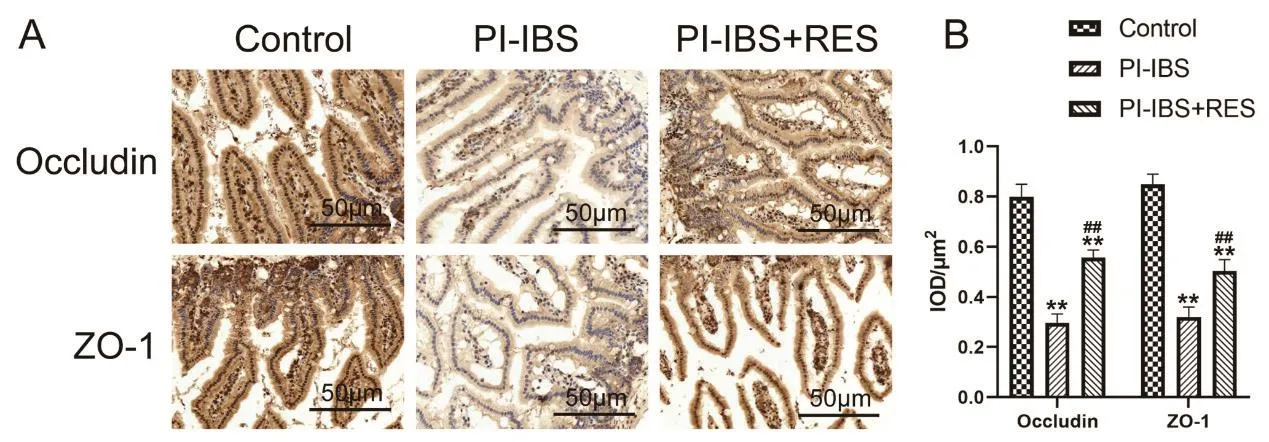
图1 RES对小鼠结肠Occludin和ZO-1表达的影响
4 小鼠结肠粘膜透射电镜观察
各组小鼠结肠组织透射电镜的结果显示,Control组小鼠结肠组织上皮完整,微绒毛有序,紧密连接完整,线粒体完整,线粒体嵴清晰明显(图2A,B)。与Control组比较,PI-IBS小鼠的结肠组织上皮不完整,微绒毛紊乱,紧密连接不完整,线粒体嵴不明显或消失。而与PI-IBS相比,白藜芦醇治疗(PI-IBS+RES组)显著改善了结肠组织微绒毛、紧密连接和细胞器的病变(图2A,B)。
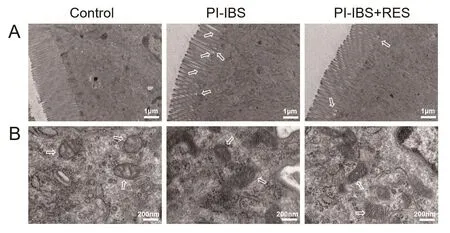
图2 透射电镜检测RES对小鼠结肠组织病变的作用
5 RES对小鼠结肠相关蛋白表达的影响
使 用 Western blot方 法 检 测 RES 对 PI-IBS 小鼠结肠相关蛋白 PKA、p-CREB、CREB、BDNF和Claudin-2的表达(图3A)。定量分析结果表明,与Control组比较,PI-IBS小鼠的结肠粘膜中PKA、p-CREB、BDNF和Claudin-2表达显著升高(t=11.6532,P=0.0078,t=-3.5674,P=0.0084,t=4.5821,P=0.0091和t=-5.8659,P=0.0063;图3A);与 PI-IBS组 比较,PI-IBS+RES小鼠的结肠粘膜中PKA、p-CREB、BDNF和 Claudin-2的 表 达 显 著 降 低(t=5.7685,P=0.0038,t=3.5236,P=0.0054,t=-5.8964,P=0.0032和t=6.3562,P=0.0260;图3A);而在海马体中,与Control组比较,PI-IBS小鼠的海马体中PKA、p-CREB和 BDNF表达显著降低(t=5.5238,P=0.0047,t=3.6985,P=0.0056和t=4.6332,P=0.0023;图3B);与PI-IBS组比较,PI-IBS+RES小鼠的海马体中PKA、p-CREB和BDNF的表达显著增高(t=6.3221,P=0.0075,t=-7.2658,P=0.0092 和t=7.6954,P=0.0055;图3B)
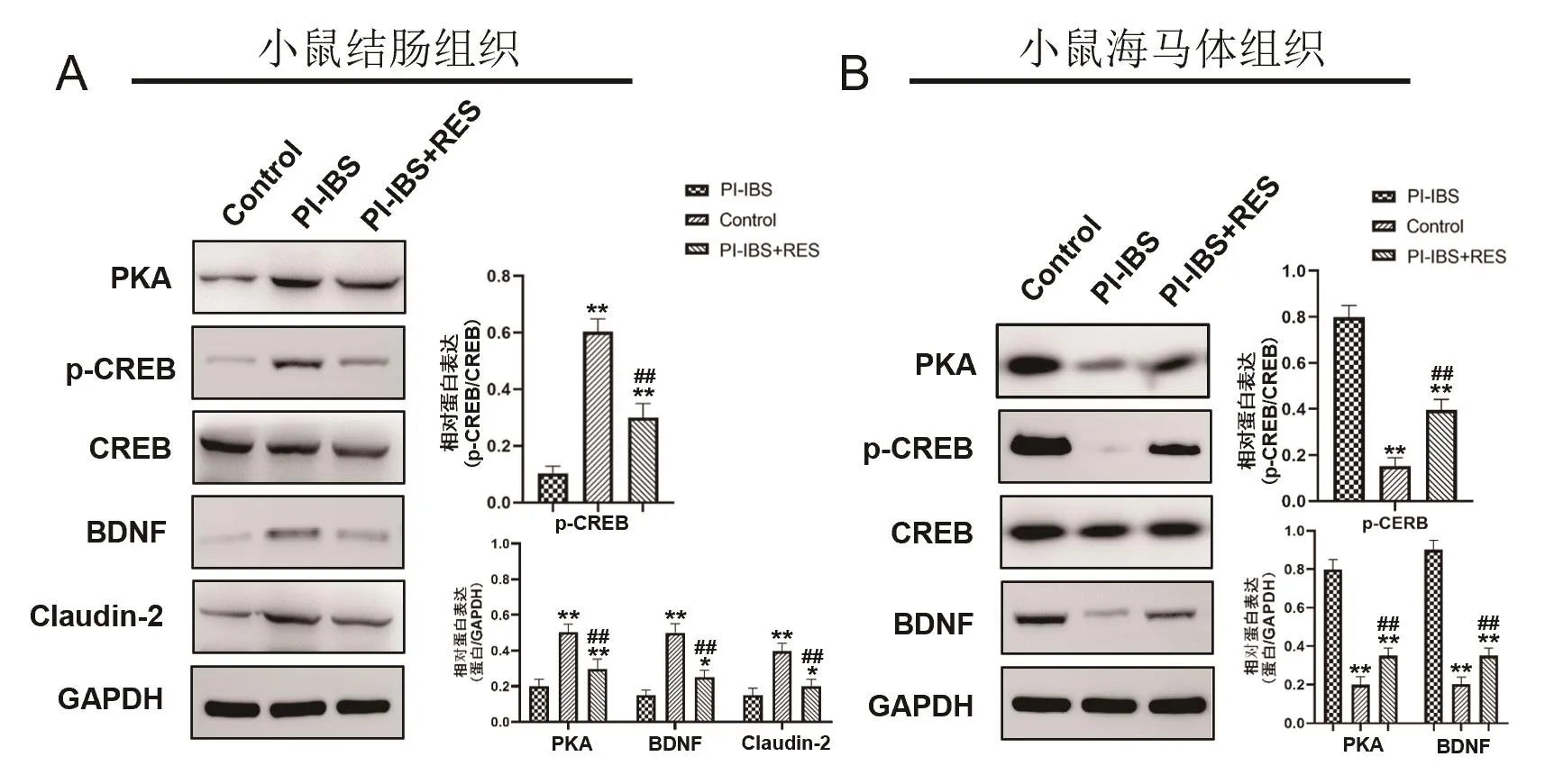
图3 RES对小鼠结肠相关蛋白表达的影响
讨 论
有研究表明多酚类化合物RES在情绪障碍疾病中的作用,其中有涉及神经系统的保护[24]、抗抑郁[25]以及神经退行性疾病的预防作用[26]等。肠屏障缺陷是和胃肠疾病(包括IBS)发生、恶化和随后炎症反应的重要原因[27]。鉴于IBS在肠道和精神情绪方面的病理特点与RES的药理特点相吻合,本实验探究了RES在调节PI-IBS小鼠肠上皮屏障功能和内脏敏感性中的作用和机制。使用TNBS小鼠直肠内给药28天后(恢复期)形成PI-IBS模型,表现为肠粘膜屏障功能受损,肠道通透性增加,与对照组相比,PIIBS小鼠粪便含水量显著增加;内脏疼痛阈值下降,肠道敏感性增加;结肠粘膜中紧密连接(TJ)蛋白包括 Occludin和 ZO-1显著降低,而 PKA、p-CREB、BDNF和Claudin-2表达明显升高。而在小鼠海马体,PKA、p-CREB、BDNF的表达模式与结肠完全相反。这一结果与Yu等人的实验结果相似[19,24],即RES可以逆转脑和肠中BDNF的表达,通过调节脑-肠相互作用,维持脑-肠相互作用的稳态。我们的结果证实RES能改善IBS症状,并且RES对炎症诱导的小鼠海马PKA、pCREB和BDNF表达的降低和结肠PKA、pCREB和BDNF表达的增高有一定的抑制作用。RES对IBS大鼠脑肠BDNF系统紊乱的调节作用与其参与PKA-CREB-BDNF信号调节有关[28]。临床上,IBS-D患者肠黏膜BDNF表达也显著上调[29]。BDNF在不同的损伤过程中上调:在中枢神经系统,BDNF上调参与了多发性硬化病变的内源性神经营养支持[30];在血管系统,成年大鼠和人主动脉的新生内膜血管平滑肌细胞中BDNF的表达显著增加以应对血管损伤[31],这一过程在新生内膜形成过程中持续存在;这些结果说明BDNF在PI-IBS小鼠肠道屏障改变中具有病理生理的作用。
肠屏障缺陷被认为是随后炎症反应和重要胃肠疾病(包括肠易激综合征)发生和恶化的关键步骤[27]。为了进一步探讨RES调节肠上皮屏障功能的机制,我们探究了RES和TJ蛋白的关系。我们证明RES通过调控BDNF对肠上皮屏障的调节与肠上皮细胞TJ蛋白表达的改变有关。TJ跨膜蛋白如Occludin、Claudin-1和支架蛋白ZO-1负责屏障的完整性[32]。本研究观察到RES处理后结肠粘膜中Occlutdin和ZO-1的表达上调和Claudin-2表达下降。Claudin-2可增加上皮细胞对水的通透性,在孔道形成和维持肠黏膜屏障等方面发挥重要作用[33]。研究发现IBS大鼠结肠组织Claudin-2表达增多,ZO-1等表达减少,肠黏膜屏障损伤[19]。由此可见,Claudin-2 等TJ 蛋白数量和结构功能的改变,可导致肠上皮紧密连接损伤,引起肠黏膜屏障破坏,继而引起腹泻等症状的产生。临床上,IBS-D患者的结肠和空肠中TJ蛋白Occludin、ZO-1、claudin-1、claudin-2的表达会发生改变,并伴有相应的肠屏障缺损[28]。本研究表明,在TNBS诱导的结肠炎后PI-IBS小鼠表现出肠屏障结构和功能的破坏,与TJ蛋白的表达水平改变有关,这是IBS-D患者的共同特征[34]。
综上,本研究表明RES 可通过调控PKA/CERB/BDNF信号从而调节结肠TJ蛋白的表达;显著缓解PI-IBS小鼠肠粘膜屏障损伤。为RES用于PI-IBS临床治疗提供了实验基础和理论依据。
