西黄丸治疗原发性肝癌的活性成分及作用机制*
2023-03-22龙雪晴陈威童汪霞
龙雪晴,陈威,童汪霞
1 广西中医药大学研究生院 广西南宁 530001
2 广西中医药大学附属瑞康医院 广西南宁 530000
肝细胞癌(Hepato Cellular Carcinoma,HCC)是最常见的原发性肝癌,占所有原发性肝脏恶性肿瘤的90%以上[1]。原发性肝癌是一个重大的国际健康问题。全球肝癌发病率一直在上升,2012年新发病例增至782,000例[2]。根据巴塞罗那临床肝癌(Barcelona Clinical Liver Cancer,BCLC)分 期系统,肝癌的治疗应利用肿瘤负荷、潜在的肝功能和表现状态来对患者进行分层,以选择适当的治疗方案。但总的发展趋势正朝着治疗方案的整合发展。多作用、多靶点的治疗将显示出比任何单一手术或靶点药物更好的疗效。
中医将原发性肝癌以“肝积”称之,中药活性成分通过多种机制发挥抗肝癌作用,包括调节肿瘤组织微环境,抑制肿瘤干细胞增殖,抑制肿瘤血管形成,促肿瘤细胞凋亡、抑制其转移,还通过免疫炎症调节杀灭肿瘤细胞[3-4]。西黄丸处方来源于《外科证治全生集》,是清代名医王洪绪的祖传秘方,由牛黄(NH)15g,麝香(SX)15g,乳香(RX)550g,没药(MY)550g制成[5]。全方以清热解毒与豁痰散结为主,活血祛瘀药为辅,多用于治疗痈疽疔毒、瘰疬、流注、癌肿等。现代药理研究表明,西黄丸中的活性成分可通过多个靶点干预肿瘤细胞的代谢、转运或吸收,从而抑制肿瘤生长、侵袭和转移。西黄丸中的几种成分,如麝香酮、β-乳香酸及没药甾酮,通过抑制肿瘤新生血管生成,抑制肿瘤细胞DNA的合成以及抑制抗凋亡基因等机制而显示出治疗肿瘤的活性[6-7]。然而,西黄丸的综合成分及其多重作用,以及抗肝癌的潜在机制还没有得到很好地阐明。
网络药理学是一种新兴的方法,这一方法已经成功地用于阐明中医药在几种疾病中的多靶点效应[8-10]。网络药理学有效地弥合了西医和传统医学之间的鸿沟,极大地促进了对中药协同作用的机械性研究[11]。本研究旨在运用系统网络药理学分析方法,鉴定中药复方西黄丸治疗原发性肝癌的活性成分及其作用机制。
材料与方法
1 西黄丸活性成分的提取与筛选
西黄丸中牛黄、乳香、没药的化学成分均来自中医药系统药理数据库分析平台TCMSP(https://tcmspw.com/tcmsp.php)。分别以牛黄、乳香、没药为关键检索词,在TCMSP数据库中获得了西黄丸中3味药物的有效活性成分,并通过口服生物利用度(OB),药物相似性(DL)等信息对上述三种药物活性成分的ADME性质进行过滤。麝香则使用BTAMAN-TCM数据库查找药物的有效活性成分,在SWISSADME数据库中对有效成分依据其ADME性质进行过滤,过滤条 件 如 下:GI absorption:high 以 及 Lipinski,Ghose,Veber,Egan,Muegge5个条件里面满足2个及以上为YES为符合纳入标准。
2 西黄丸活性成分作用靶点的预测
西黄丸中的牛黄、乳香、没药三种药物在TCMSP数据库中提取活性成分的对应靶点,麝香则使用SwissTargetForecast (http://www.swisstargetprediction.ch/)数据库提取相应靶标[12]。目的蛋白的标准基因名称和UniProtID从UniProt(https://www.uniprot.org/)数据库中获得,用“人类”对物种进行限制[13]。
3 原发性肝癌肿瘤基因的提取
在TCGA数据库中,只提取能翻译为蛋白的原发性肝癌转录组数据中的基因表达量。其中肿瘤样本407例,正常组织58例。按照fdr=0.05,logFC=1进行计算,得到较正常组织基因表达异常的肿瘤基因。
4 核心靶点筛选及有效成分-靶标的网络构建
使用在线工具Venny(http://bioinformatics.psb.ugent.be/webtools/Venn/)绘制西黄丸有效活性成分靶点和原发性肝癌相关靶点的韦恩图,进而得到交集靶点。使用Cytoscape v3.8.0软件构建西黄丸有效活性成分与交集靶标之间的调控网络图。
5 蛋白质相互作用关系分析(PPI网络)
将筛选得到的西黄丸抗肝癌的交集靶点蛋白以gene symbol形式上传到 String 数据库(https://stringdb.org/),限定研究物种为人类,置信分数>0.4,进行蛋白与蛋白相互作用分析,得到蛋白质相互作用网络图。
6 中心网络分析及核心基因的筛选
中心网络分析采用拓扑法。通过中心度(DC)、中间中心度(BC)和贴近中心度(CC),特征向量(EC),基于局部平均连接度的方法(LAC)这5个拓扑参数来评价网络中节点的中心属性。在中心网络中,以上参数均设定为≥中位值为筛选标准获得关键靶点。
7 西黄丸相关靶点的功能富集分析
使用 R studio中的“clusterProfiler”软件包对核心基因进行GO(Gene Ontology)富集分析及KEGG(Kyoto Encyclopedia of Genes and Genomes)通路分析。其中,显著富集的KEGG通路应至少含有3个基因,且P<0.05[14]。
8 分子对接评价
使用AutoDock 4.0软件评估具有活性化合物的核心基因,该软件被广泛用于研究配体与蛋白质的结合构象和结合自由能[15]。
结 果
1 西黄丸生物活性物质的提取
使用TCMSP数据库及BTAMAN-TCM数据库检索西黄丸四种药物所含的有效成分。从TCMSP数据库中,共得到牛黄19个化合物和乳香127个化合物,没药276个化合物。从BTAMAN-TCM数据库中检索到麝香含29个化合物。牛黄、乳香及没药通过ADME相关药代动力学参数OB和DL进行筛选,筛选标准为OB≥30%和DL≥0.18。麝香所含有效成分使用WISSADME数据库过滤,过滤条件为 GI absorption:high 以及 Lipinski,Ghose,Veber,Egan和Muegge以上5项条件里面满足2项YES为纳入标准。在此基础上再删除无对应靶点的化合物后,牛黄含5种化合物,乳香含5种,没药含31种,麝香共含8种化合物,综合以上药物共鉴定出无重复有效化合物成分共49种(图1A)。
2 西黄丸有效成分的作用靶点
西黄丸中的牛黄、没药、乳香的作用靶点在TCMSP数据库中提取。在合并重复靶点后,牛黄5种化合物成分对应靶点共5个,没药31种化合物成分共对应175个靶点基因,乳香5种化合物成分共对应11个靶点基因。麝香有效成分的作用靶点在SwissTargetPrediction数据库中按照probability×>0.5进行过滤,合并重复的靶点后,麝香8种化合物成分共对应92个靶点基因。综合以上,西黄丸中49种化合物确定了245个靶点基因(图1B)。
3 药物有效成分及其对应的靶点构建网络
在UniProt数据库中将对应的基因名称转换为基因符号,利用Cytoscape构建了化合物和靶点基因间的相互作用网络。如图1C所示,化合物和靶点(Compounds-Targets)相互作用的二分图,由294个节点(化合物49个,靶点基因245个)和513条边组成。其中,位居前三的重要成分分别为MOL000098(quercetin,槲皮素,138个连接)、CID5281670(Morin,桑色素,72个连接)和MOL000358(beta-sitosterol,β-谷甾醇,28个连接)。这些结果表明,一种化合物可以影响多个靶点,这些靶点可能与西黄丸的抗肿瘤作用有关。
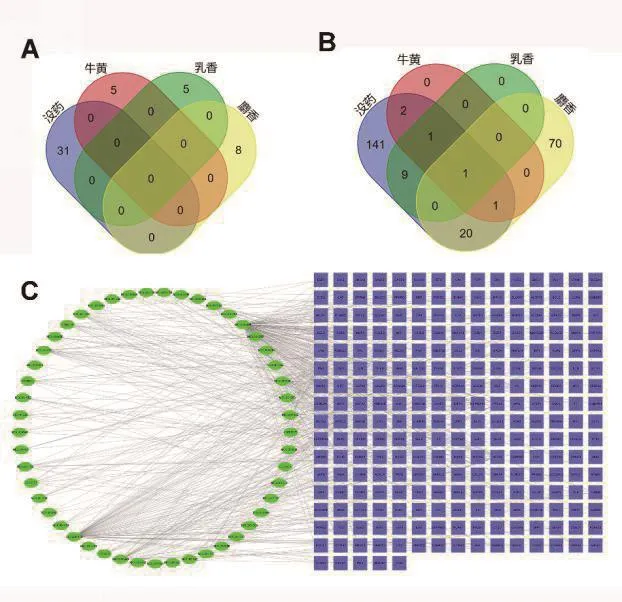
图1
4 原发性肝癌差异基因的提取及药物-肿瘤靶点基因的筛选
在TCGA数据库中,调取原发性肝癌转录组数据中的基因表达量,其中,肿瘤样本407例,正常组织对照58例。按照fdr=0.05,logFC=1进行计算,共有6229个基因差异表达,其中,5895个基因表达上调,334个基因表达下调。上调及下调前20位的基因表达如图2A所示。我们将之前得到的245个药物靶点基因与6229个肝癌差异基因进行交集,共得到87个交集基因。其中,74个基因表达上调,13个基因表达下调(图2B)。
5 西黄丸活性成分-原发性肝癌靶点网络的构建
使用cytoscape软件构建了药物活性成分和交集靶点间的网络图(图2C)。该网络中共有115个节点,由28个活性成分和87个肿瘤靶点组成,通过156个相互作用连接。其中MOL000098(quercetin,槲皮素,49个连接),CID5281670(Morin桑色素,27个连接),MOL000358(beta-sitosterol,β-谷甾醇,9个连接)是权重靠前3的药物有效成分;而靶点中排列靠前的基因分别为PTGS2(14个连接),HSP90AB1(9个连接)、CHRM3及CYP19A1(均为7个连接)。
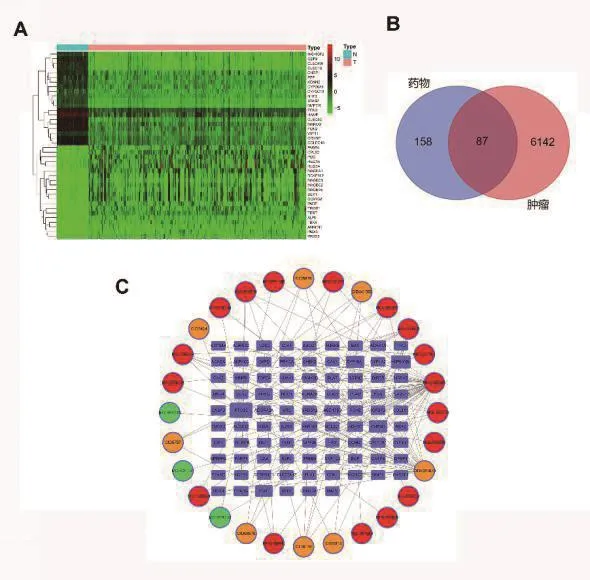
图2
6 PPI网络分析与关键活性成分筛选
利用String在线数据库分析蛋白质与蛋白质的相互作用,构建相关的PPI网络,并用cytoscape软件进行可视化。以置信度0.4为阈值,我们在PPI网络中找到了82个节点和484个交互。使用cytoscape软件中的插件cytoNCA软件对上述网络中的关键基因进行过滤,过滤条件为:Betweenness:21.24276182,Closeness: 0.465517241,Degree:10,Eigenvector: 0.056190023,LAC: 5.0714285715,Network:6.4666666665,共得到27个关键基因,如图3A中黄色圆形所示。用cytoscape软件中的插件cytoNCA软件再次对上述网络中的关键基因进行过滤,过滤条件为:Betweenness: 5.763564214,Closeness: 0.65,Degree: 24,Eigenvector: 0.169159561,LAC: 19,Network: 19.95859213,得到 12个关键基因,如图3B 中黄色圆形所示。将这些关键基因构建子网络,这个网络由12个基因,124条边组成,如图3C所示。这12个核心基因被鉴定为中枢基因,包括FOS、CCNB1、CASP8、ESR1、CASP3、EGF、BCL2L1(均为 22个连接)以及MMP9、SRC(均为20个连接)和PTGS2、CDK1、CDK2(均为18个连接)。接下来我们构建了能与12个核心基因相互作用的化合物-靶点调控网络(图3D),这个网络由31个节点(化合物19个,靶点基因12个),41条边组成。在药物活性成分和12个关键基因的调控网络中,对应靶点较多的是来自没药的MOL000098(quercetin,槲皮素),对应靶点9个。其次是来自麝香的CID5281670(Morin,桑色素),对应靶点3个。来自没药的MOL000358(beta-sitosterol,β- 谷甾醇)及 MOL001002(ellagic acid,鞣花酸),对应靶点均为3个。
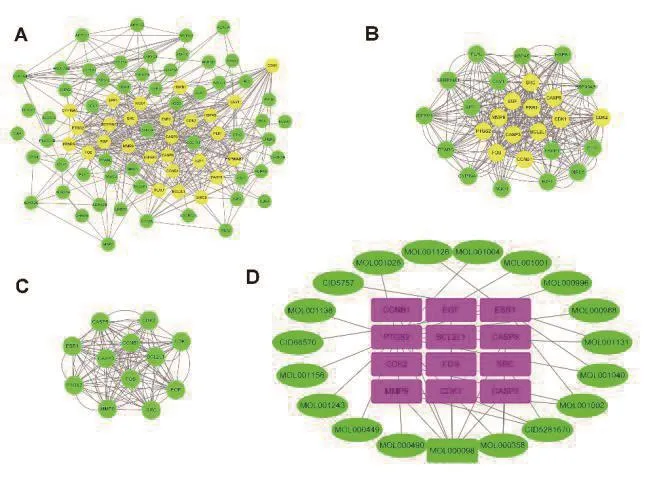
图3
7 活性成分-肝癌靶点网络GO富集分析和KEGG通路分析
为了研究西黄丸与原发性肝癌治疗相关的相互作用网络的生物学功能,我们使用clusterprofile R软件包对12个核心基因进行了GO和KEGG途径富集分析。分析了三种GO类别,包括细胞组分(CC,cell component)、分子功能(MF,molecular function)和生物过程(BP,biological process)。GO 和 KEGG 途经富集分析结果见图4A-B。细胞成分显示与周期蛋白依赖的蛋白激酶全酶复合物,丝氨酸/苏氨酸蛋白激酶复合物的合成以及膜筏,膜微结构域等细胞膜成分密切相关,这些酶类主要参与细胞周期及信号转导过程,而膜筏及膜微结构域等则参与细胞质膜或胞浆中的蛋白质的合成,一起调节癌细胞的增殖。分子功能主要涉及凋亡过程及细胞周期过程中重要参与酶类的活性调控,与肝癌细胞的增殖及凋亡息息相关。结合BP结果提示,西黄丸可能调节与原发性肝癌相关的生物学过程,如“细胞对化学压力的反应”、“对活性氧的反应”、“凋亡信号通路的负调控”等。KEGG富集分析结果则提示与原发性肝癌相关的通路包括“p53信号通路”、“乙型肝炎病毒”、“IL-17信号通路”、“凋亡通路”和“病毒致癌相关通路”(图4B)。表明西黄丸可能通过与细胞外空间、质膜或胞浆中的蛋白质、酶和转录因子结合来调节癌细胞的凋亡及增殖,从而在原发性肝癌中表现出抑制作用。我们以p53信号通路为例,观察上述核心基因在通路中的位置,具体在通路中的位置见图5。
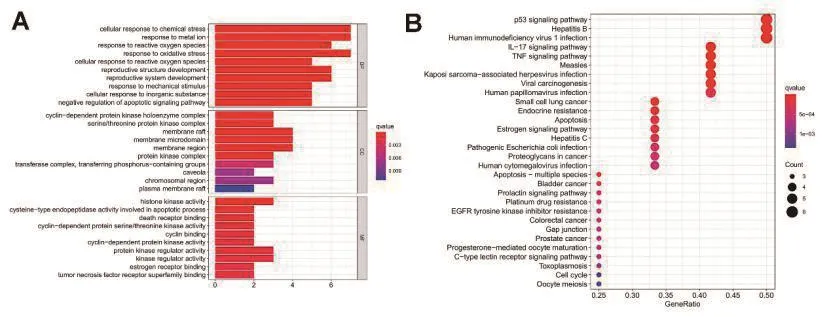
图4 西黄丸活性成分对应靶点的 GO(Gene Ontology)及 KEGG(Kyoto Encyclopedia of Genes and Genomes)富集分析结果
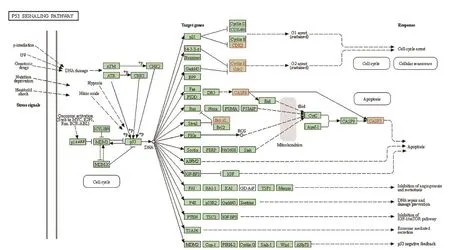
图5 p53信号通路的KEGG富集图
8 分子对接
为了验证化合物与靶点基因之间结合的可能性,我们以p53信号通路为例,做了有效成分与核心基因的分子对接。BCL2L1与槲皮素,最佳结合自由能为-7.9kcal/mol;CASP3与槲皮素,最佳结合自由能为-8.0kcal/mol;CASP3与β-谷甾醇,最佳结合自由能为-8.6kcal/mol;CASP8与槲皮素,最佳结合自由能为-7.6kcal/mol;CASP8与β-谷甾醇,最佳结合自由能为-7.0kcal/mol;CCNB1与槲皮素,最佳结合自由能为-7.4kcal/mol;CDK1与槲皮素,最佳结合自由能为-8.4kcal/mol;CDK1与桑色素,最佳结合自由能为-8.4kcal/mol;CDK2与鞣花酸,最佳结合自由能为-10.1kcal/mol(图6)。
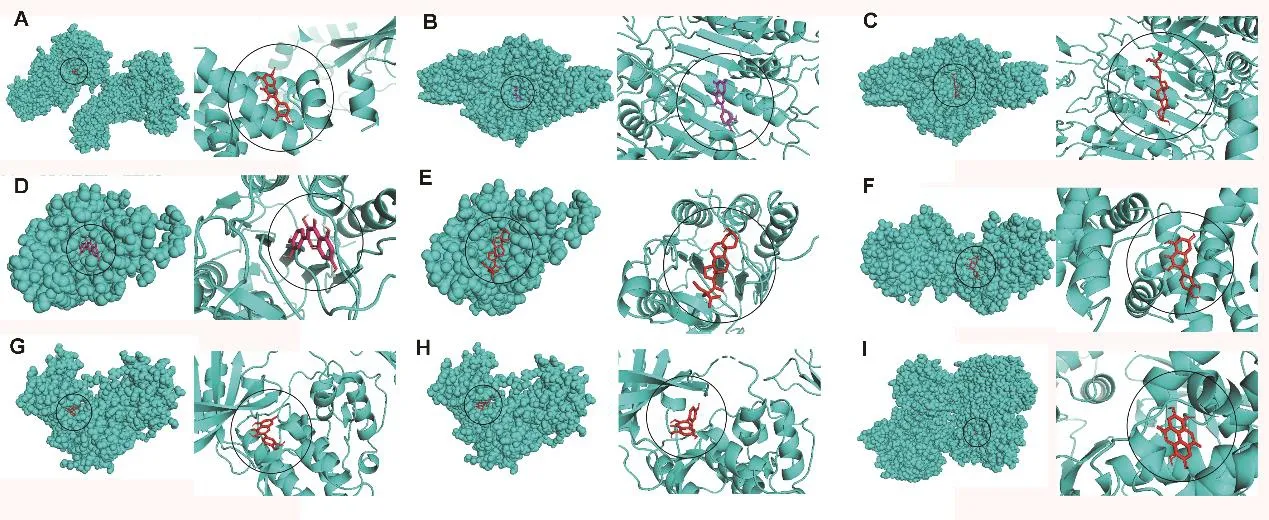
图6 原发性肝癌靶基因BCL2L1、CASP3、CASP8、CCNB1、CDK1、CDK2与药物有效成分槲皮素、β-谷甾醇、鞣花酸、桑色素的分子对接图
讨 论
根据中医辨证论治原则,正气内虚,肝气郁结,瘀毒留滞是肝癌形成的主要因素。中医药治疗肝癌以扶正祛邪、攻补兼施为基本原则,根据病情进展程度、病程长短具体辨证施治。西黄丸作为具有抗癌作用的经典名方,具有扶正固本、清热解毒、软坚散结、消肿镇痛功效,临床主要用于肝癌、乳腺癌、肺癌等多种恶性肿瘤的治疗和辅助治疗。在本研究中,我们利用现代网络药理学对其可能的活性成分及其抗肿瘤机制进行了分析并得到以下结果。
研究中,我们从公共数据库中共鉴定出西黄丸四种药物的49个活性化合物和245个化合物相关靶点,以及6229个肝癌相关靶点。在这些靶点中,有87个靶点在化合物相关靶点和肝癌相关靶点之间共享,提示西黄丸有抗肝癌的作用。通过网络建设和中心网络评价,筛选出西黄丸抗肝癌靶点网络中的12个关键基因。在12个关键基因的KEGG富集分析结果中,与肝癌相关并排列靠前的3个通路分别为:p53信号通路,乙型肝炎病毒感染相关通路及IL-17信号通路。这些信号通路涉及肝癌的发生,凋亡及自身免疫过程。说明西黄丸的有效成分可以通过上述信号通路对原发性肝癌进行多靶点干预。
西黄丸中的四种药物分别是牛黄、麝香、乳香(醋制)和没药(醋制)。牛黄为方中君药,来源为牛科动物黄牛或水牛的干燥胆结石(主要来自于胆囊结石,少数为胆管或肝管结石)。其中的物质主要包含胆红素、胆汁酸、胆固醇等成分。牛黄味甘,性凉,归心、肝经,具有清热解毒、化痰散结,息风定惊功能[16-17]。臣药麝香为鹿科动物林麝、马麝或原麝成熟雄体香囊中的干燥分泌物[18],其物质主要包含麝香酮、降麝香酮、芳活素等有效成分。麝香味辛,性温,归心、脾经。具有开窍辟秽、活血散结的作用。佐药乳香为橄榄科植物乳香树及同属植物茎枝树皮部渗出的胶状树脂。其物质主要包含α-乳香脂酸,β-乳香脂酸,蒎烯等成分。乳香性温,味辛、苦,具有消肿、镇痛、活血功效。没药在西黄丸中为佐药,是橄榄科植物没药树及同属其他种植物树皮渗出的油胶状树脂。其成分包括倍半菇、甾体、木脂素类等物质。没药性平、味苦,归心、肝脾经。具有活血止痛、消肿生肌功效[19]。全方具有清热解毒、化痰散结、活血化瘀之功效,祛邪而不伤正。
以往研究表明,西黄丸可通过抑制肿瘤细胞生长、侵袭和肿瘤组织内血管生成,通过提高机体免疫力,逆转免疫抑制微环境,抑制肿瘤的发生发展和侵袭转移。如在Xinye L等人的研究中,西黄丸可以通过调控PI3K/AKT信号通路,JNK1/AP-1信号通路或MEKK1/SEK1等信号通路来抑制肿瘤生长和增殖[20-21];在Wang X等人的研究中,西黄丸可以通过降低 EMT 转录因子 ZEB 1(zinc finger E-box-binding protein 1)的活性,下调其下游靶基因 ERK 1/2、E- 钙黏蛋白、闭锁蛋白(occludin)和连接附着分子(JAM 1)等因子的表达水平,从而逆转ZEB 1介导的EMT,实现抗结肠癌复发、侵袭转移的目的[22];此外,研究还发现,西黄丸还可以通过促进Th1细胞增殖并分泌IL-2和IFN-γ,对免疫微环境进行调控,进而直接或间接发挥抗乳腺癌作用[7]。
在本研究中,西黄丸活性成分对应肝癌靶点的调控网络中,12个关键基因富集在与原发性肝癌相关的通路上,包括“p53信号通路”、“乙型肝炎病毒”、“IL-17信号通路”,“凋亡通路”及“病毒致癌相关通路”。也就是说,西黄丸可以通过调控细胞凋亡,肿瘤免疫及乙型肝炎病毒感染等相关通路而发挥抗肝癌作用。我们这些结果与以往研究相符,说明了我们预测结果的可靠性。
在西黄丸调控肝癌靶点网络中,西黄丸中的28种活性成分对应了肝癌的87个靶点。从西黄丸药物活性成分的来源来看,没药的活性成分有17个,麝香有8个,乳香有3个。从药物活性成分对应靶点的数量来看,以没药中的MOL000098(quercetin,槲皮素)对应靶点最多,有49个靶点;其次为麝香中的CID5281670(Morin,桑色素)对应27个靶点;排列第三的是没药中的MOL000358(β-sitosterol,β-谷甾醇)对应9个靶点。当进行权重筛选后,在12个核心基因对应关系里面,依然是上述三个活性成分对应较多的靶点。来自没药的MOL000098(quercetin,槲皮素)和MOL000358(β-sitosterol,β-谷甾醇)分别对应靶点9个和3个。麝香中的CID5281670(Morin,桑色素)对应靶点3个。因此西黄丸抗肝癌的有效成分中的最重要的是槲皮素、β-谷甾醇和桑色素。
槲皮素(quercetin)是一种在肿瘤领域极具潜力的黄酮类化合物,广泛存在于各种植物材料(叶子、谷物、水果和蔬菜)以及常见的食品和饮料中。槲皮素的抗癌作用依赖于其通过调控细胞周期素、促凋亡、PI3K/Akt和丝裂原活化蛋白激酶(MAPK)等分子途径抑制细胞增殖、诱导凋亡、引起细胞周期阻滞和抑制有丝分裂过程。例如槲皮素以时间和剂量依赖的方式抑制SKOV-3卵巢癌细胞[23]和MCF-7乳腺癌细胞[24]的增殖并增加促凋亡生物标记物Survivin的水平。在高浓度时槲皮素还能抑制细胞周期从G0/G1期向G2/M期进展。槲皮素能够降低B淋巴瘤细胞(PEL,一种侵袭性B细胞淋巴瘤细胞)BC3、BCBL1和BC1的细胞活力和生长,但对正常B淋巴细胞没有细胞毒作用[25]。槲皮素还可以通过失活Akt-mTor通路[26]和缺氧诱导因子-1α信号[27],诱导胃和乳腺癌细胞保护性自噬。
β-谷甾醇是分布于多种植物中含量最丰富的植物甾醇,它对多种癌症具有抑制活性。其抗癌活性与刺激凋亡细胞死亡、细胞周期阻滞和激活鞘磷脂周期有关。Zhao Y[28]等的研究表明,β-谷甾醇在体外对SGC-7901人胃癌细胞具有明显的生长抑制和诱导凋亡作用。Baskar[29]发现β-谷甾醇能减弱β-连环蛋白和增殖细胞核抗原的表达,是一种潜在的治疗结肠癌的抗癌药物。Jourdain[30]发现β-谷甾醇对前列腺癌癌细胞有低生长抑制作用。
桑色素(Morin)是一种黄酮类化合物,广泛分布于无花果、杏仁和板栗中[31]。桑色素具有多种生物学特性,如抗炎、抗氧化、抗突变[32]。越来越多的证据也显示桑色素通过抑制多种癌细胞株的增殖、促进凋亡和化疗敏感性而具有抗癌作用[31-33];如桑色素能通过降低细胞存活率和增殖能力以及增加凋亡诱导作用实现对TOV-21G和SK-OV-3卵巢癌细胞的抗肿瘤活性[34],同时能增加卵巢癌细胞对顺铂的敏感性。桑色素能够部分通过抑制Akt的激活来抑制高转移乳腺癌细胞的肿瘤进展和EMT过程[34]。桑色素通过激活hippo信号通路来靶向细胞生存分子,如NF-κB p65和β-catenin,从而促进肝癌细胞凋亡[35]。
综上所述,本研究初步预测了西黄丸抗肝癌的分子机制。这些发现为深入了解西黄丸治疗肝癌的潜在机制提供了依据,也为研究该中药复方更为复杂的作用机制以及为进一步的实验验证其作用机制提供了参考。
不足及展望
中草药成分复杂,仅通过对药物有效成分及靶点的成分鉴定和预测,无法明确化合物之间是否有协同或拮抗作用;此外,我们利用PPI网络选择了核心基因,它们通常是这些重要信号通路中的上游分子或中心分子。然而,在原发性肝癌的发病机制中,仍存在多个下游蛋白。因此,在未来的工作中发现和鉴定更多与这些下游蛋白相互作用的化合物是很重要的。
结 论
西黄丸内的槲皮素、β-谷甾醇和桑色素等有效成分可通过作用于p53信号通路、IL-17信号通路和凋亡通路上的多个关键基因发挥多靶点抗肝癌作用。
