44个紫花苜蓿品种的酸铝适应性与耐受性评价
2023-03-21田政杨正禹陆忠杰罗奔张茂董瑞
田政,杨正禹,陆忠杰,罗奔,张茂,董瑞
(贵州大学动物科学学院,贵州 贵阳 550025)
目前,全世界约有30%耕地是酸性土壤,全球范围内有20%的玉米(Zea mays)、13%的水稻(Oryza sativa)生长在该区域,严重影响农业生产[1]。我国酸性土壤总面积达203 万hm2,分布遍及南方15 个省区[2]。铝(Al)是土壤中含量最多的金属元素,其在地壳中平均含量约为8%[3]。铝毒害被认为是酸性土壤中限制植物生长发育的主要因素。土壤中铝的存在与土壤的酸碱度密切相关,当土壤pH 值低于5.5时,土壤中会溶出更多的[Al(H2O)6]3+或Al3+,影响植物的生长发育[4]。土壤酸铝胁迫对植物的毒害症状主要表现为:主根伸长受到抑制,根尖、侧根粗短且脆弱易断,根冠脱落,根毛减少甚至消失,根尖表皮和外皮层细胞受到破坏等[5-6]。
紫花苜蓿(Medicago sativa)被誉为“牧草之王”,是世界上栽培面积最广的牧草,1999-2000年全世界种植面积3200 万~3227 万hm2[7],我国种植面积约为135 万hm2[8]。紫花苜蓿最适生长pH 为6.7~7.5,对酸性土壤中活性铝极度敏感,高于0.1 mmol·L-1的铝胁迫即可显著抑制其发芽和生长[9]。任晓燕[10]发现铝胁迫下紫花苜蓿幼苗的生长会受到抑制,根长、根系活力、地上生物量和地下生物量显著降低。姜娜等[11]发现铝对紫花苜蓿生长具有明显的抑制作用,同时Al 处理下苜蓿会积累大量有机酸,而且不同紫花苜蓿品种间差异较大。对于铝离子是如何激活植物中有机酸分泌,Ma 等[12]提出小麦(Triticum aestivum)和玉米有机酸阴离子的运输是通过质膜中铝激活的阴离子通道介导的,在叶子中积累铝的植物,通过与有机酸形成复合物,从内部对铝进行解毒。Barone等[13]研究发现柠檬酸合酶表达可能利于紫花苜蓿的耐铝性。Sun 等[14]研究指出苜蓿品种对铝的抗性表现出多样性,敏感型的紫花苜蓿的根尖分泌柠檬酸和苹果酸较少,而抗铝品种会分泌较多的柠檬酸和苹果酸。目前,植物根系有机酸的分泌被认为是植物抵御酸铝胁迫最重要的机制之一。但这些研究多集中于小麦、玉米、水稻等粮食作物,对紫花苜蓿研究较少,关于铝毒如何对紫花苜蓿有机酸代谢产生影响的机理仍不清楚。
因此,本研究以44 份紫花苜蓿品种为研究对象,对两个地点紫花苜蓿产量进行分析,筛选出敏感型和耐受型品种,并以之为材料进行酸铝胁迫试验,测定其在胁迫前后的电导率、存活率、根系铝含量及有机酸含量,以期为紫花苜蓿在南方酸性土壤条件下推广提供基础数据和育种材料。
1 材料与方法
1.1 试验地概况
贵州省贵阳市花溪区贵州大学试验地(106°07′E,26°11′N,海拔1100 m),位于贵州高原中部,属于亚热带季风湿润气候,具有明显的高原气候特点。年平均气温14.8 ℃,年均降水量1347.3 mm(数据来源于中国气象网)。试验地前期未种植农作物,主要以自然野生杂草为主。
贵州省铜仁市石阡县花桥镇北坪村试验地(108°20′14″E,27°32′03″N,海拔614 m),位于贵州省东部,属于中亚热带季风湿润气候,日照充足,雨量丰沛,年平均气温17.24 ℃,年均降水量1410.05 mm。试验地前茬作物为玉米。
分别在上述两个试验地开展试验,两个试验地均未种植过苜蓿属植物。收集两个试验地地表约20 cm 的土壤,去除小石块及其他杂物,烘干后磨碎过2 mm 筛,测定其土壤基础营养组成成分和pH(表1)。
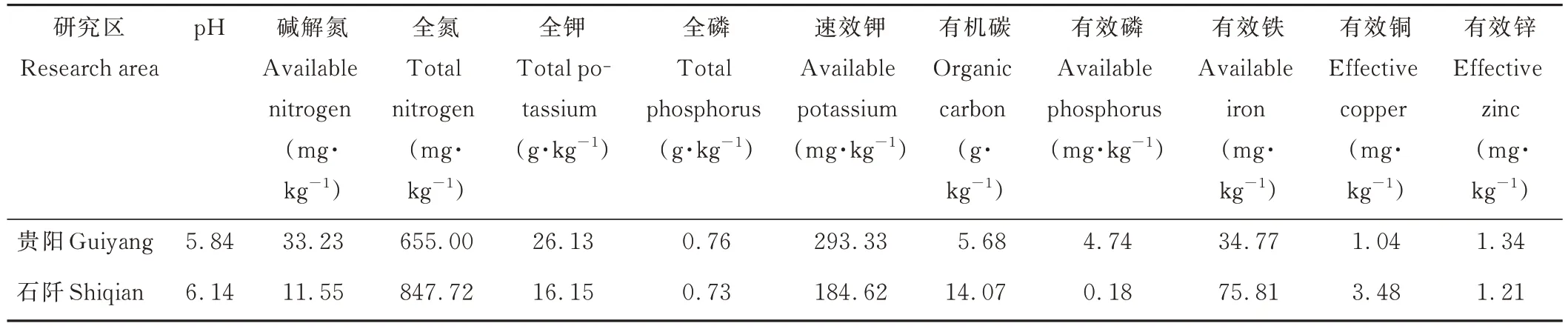
表1 两个研究区土壤营养组成成分和pH 值Table 1 Soil physical and chemical properties in the two study areas
1.2 供试苜蓿品种
供试苜蓿品种分国内品种21 份,国外品种23 份,由兰州大学草地农业科技学院王彦荣教授团队提供,详见表2。

表2 紫花苜蓿品种信息Table 2 Alfalfa species information
1.3 试验方法
1.3.1 田间试验 两个地点均于2018年10 月种植紫花苜蓿,均采用随机区组设计,两个试验点各品种均种植10 个单株,株行距均为50 cm,3 次重复。期间定期除草,不进行施肥和人工灌溉处理。于2020年刈割取样,刈割时期均为初花期,测量每次刈割的干重产量以及紫花苜蓿刈割一年的总干重。测量:各品种随机选取3 株刈割,将刈割的苜蓿植株105 ℃杀青,65 ℃烘干至恒重,电子天平称重。
使用GenStat 7.1(2003)中基因与环境互作GGE 模型对两个试验点测量的44 份紫花苜蓿性状进行综合分析,得到44 份紫花苜蓿的综合排名。
1.3.2 酸铝胁迫试验 材料为田间试验筛选到的耐受型品种阿尔冈金和敏感型品种UC-1465。种子使用1.0%(v/v)次氯酸钠灭菌5 min,蒸馏水冲洗5 次,25 ℃黑暗条件萌发3 d。待幼苗长至三叶期时,挑选长势一致的幼苗,将其种植在装有混合土壤(珍珠岩∶蛭石∶泥炭=1∶1∶2,v/v)的托盘中生长一个月,16 h/8 h(光/暗)。接着移到带有漂浮板的Hoagland 营养液(pH 5.8)中,在25 ℃下生长两周后,将幼苗移入不含AlCl3的0.5 mmol·L-1CaCl2Hoagland 营养液(pH 4.3)中预处理12 h,随后将预处理后的幼苗移入含有50 μmol·L-1AlCl3的0.5 mmol·L-1CaCl2Hoagland 营养液(pH 4.3)中做铝胁迫处理,对照组是不含AlCl3的0.5 mmol·L-1CaCl2Hoagland营养液(pH 4.3),用于后续根尖结构观察,细胞活力、铝含量、有机酸含量测定。
1.3.3 电导率与存活率 将托盘中生长2 周的紫花苜蓿幼苗浸入不含AlCl3和含有1 mmol·L-1AlCl3(pH 4.3)的0.5 mmol·L-1CaCl2Hoagland 营养液中。每组50 株,重复3 次,连续处理6 周后计算存活率。电导率采用抽气法测量,参照陈爱葵等[15]的做法,取叶片用蒸馏水冲洗干净并擦干,将叶片切割成大小相同的叶块,称取0.1 g 于装有6 mL 去离子水的注射器中,不断抽提至叶片完全沉入水底,叶片在去离子水中处理3 h 后测定浸提液电导率(R1),然后金属浴加热30 min,冷却至室温后摇匀,再次测定浸提液电导率(R2),重复3 次。
1.3.4 根尖细胞活力及结构 胁迫处理8 h 后,收集幼苗根尖并用去离子水冲洗干净,将一部分清洗干净的幼苗根尖用2 μg·mL-1的FDA 溶液染色10 min,染好色的幼苗根尖用去离子水清洗附着染料,用带有荧光装置的立体显微镜(Axio Zoom.V16,德国)观察幼苗根尖荧光强度。另一部分清洗干净的幼苗根尖放入FAA 固定液(浓度为45%无水乙醇,6%乙酸,5%甲醛)中固定,做石蜡切片,观察根尖横截面结构。
1.3.5 根系铝含量测定 胁迫处理72 h 时,将处理后的幼苗用去离子水将根冲洗干净后,根据原子吸收法[16]并利用原子吸收光谱仪(4510F,上海)分析根系Al3+含量。
1.3.6 根系有机酸含量测定 分别取胁迫前和胁迫24 h 后各0.2 g 根尖用1 mL 0.5 mol·L-1HCl 研磨并取匀浆,将匀浆液在80 ℃下加热20 min,偶尔摇动,冷却后12000 r·min-1离心10 min。取上清液过0.22 μmol·L-1过滤器,采用高效液相色谱仪(HPLC,1200 Infinity LC,Agilent,美国)分析有机酸浓度。
1.4 数据统计与分析
应用Excel 2013 对试验数据进行处理和图表制作,应用SPSS 20.0 进行单因素ANOVA 分析。
2 结果与分析
2.1 44 份紫花苜蓿品种产量分析
由表3 可知,2020年在贵阳研究区干草产量最高的5 个苜蓿品种为WL363HQ、阿尔冈金、WL354HQ、Boja 、Trifecta,总干重分别为653.38、564.15、544.17、542.40、522.56 g;干草产量最差的5 个品种为UC-1465、Orca、陇东苜蓿、三得利、中兰1 号苜蓿,总干重分别为84.31、153.22、173.73、190.76、192.54 g。在石阡研究区干草产量最高的5 个苜蓿品种为阿尔冈金、Trifecta、新疆大叶苜蓿、中牧1 号苜蓿、Vernal,总干重分别为464.91、429.94、378.21、351.74、350.40 g;干草产量最差的5 个品种为UC-1465、陇中苜蓿、CUF 101、中苜1 号苜蓿、陇东苜蓿,总干重分别为150.97、161.55、162.25、167.90、168.28 g。在两个研究区产量最高的5 个品种与最低的5 个品种之间均达到显著(P<0.05)差异。

表3 44 份紫花苜蓿品种干重方差分析Table 3 Analysis of variance of dry weight of 44 alfalfa varieties(g·plant-1·a-1)
2.2 44 份紫花苜蓿综合性评价
利用基因与环境互作GGE 模型对贵阳试验地与石阡试验地收获的44 份紫花苜蓿总干重性状进行分析,排名前五的分别为阿尔冈金、新疆大叶苜蓿、Trifecta、Vernal、中牧1 号苜蓿,后五名分别为陇中苜蓿、东苜1 号苜蓿、陇东苜蓿、CUF 101、UC-1465(表4)。根据综合分析结果,选择阿尔冈金作为酸铝胁迫耐受型品种,UC-1465 为酸铝胁迫敏感型品种开展后续试验。

表4 44 份紫花苜蓿田间试验综合排名Table 4 Comprehensive ranking of 44 alfalfa field trials
2.3 电导率与存活率分析
经AlCl3连续处理六周后UC-1465 电导率显著(P<0.05)高于阿尔冈金,分别为468.0 和253.5 mS·cm-1。对照组中的阿尔冈金和UC-1465 的存活率分别为92%和88%,经过AlCl3处理后的阿尔冈金存活率可达64%,UC-1465 的存活率仅为10%,阿尔冈金的存活率显著(P<0.05)高于UC-1465(图1)。

图1 铝胁迫对紫花苜蓿相对电导率和存活率的影响Fig.1 Effect of Al stress on the relative conductivity and survival rate of alfalfa大写字母代表不同铝浓度胁迫间的差异性(P<0.05);小写字母代表不同品种间的差异性(P<0.05)。下同。The capital letters represent the differences(P<0.05)among different aluminum concentration stress;The lowercase letters represent the differences(P<0.05)among different varieties.The same below.
2.4 根尖细胞活力及结构
未经胁迫的阿尔冈金和UC-1465 根尖荧光均较强,胁迫后两者根尖荧光强度均降低,且UC-1465 的根尖荧光强度弱于阿尔冈金(图2Ⅰ)。未经胁迫的两个品种根尖表皮细胞结构完整,无细胞增大及破损现象,胁迫后阿尔冈金根尖表皮细胞较完整,细胞壁较对照出现增厚;UC-1465 根尖表皮细胞破损,细胞增大(图2Ⅱ)。
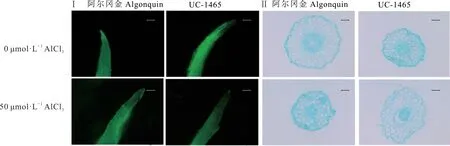
图2 紫花苜蓿铝胁迫前后根尖细胞活力及结构Fig.2 Cell changes of alfalfa before and after Al stressⅠ:荧光强度,标尺0.2 mm Fluorescence intensity,ruler 0.2 mm;Ⅱ:根尖横截面结构,标尺50 μm Root cross-sectional structure,ruler 50 μm.
2.5 根系铝含量
在对照组中阿尔冈金和UC-1465 的Al 含量分别为36.37 和50.01 μg·g-1;经过50 μmol·L-1AlCl3处理后的阿尔冈金和UC-1465 的铝含量分别为72.71 和112.70 μg·g-1,处理组中UC-1465 和阿尔冈金根系的Al 含量均显著(P<0.05)增加,且UC-1465 的根系Al 含量显著(P<0.05)高于阿尔冈金(图3)。

图3 铝胁迫对UC-1465 和阿尔冈金根系Al 浓度的影响Fig. 3 Effect of Al stress on Al concentration in roots of UC-1465 and Algonquin
2.6 根系有机酸含量测定
与对照相比胁迫后两个品种的有机酸含量均有增加,如图4 所示:胁迫前阿尔冈金和UC-1465 的草酸、酒石酸、苹果酸、乳酸、乙酸、柠檬酸、琥珀酸、反丁烯 二 酸 含 量 分 别 为248117.16 μg·mL-1、705.03 μg·mL-1、70.84 μg·mL-1、441.87 μg·mL-1、162.44 μg·mL-1、99.58 μg·mL-1、3111.92 μg·mL-1、984.60 μg·mL-1和114474.70 μg·mL-1、176.66 μg·mL-1、33.36 μg·mL-1、408.16 μg·mL-1、65.32 μg·mL-1、58.27 μg·mL-1、2309.79 μg·mL-1、818.70 μg·mL-1,胁迫后草酸、酒石酸、苹果酸、乳酸、乙酸、柠檬酸、琥珀酸、反丁 烯 二 酸 含 量 分 别 为308731.41 μg·mL-1、5475.61 μg·mL-1、290.29 μg·mL-1、702.96 μg·mL-1、249.93 μg·mL-1、3122.88 μg·mL-1、3119.34 μg·mL-1、1346.66 μg·mL-1和303701.88 μg·mL-1、5047.51 μg·mL-1、143.81 μg·mL-1、572.42 μg·mL-1、206.91 μg·mL-1、2371.91 μg·mL-1、2366.58 μg·mL-1、1178.73 μg·mL-1,相比于酸铝处理前两个品种的草酸、酒石酸、苹果酸、乙酸、柠檬酸、反丁烯二酸含量均显著增高(P<0.05),乳酸含量虽有增加,但不显著;在酸铝胁迫24 h 后,阿尔冈金的苹果酸含量显著(P<0.05)高于UC-1465。

图4 紫花苜蓿根系铝处理0、24 h 的有机酸含量Fig.4 The content of organic acids in alfalfa roots treated with aluminum at 0 and 24 h
3 讨论
3.1 紫花苜蓿适应性评价
李文英等[17]研究表明不同经纬度种植的蒙古栎(Quercus mongolica)其表型性状与地理气候因子存在显著或极显著的相关关系,说明植物的生长主要受到基因及环境的综合作用。关于基因与环境的互作,不同作物品种都有其最适宜的种植和推广区域,本研究对紫花苜蓿两地一年多品种产量进行综合评价,能真正反映不同品种的适应性,从而获得准确的结果。本研究对贵阳和石阡44 份紫花苜蓿品种测量的总干重综合评价,得到5 个产量高且适应性强的紫花苜蓿品种,分别为阿尔冈金、新疆大叶苜蓿、Trifecta、Vernal 和中牧1 号苜蓿;这与刘明秀[18]、莫本田等[19]、柳海鹰[20]的研究结果有差异,这可能与品种特性、生境条件、种植密度、栽培方式和刈割次数的不同有关。
3.2 两个品种的抗铝性评价
王运琦等[21]研究发现,紫花苜蓿的存活率会随着胁迫浓度的增大而变小;Tamás 等[22]观察到Al 处理24 h 后大麦(Hordeum vulgare)根尖相对铝含量呈上升趋势;Silva 等[23]观察到小麦根尖Al 处理24、72 h 后耐铝品种和敏感品种根尖铝含量均上升,且敏感型大于耐受型。本研究发现,铝胁迫前后两个品种根尖结构发生变化,敏感型细胞结构被破坏,导致其根系丧失对重金属离子的防御功能,电导率显著增大,这与前人研究结果一致[14,24-25]。
3.3 有机酸在铝抗性中的作用
大量研究表明,铝胁迫下根系分泌有机酸是植物耐受铝的主要机制之一。Liao 等[26]的研究得出柠檬酸、苹果酸、草酸是植物抵御铝胁迫的重要机制。根系分泌的有机酸可络合铝离子,有机酸是关键的铝解毒剂[27]。柠檬酸和苹果酸是大多数植物根尖适应铝毒性所分泌的主要有机酸[28-30]。Silva 等[23]对不同基因型大豆(Glycine max)进行Al 处理,前6 h 所有基因型的柠檬酸和苹果酸外排均增加,但只有耐铝基因型的柠檬酸和苹果酸外排持续时间较长。Ling 等[31]研究发现铝胁迫会促进黑麦(Secale cereale)分泌柠檬酸,铝胁迫浓度越高,时间越长,柠檬酸分泌量越大。Miyasaka 等[30]研究表明,铝胁迫下耐受型菜豆(Phaseolus vulgaris)品种分泌的柠檬酸是对照组的70 倍,且耐受品种分泌的柠檬酸含量较敏感品种高10 倍。Yang 等[32]研究也发现,铝胁迫下,耐受型品种分泌的柠檬酸比敏感品种高。本研究中,Al 处理下阿尔冈金与UC-1465 的根系柠檬酸、苹果酸、乙酸、酒石酸、反丁烯二酸、草酸和琥珀酸分泌均显著(P<0.05)增加,表明紫花苜蓿可通过分泌有机酸来缓解铝毒。同时,阿尔冈金与UC-1465 根系柠檬酸分泌量增加最为明显,说明柠檬酸可能是紫花苜蓿缓解铝毒的主要解毒剂,这与Takashi等[33]、Wu 等[34]、Dai 等[35]、Liu 等[36]、Yang 等[37]的研究结果一致。
此外,本研究发现胁迫前后两个品种间仅苹果酸差异达到显著水平。而Sun 等[14]对不同耐铝性紫花苜蓿品种进行铝胁迫研究,结果表明耐受型品种柠檬酸含量显著高于敏感型品种,而苹果酸无显著(P>0.05)差异,本研究结果与其不一致。结果表明,不同紫花苜蓿品种有机酸合成与分泌存在差异,且耐受型紫花苜蓿防御酸铝胁迫策略不同为后续研究提供了新的思路。
4 结论
通过两个试验点的产量分析,从44 份紫花苜蓿品种中筛选出阿尔冈金、新疆大叶苜蓿、Trifecta、Vernal 和中牧1 号苜蓿5 个强适应品种。紫花苜蓿对酸铝胁迫的响应主要通过柠檬酸、苹果酸、乙酸、酒石酸、反丁烯二酸和草酸的显著(P<0.05)增加来体现,所以有机酸(尤其是苹果酸)的合成和分泌增多可能是其耐酸铝胁迫的重要原因。
