半干旱草甸草地不同处理下植被特征与土壤酶活性的变化
2023-03-21王志婷刘廷玺童新段利民李东方刘小勇
王志婷,刘廷玺,2,3,童新,2,3,段利民,2,3,李东方,2,刘小勇
(1. 内蒙古农业大学水利与土木建筑工程学院,内蒙古 呼和浩特 010018;2. 内蒙古自治区水资源保护与利用重点实验室,内蒙古 呼和浩特 010018;3. 黄河流域内蒙段水资源与水环境综合治理协同创新中心,内蒙古 呼和浩特 010018;4. 乌兰察布市水文勘测局,内蒙古 乌兰察布 012000)
草地面积占我国国土总面积的41%左右[1]。20 世纪90年代初到90年代末,草地退化面积多达51%左右,集中在我国的呼伦贝尔、锡林浩特、科尔沁等草原区[2];近年来,当地畜牧部门为了改善草地环境,实施了围栏封育等措施,使得草场退化面积大幅度地减少,但由于气候干旱等自然因素的影响,草场理论载畜量还是呈现下降趋势。近几年牧民放牧活动加强,造成草地牲畜超载尤为严重。草原退化导致畜牧业生产条件恶化,草场单位载畜量降低,植被草场与牲畜产生矛盾,形成恶性循环[3]。科尔沁沙地位于我国北方农牧交错区,面临全球气候变化与区域人类活动的影响[4],植被急剧减少,植被群落多样性以及生产力下降,土地沙化严重,生态环境将面临挑战[5]。如何对退化草地进行恢复治理,对于保护科尔沁沙地草地土壤生态环境,实现草地资源的可持续利用具有重要的现实意义。
土壤作为陆地生态系统的重要组成部分,在物质循环、能量流动过程中发挥着重要作用,而土壤酶是土壤系统中最活跃的组分之一[6]。研究表明,土壤酶活性与土壤理化指标关系密切,而现如今,随着气候变化和人类活动加剧,土地利用强度不断增大,草甸草地呈现出明显的退化趋势,对土壤环境质量和土壤健康状况的评估越来越重要,传统的理化指标难以满足土壤质量、土壤恢复状况评估的需要[3],而土壤酶活性可全面地反映土壤环境质量和肥力状况,可作为判别胁迫环境下土壤生态环境退化早期的预警指标之一。
退化草地的恢复工作在过去几十年成为生态学领域的研究重点[4]。草地退化是一个复杂的生态过程,直接表现为植被退化与土壤退化[7]。目前关于放牧、刈割和火烧对草地植被的影响主要集中在单独的放牧处理[5]和刈割处理[8-9],多侧重于对植被群落多样性、生活型群落结构的研究。目前关于不同草地处理方式对土壤特征影响的研究主要集中在不同处理对土壤理化性质[10]、微生物群落结构[11]和土壤酶活性[12]影响等方面。前人对放牧的研究主要集中在不同放牧强度对草地植被的影响[5],研究结果认为,轻度或中度放牧是良好的草地处理方式,因为适宜的放牧强度可以刺激牧草再生,促进草地植被群落多样性和生物量的生长[13-14]。刈割通过移除部分或全部的地上生物量来改变植物种间、种内竞争强度,为竞争力较弱的物种提供繁殖机会和生长空间,来改善植物群落结构和物种组成[15-16]。研究表明刈割在增加草地群落的盖度、地上生物量的同时还可以增加群落多样性[17]。这些处理方式仅考虑放牧、刈割、围封3 种方式,处理方式过于单一。前人针对不同草地处理对土壤或者植被的影响,对土壤特性和植被特征相结合的规律性研究尚显不足。且大多局限于植被生长的某一个时期,考虑整个生长季土壤酶活性变化研究的较少。
本研究以科尔沁草甸草地为研究对象,设置围封(enclosure,UNM)、围封+刈割(enclosure+mowing,M)、围封+火烧(enclosure+burning,F)、放牧(grazing,G)4 种处理方式,对不同生长季土壤温度、水分、酶活性和植被特征进行规律性研究,为探究科尔沁草甸草地最佳的管理方式提供理论依据和数据支撑。
1 材料与方法
1.1 试验区概况
研究区位于科尔沁沙地东南部的阿古拉生态水文试验站,行政隶属于内蒙古自治区通辽市科尔沁左翼后旗,地理位置122°33'00″-122°41'00″E,43°18'48″-43°21'24″N(图1),属温带大陆性季风气候,年平均气温6.6 ℃,多年平均降水量389 mm,多年平均蒸发量1412 mm(Φ20 cm 蒸发皿)。土壤类型主要为风沙土、栗钙土,海拔186~232 m。研究区南北两侧向中心分布有流动沙丘、半流动半固定沙丘、固定沙丘、过渡带低缓沙丘、草甸农田、草甸草地、湖泊等十多种地貌类型,为独特的沙丘-草甸相间地区。草甸植被主要以芦苇(Phragmites australis)、羊草(Leymus chinensis)、拂子茅(Calamagrostis epigeios)、蒲公英(Taraxacum mongolicum)等为主,沙丘植被主要以小叶锦鸡儿(Caragana microphylla)、差巴嘎蒿(Artemisia halodendron)、冷蒿(Artemisia frigida)、沙蓬(Agriophyllum squarrosum)、黄柳(Salix gordejevii)、叉分蓼(Polygonum divaricatum)等为主,人工植被主要为玉米(Zea mays)、水稻(Oryza sativa)、杨树(Populus)等。研究区及试验点位置如图1。草甸草地试验点共布设5 处,其处理方式和方法见表1。

表1 不同样地草地处理方式Table 1 Different ways of dealing with grass

图1 研究区试验点布设及草地处理方式示意图Fig.1 Layout of test points and grassland treatment mode in the study areaD1、C2、C3、E2和C4分别代表草甸地样地名称。D1,C2,C3,E2 and C4 represent the names of meadow grassland sites,respectively.
1.2 试验设计
如图2 所示,选定的5 个样点围封面积均为400 m²(20 m×20 m),围栏外为自由放牧状态,确定为自由放牧区(G)。自2010年8 月围封以来,C2、C3、D1围栏内无其他处理方式,植被处于自然生长状态。2019年8 月,对C2样地围栏内面积的1/2 进行刈割处理,确定为围封+1年刈割区(M1),2020年4 月对1/4 面积进行火烧处理,确定为围封+火烧区(F),剩余1/4 面积不做任何处理,确定为围封区(UNM);对C3样地内围封面积的1/2 进行刈割处理,确定为围封+1年刈割区(M1),剩余1/2 面积不做处理,确定为围封区(UNM);D1样地内的1/2 面积进行火烧处理,确定为围封+火烧区(F),剩余1/2 面积也不做任何处理,确定为围封区(UNM)。C4、E2点经围封处理后每年都进行刈割处理,确定为围封+多年刈割区(ML)。如图2 所示,为了降低试验中的误差,5 个草甸草地点不同处理区均匀布设了6~9 个取土样点,3 个面积大小为1 m×1 m 植被样方;自由放牧区各个方向均匀布设2 个植被样方,3 个取土点,一共8 个植被样方,12 个取土点;取样过程中,将同一个处理区同一土层深度土样放入同一自封袋进行混匀,同一处理区3 个植被样方的植被数据取平均值,代表不同处理区的重复试验。同一样地不同处理的地形地貌、土壤类型一致,故可以认为不同处理区之间的差异均由处理方式的不同而引起。

图2 草甸草地不同草地处理方式示意图Fig.2 Schematic diagram of different grassland treatments in meadow grassland
1.3 调查项目和方法
1.3.1 样方布设及植被调查 植被调查选择在植被的返青期(5 月)、生长茂盛期(6、7 月)、成熟期(8 月)进行。调查时,记录样方内的植被类型和植被种类,对不同植被种类选取20 个代表植株取平均求植被高度,利 用 无 人 机(DJI Phantom 4 Pro V2.0,DGI Technology,中国深圳)垂直拍照结合目估的方法获取样方总盖度。将样方内的植被分物种齐地剪取,105 ℃杀青,65 ℃烘干48 h 至恒重,算取样方内的地上生物量。
1.3.2 土壤样品的采集和测定 5 月初在各试验点每个处理区均匀布设8~10 个土壤取样点,在植被返青期(5 月)、生长茂盛期(6、7 月)、成熟期(8 月)、枯黄期(9、10 月),于当日7:00、10:00、13:00、16:00,采用TDR150(Spectrum,美国)测定地表下5、10、20 cm 的土壤温度、土壤含水率值,同一日的数据取平均代表该日的土壤水分、土壤温度值。同时,在每个处理区内设定取土点(图2),取土前先将土壤表面凋落物清理干净,按照0~5 cm、5~10 cm、10~20 cm 土层用土钻分层采集土样,同一类型区同一土层深度土样混合均匀放入提前标记好的自封袋,带回室内阴凉处自然风干,风干后过2 mm 筛,除去大颗粒石块和根系,装袋标记,放在阴凉处保存。
1.3.3 土壤酶活性的测定 土壤酶活性均选用“北京索莱宝”公司的试剂盒来测试,碱性磷酸酶(alkaline phosphatase,S-AKP)采用S-AKP/ALP 活性检测试剂盒,土壤蔗糖酶(soil sucrase,S-SC)采用S-SC 活性检测试剂盒,土壤脲酶(soil urease,S-UE)采用S-UE 活性检测试剂盒,根据试剂盒的具体要求再进行过筛,均采用微量法[18]进行测定。
1.4 数据处理
用SPSS 19.0 和Origin 2018 软件进行图形制作和数据统计分析,统计检验的显著性水平选择P检验标准,采用单因素水平分析(One-way ANOVA)进行显著性检验和多重分析(LSD),结果用平均值±标准偏差来表示。
2 结果与分析
2.1 生长季植被群落变化
如图3 所示,生长季不同月份,各试验点G 较UNM 处理表现不尽一致。在整个生长季各试验点G 较UNM处理植被高度、地上生物量总体降低,丰富度指数增加;植被盖度在不同点的表现不一致,C2、C3、D1点植被盖度在整个生长季变化规律不一致。C2点植被高度G 较UNM 处理在5-6 月无显著差异(P>0.05),7-8 月显著降低(P<0.05);C3点植被高度G 较UNM 处理在5-8 月显著降低(P<0.05);D1点植被高度G 较UNM 处理在5 月无显著差异(P>0.05),6-8 月显著降低。C2点植被盖度G 较UNM 处理在5 月无显著差异(P>0.05),6-7 月显著增加(P<0.05),8 月显著降低(P<0.05);C3、D1点植被盖度5-6 月G 显著大于UNM 处理(P<0.05),C3点7-8月G 显著小于UNM 处理(P<0.05),D1点7-8 月无显著差异(P>0.05)。C2点地上生物量G 较UNM 处理5-6月无显著差异(P>0.05),7-8 月显著降低;C3点5 月G 较UNM 处理显著增加(P<0.05),6-8 月显著降低(P<0.05);D1点5 月G 较UNM 处理显著增加(P<0.05),6 月无显著差异(P>0.05),7-8 月显著降低(P<0.05);D1点丰富度指数G 较UNM 处理在整个生长季均无显著差异(P>0.05),其他点在各生长季均显著增加(P<0.05)。

图3 各试验点草地不同处理植被群落特征的月变化Fig.3 Monthly variation of vegetation community characteristics in different treatments of grassland in different experimental sites同行不同小写字母代表该指标在不同处理下差异显著(P<0.05)。Different lowercase letters mean significant differences at the 0.05 level.
生长季不同月份,各试验点F 较UNM 处理表现不尽一致。各试验点F 较UNM 处理在整个生长季植被高度、盖度和地上生物量总体上均增加;丰富度指数在不同点表现不同,C2点F 较UNM 处理增加,D1点无显著差异。F 较UNM 处理植被高度在C2和D1点5-6 月无显著差异(P>0.05),7-8 月显著增加(P<0.05)。C2点植被盖度F 较UNM 处理5 和8 月无显著差异(P>0.05),6-7 月显著增加(P<0.05),D1点在整个生长季显著增加(P<0.05)。各试验点地上生物量F 较UNM 处理在整个生长季均显著增加(P<0.05)。D1点在整个生长季丰富度指数F 较UNM 处理无显著差异(P>0.05),C2点5-7 月无显著差异(P>0.05),8 月显著增加(P<0.05)。
生长季不同月份,M1较UNM 处理在各试验点表现不尽一致。各试验点M1较UNM 处理植被盖度、丰富度指数在整个生长季总体性增加,植被高度和地上生物量在不同点表现不一致;C2点M1较UNM 处理植被高度、地上生物量均降低,C3点增加。C2点植被高度M1较UNM 处理在5-6 月无显著差异(P>0.05),7-8 月显著降低(P<0.05);C3点5-7 月M1较UNM 处理无显著差异(P>0.05),8 月显著增加(P<0.05)。植被盖度在C2点M1较UNM 处理5 和8 月无显著差异(P>0.05),6-7 月显著增加(P<0.05);C3点在整个生长季均显著增加(P<0.05)。地上生物量在C2点M1较UNM 处理5-6 月显著增加(P<0.05),7-8 月显著降低(P<0.05);C3点在整个生长季均显著增加(P<0.05)。丰富度指数在C2点M1较UNM 处理5 月无显著差异(P>0.05),C2点6-8 月和C3点整个生长季均显著增加(P<0.05)。
生长季不同月份,E2、C4点ML较G 处理表现一致。不同点ML较G 处理,5 月植被高度无显著差异(P>0.05),6-8 月植被高度和植被盖度、地上生物量在整个生长季显著增加(P<0.05),丰富度指数在整个生长季显著降低(P<0.05)。
2.2 生长季土壤温度变化
如图4 所示,不同处理方式下草地各土层地温5-10 月动态变化趋势总体相似,5-8 月地温逐渐升高,峰值出现在8 月,这是因为8 月的气温较高,降水较少,所以土壤温度最高,本年度9 月降水较多,气温较低,地温开始下降。不同处理下,土壤温度无显著差异(P>0.05)。
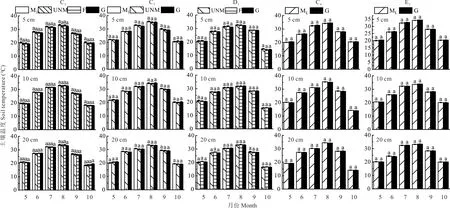
图4 不同处理方式草地生长季土壤温度的月变化Fig.4 Monthly variation of soil temperature in growing season of grassland under different treatments相同字母代表不同草地处理下差异不显著(P>0.05),不同字母代表不同草地处理下差异显著(P<0.05),下同。Same letters mean no significant differences at the 0.05 level among different grassland treatments;Different letters mean significant differences at the 0.05 level among different grassland treatments,the same below.
2.3 生长季不同处理方式草地土壤含水率的月变化
如图5 所示,C2、C3点草地不同处理方式各土层深度5-10 月土壤含水率的动态变化趋势总体相似。5、10 cm土层深度5-6 月急剧降低,6-7 月稍有回升,随后逐渐稳定至9 月稍有增加随后稳定,20 cm 土层深度整个生长季土壤水分变化不大。不同处理在整个生长季差异不显著(P>0.05)。

图5 不同处理方式草地生长季土壤含水率的月变化Fig.5 Monthly changes of soil moisture content in growing season of grassland under different treatments
2.4 生长季不同处理方式草地土壤酶活性的月变化
土壤中脲酶的专一性较强,其可以将尿素水解成氨、二氧化碳和水,因此,尿素的水解与脲酶密切相关。土壤蔗糖酶对增加土壤中的易溶性营养物质起着重要作用。土壤磷酸酶是一类催化土壤有机磷矿化的酶,其活性的高低直接影响着土壤中有机磷的分解转化及其生物有效性,是评价土壤磷素生物转化方向与强度的指标。
结果表明,随着土层深度的增加,3 种水解酶活性均降低,且不同处理间的差异逐渐降低。
图6 和图7 表明,C2、C3和E2点不同土层深度脲酶、蔗糖酶活性在5-8 月随着月份的推进而增加,8 月后又随月份推进而降低,C4、D1点在整个生长季呈现双峰型变化规律,峰值出现在6 和8 月。图8 表明,C2和C4点碱性磷酸酶活性在整个生长季呈现抛物线变化规律,峰值出现在8 月,C3、D1点0~10 cm 和E2点呈现双峰型变化规律,峰值均 出 现 在8 月,D1点0~10 cm 和C3点 次 峰 出 现 在5 月,E2点0~5 cm 次峰出现在6 月,10~20 cm 次 峰 出 现在5 月。

图6 生长季不同处理方式草地土壤脲酶活性的月变化Fig.6 Monthly changes of S-UE activity in growing season of grassland under different treatments
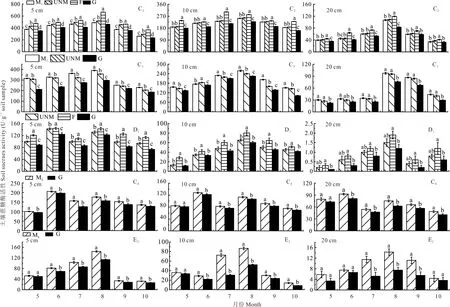
图7 生长季不同处理方式草地土壤蔗糖酶活性的月变化Fig.7 Monthly changes of S-SC activity in growing season of grassland under different treatments
由图6~8 可知,C2点各月份不同土层深度3 种酶活性不同处理整体均表现为F>UNM>M1>G。随着土层深度的增加3 种水解酶活性逐渐降低且不同土层深度间差异显著(P<0.05),3 种水解酶活性5-9 月不同处理差异显著(P<0.05);脲酶活性10~20 cm 土层M1、G 与UNM 处理差异不显著(P>0.05),F 与其他处理差异显著(P<0.05);蔗糖酶活性在10~20 cm 土层F 较UNM 处理差异显著(P<0.05),M1较UNM 处理差异不显著(P>0.05),5~10 cm 土层整个生长季和10~20 cm 土层5-8 月G 较UNM 处理差异显著(P<0.05);碱性磷酸酶活性5~10 cm 土层在5-8 月不同处理差异显著(P<0.05),9-10 月M1、F、G 较UNM 处理差异显著(P<0.05);10~20 cm 土层在各月份M1、G 较UNM 处理差异不显著(P>0.05),F 与其他处理差异显著(P<0.05)。
C3点各月份不同土层深度3 种水解酶活性不同处理均表现为M1>UNM>G,0~10 cm 土层深度3 种酶活性不同处理差异显著(P<0.05),脲酶活性10~20 cm 土层不同处理间无显著差异(P>0.05);蔗糖酶和碱性磷酸酶活性10~20 cm 土层M1与UNM 处理差异不显著(P>0.05),G 与UNM 处理差异显著(P<0.05)。
D1点3 个土层深度3 种水解酶活性不同处理均表现为F>UNM>G;脲酶活性在0~5 cm 土层5-8 月不同处理间差异显著(P<0.05),0~5 cm 土层9-10 月和5~20 cm 土层整个生长季F 与UNM 处理无显著差异(P>0.05),不同土层深度G 较UNM 处理在整个生长季均显著降低(P<0.05);蔗糖酶活性在0~5 cm 土层不同处理间差异显著(P<0.05),5~10 cm 土层F 与UNM 处理差异显著(P<0.05),10~20 cm 土层F 与UNM 处理差异不显著(P>0.05),5~20 cm 土层G 与UNM 处理差异不显著(P>0.05);碱性磷酸酶在0~5 cm 土层整个生长季和5~10 cm 土层5-9 月不同处理间差异显著(P<0.05),5~10 cm 土层10 月和10~20 cm 整个生长季UNM 处理与F 处理差异不显著(P>0.05),与G 处理差异显著(P<0.05)。
C4、E2点蔗糖酶和碱性磷酸酶活性不同处理在不同土层深度整个生长季均表现为ML>G,脲酶活性表现为ML<G;C4点脲酶活性在0~5 cm 土层整个生长季和5~10 cm 土层5-9 月不同处理间差异显著(P<0.05),5~10 cm 土层10 月和10~20 cm 土层各生长季不同处理间无显著差异(P>0.05);蔗糖酶活性在0~5 cm 土层整个生长季和5~20 cm 土层6-10 月不同处理间差异显著(P<0.05);碱性磷酸酶活性在0~10 cm 土层整个生长季和10~20 cm 土层6-9 月不同处理间差异显著(P<0.05),5 月和10 月不同处理间无显著差异(P>0.05)。E2点脲酶活性在0~5 cm 土层5-9 月、5~10 cm 土层整个生长季和10~20 cm 土层7-8 月不同处理间差异显著(P<0.05),0~5 cm 土层10 月,10~20 cm 土层在5-6 月、9-10 月无显著差异(P>0.05);蔗糖酶活性在0~10 cm 土层6-10 月、10~20 cm 土层7-9 月差异显著(P<0.05),0~10 cm 土层5 月、10~20 cm 土层5-6 月和10 月不同处理间无显著差异(P>0.05);碱性磷酸酶活性在0~20 cm 土层整个生长季不同处理间差异显著(P<0.05)。
2.5 植被特征与土壤酶活性相关性分析
图9 展示了研究区草甸草地植被特征与土壤酶活性的相关性。在整个生长季,植被高度、地上生物量、丰富度指数与土壤温度呈显著正相关,植被盖度与土壤水分呈显著负相关。3 种水解酶活性均与植被高度、地上生物量、丰富度指数呈显著正相关,土壤碱性磷酸酶、脲酶活性与土壤温度呈显著正相关,土壤脲酶活性与土壤水分呈显著正相关。3 种酶活性之间呈显著正相关,说明在整个酶促反应过程中,不同的土壤酶活性不仅发挥自身特性,而且相互协调并相互激发其他酶活性,共同促进植被营养物质的转化。

图9 植被特征与土壤酶活性的相关性Fig.9 Correlation between vegetation characteristics and soil enzyme activities
3 讨论
3.1 土壤酶活性随土层深度的变化
土壤酶活性具有“表聚性”,3 种水解酶活性均随着土层深度的增加逐渐降低。吴旭东等[19]、Hechmi 等[20]研究认为:1)表层土壤直接接触空气,土壤结构疏松,土壤通透性良好;2)表层土壤直接接触来自太阳辐射的光照,土壤温度较高;3)草甸草地生长茂盛,表层土壤根系较为发达,根系分泌物较多,土壤肥力较为旺盛,土壤生物活动频繁、活跃,分泌的催化剂酶类多,使得表层土壤酶活性最强。随着土层深度的增加,不同处理酶活性差异逐渐降低。由于科尔沁草地植被茂密,凋落物和植被根系均集中在土壤表层,表层土壤养分高,使得表层土壤酶活性差异显著[21]。
3.2 不同处理下草地土壤酶活性的变化
草甸草地生态系统自身有较高的稳定性和特殊的维持机制,但由于半干旱地区草地生态环境的脆弱性和敏感性,草甸草地一旦遭到破坏,自我恢复能力极差。然而,不同干扰方式也是生态系统演替的外在驱动力,推动了系统的进化和演变[12]。前人针对放牧对酶活性的影响主要集中在不同放牧强度对酶活性的研究,研究结果规律不一。Fterich 等[22]和Monokrousos 等[23]研究认为,随着放牧强度的增加,酶活性逐渐降低。土壤酶主要来自土壤微生物和植物根系的分泌,与土壤生态系统功能具有直接的关系[24],随着放牧强度的增加,微生物可利用的碳源和氮源减少,降低了微生物的活性,进而降低酶活性[25]。且长期放牧会增加裸露土壤的百分比,植物消耗严重,植被光合作用减弱,进入土壤根系的养分降低,从而降低了微生物活性,导致酶活性降低[26]。本研究区地处牧区,当地村民以放牧为主,放牧强度较强,放牧历时较长,长期放牧使得植被践踏严重,相对围封处理,3 种水解酶活性均降低。草地围封后,表层凋落物积累增多,使土壤的肥力得到改善,导致酶活性增加[20]。这与牛得草等[27]的研究结果一致。而Khomutova 等[28]研究表明,中度放牧干扰下,土壤水解酶活性最大。大型食草动物通过影响养分循环和营养丰富的粪便和尿液输入,对草原土壤微生物群落产生显著影响[29]。适度放牧可以刺激分蘖,清除植物衰老组织,有利于植物再生[29]。由于放牧处于中度干扰,达到了中等植物消耗和高粪便输入,土壤水解酶活性达到最大值。
前人针对火烧对草地的研究主要集中在火灾干扰频率[30]和火灾后[31]土壤酶活性特征。Biggs[31]在亚利桑那州东南部草地的研究认为,土壤温度和湿度没有受到火灾频率的影响,微生物群落对其却非常敏感[32]。Xue 等[33]对呼伦贝尔草甸草原的研究认为,中度至高度火灾之后,微生物通过火烧直接被杀死,或者受到表面有机碳氧化以及植被完全消失的影响,从而减少了可能影响土壤酶活性输入土壤的潜力和养分含量,土壤酶活性降低。林亚军等[34]在古尔班通古特沙漠和王丽红等[35]在大兴安岭的火烧迹地研究认为,火烧烧毁地表覆盖物导致地表总辐射增强,地表温度升高,土壤酶失活,微生物的数量和结构发生变化,致使微生物活性较低,导致微生物分泌的酶减少[36],前者研究的是火烧对沙地土壤酶活性的影响,沙地植被生长稀疏,一经火烧,地面裸露,地表温度升高,过高温度使得土壤酶活性降低甚至失活。周道玮等[37]对草地研究认为,火烧后不久,火烧地土壤微生物低于未烧地,经过一段时间恢复,火烧地微生物逐渐增加并超过未烧地,说明火烧对土壤酶活性的影响具有一定的时间效应。而本研究区位于科尔沁草甸草地,早春火烧(4 月)后,大约1 月后开始取样,土壤表层的凋落物以灰分的形式进入土壤,土壤水分多且植被生长茂密,植被根系对养分的吸收比较灵敏,根系分泌物增加,土壤酶活性显著增加。
刈割对土壤酶活性影响的研究主要是针对刈割方法[38]和刈割频率[39]对土壤酶活性的影响。刈割主要是通过减少地上生物量来减少植物向土壤中的碳输入,从而抵消了土壤碳积累的正面氮效应[40]。刈割后植被的光合作用减弱,使得向土壤中蓄积的碳降低,土壤肥力下降,酶活性也随之减弱。而不同功能群物种对刈割响应差异很大,王梅等[9]认为,不同功能群物种对刈割响应差异不同,刈割处理下,禾本科普遍实现了超补偿,而菊科却出现了不足补偿。C2点的植被类型主要以禾本科和菊科为主,C3点以禾本科为主,植被群落不同,经刈割后的补偿能力不同。使得C3点经刈割后土壤酶活性增加,C2点降低。
放牧和割草对土壤化学性质的影响,有机物的输入是形成有机质的主要因素[41]。在割草系统中,微生物活动完全由植物凋落物推动,而在放牧系统中,有机物输入主要由动物沉积物提供[42]。土壤中有机质含量高,可以通过给微生物提供适当的底物,来提高土壤的微生物活性,从而刺激土壤酶的合成[43]。刈割后产生的酶活性比放牧过程中产生的酶活性更为活跃,割草系统中的微生物可以保持活跃并用于酶的形成[42]。草地刈割较放牧处理,蔗糖酶和碱性磷酸酶活性均增加。然而,脲酶活性在各试验点的表现不一致。E2和C4点放牧区放牧强度较强,有大量粪便的输入和大量易获得的化合物[43],牲畜在践踏的同时会促进凋落物及粪便的分解[44],牛羊粪便中含有大量的尿素成分[45],加快了植物体的周转速率,使得土壤脲酶活性增加。
3.3 不同处理方式对草地植被特征的影响
放牧过程中牲畜进行踩踏和觅食,对土壤环境造成破坏,打破了原有植被环境的平衡,影响了植被的正常生长。经放牧后,各生长季植被高度、盖度、地上生物量均降低[46-48]。Marty[49]研究表明,和封育草甸相比,放牧过程显著增加丰富度指数。在围封处理下,研究区草甸草地的生产力较高,植被群落冠层对光照资源的竞争激烈,导致那些对光资源和养分竞争能力较弱的物种最终消失[50-51]。此外,放牧会极大地增加群落的间隙和物种的再生速度[52],为外来物种的发展提供了生长空间。长期围封土壤表面富集较多凋落物和立枯物,向土壤深层输入大量的养分,增加了优势种生物量,促进退化草地的正向演替[53]。
刈割对植物造成机械损伤对其生长具有一定的刺激性,且刈割改变了周围的光环境,削弱了优势植被的生长空间,为群落下层植被提供生长空间,为杂草类生长和繁殖创造机会[8]。研究表明,植被经过刈割,盖度和丰富度指数均增加,这与Antonsen 等[54]和Kotas 等[55]的研究结果一致。不同功能群物种对刈割响应差异很大[56],C2和C3植被群落不同,经刈割后的补偿能力不同。C3植被群落以禾本科为主,C2以禾本科和菊科为主,经刈割后,C2点植被高度、地上生物量降低,C3研究结果与其相反。王梅等[9]认为,不同功能群物种对刈割响应不同,刈割处理下,禾本科普遍实现了超补偿,而菊科却出现了不足补偿。
Julieta 等[56]对阿根廷西北部草原和常明[57]对高山草甸的植被特征研究表明,火烧消除了地上立枯物和凋落物,改善了植被的生长环境,增加了土壤养分,改善了光照条件,为竞争力较弱的植被进入提供了生存空间。本研究结果表明,不同点经火烧后植被高度、盖度、地上生物量在整个生长季总体呈现增加的趋势。火烧对物种丰富度的影响,因火烧强度、频率和季节不同规律不一致。Flematti 等[58]研究认为,火烧降低土壤表面枯落物比例后为新生的草本植物创造良好生境,同时火烧释放的氰化物又能刺激灾后种子的萌发,说明火烧可以提高草地的物种丰富度。本研究结果显示,火烧可以增加群落的丰富度指数,但是差异不显著,说明经过一次火烧,新生物种的生长需要缓冲期。
本研究表明,放牧较刈割显著增加了物种多样性,这是由于放牧的过程中,创造了裸露的地面空隙,为新生植被的生长创造了条件。不同点放牧较刈割,植被高度、盖度、地上生物量降低,这是由于研究区牧民长期放牧,牲畜的践踏和采食破坏了植被的生长环境。
4 结论
随着土层深度的增加土壤酶活性逐渐降低,且不同处理差异逐渐降低,具有“表聚性”特征。
研究区地处牧区,围封处理避免了牲畜的采食、践踏和人类活动的干扰,植被高度、盖度、地上生物量和3 种土壤酶活性均增加,而长期围封土壤表层堆积了较多的立枯物,一些对光资源或养分竞争能力较弱的物种,由于受到“光资源”限制,在植被群落中逐渐消失,丰富度指数降低;放牧过程中牲畜优先喜食高大的禾本科,植被高度、盖度和地上生物量均降低,植被消耗严重使植被光合作用进入土壤根系的养分降低,改变了微生物活性,导致酶活性降低,而放牧促进植被群落间隙形成和物种的再生速度,为弱势物种创造各种生境,丰富度指数增加;刈割后植被的补偿性因植被群落不同产生差异,禾本科物种经刈割后出现了超补偿,植被高度、盖度、地上生物量和土壤酶活性均增加,而菊科物种经刈割后补偿性较差,植被特征和土壤酶活性均降低。火烧消除了地上立枯物和凋落物,改善了光照条件,土壤肥力增加,改善了植被的生长环境,植被高度、盖度、地上生物量和土壤酶活性均增加,且以上指标在4 种处理方式下最大。
研究区地处半干旱地区,降水较少,使得逐年积累的凋落物难以分解,阻碍了植被的更新,在不同处理的对比分析下,控制性火烧是最佳的草地管理方式,可实现草地生态系统的可持续发展。
