橡胶树红根病病原菌木聚糖酶编码基因GpTR1774的克隆与表达分析
2023-03-18伏雪涂敏蔡海滨张红骥于德才曾霞
伏雪 涂敏 蔡海滨 张红骥 于德才 曾霞

摘 要:細胞壁降解酶是诸多病原真菌的重要致病因子,其中木聚糖酶作为最重要的半纤维素酶,在丝状真菌降解细胞壁侵染寄主的过程中占有重要作用。本研究以橡胶树红根病病原菌HD3为材料,采用RT-PCR克隆木聚糖酶编码基因GpTR1774的基因序列,对其进行生物信息学分析;用HD3侵染橡胶树热研73397组培苗根部,电镜观测病原菌对根部细胞的侵染和破坏过程,并利用qRT-PCR方法测定不同侵染时间GpTR1774基因的表达量。结果表明:GpTR1774基因cDNA全长为780 bp,编码259个氨基酸,其中含量最丰富的氨基酸为丙氨酸(Ala),占15.1%;预测蛋白分子量为28.12 kDa,脂肪系数为81.93,等电点为9.07,属亲水性蛋白,共有15个磷酸化位点,无信号和肽跨膜域,定位于细胞溶质;α-螺旋和无规则卷曲是GpTR1774蛋白二级结构的主要元件,分别占氨基酸序列的38.10%和41.31%。系统进化树分析显示,GpTR1774基因与狭长孢灵芝木聚糖酶基因相似度最高,达87.5%。qRT-PCR显示,木聚糖酶GpTR1774基因表达量整体趋势为先上升后下降,侵染3 d和4 d表达量极显著上升,4 d达到最高水平,约为侵染初始的16倍。本研究结果初步表明,木聚糖酶编码基因GpTR1774很可能参与橡胶树红根病病原菌的致病过程,为橡胶树红根病的致病机理解析和绿色防控提供参考。
关键词:热研73397;红根病病原菌;GpTR1774基因;侵染过程;qRT-PCR中图分类号:S763.7 文献标识码:A
Cloning and Expression Analysis of Xylanase GpTR1774 Gene from Ganoderma pseudoferreum
FU Xue1,2, TU Min2*, CAI Haibin1,2, ZHANG Hongji1, YU Decai1*, ZENG Xia2
1. Plant Protection College, Yunnan Agricultural University, Kunming, Yunnan 650201, China; 2. Rubber Research Institute, Chinese Academy of Tropical Agricultural Sciences, Haikou, Hainan 571101, China
Abstract: Cell wall degrading enzymes are important pathogenic factors of many pathogenic fungi, among which xylanase, as the most important hemicellulase, plays an important role in the process of host cell wall degrading by filamentous fungi to achieve host infection. In this study, RT-PCR was used to clone the coding region of xylanase GpTR1774 gene of Ganoderma pseudoferreum strain HD3 and analyze its bioinformatics. The root of Hevea tissue cultured seedlings Reyan 73397 were infected with HD3, meanwhile infection and destruction process of root cells were observed by electron microscopy. The gene expression of GpTR1774 was determined by qRT-PCR. The results showed that the total length of GpTR1774 cDNA was 780 bp, encoding 259 amino acids, among which the most abundant amino acid was alanine (Ala), accounting for 15.1%. The molecular weight of GpTR1774 protein was 28.12 kDa, fat coefficient was 81.93, and the isoelectric point was 9.07. It was a hydrophilic protein with 15 phosphorylation sites, no signal and peptide transmembrane domain, and was located in the cell solute. The main components of the secondary structure α-helix and random curling are the main components of the secondary structure of GpTR1774 protein, accounting for 38.10% and 41.31% of the amino acid sequence, respectively.Phylogenetic analysis showed that GpTR1774 gene had the highest similarity with xylanase gene of Ganoderma boninense, reaching 87.5%. qRT-PCR showed that the overall gene expression trend of xylanase GpTR1774 was firstly increased and then decreased. The expression level of GPTR1774 increased significantly on the 3rd and 4th day after infection, and reached the highest level on the 4th day, about 16 times of the initial level. The results of this study indicate that the xylanase GpTR1774 gene was likely to be involved in the pathogenesis of G. psedoferreum, providing reference for the pathogenesis analysis and green prevention and control of G. psedoferreum.
Keywords: Hevea brasiliensis Reyan 73397; Ganoderma pseudoferreum (Wakef) v. Over. et Steinm; GpTR1774; infection process; qRT-PCR
DOI: 10.3969/j.issn.1000-2561.2023.12.011
橡胶树(Hevea brasiliensis)生产的天然橡胶是重要工业原料和战略物质,世界范围内共有8种根病为害,其中红根病是我国植胶区发病面积最广、严重度最高的土传病害,发病严重的林段发病率可达40%,给我国橡胶产业带来巨大损失[1-2]。其病原菌为Ganoderma pseudoferreum (Wakef) v. Over. et Steinm,属担子菌,层菌纲,灵芝属[3-4],是一类木腐真菌。木腐真菌主要借助菌丝或菌丝体蔓延,菌丝端头能分泌半纤维素降解酶类、纤维素降解酶类、木质素降解酶类等,分解细胞壁组织中的半纤维素、纤维素和木质素等,使长链大分子断裂,损害植株组织结构,削弱寄主生活力[5-7]。
植物细胞壁是病菌与寄主互作的重要场所,同时也是病原菌入侵、扩展的第一道防线[8],多种植物病原真菌的重要致病因子主要是细胞壁降解酶,主要通过降解植物细胞壁以便病原菌侵入植物体内[9]。木聚糖是半纤维素的主要组成成分,也是自然界中含量及其丰富的多糖,广泛存在于植物组织的细胞壁中[10-13]。木聚糖酶是一类可降解木聚糖的酶系,主要来源有放线菌、细菌和真菌,它可以随机切断植物细胞壁木聚糖的β-1,4主链,可将木聚糖降解为木糖或低聚木糖[12, 14-15]。近些年,对木聚糖酶基因的分子生物学的研究快速展开,许多真菌木聚糖酶基因被克隆,而研究最多的是木霉、青霉、黑曲霉和棒曲霉等。KINOSHITA等[16]从黑曲霉中克隆得到编码木聚糖酶B的基因xynNB,并在白曲霉中成功表达。AHMED等[17]综述了真菌来源木聚糖酶的分子克隆。BAGEWADI等[18]从桔青霉HZN13菌株中克隆得到Xyl-Iib基因。周彩霞等[8]从梳棉状嗜热真菌克隆了2种木聚糖酶基因,分别是xyn11A和xyl43。XIE等[19]从镰刀菌Q7-31中克隆得到对水稻细胞壁具有强降解能力的木聚糖酶基因Xyn8。JIANG等[20]和杨行等[21]在土壤中分离鉴定得到1株具有高木质纤维素分解能力的嗜热丝状真菌毛壳霉CQ31,从中克隆得到对阿拉伯木聚糖具有较高酶活的GH11家族木聚糖酶基因CsXyn11B。
隨着研究的不断深入,细胞壁降解酶基因的功能及致病机理被逐渐认识,但细胞壁降解酶基因在橡胶树红根病病原菌中研究却未见报道,相关基因的克隆、表达分析等均需进行研究。本研究克隆得到1个橡胶树红根病病原菌的木聚糖酶编码基因GpTR1774,通过分析其生物信息学和不同侵染时间基因表达变化,确定细胞壁降解酶是否为橡胶树红根病病原菌主要的致病生化因子,为橡胶树红根病的防控和抗红根病育种奠定理论基础。
1 材料与方法
1.1 材料
橡胶树红根病病原菌菌株HD3由本课题组分离鉴定和保存,分离自中国热带农业科学院试验场三队感染红根病的橡胶树病根。接种材料为巴西橡胶树无性系热研73397组培苗,由中国热带农业科学院橡胶研究所组培与转基因育种课题组提供,苗高10~13 cm,根健壮,具一蓬叶。
1.2 方法
1.2.1 RNA提取和反转录 参照林仕凯等[22]的方法将橡胶树红根病病原菌HD3接种后的0、3、4、5、6、7、8、9、10 d菌丝进行收集,使用TIANGEN多糖多酚植物总RNA试剂盒提取总RNA,裂解液使用HL,利用北京全式金生物技术有限公司反转录试剂盒获得cDNA。
1.2.2 木聚糖酶编码基因GpTR1774基因克隆 通过本实验室建立的橡胶树红根病病原菌转录组数据库,筛选获得木聚糖酶编码基因序列。采用Primer Premier 5.0软件对橡胶树红根病病原菌木聚糖酶编码GpTR1774设计相关引物(表1),参照柯萍萍[23]的方法选用18S rRNA为内参基因。以橡胶树红根病病原菌的cDNA为模板,利用PCR扩增木聚糖酶编码基因GpTR1774的全长序列,对PCR产物目的条带进行切胶回收,送往海口楠山基因生物技术有限公司测序。
1.2.3 木聚糖酶编码基因GpTR1774生物信息学及进化分析 使用表2中的7类软件进行木聚糖酶编码基因GpTR1774的生物信息学和进化分析。
1.2.4 橡胶树红根病病原菌侵染根部观察 参考涂敏等[24]的方法,将红根病病原菌接种至橡胶树组培苗根部,每个处理3个重复。分别在接种后的0、1、2、3、4、5、6、7、8、9、10 d观察、拍照。
1.2.5 木聚糖酶GpTR1774基因表达分析 刮取侵染3~10 d橡胶树组培苗根部菌丝体,参照1.2.1和1.2.2的方法,提取不同侵染时间的红根病病原菌的总RNA,选用橡胶树红根病病原菌18S rRNA基因为内参(表1)。采用qRT-PCR方法检测木聚糖酶编码基因GpTR1774基因相对表达量,反应体系和程序参考孙茜茜等[25]的方法。
1.3 数据处理
通过2–ΔΔCT法计算木聚糖酶编码基因GpTR 1774相对表达量,使用Excel软件制图。
2 结果与分析
2.1 木聚糖酶编码基因GpTR1774的克隆分析
测序结果和凝胶电泳显示,PCR克隆得到木聚糖酶编码基因GpTR1774序列长度为780 bp (图1),编码259个氨基酸(图2),丙氨酸(Ala)的含量最丰富,占氨基酸总数的15.1%,木聚糖酶GpTR1774蛋白分子式C1259H1956N360O372S1,推导的氨基酸分子量为28.12 kDa,等电点为9.07,不稳定系数为27.73,脂肪系数为81.93,正电荷残基数为31,负电荷残基数为28,总平均亲水性–0.2000,木聚糖酶GpTR1774蛋白为亲水性蛋白。
2.2 木聚糖酶编码基因GpTR1774生物信息学分析
2.2.1 信号肽、亚细胞定位、跨膜区及磷酸化位点预测 利用生信软件分析工具预测木聚糖酶GpTR1774蛋白存在信号肽的概率为0.0146(图3A),没有跨膜结构域,位于细胞溶质中(图3B)。
磷酸化位点分析发现木聚糖酶GpTR1774肽链中可能发生磷酸化,含有6个苏氨酸磷酸化位点,7个丝氨酸磷酸化位点和2个酪氨酸磷酸化位点(图3C)。
2.2.2 木聚糖酶GpTR1774蛋白保守结构域及二、三级结构预测 生物信息学分析表明木聚糖酶GpTR1774在8~259氨基酸之间存在1个NADB保守结构域(图4A)。在木聚糖酶GpTR1774蛋白的二级结构中,α-螺旋占38.10%,β-折叠占15.44%,β-转角占4.63%,无规则卷曲占41.31%(图4B)。由此可以看出,在GpTR1774蛋白二级结构中,无规则卷曲和α-螺旋所占比重较多,β-转角占比较少,α-螺旋和无规则卷曲是木聚糖酶GpTR1774蛋白二级结构的主要元件。其三级结构与二级结构预测结果相符合(图4C)。
2.3 木聚糖酶GpTR1774蛋白的同源性比对及系统进化分析
通过对木聚糖酶GpTR1774进行氨基酸序列同源比对,发现木聚糖酶GpTR1774氨基酸序列与灵芝属参考序列的蛋白序列(LR_28215.1)相似度较高(图5)。通过构建的系统发育进化树,可知橡胶树红根病病原菌木聚糖酶GpTR1774与引起油棕茎基腐病的狭长孢灵芝木聚糖酶亲缘关系最近,相似度达87.5%;与茄根菌木聚糖酶的亲缘关系最远,相似度为11.2%(图6)。
2.4 木聚糖酶编码基因GpTR1774基因表达分析
2.4.1 红根病病原菌侵染橡胶树组培苗根部 将HD3菌株接种至橡胶树组培苗根部后,第1天和第2天肉眼无法观察到菌丝体在根部的侵染,至第3天可见菌丝体侵染至根表面(图7),随着侵染天数的增加,菌丝体逐渐迅速向上蔓延至整个根部(侵染10 d),菌丝平均侵染速度为2.1 mm/d。
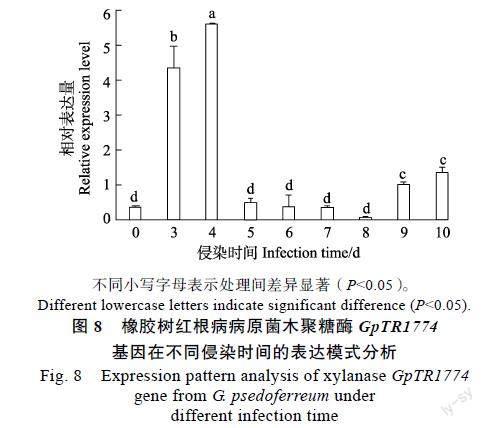
2.4.2 橡胶树红根病病原菌木聚糖酶编码基因GpTR1774基因表达分析 采用qRT-PCR分析红根病病原菌侵染橡胶树组培苗材料后木聚糖酶编码基因GpTR1774相对表达量的变化。结果显示,木聚糖酶编码基因GpTR1774表达量整体趋势为先上升后下降,侵染第3天和4天表达量极显著上升,在第4天达到最高水平,为5.62,约为侵染初始(0 d)表达量的16倍(图8)。
3 讨论
红根病是我国橡胶树生产中最重要的土传病害,而橡胶红根病病原菌致病机理包括病原菌在根部的侵染进程、侵染中的关键基因等报道甚少。在本实验室前期研究的基础上,通过利用橡胶树组培苗进行试管内无菌接种,可以观察病原菌的侵染进程。孙明明等[26]研究大豆菌核病菌丝侵染过程,发现接种大豆菌核病的叶片及茎秆在取样过程中需要有一定的发病区域,通过取样观察,选择在接种后3 d发病区域内可以满足取样操作。本研究接种后观察发现,接种3 d后可肉眼观察到少量菌丝体蔓延至橡胶树根部,透射电镜结果显示3 d后根部表皮最外层细胞被破坏,多数表皮细胞中可见菌丝体。直接观察和透射电镜结果可知,第3天是红根病病原菌穿透表层细胞壁,侵染橡胶树根部的关键时间点。
真菌细胞壁降解酶基因与真菌的致病性密切相关,本研究从橡胶树红根病病原菌中克隆到一个木聚糖酶编码基因GpTR1774,预测主要定位于细胞溶质中且无跨膜结构域。孙茜茜等[25]通过qRT-PCR检测发现,GPFTR1蛋白编码基因分别在橡胶红根病病原菌受己唑醇和青蒿琥酯胁迫處理0、2、6、12、24、72 h,在处理6 h表达量最高,表明GPFTR1蛋白编码基因早期上调显著。孙佳宁等[27]发现木葡聚糖酶编码基因CvXEG1在葡萄白腐病病原菌侵染早期大量表达。LU等[28]分析了木聚糖酶编码基因RcXYN1-RcXYN9基因在侵染过程中接种后18、36、72、96、240 h的表达,接种稻瘟病菌后,RcXYN6和RcXYN7的转录水平在72、96、240 h时上调,在240 h时显著上调。LAI等[29]和GARC?A等[30]从其他真菌病原
体中也观察到一些木聚糖酶基因的早期表达。本研究发现木聚糖酶编码基因GpTR1774在橡胶树红根病病原菌中表达,但表达量存在一定差异,早期大量表达,随着侵染时间的增加,该基因表达水平先上升后下降,在侵染第3天和第4天基因表达量剧增,可以推测在第3天和第4天,红不同小写字母表示处理间差异显著(P<0.05)。
根病病原菌分泌较多木聚糖酶,促进了根部细胞壁中半纤维素的降解。在后续研究中,可通过构建木聚糖酶GpTR1774基因的基因敲除突变体,进一步研究木聚糖酶GpTR1774基因在橡胶树红根病病原菌致病过程中的功能,为橡胶树红根病病原菌的致病机理解析奠定基础。
参考文献
[1] 张贺, 蒲金基, 张欣, 谢艺贤, 漆艳香. 橡胶树红根病病原菌生物学培养特性[J]. 热带作物学报, 2008, 29(5): 632-635.ZHANG H, PU J J, ZHANG X, XIE Y X, QI Y X. Biological characteristics of the pathogenic fungus of red root disease of hevea rubber tree[J]. Chinese Journal of Tropical Crops, 2008, 29(5): 632-635. (in Chinese)
[2] 張运强, 张辉强, 邓晓东. 橡胶树红根病病原菌的鉴定[J]. 热带作物学报, 1997(1): 16-23.ZHANG Y Q, ZHANG H Q, DENG X D. Identification of pathogenic fungi of rubber red root disease[J]. Chinese Journal of Tropical Crops, 1997(1): 16-23. (in Chinese)
[3] NANDRIS D, NICOLE M, GEIGER J P. Root rot diseases[J]. Plant Disease, 1987, 71(4): 298-306.
[4] 丁婧钰. 橡胶树与相思树病原灵芝种类鉴定及生物学特性研究[D]. 海口: 海南大学, 2018.DING J Y. Type identification of pathogenic ganoderma and biological characteristics of the rubber tree and Acacia spp.[D]. Haikou: Hainan University, 2018. (in Chinese)
[5] WAN C, LI Y. Fungal pretreatment of lignocellulosic biomass[J]. Biotechnology Advances, 2012, 30(6): 1447-1457.
[6] RABEMANOLONTSOA H, SAKA S. Various pretreatments of lignocellulosics[J]. Bioresource Technology, 2016, 199: 83-91.
[7] CHEN H, LIU J, CHANG X, CHANG X, CHEN D, XUE Y, LIU P, LIN H, HAN S. A review on the pretreatment of lignocellulose for high-value chemicals[J]. Fuel Processing Technology, 2017, 160: 196-206.
[8] 周彩霞, 赵治巧, 唐宇佳, 金伟琼, 肖义蓉, 王寅生, 李蕴哲, 唐自钟, 陈惠. 产木聚糖酶嗜热真菌鉴定、酶基因克隆及生物信息学分析[J]. 基因组学与应用生物学, 2021, 40(1): 197-203.ZHOU C X, ZHAO Z Q, TANG Y J, JIN W Q, XIAO Y R, WANG Y S, LI Y Z, TANG Z Z, CHEN H. Identification of xylanase-producing thermophilic fungi, cloning of enzyme gene and bioinformatics analysis[J]. Genomics and Applied Biology, 2021, 40(1): 197-203. (in Chinese)
[9] 王鹏程, 郝海婷, 王兰, 凌新慧. 枣黑斑病菌细胞壁降解酶活性测定及致病性分析[J]. 果树学报, 2019, 36(7): 903-910.WANG P C, HAO H T, WANG L, LING X H. Analysis of cell wall degrading enzymes from black spot pathogen and itspathogenicity[J]. Journal of Fruit Science, 2019, 36(7): 903-910. (in Chinese)
[10] 杨毅. 产黄青霉半纤维素酶促进木质纤维素降解的机制研究[D]. 北京: 中国农业大学, 2019.YANG Y. Mechanism of enhancing lignocellulose hydrolysis byhemicellulases from Penicillium chrysogenum[D]. Beijing: China Agricultural University, 2019. (in Chinese)
[11] LIMAYEM A, RICKE S C. Lignocellulosic biomass for bioethanol production: current perspectives, potential issues and future prospects[J]. Progress in Energy and Combustion Science, 2012, 38(4): 449-467.
[12] 高雅君, 丁長河. 木聚糖酶在食品工业中的应用研究进
展[J]. 粮食与食品工业, 2017, 24(2): 32-36.GAO Y J, DING C H. Research progress on the application of xylanase in food industry[J]. Cereal and Food Industry, 2017, 24(2): 32-36. (in Chinese)
[13] BEG Q, KAPOOR M, MAHAJAN L, HOONDAL G S. Microbial xylanases and their industrial applications: a review[J]. Applied Microbiology and Biotechnology, 2001, 56: 326-338.
[14] 谢占玲. 植物细胞壁降解真菌及酶的研究[D]. 兰州: 甘肃农业大学, 2011.XIE Z L. The study on plant cell wall degrading fungi and b their enzyme[D]. Lanzhou: Gansu Agricultural University, 2011. (in Chinese)
[15] COLLINS T, GERDAY C, FELLER G. Xylanases, xylanase families and extremophilic xylanases[J]. FEMS microbiology reviews, 2005, 29(1): 3-23.
[16] KINOSHITA K, TAKANO M, KOSEKI T, IWANO K. Cloning of the xynNB gene encoding xylanase B from Aspergillus niger and its expression in Aspergillus kawachii[J]. Journal of Fermentation and Bioengineering, 1995, 79(5): 422-428.
[17] AHMED S, RIAZ S, JAMIL A. Molecular cloning of fungal xylanases: an overview[J]. Applied Microbiology and Biotechnology, 2009, 84: 19-35.
[18] BAGEWADI Z K, MULLA S I, NINNEKAR H Z. Purification, characterization, gene cloning and expression of GH-10 xylanase (Penicillium citrinum isolate HZN13)[J]. 3 Biotech, 2016, 6(2): 1-9.
[19] XIE Z L, GAO H Y, ZHANG Q, LIU Y. Cloning of a novel xylanase gene from a newly isolated Fusarium sp. Q7-31 and its expression in escherichia coli[J]. Brazilian Journal of Microbiology, 2012, 43: 405-417.
[20] JIANG Z, CONG Q, YAN Q, KUMAR N, DU X. Characterisation of a thermostable xylanase from Chaetomium sp. and its application in Chinese steamed bread[J]. Food Chemistry, 2010, 120(2): 457-462.
[21] 楊行, 马俊文, 李延啸, 江正强, 刘学强, 闫巧娟. 毛壳霉木聚糖酶B(CsXyn11B)的分泌表达及其在面包中的应用[J]. 食品工业科技, 2023, 44(4): 108-113.YANG X, MA J W, LI Y X, JIANG Z Q, LIU X Q, YAN Q J. Secretion and expression of mucor xylanase B (CsXyn11B) and its application in bread[J]. Science and Technology of Food Industry, 2023, 44(4): 108-113. (in Chinese)
[22] 林仕凯, 涂敏, 鲁红学, 王晓芳, 蔡海滨, 胡彦师, 孙爱花, 程汉. 巴西橡胶树红根病病菌液体培养条件优化研究[J]. 热带农业科学, 2014, 34(10): 71-74.LIN S K, TU M, LU H X, WANG X F, CAI H B, HU Y S, SUN A H, CHENG H. Optimization of ganoderma pseudoferreum liquid culture condition[J]. Chinese Journal of Tropical Agriculture, 2014, 34(10): 71-74. (in Chinese)
[23] 柯萍萍. 松杉灵芝漆酶基因的克隆及其qRT-PCR分析[D]. 福州: 福建农林大学, 2012.KE P P. Cloning and qRT-PCR analysis of a laccase gene from Ganoderma tsugae[D]. Fuzhou: Fujian Agriculture and Forestry University, 2012. (in Chinese)
[24] 涂敏, 蔡海滨, 胡彦师, 程汉, 孙爱花, 黄华孙. 一种橡胶树红根病接种方法: ZL201511016106.1[P]. 2019-04-02.TU M, CAI H B, HU Y S, CHENG H, SUN A H, HUANG H S. A method for inoculation of red root disease of rubber tree: ZL201511016106.1[P]. 2019-04-02. (in Chinese)
[25] 孙茜茜, 何其光, 靳鹏飞, 吴迪, 张骕, 缪卫国, 刘文波, 邬国良. 橡胶树红根病菌GPFTR1基因的克隆、亚细胞定位与表达分析[J]. 基因组学与应用生物学, 2019, 38(8): 3646-3653.SUN Q Q, HE Q G, JIN P F, WU D, ZHANG S, MIAO W G, LIU W B, WU G L. Cloning, subcellular localization and expression analysis of GPFTR1 gene from Ganoderma pseudoferreum[J]. Genomics and Applied Biology, 2019, 38(8): 3646-3653. (in Chinese)
[26] 孫明明, 吕世翔, 李智媛, 王萍, 王冠, 赵雪, 韩英鹏, 李文滨. 大豆菌核病菌丝侵染茎叶过程扫描电镜观察研究[J]. 大豆科学, 2020, 39(1): 123-129.SUN M M, LYU S X, Ll ZH Y, WANC P, WANC G, ZHAO X, ZHAO X, HAN Y P, LI W B. Study of scanning electron microscopic observation on the mycelium infectionprocess of soybean sclerotinia sclerotirum on leaf and stem[J]. Soybean Science, 2020, 39(1): 123-129. (in Chinese)
[27] 孙佳宁, 秦嘉星, 王倩楠, 李保华, 周善跃. 木葡聚糖酶基因CvXEG1在葡萄白腐病菌致病中的功能解析[C]//中国植物病理学会. 植物病理科技创新与绿色防控——中国植物病理学会2021年学术年会论文集. SUN J L, QIN J X, WANG Q N, LI B H, ZHOU S Y. Functional analysis of xyloglucanase gene CvXEG1 in the pathogenesis of grape white rot[C]//Chinese Society of Plant Pathology. Technological innovation of plant pathology and green prevention and control——Proceedings of the 2021 Annual Conference of the Chinese Society of Plant Pathology. (in Chinese)
[28] LU L, LIU Y, ZHANG Z. Global characterization of GH10 family xylanase genes in Rhizoctonia cerealis and functional analysis of xylanase RcXYN1 during fungus infection in wheat[J]. International Journal of Molecular Sciences, 2020, 21(5): 1812.
[29] LAI M W, LIOU R F. Two genes encoding GH10 xylanases are essential for the virulence of the oomycete plant pathogen Phytophthora parasitica[J]. Current Genetics, 2018, 64: 931- 943.
[30] GARC?A N, GONZ?LEZ M A, GONZ?LEZ C, BRITO N. Simultaneous silencing of xylanase genes in Botrytis cinerea[J]. Frontiers in Plant Science, 2017, 8: 2174.
