椰枣F1分离群体表型多样性的分析与评价
2023-03-18王义符海泉张宁高兆银胡美姣洪小雨李东霞徐中亮
王义 符海泉 张宁 高兆银 胡美姣 洪小雨 李东霞 徐中亮
摘 要:為了解椰枣F1分离群体的表型性状的多样性,本研究以143份椰枣F1分离群体为供试材料,对其株高、冠幅、茎围、枝条数和叶斑病发病情况等17个表型性状进行多样性、相关性、主成分及聚类分析。结果表明:椰枣F1分离群体表型变异程度高,具有丰富的多样性。数量性状变异程度较高,变异系数为10.927%~43.350%,其中茎围的变异系数最大。质量性状变异系数为31.447%~44.619%,其中裂叶叶色和裂叶坚硬程度的变异系数分别为44.619%和42.571%。相关性分析表明:株高、冠幅、茎围、枝条数、第三枝长、刺区长度、裂叶总数、裂叶长、裂叶宽、裂叶厚度、裂叶叶色11个性状两两间均达到极显著正相关;叶斑病发病情况与其余16个性状均呈负相关。主成分分析显示,6个主成分的累计贡献率达87.51%,其中第1主成分特征值为10.0836,贡献率为59.32%,主要包含株高、第三枝长、冠幅、茎围和枝条数这5个指标共同影响,其中株高的特征值最大为0.2948,主要反映的了椰枣株高和长势情况。聚类分析表明:143份椰枣F1分离群体可分5大类群,第Ⅰ类群包括33份,多为冠幅最小、枝条数最少、裂叶最短、叶斑病发病程度最重的资源;第Ⅱ类群包括39份,为株高最矮、茎围最小、第三枝长最短、叶斑病发病情况较重的资源;第Ⅲ类群包括23份,为裂叶较长、裂叶叶色较深、株型较直立、叶斑病发病情况较轻的资源;第Ⅳ类群包括33份,为裂叶长宽比较大、裂叶较硬、叶斑病发病最轻的表型性状优良资源;第Ⅴ类群包括14份,为裂叶长宽比较小、株型为开张型的资源。本研究结果可为后期椰枣亲本优良性状选育提供理论依据。
关键词:椰枣;分离群体;表型性状;多样性;聚类分析中图分类号:S667.9 文献标识码:A
Analysis and Evaluation of Phenotypic Characters of F1 Segregation Populations of Date Palm
WANG Yi1, FU Haiquan1, ZHANG Ning1,2, GAO Zhaoyin3, HU Meijiao3, HONG Xiaoyu4, LI Dongxia1, XU Zhongliang1,2*
1. Coconut Research Institute, Chinese Academy of Tropical Agricultural Sciences / National Tropical Palm Germplasm Nursery, Wenchang, Hainan 571339, China; 2. Sanya Research Academy, Chinese Academy of Tropical Agricultural Sciences, Sanya, Hainan 572000, China; 3. Environment and Plant Protection Institute, Chinese Academy of Tropical Agricultural Sciences / Key Laboratory of Integrated Pest Management on Tropical Crops, Ministry of Agriculture and Rural Affairs, Haikou, Hainan 571101, China; 4. College of Horticulture & Forestry Sciences, Huazhong Agricultural University, Wuhan, Hubei 430070, China
Abstract: In order to understand the diversity of phenotypic traits in F1 segregation populations of date palm, this study used 143 F1 segregation populations of date palms as test materials to analyze the diversity, correlation, principal component and cluster analysis of 17 phenotypic traits, including plant height, crown breadth, stem girth, number of branches and leaf spot incidence. The results showed that there was a high degree of phenotypic variation and rich diversity in F1 segregation population of date palms. The variation degree of quantitative characters was high, the coefficient of variation ranged from 10.927% to 43.350%, and the coefficient of variation of stem girth was the largest. The coefficients of variation of quality traits ranged from 31.447% to 44.619%, among which the coefficients of variation of tiller leaf color and leaf hardness were 44.619% and 42.571%, respectively. The correlation analysis showed that plant height, crown breadth, stem girth, number of branches, the third branch of long, the thorn area length, the total number of tiller leaves, tiller leaves length, tiller leaves width, tiller leaf thickness and leaf color were positively correlated with each other. The incidence of leaf spot was negatively correlated with the other 16 traits. The principal component analysis showed that the cumulative contribution rate of the six principal components reached 87.51%, of which the characteristic value of the first principal component was 10.0836, and the contribution rate was 59.32%. It is mainly affected by the five indicators of plant height, third branch length, crown breadth, stem girth and branch number. The characteristic value of plant height is the largest, which is 0.2948, which mainly reflects the height and growth trend of date palm. The cluster analysis showed that the 143 F1 generation dates could be divided into five groups: Group Ⅰ included 33 dates with the smallest crown, the least number of branches, the shortest tiller leaves length, and the highest incidence of leaf spot disease. Group Ⅱ included 39 dates resources with the shortest plant height, the smallest stem girth, the shortest third branch length, and the heaviest incidence of leaf spot disease. Group Ⅲ included 23 dates resources with longer tiller leaves, darker tiller leaves, erect plant type and mild incidence of leaf spot disease. Group Ⅳ included 33 dates resources with excellent phenotypic traits such as large ratio of leaf length to width of tiller leaves, stiffer tiller leaves and the least incidence of leaf spot disease. Group Ⅴ included 14 dates resources with small ratio of tiller leaves length to width ratio and open plant type. The results of this study can provide a theoretical basis for the breeding of superior parental traits in later stage of date palm.
Keywords: date palm; segregation population; phenotypic characters; diversity; cluster analysis
DOI: 10.3969/j.issn.1000-2561.2023.12.014
椰枣树(Phoenix dactylifera L.)是雌雄异株的多年生植物,属于棕榈科刺葵属,它具有耐旱、耐碱、耐热的特点,因此能够适应高温干旱、盐碱、沙漠等极端恶劣的生态环境,广泛分布于中东和北非等干热地区,在我国海南、云南、广东等地均有分布[1]。果实为椰枣(date palm),又名波斯枣、番枣、伊拉克枣。椰枣富含铁、钙、铜、磷、维他命、碳水化合物、蛋白质、脂肪、纤维素、氨基酸和维生素等大量矿质元素和营养物质[2],是阿拉伯国家重要的经济作物和粮食作物[3],也被称为“阿拉伯民族之树”和“沙漠面包”,在确保阿拉伯国家粮食安全和生态安全中发挥着重要作用[4-5]。随着“一带一路”建设的推进,促进了世界热区特色经济作物流入中国,椰枣也越来越多的为中国百姓所熟知。海南省文昌市位于东经110°34′、北纬19°59′,具有热带和亚热带气候特点,全年无霜冻,雨季明显,雨量丰富,湿度大,土壤为滨海沙土,肥力中等、偏酸性,pH为5.4,适合椰枣树生长。中国热带农业科学院椰子研究所正在进行椰枣种质资源的引种、试种与风险评估工作。
植物表型性状评价及鉴定是棕榈作物种质资源利用和育种研究的重要手段和方法,也是种及种以上分类和植物新品种特异性、一致性及稳定性测试的主要依据[6]。表型性状是植物种质资源最直观的表现,也是优良品种选育的基础,了解和掌握表型性状的多样性,对挖掘有益资源、创制新种质等具有重要意义[7]。种质资源研究最基本的方法是测定其表型性状,同时也是种质分类标准的重要依据之一。因此,对种质资源进行分类比较时可以利用表型性状来进行[8]。椰枣种质资源的引进极大地丰富了我国椰枣种质资源库,然而有大量研究表明椰枣具有丰富的表型性状和遗传多样性,国外已经开发出通过分子标记等手段对椰枣的遗传多样性进行分析[9-11]。椰枣是雌雄异株、异花授粉植物,因此通过种子繁殖不仅会产生丰富的遗传变异,而且将产生新的基因型和表现型,从而为椰枣提供丰富的育种新材料。
目前,我国对于椰枣种质资源的表型性状研究尚未见报道,因此本研究以中国热带农业科学院椰子研究所徐中亮等前期收集的骨干亲本,通过杂交育种构建的143份椰枣F1分离群体为供试材料,采用相关性分析、主成分分析和聚类分析相结合的分析方法[12],对椰枣F1分离群体的表型性状进行分析与评价,为更加全面地揭示椰枣的表型多样性、进一步开展椰枣种质资源的创新利用、筛选优良抗病亲本和适栽品种等研究提供优异种质材料和参考依据。
1 材料与方法
1.1 材料
供试材料为2018年于海南省三亚市调查时发现的生长10年以上的椰枣树,父本为感病资源,母本为抗病资源。父本、母本树干高5.0~ 6.0 m,茎围50.0~60.0 cm;雄花花苞数量10~14个,雌花花苞数量10~12个。在开花期对父母本进行套袋处理,采集雄花进行人工授粉,果实成熟后采集全部果实进行实验室繁育,获得F1分离群体143份。于2019年3月将F1分离群体全部移植到中国热带农业科学院椰子研究所国家热带棕榈种质资源圃椰枣分区,在资源圃内只进行常规管理,日常除草、浇水、施肥,不施用任何杀虫剂和杀菌剂。
1.2 方法
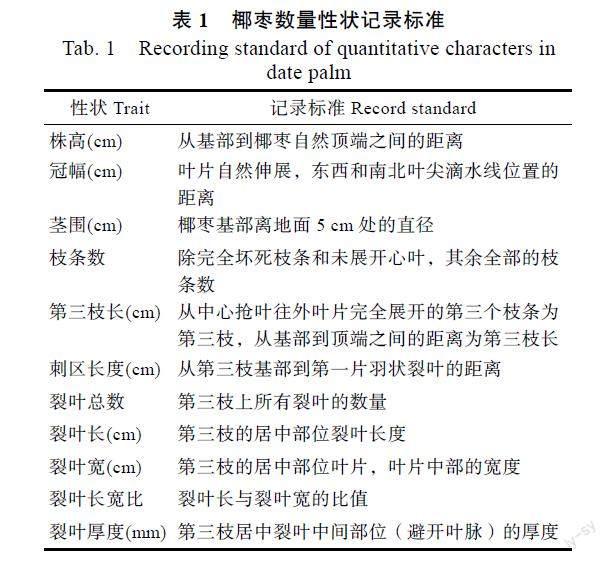
1.2.1 数量性状的测定 参考EISSA等[13]、SIMOZRAG等[14]的相关测定方法和性状描述有所改动,对143份椰枣F1分离群体的11个数量性状(株高、冠幅、茎围、枝条数、第三枝长、刺区长、裂叶总数、裂叶长、裂叶宽、裂叶长宽比、裂叶厚度)进行观察和测量记录(表1),采用电子游标卡尺和钢卷尺测定。
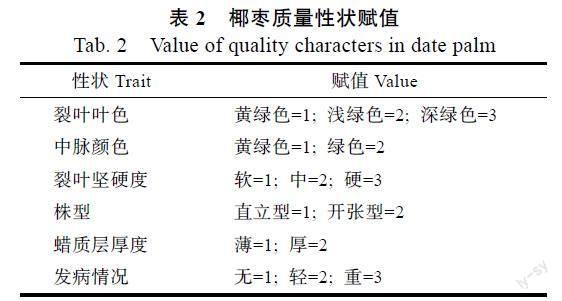
1.2.2 质量性状的描述 对143份椰枣F1分离群体的6个质量性状进行调查记录,参考EISSA等[13]、HANANE等[15]将裂叶叶色、中脉颜色、裂叶坚硬程度、株型、蜡质层厚度和叶斑病的发病情况进行编码,其中二元性状3个,编码1,2;多元性状3个,编码1,2,3,各性状编码详见表2。
1.3 数据处理
利用Microsoft Excel 2016软件进行数据统计和计算,运用SPSS 17.0和SAS 9.2软件进行植物学性状的相关分析、主成分分析和聚类分析。聚类方法为类平均法,以欧氏距离绘制树状聚类图[16]。
2 结果与分析
2.1 椰枣F1分离群体表型性状的变异分析
从表3可以看出,椰枣F1分离群体的17个表型性状变异性大。11个数量性状中极差最大的为冠幅,达到232.300 cm,其次是株高(148.100 cm),最小的是裂叶厚度(0.136 mm)。数量性状的变异系数在10.927%~43.350%之间,变化范围较大,其中茎围、枝条数、刺区长度和株高变异系数在30%以上,分别为43.350%、42.780%、39.679%和31.868%,变异系数最小的是裂叶厚度,为10.927%。6个质量性状的变异系数在31.447%~44.619%之间,变异系数均大于30%,其中裂叶叶色的变异系数最大,为44.61%,变异幅度为1~3;其次是裂叶叶片坚硬程度为42.571%,变异幅度为1~3;最小的为叶斑病发病情况31.447%,变异幅度为1~3。该结果表明,143份椰枣F1代长势差异较大,各表型性状也存在較大的差异,具有丰富的变异。
从表4可以看出,6个质量性状中检测到15个变异,其中裂叶叶色、裂叶叶片坚硬程度和叶斑病发病情况的变异数为3,其余3个性状的变异数为2。结合表2从各质量性状的分布频率可以看出中脉颜色分布在第1级别(黄绿色)的频率最高,占79.7%,其次是分布在蜡质层第1级别(薄)的为78.3%,最低的分布在裂叶叶色第3级别(深绿色)的为10.5%;在株型的2个级别中分布较为均匀,其中第1级别(直立型)占46.9%,第2级别(开张型)占53.1%。
2.2 椰枣表型性状的相关性分析
对143份供试材料17个表型性状进行相关性分析发现(表5),所有性状之间均存在不同程度的相关性。136对性状组合中有121对具有显著相关关系,15对无显著相关关系。相关系数均大于0.8000的有15组,均呈极显著正相关,分别为株高与冠幅、茎围、枝条数、第三枝长、裂叶长;冠幅与茎围、枝条数、第三枝长、裂叶总数;茎围与枝条数、第三枝长、裂叶总数;枝条数与叶片厚度;第三枝长与裂叶总数、裂叶长;相关系数达到0.7000以上的有16组,均呈极显著正相关。
株高、冠幅、茎围、枝条数、第三枝长、刺区长度、裂叶总数、裂叶长、裂叶宽、裂叶厚度、裂叶叶色11个性状两两间相关关系均达到极显著正相关,表明椰枣的这11个表型性状相关性强。第三枝长与除株型外所有表型性状均呈极显著正相关,其中与株高相关系数最大为0.9633;其次是冠幅相关系数为0.8890;再次为茎围相关系数为0.8586,表明第三枝长与长势相关的表型性状间有较强的正相关性。叶斑病发病情况与其他16个性状均呈负相关,其中与株高、冠幅、茎围、枝条数、第三枝长、刺区长度、裂叶总数、裂叶长、裂叶宽、裂叶叶片长宽比、裂叶厚度、裂叶叶色、中脉颜色、裂叶坚硬度、蜡质层厚度,呈极显著负相关,与株型呈负相关,但不显著;与椰枣裂叶叶色的负相关性最强,相关系数为?0.7989;其次是株高、第三枝长、枝条数、冠幅、茎围,相关系数分别为?0.6720、?0.6532、?0.6498、?0.6350、?0.6248,其数值均小于?0.6000,表明椰枣叶斑病发病情况与裂叶叶色和植株长势相关的表型性状间有较强的负相关性。因此,椰枣第三枝长与长势相关的表型性状间呈正相关,与叶斑病发病情况呈負相关,初步确定椰枣第三枝长可以用来反映椰枣长势情况与叶斑发病情况。椰枣叶斑病发病情况与裂叶叶色呈极显著负相关,表明发病时首先反应在裂叶叶色上;与植株长势呈显著负相关,即椰枣长势越好,叶斑病发病情况越轻,越适合我国栽培种植。
2.3 椰枣表型性状的主成分分析
采用SPSS 17.0软件将数据进行标准化处理,对处理后的数据进行主成分分析,得到椰枣表型性状的主成分的特征值、贡献率、累计贡献率和特征向量(表6、表7)。有研究认为,特征值大于等于1或者累计贡献率大于85%的主成分具有一定代表性[17]。从表6可以看出,前6个主成分的累计贡献率达到87.51%,根据累计贡献率大于85%的标准,表明这6个主成分可以反映全部指标的大部分遗传信息,而其他成分的特征值均小于1,且贡献率趋于平缓,代表性不强,因此用前6个主成分对椰枣表型变异进行综合评价。
由表6和表7可知,第1主成分的特征值为10.0836,贡献率为59.32%,在第1主成分中,主要包含株高、第三枝长、冠幅、茎围和枝条数这5个指标共同影响,其中株高的特征值最大为0.2948,其次为第三枝长、冠幅、茎围与枝条数特征值分别为0.2936、0.2930、0.2883、0.2856;叶斑病发病情况在第1主成分中的特征值为?0.2373,这类性状主要反映的是椰枣株高和长势情况。第2主成分特征值为1.4021,贡献率为8.25%,主要包含裂叶长宽比、裂叶长、蜡质层厚度、中脉颜色、裂叶宽这5个指标共同影响,特征值分别为0.6901、0.3174、?0.3144、?0.2869和?0.2690,这类性状主要反映的是椰枣裂叶叶片形态特征。第3主成分主要是株型、中脉颜色、裂叶坚硬度、裂叶叶色这4个指标影响,特征值分别为0.5420、?0.3652、?0.3251和?0.2924,这类性状主要反映的是椰枣外观形态。第4主成分主要是株型和裂叶长宽比这2个指标影响,特征值分别为0.7089和0.4233,这类性状主要反映的是椰枣株型形态。第5主成分主要是刺区长度、裂叶厚度、枝条数和第三枝长这4个指标影响,特征值分别为0.8050、?0.3035、?0.2597、0.2175,这类性状主要反映的是椰枣刺区长度。第6主成分主要是叶斑病发病情况、裂叶叶色、裂叶坚硬度和裂叶厚度这4个指标影响,特征值分别为0.5746、?0.4486、0.4153和0.3824,这类性状主要反映的是椰枣叶斑病发病情况。
2.4 椰枣F1分离群体的聚类分析
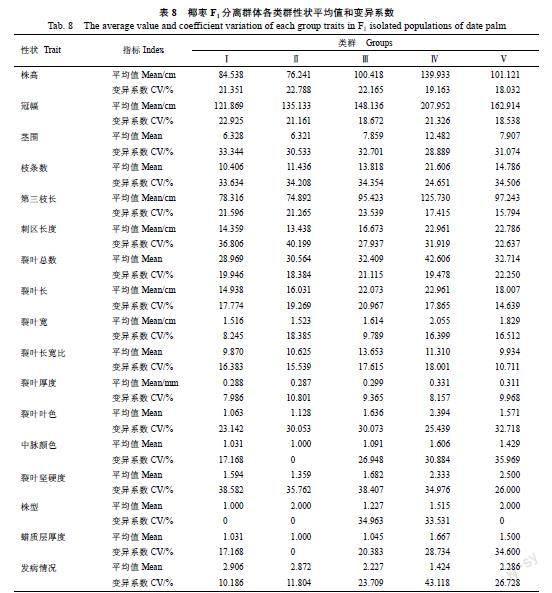
聚类分析已经广泛应用于育种材料的亲本选配、种质资源的分类以及品种间遗产差异性分析等研究[18-19]。本研究基于17个表型性状数据的相关性分析和主成分分析结果,采用欧式距离平方法进行系统聚类分析[20],在欧式距离为0.21时,143份椰枣F1代分为5个类群(图1),各类群性状的分类情况见图2,平均值及变异系数见表8。
第Ⅰ类群包括33份,占供试椰枣的23.08%,其主要特征是株高较矮(平均值为84.538 cm)、冠幅最小(平均值为121.869 cm)、茎围较小(平均值为6.328 cm)、枝条数最少(平均值为10.406个)、第三枝长较短(平均值为78.316 cm)、刺区长度较短(平均值为14.359 cm)、裂叶总数最少(平均值为28.969片)、裂叶最短(平均值为14.938 cm)、裂叶最窄(平均值为1.516 cm)、裂叶长宽比最小(平均值为9.870)、裂叶较薄(平均值为0.288 mm)、裂叶叶色最浅(平均值为1.063)、中脉颜色较浅(平均值为1.031)、裂叶坚硬度较软(平均值为1.594)、株型为直立型(平均值为1.000)、蜡质层较薄(平均值为1.031)和叶斑病发病情况最重(平均值为2.906);其中裂叶坚硬度变异系数最高为38.582%,其次是刺区长度与枝条数,分别为36.806%、33.634%;株型的变异系数最小0。综上所述,该类群为冠幅最小、枝条数最少、裂叶最短、裂叶最窄、叶斑病发病程度最重的椰枣资源,不适合作为我国选育适栽目标亲本的材料。
第Ⅱ类群包括39份,占供试椰枣的27.27%,其主要特征是株高最矮(平均值为76.241 cm)、冠幅较小(平均值为135.133 cm)、茎围最小(平均值为6.321 cm)、枝条数较少(平均值为11.436个)、第三枝长最短(平均值为74.892 cm)、刺区长度最短(平均值为13.438 cm)、裂叶总数较少(平均值为30.564片)、裂叶较短(平均值为16.031 cm)、裂叶较窄(平均值为1.523 cm)、裂叶长宽比中等(平均值为10.625)、裂叶厚度最薄(平均值为0.287 mm)、裂叶叶色较浅(平均值为1.128)、中脉颜色最浅(平均值为1.000)、裂叶坚硬度最软(平均值为1.359)、株型为开张型(平均值为2.000)、蜡质层最薄(平均值为1.000)和叶斑病发病情况较重(平均值为2.872);其中刺区长度变异系数最高为40.199%,其次是裂叶坚硬度与枝条数,分别为35.762%、34.208%;中脉颜色、株型与蜡质层的变异系数最小为0。综上所述,该类群为株高最矮、茎围最小、第三枝长最短、刺区长度最短、裂叶厚度最薄、中脈颜色最浅、裂叶坚硬度最软、蜡质层最薄、叶斑病发病情况较重的椰枣资源,不适合作为我国选育适栽目标亲本的材料。
第Ⅲ类群包括23份,占供试椰枣的16.08%,其主要特征是株高中等(平均值为100.418 cm)、冠幅中等(平均值为148.136 cm)、茎围中等(平均值为7.859 cm)、枝条数中等(平均值为13.818个)、第三枝长中等(平均值为95.423 cm)、刺区长度中等(平均值为16.673 cm)、裂叶总数中等(平均值为32.409片)、裂叶较长(平均值为22.073 cm)、裂叶宽中等(平均值为1.614 cm)、裂叶长宽比最大(平均值为13.653)、裂叶厚度中等(平均值为0.299 mm)、裂叶叶色较深(平均值为1.636)、中脉颜色中等(平均值为1.091)、裂叶坚硬度中等(平均值为1.682)、株型较直立
(平均值为1.227)、蜡质层中等(平均值为1.045)和叶斑病发病情况较轻(平均值为2.227);其中裂叶坚硬度变异系数最高为38.407%,其次是株型与枝条数,分别为34.963%、34.354%;裂叶厚度的变异系数最小9.365%。综上所述,该类群为裂叶较长、裂叶叶色较深、株型较直立、叶斑病发生情况较轻的椰枣资源,可以作为我国较大密度下选育适栽目标亲本的材料。
第Ⅳ类群包括33份,占供试椰枣的23.08%,其主要特征是株高最高(平均值为139.933 cm)、冠幅最大(平均值为207.952 cm)、茎围最大(平均值为12.482 cm)、枝条数最多(平均值为21.606个)、第三枝长最长(平均值为125.730 cm)、刺区长度最长(平均值为22.961 cm)、裂叶总数最多(平均值为42.606片)、裂叶最长(平均值为22.961 cm)、裂叶最宽(平均值为2.055 cm)、裂叶长宽比较大(平均值为11.310)、裂叶厚度最厚(平均值为0.331 mm)、裂叶叶色最深(平均值为2.394)、中脉颜色最深(平均值为1.606)、裂叶坚硬度较硬(平均值为2.333)、株型中等(平均值为1.227)、蜡质层最厚(平均值为1.667)和叶斑病发病情况最轻(平均值为1.424);其中叶斑病发病情况的变异系数最高为43.118%,其次是裂叶坚硬度和株型,分别为34.976%、33.531%;裂叶厚度的变异系数最小为8.157%。综上所述,该类群为株高、冠幅、茎围、枝条数、第三枝长、刺区长、裂叶总数、裂叶长、裂叶宽、裂叶厚度、裂叶叶色、中脉颜色、蜡质层13个性状都为最大或最好,裂叶长宽比较大、裂叶坚硬度较硬、株型中等、叶斑病发病情况最轻的椰枣资源,可以作为我国选育适栽目标亲本的材料。
第Ⅴ类群包括14份,占供试椰枣的9.79%,其主要特征是株高较高(平均值为101.121 cm)、冠幅较大(平均值为162.914 cm)、茎围较大(平均值为7.907 cm)、枝条数较多(平均值为14.786个)、第三枝长较长(平均值为97.243 cm)、刺区长度较长(平均值为22.786 cm)、裂叶总数较多(平均值为32.714片)、裂叶长中等(平均值为18.007 cm)、裂叶较宽(平均值为1.829 cm)、裂叶长宽比较小(平均值为9.934)、裂叶厚度较厚(平均值为0.311 mm)、裂叶叶色中等(平均值为1.571)、中脉颜色较深(平均值为1.429)、裂叶坚硬度最硬(平均值为2.500)、株型为开张型(平均值为2.000)、蜡质层较厚(平均值为1.500)和叶斑病发病情况中等(平均值为2.286);其中中脉颜色变异系数最高为35.969%,其次是蜡质层与枝条数,分别为34.600%、34.506%;株型的变异系数最小0。综上所述,该类群为裂叶长宽比较小、裂叶坚硬度最硬、株型为开张型的椰枣资源,可以作为我国选育适栽目标亲本的材料。
3 讨论
对植物表型性状的分析与评价是植物种质资源分类和评价的主要手段,熟悉和掌握植物主要表型性状,对提高资源利用率、品种创新具有重要意义[21],也是利用种质资源和创制新种质的基础和前提[22]。研究表明结合多元统计分析的手段,可以对不同来源的资源进行鉴别和分类,有助于了解不同资源的亲缘关系,为挖掘利用优良种质资源、创制新种质、提高新品种培育效率提供依据和基础[23]。掌握资源主要性状特性是植物育种与遗传学研究的基础,丰富的资源是新种质创制和选育优良品种的前体,而资源评价及鉴定是筛选优质或特异性状的主要手段之一[24]。然而,大多数表型性状都受到生态环境条件的影响或随着植物发育阶段的变化而变化。椰枣是雌雄异株,异花授粉的二倍体植物,种子繁殖会产生丰富的遗传变异、新的基因型和表现型,被认为是椰枣变异的主要来源。因此,为更好的了解椰枣在我国海南省的生长适应性,为今后椰枣育种工作中目标性状的筛选与确定工作,本研究对参试的143份椰枣F1分离群体进行了多样性分析和聚类分析。
吕伟等[25]研究表明,当变异系数达到10%以上时,表明所选种质材料间有显著差异;SIMOZRAG等[14]对阿尔及利亚的89个椰枣品种的表型多样性进行了调查,发现大部分表型性状存在显著差异性;AHMED等[26]对阿德拉尔地区23个椰枣品种的30个性状进行调查,也发现椰枣种质资源具有丰富的表型多样性。本研究的结果与其相一致,发现椰枣F1分离群体表型性状在个体间差异较大,不同个体间变异丰富,类型广泛,能为椰枣后期高效利用、创制新的种质材料和选育新品种提供丰富的遗传变异材料,具有很好的选择利用前景。
BEDJAOUI等[27]对阿尔及利亚的26个椰枣品种的52个性状进行了表型多样性评价,发现当地栽培品种间形态变异较大,各性状间有着显著的相关性。本研究结果与其相一致,发现椰枣17个表型性状相关性很大,其中与生长发育相关的11个表型性状两两间相关关系均达到极显著正相关。并且发现叶斑病发病情况与其余15个性状呈极显著负相关,表明椰枣叶斑病发病情况与植株的长势有很大的关系,长势越好,叶斑病发病情况越轻。
主成分分析能够在保留原有信息的基礎上选择较少的指标或因子来反映原来的指标信息,起到降维的多元统计,这种方法在多种植物上普遍运用[28-29]。本研究发现椰枣17个表型性状可转化为6个主成分因子,其中第1主成分贡献率为59.32%,主要包含株高、第三枝长、冠幅、茎围和枝条数这5个指标共同影响,主要反映的是椰枣株高和长势情况,表明椰枣的表型性状主要集中于椰枣的生长发育上。
ELHOUMAIZI等[30]发现摩洛哥椰枣品种间的形态差异较大,利用聚类分析,将其分为不同的类群,获得最适合栽培的品种;MOHAMMED等[1]通过16个表型性状,研究苏丹7个椰枣品种的变异性和多样性水平,发现品种间的变异程度较高,将7个椰枣品种分为了3个类群。本研究将143份椰枣F1分离群体分为5个类群,结合主成分分析,其中第Ⅳ类群33份椰枣F1分离群体的13个表型性状表现优异,第1主成分主要因子的平均值最大,叶斑病发病情况最轻,有益性状最明显,初步确定为我国选育适栽目标亲本的优良材料。其次是第Ⅲ类群(23份)、第Ⅴ类群(14份),各表型性状表现中等,主成分主要因子的平均值较大,叶斑病发病情况轻,初步确定为较适合作为筛选我国适栽目标亲本的材料。最差的是第Ⅰ类群(33份)和第Ⅱ类群(39份),各表型性状表现差,主成分主要因子的平均值小,叶斑病发病情况最重,初步确定为不适合作为选育适栽目标亲本的材料。
综上所述,通过对143份椰枣F1分离群体进行综合评价,证明椰枣F1分离群体变异较大,类型丰富;各表型性状相关性大,叶斑病发病情况与生长发育性状呈负相关;6个主成分所构成的信息量为总信息量的87.51%,反映了全部信息中的大部分信息;5个类群中,第Ⅳ类群33份椰枣F1分离群体表型性状表现优异,叶斑病发病情况最轻,有益性状最明显,初步确定可以作为我国选育适栽目标亲本的优良材料;第Ⅲ类群和第Ⅴ类群各表型性状表现中等,初步确定为较适合作为筛选适栽目标亲本的材料;第Ⅰ类群和第Ⅱ类群各表型性状表现差,初步确定为不适合作为选育适栽目标亲本的材料,但可作为其他种质筛选或拓宽使用。本研究是我国首次开展对椰枣表型性状的评价与分析,鉴定出了一批具有优异表型性状的资源,发现椰枣表型性状变异丰富,各性状之间关联较为密切。随着对植物遗传多样性的研究的深入和现代分子生物技术的快速发展,分子标记的手段在越来越多的植物上得到运用[31-32],因此,下一步开展椰枣遗传育种时,将表型性状研究和分子生物学技术相结合,将能更快速挖掘出优秀椰枣资源。本研究结果将为椰枣资源的高效利用、创制新的种质材料和选育新品种提供参考依据。
参考文献
[1] MOHAMMED E, LARISA G G, CLAID M, Phenotypic diversity of date palm cultivars (Phoenix dactylifera L.) from Sudan estimated by vegetative and fruit characteristics[J]. International Journal of Biodiversity, 2015(5): 1-7.
[2] 程宇航. 阿拉伯人与阿拉伯椰枣[J]. 老区建设, 2012(17): 57-59.CHENG Y H. The Arabian and the Arabian date palm[J]. Old Liberated Area Built, 2012(17): 57-59. (in Chinese)
[3] 黄循精. 2002年世界椰枣的产销简况[J]. 世界热带农业信息, 2003(8): 14-16.HUANG X J. Production and marketing of world date palm in 2002[J]. World Tropical Agriculture Information, 2003(8): 14-16. (in Chinese)
[4] Al-ALAWI R A, AL-MASHIQRI J H, AL-NADABI J S M, AL-SHIHI B I, BAQI Y. Date palm tree (Phoenix dactylifera L.): natural products and therapeutic options[J]. Frontiers in Plant Science, 2017, 8: 845.
[5] JOHNSON D V, Al-KHAYRI J M, JAIN S M. Introduction: date production status and prospects in Asia and Europe[M]//Date Palm Genetic Resources and Utilization: Volume 2. Berlin: Springer Netherland, 2015.
[6] 聂石辉, 彭琳, 王仙, 季良. 鹰嘴豆种质资源农艺性状遗传多样性分析[J]. 植物遗传资源学报, 2015, 16(1): 64-70.NIE S H, PENG L, WANG X, JI L. Genetic diversity of agronomic traits in chickpea (Cicer arietinum L.) germplasm resources[J]. Journal of Plant Genetic Resources, 2015, 16(1): 64-70. (in Chinese)
[7] 张叶, 叶蓓蕾, 邬静, 刘乐, 黎维诗, 郝代成, 谢尚潜, 凌鹏. 77份文心兰种质资源表型性状遗传多样性分析[J]. 热带作物学报, 2021, 42(8): 2183-2190.ZHANG Y, YE B L, WU J, LIU L, LI W S, HAO D C, XIE S Q, LING P. Analysis of genetic diversity of phenotypic traits of 77 Oncidium germplasm resources[J]. Chinese Journal of Tropical Crops, 2021, 42(8): 2183-2190. (in Chinese)
[8] 張燕, 杨衍, 田丽波, 商桑. 基于表型性状的苦瓜种质资源评价和遗传多样性的分析[J]. 分子植物育种, 2016, 14(1): 239-250.ZHANG Y, YANG Y, TIAN L B, SHANG S. Evaluation and genetic diversity of bitter gourd varieties based on phenotypic traits[J]. Molecular Plant Breeding, 2016, 14(1): 239-250. (in Chinese)
[9] SOMAYEH S, ZAHRA N, MASOUD S, SEYYED S M. Insight into date palm diversity: genetic and morphological investigations[J]. Plant Molecular Biology Reporter, 2021, 39(1): 137-145.
[10] SRINIVASA R C, YOUNG P, THOMPSON K, BOCHRA A B, BHAVESH G, SUBHASH N, KRUEGER R, BENNETZEN J L. Phoenix phylogeny, and analysis of genetic variation in a diverse collection of date palm (Phoenix dactylifera) and related species[J]. Plant Diversity, 2019, 41(5): 330-339.
[11] AHMED T A, Al-QARADAWI A Y. Genetic diversity of date palm genotypes in Qatar as determined by SSR and ISSR markers[J]. Acta Horticulturae, 2010(882): 279-286.
[12] 裴鑫德. 多元统计分析及其应用[M]. 北京: 北京农业大学出版社, 1990: 213-235.PEI X D. Multivariate statistical analysis and its application[M]. Beijing: Beijing Agricultural University Publishing house, 1990: 213-235. (in Chinese)
[13] EISSA E A, El-RAZEK A B A, El-SHARABASY S F, RIZK R M. Morphological and molecular genetic characterization of soft date palm (Phoenix dactylifera L.) cultivars in Egypt[J]. Egyptian Journal of Genetics And Cytology, 2009, 38: 269-284.
[14] SIMOZRAG A, CHALA A, DJEROUNI A, BENTCHIKOU M E. Phenotypic diversity of date palm cultivars (Phoenix dactylifera L.) from Algeria[J]. Gayana Botanica, 2016, 73(1): 42-53.
[15] HANANE B, HALIMA B. Assessment of phenotypic diversity of local Algerian date palm (Phoenix dactylifera L.) cultivars[J]. Journal of the Saudi Society of Agricultural Sciences, 2020, 19(1): 65-75.
[16] 王英成, 蘆光新, 邓晖, 蒋汉元, 姚世庭, 党宁, 李欣, 黄彩霞, 赵丽蓉, 王志慧. 基于主成分分析的青贮玉米品种农艺性状评价及筛选研究[J]. 草地学报, 2019, 27(6): 1725-1732.WANG Y C, LU G X, DENG H, JIANG H Y, YAO S T, DANG N, LI X, HUANG C X, ZHAO L R, WANG Z H. Evaluation and screening of agricultural characters of silage maize varieties based on principal component analysis[J]. Acta Agrestia Sinica, 2019, 27(6): 1725-1732. (in Chinese)
[17] 喻华平, 赵志常, 高爱平, 罗睿雄. 基于主成分分析和聚类分析的23份黄皮种质资源的品质评价[J]. 热带作物学报, 2022, 43(7): 1357-1364.YU H P, ZHAO Z C, GAO A P, LUO R X. Quality evaluation of 23 species of Clausena lansium (Lour.) skeels germplasm resources based on principal component analysis and cluster analysis[J]. Chinese Journal of Tropical Crops, 2022, 43(7): 1357-1364. (in Chinese)
[18] 宋全昊, 金艳, 宋佳静, 陈杰, 赵立尚, 白冬, 陈亮, 朱统泉. 61份小麦异源附加系种质的表型多样性分析[J]. 江苏农业科学, 2022, 50(16): 79-86.SONG Q H, JIN Y, SONG J J, CHEN J, ZHAO L S, BAI D, CHEN L, ZHU T Q. Phenotypic diversity analysis of 61 heterologous additional lines of wheat[J]. Jiangsu Agricultural Sciences, 2022, 50(16): 79-86. (in Chinese)
[19] 顏泽洪, 郑有良, 周永红, 刘登才, 兰秀锦, 魏育明, 侯永翠. 小麦异源(黑麦)重组系遗传聚类分析[J]. 麦类作物学报, 2000, 20(4) : 27-31.YAN Z H, ZHENG Y L, ZHOU Y H, LIU D C, LAN X J, WEI Y M, HOU Y C. Study on the genetic cluster analysis of wheat rye recombination lines[J]. Journal of Triticeae Crops, 2000, 20(4): 27-31. (in Chinese)
[20] 徐志军, 吴小丽, 胡小文, 刘洋. 33份引进花生资源表型遗传多样性分析及在粤西地区的适应性初步评价[J]. 热带作物学报, 2021, 42(7): 1885-1895.XU Z J, WU X L, HU X W, LIU Y. Phenotypic diversity of 33 introduced peanut germplasm accessions and preliminary adaptability evaluation in west Guangdong[J]. Chinese Journal of Tropical Crops, 2021, 42(7): 1885-1895. (in Chinese)
[21] 黎裕, 李英慧, 杨庆文, 张锦鹏, 张金梅, 邱丽娟, 王天宇. 基于基因组学的作物种质资源研究: 现状与展望[J]. 中国农业科学, 2015, 48(17): 3333-3353.LI Y, LI Y H, YANG Q W, ZHANG J P, ZHANG J M, QIU L J, WANG T Y. Genomics-based crop germplasm research: advances and perspectives[J]. Scientia Agricultura Sinica, 2015, 48(17): 3333-3353. (in Chinese)
[22] 彭楓, 赵孟良, 徐晨曦, 王小丽, 葛晨辉, 王全华, 蔡晓锋. 基于表型性状的菠菜种质资源遗传多样性分析[J]. 分子植物育种, 2021, 19(5): 1698-1708.PENG F, ZHAO M L, XU C X, WANG X L, GE C H, WANG Q H, CAI X F. Genetic diversity analysis of spinach germplasm resources based on phenotypic traits[J]. Molecular Plant Breeding, 2021, 19(5): 1698-1708. (in Chinese)。
[23] 李祥栋, 潘虹, 陆秀娟, 魏心元, 陆平, 石明, 练启仙. 薏苡属种质资源的主要表型性状多样性研究[J]. 植物遗传资源学报, 2019, 20(1): 229-238.LI X D, PAN H, LU X J, WEI X Y, LU P, SHI M, LIAN Q X. Analysis of main phenotypic characteristics in coix L. germplasm resources[J]. Journal of Plant Genetic Resources, 2019, 20(1): 229-238. (in Chinese)
[24] 兴旺, 崔平, 潘荣, 苏宝忠. 不同国家甜菜种质资源遗传多样性研究[J]. 植物遗传资源学报, 2018, 19(1): 76-86.XING W, CUI P, PAN R, SU B Z. Genetic diversity of sugar beet from different countries[J]. Journal of Plant Genetic Resources, 2018, 19(1): 76-86. (in Chinese)
[25] 吕伟, 韩俊梅, 文飞, 任果香, 王若鹏, 刘文萍. 不同来源芝麻种质资源的表型多样性分析[J]. 植物遗传资源学报, 2020, 21(1): 234-242.LYU W, HAN J M, WEN F, REN G X, WANG R P,LIU W P. Phenotypic diversity analysis of sesame germplasm resources[J]. Journal of Plant Genetic Resources, 2020, 21(1): 234-242. (in Chinese)
[26] AHMED M, BOUNA Z, LEMINE F, DJEH T, MOKHTAR T, SALEM A. Use of multivariate analysis to assess phenotypic diversity of date palm (Phoenix dactylifera L.) cultivars[J]. Scientia Horticulturae, 2011, 127(3): 367-371.
[27] BEDJAOUI H, BENBOUZA H. Assessment of phenotypic diversity of local Algerian date palm (Phoenix dactylifera L.) cultivars[J]. Journal of the Saudi Society of Agricultural Sciences, 2018,19(1): 65-75.
[28] 王建丽, 刘杰淋, 朱瑞芬, 钟鹏, 尤佳, 邸桂俐, 韩微波, 申忠宝. 28份籽粒苋种质资源的主要农艺性状遗传多样性分析[J]. 草地学报, 2020, 28(4): 1050-1059.WANG J L, LIU J L, ZHU R F, ZHONG P, YOU J, DI G L, HAN W B, SHEN Z B. Genetic diversity analysis of major agronomic traits in 28 Amaranthus hypochondriacus germplasm resources[J]. Acta Agrestia Sinica, 2020, 28(4): 1050-1059. (in Chinese)
[29] 楊磊, 靳娟, 樊丁宇, 赵国庆, 杨宏顺, 郝庆. 新疆石榴果实品质主成分分析[J]. 新疆农业科学, 2018, 55(2): 262-268.YANG L, JIN J, FAN D Y, ZHAO G Q, YANG H S, HAO Q. Principal component analysis of fruit quality of different pomegranate varieties in Xinjiang[J]. Xinjiang Agricultural Sciences, 2018, 55(2): 262-268. (in Chinese)
[30] ELHOUMAIZI M A, SAAIDI M, OIHABI A, CILAS C. Phenotypic diversity of date-palm cultivars (Phoenix dactylifera L.) from Morocco[J]. Genetic Resources and Crop Evolution, 2002, 49(5): 483-490.
[31] 李英英, 郑云柯, 晏小霞, 王清隆, 羊青, 汤欢, 王茂媛, 王祝年. 益智种质资源表型性状的遗传多样性分析[J]. 热带作物学报, 2022, 43(1): 94-100.LI Y Y, ZHENG Y K, YAN X X, WANG Q L, YANG Q, TANG H, WANG M Y, WANG Z N. Genetic diversity analysis of Alpinia oxyphylla germplasm resources by phenotypic traits[J]. Chinese Journal of Tropical Crops, 2022, 43(1): 94-100. (in Chinese)
[32] 王祝年, 邱燕连, 晏小霞, 陈永锋, 叶才华. 海南岛益智种质资源表型变异及ISSR分析[J]. 热带作物学报, 2016, 37(9): 1695-1702.WANG Z N, QIU Y L, YAN X X, CHEN Y F, YE C H. Morphological variation and ISSR analysis of Alpinia oxyphylla germplasm resources from Hainan Island[J]. Chinese Journal of Tropical Crops, 2016, 37(9): 1695-1702. (in Chinese)
