突出核心素养 考查关键能力
——评析2022年全国乙卷化学实验综合题
2023-03-18李小波
李小波
(安徽省蒙城县第二中学)
高考中,化学实验综合题所占分值较高,主要考查化学实验基础知识、基本操作、实验数据的分析和处理、实验方案的设计与评价等.从近几年高考试题的命题趋势来看,题目的难度保持稳定,突出了对核心素养、关键能力的考查.
1 试题整体分析与评价
题目二草酸合铜(Ⅱ)酸钾(K2[Cu(C2O4)2])可用于无机合成、功能材料制备.实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
Ⅰ.取已知浓度的CuSO4溶液,搅拌下滴加足量NaOH 溶液,产生浅蓝色沉淀.加热,沉淀转变成黑色,过滤.
Ⅱ.向草酸(H2C2O4)溶液中加入适量K2CO3固体,制得KHC2O4和K2C2O4混合溶液.
Ⅲ.将Ⅱ的混合溶液加热至80~85 ℃,加入Ⅰ中的黑色沉淀.全部溶解后,趁热过滤.
Ⅳ.将Ⅲ的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(Ⅱ)酸钾晶体,进行表征和分析.
回答下列问题:
(1)由CuSO4·5H2O 配制Ⅰ中的CuSO4溶液,下列仪器中不需要的是_________(填仪器名称).
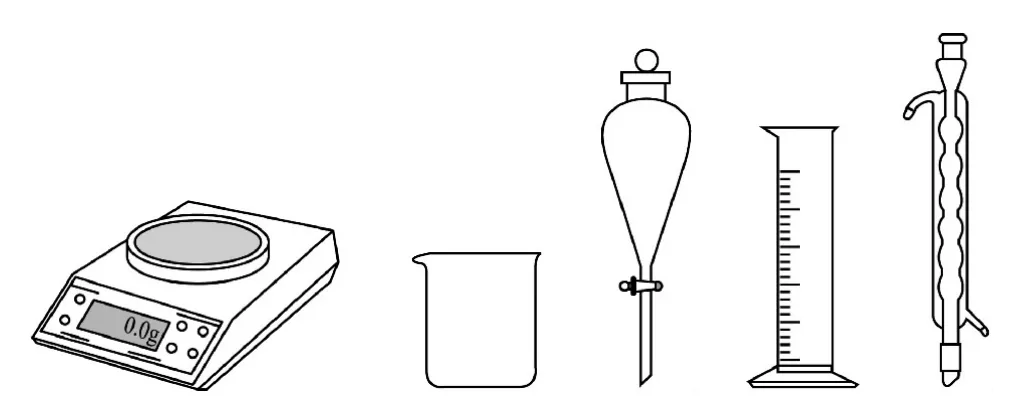
图1
(2)长期存放的CuSO4·5H2O 中,会出现少量白色固体,原因是________.
(3)Ⅰ中的黑色沉淀是_________(写化学式).
(4)Ⅱ中原料配比为n(H2C2O4)∶n(K2CO3)=1.5∶1,写出反应的化学方程式:_______.
(5)Ⅱ中,为防止反应过于剧烈而引起喷溅,加入K2CO3应采取_________的方法.
(6)Ⅲ中应采用_________进行加热.
(7)Ⅳ中“一系列操作”包括________.
解析(1)由CuSO4·5H2O 固体配制硫酸铜溶液,需用天平称量一定质量的CuSO4·5H2O 固体,将称量好的固体放入烧杯中,用量筒量取一定体积的水溶解CuSO4·5H2O,因此用不到的仪器有分液漏斗和球形冷凝管.(2)CuSO4·5H2O 含结晶水,长期放置会风化失去结晶水,生成无水硫酸铜,无水硫酸铜为白色固体.(3)硫酸铜溶液与氢氧化钠溶液反应生成蓝色的氢氧化铜沉淀,加热,氢氧化铜分解生成黑色的氧化铜沉淀.(4)草酸和碳酸钾以物质的量之比为1.5∶1发生非氧化还原反应,生成KHC2O4、K2C2O4、CO2和水,依据原子守恒可知,反应的化学方程式为3H2C2O4+2K2CO3=2KHC2O4+K2C2O4+2H2O+2CO2↑.(5)为防止草酸和碳酸钾反应时过于剧烈,造成液体喷溅,可减缓反应速率,将碳酸钾分批加入并搅拌.(6)Ⅲ中将混合溶液加热至80~85℃,应采取水浴加热,使液体受热均匀.(7)从溶液中获得晶体的一般方法为先加热蒸发浓缩再冷却结晶,进一步通过过滤、洗涤、干燥得到晶体,因此将Ⅲ的滤液用蒸汽浴加热浓缩、冷却结晶、过滤、洗涤、干燥,得到二草酸合铜(Ⅱ)酸钾晶体.
2 物质制备实验操作考查中应注意的问题
1)注意实验操作的顺序,以与气体有关实验的操作为例:根据要求选择装置→连接装置检验气密性→装固体药品→添加液体药品→开始实验(观察并分析实验现象)→尾气处理→拆卸清洗仪器等.
2)注意加热操作的基本要求:实验加热前一般应先用原料气或者是性质稳定的气体赶走空气或者水蒸气后,才能点燃酒精灯,其目的一般是防止产物被氧化、水解及防止爆炸等.反应结束后,要在熄灭酒精灯后继续通一段时间原料气或性质稳定的气体,直到冷却为止.
3)注意尾气的一般处理方法:有毒气体常用溶液(或固体)吸收,能燃烧的将之点燃转化为无毒气体或者其他物质才能排放,同时要注意防止倒吸.
4)注意特殊的实验装置:a)实验中用碱石灰吸收测定生成CO2的质量时,前端要干燥除去水蒸气,末端也要连接装置防止空气中的CO2和水蒸气对实验结果造成干扰.b)制取在空气中易吸水潮解(如氢氧化钠)、易水解(如Al2S3、AlCl3、Mg3N2等)的物质时,为了防止空气中的水蒸气进入,要在装置末端再接一个干燥装置.
变式(2022年湖南卷)某实验小组以BaS溶液为原料制备BaCl2·2H2O,并用重量法测定产品中BaCl2·2H2O 的含量,设计了如下实验方案.
可选用试剂:NaCl晶体、BaS溶液、浓H2SO4、稀H2SO4、CuSO4溶液、蒸馏水.
步骤1.BaCl2·2H2O 的制备.
按图2所示装置进行实验,得到BaCl2溶液,经一系列步骤获得BaCl2·2H2O 产品.
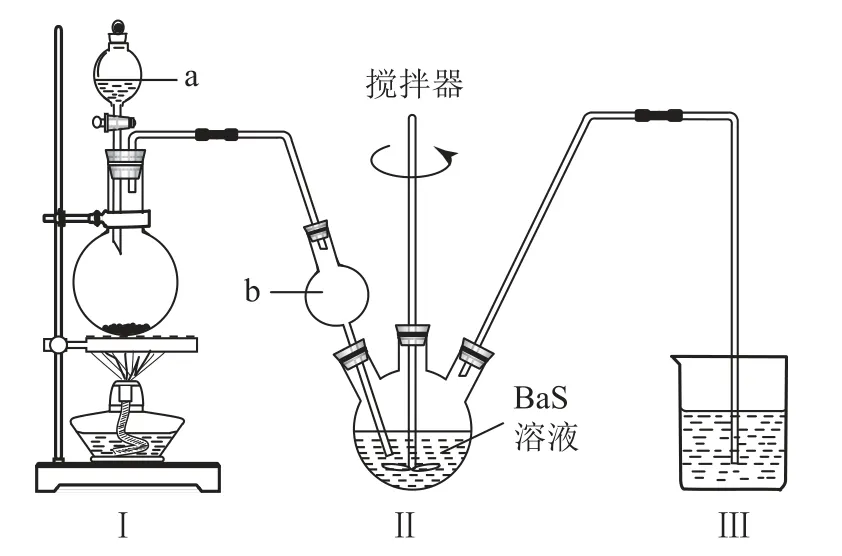
图2
步骤2.产品中BaCl2·2H2O 的含量测定.
①称取产品0.5000g,用100mL水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得的溶液中逐滴加入热的0.100mol·L-1H2SO4溶液;
③沉淀完全后,60℃水浴40min,经过滤、洗涤、烘干等步骤,称量白色固体,质量为0.4660g.
回答下列问题:
(1)Ⅰ是制取_________气体的装置,在试剂a过量并微热时,发生主要反应的化学方程式为________.
(2)Ⅱ中b仪器的作用是_________;Ⅲ中的试剂应选用________.
(3)在沉淀过程中,某同学在加入一定量热的H2SO4溶液后,认为沉淀已经完全,判断沉淀已完全的方法是_________.
(4)沉淀过程中需加入过量的H2SO4溶液,原因是_________.
(5)在过滤操作中,下列仪器不需要用到的是_________(填名称).
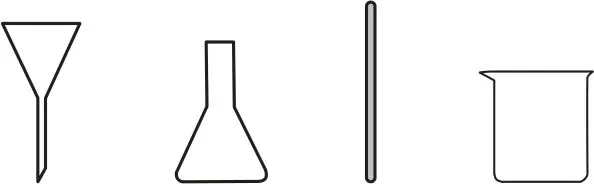
图3
(6)产品中BaCl2·2H2O 的质量分数为________(保留3位有效数字).
解析(1)装置Ⅰ为浓H2SO4和NaCl共热制取HCl气体的装置,在浓H2SO4过量并微热时,浓H2SO4与NaCl反应生成NaHSO4和HCl,发生主要反应的化学方程式为NaHSO4+HCl↑.(2)HCl极易溶于水,装置Ⅱ中b仪器的作用为防止倒吸;装置Ⅱ中HCl与BaS 溶液反应生成H2S,H2S有毒,对环境有污染,装置Ⅲ中应盛放CuSO4溶液,用于吸收H2S.(3)H2SO4与BaCl2反应生成BaSO4沉淀,因此判断沉淀已完全的方法是静置,取上层清液于一支洁净的试管中,继续滴加H2SO4溶液,若无白色沉淀生成,则已沉淀完全.(4)为了使Ba2+沉淀完全,沉淀过程中需加入过量的H2SO4溶液.(5)过滤用到的仪器有:铁架台、烧杯、漏斗、玻璃棒,用不到锥形瓶.(6)由题意可知,BaSO4的物质的量为,依据钡原子守恒,产品中BaCl2·2H2O 的物质的量为0.002mol,质量为0.002mol×244g·mol-1=0.488g,质量分数为
2022年全国乙卷化学实验综合题遵循课程标准,依托高考评价体系,突出学科主干内容,以促进考生形成正确严谨的化学价值观念和科学思维,提升考生的综合素质为目的,在对接新课改、新课程,深化考试内容和改革高考评价体系等方面均有突破和创新.
(完)
