关注水解常数的考查
2023-03-18张景永
张景永
(山东省东明县第一中学)
与弱酸(碱)电离平衡常数相似,弱酸(碱)对应的盐会发生水解,弱酸(碱)盐水解反应的平衡常数叫作水解平衡常数,通常用Kh表示.对于盐的水解平衡:对于水解平衡常数的考查主要是影响水解平衡的因素、水解常数大小比较、水解平衡常数计算、水解平衡常数的应用.
1 影响水解平衡常数的因素
影响水解平衡的因素主要是内因——构成盐的酸(碱)的相对强弱,酸(碱)越弱水解常数越大,即越弱越水解;影响水解平衡的次要因素是外因——浓度、温度等.盐溶液越稀水解程度越大,即越稀越水解;水解过程吸热,升高温度促进水解.
例1下列叙述正确的是( ).
A.某温度下,一元弱酸HA 的Ka越小,则NaA的Kh(水解常数)越小
B.浓度均为0.1 mol·L-1的CH3COONH4和NaHCO3溶液中,Kh(CH3COO-)<Kh(HCO-3)
C.升高温度,盐类的水解常数Kh增大
D.CH3COOH 的Ka=1.75×10-5,HClO 的Ka=4.0×10-8,水解常数Kh(CH3COO-)>Kh(ClO-)
分析某温度下,一元弱酸HA 的Ka越小,则A-和H+结合就越容易,则NaA 越易水解,Kh(水解常数)越大,选项A 错误.CH3COONH4为弱酸弱碱盐,相互促进水解,NaHCO3为强碱弱酸盐,不能比较等浓度溶液的二者水解常数大小,选项B 错误.盐的水解是吸热反应,升高温度,促进盐的水解,则盐类的水解常数Kh增大,选项C 正确.弱酸根离子水解时,酸越弱酸根离子越易水解,酸性CH3COOH>HClO,则水解常数Kh(CH3COO-)<Kh(ClO-),选项D 错误.答案为C.
点评相同条件下,酸越弱水解常数越大;温度升高水解常数增大;盐的离子水解还受到另一离子的影响.
2 水解平衡常数与电离平衡常数的关系
盐的水解是盐的离子与水电离产生的H+或OH-结合生成弱酸或弱碱的反应,因此
例225 ℃时,H2S的Ka1=1.3×10-7,Ka2=7.1×10-15.下列说法正确的是( ).
A.Na2S溶液加水稀释溶液的pH 增大
B.Na2S 溶液中满足:c(Na+)+c(H+)=c(HS-)+c(S2-)+c(OH-)
C.HS-的电离程度大于HS-的水解程度
D.S2-的水解常数Kh=1.41
分析Na2S溶液中S2-发生水解反应生成HS-和OH-,加水稀释溶液的c(OH-)减小,pH 减小,选项A 错误.Na2S 溶液中存在电荷守恒:c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-),选项B 错误.HS-的电离常数为Ka2=7.1×10-15,HS-的水解常数为,则HS-水解程度大于电离程度,选项C错误.S2-以第一步水解为主,水解方程式为S2-+H2O⇌HS-+OH-,水解常数,选项D 正确.答案为D.
点评判断酸式盐溶液的酸碱性,要先计算出酸式根离子的水解常数,再根据酸式根离子的电离程度和水解程度大小比较,电离程度大于水解程度溶液显酸性,电离程度小于水解程度溶液显碱性.
3 水解平衡常数的计算
水解常数的计算除了利用水解常数和电离常数的关系外还可以根据溶液的pH 或酸碱中和滴定曲线计算.
3.1 根据盐溶液的pH 计算水解平衡常数
例3常温下浓度为0.1mol·L-1的NaClO 溶液的pH=10.2,计算ClO-+H2O⇌HClO+OH-的水解常数.
分析NaClO溶液中c(H+)=10-10.2mol·L-1,则c(OH-)=10-3.8mol·L-1.ClO-+H2O⇌HClO+OH-的平衡常数为
点评弱酸盐的离子水解生成的弱酸浓度和c(OH-)近似相等.
3.2 根据酸碱中和滴定曲线计算水解平衡曲线
例4常温下,用0.010 mol·L-1NaOH 溶液滴定0.010 mol·L-1的二元酸H2A 溶液,H2A、HA-、A2-的物质的量分数δ(X)随pH 变化如图1所示.下列说法错误的是( ).
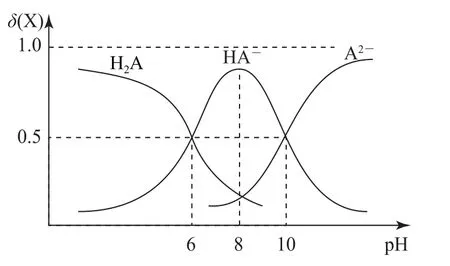
图1
A.滴加过程中离子浓度始终满足:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
B.H2A 的第一步电离平衡常数Ka1=1×10-6
C.HA-的水解常数Kh=1×10-10
D.将0.020mol·L-1Na2A 溶液和0.010mol·L-1HCl溶液等体积混合,所得溶液的pH 约为10
分析用NaOH 溶液滴定H2A 溶液,随着NaOH 溶液滴入,H2A 浓度一直减小,HA-浓度增大后减小,A2-一直增大;由电荷守恒,离子浓度始终满足:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),选项A 说法正确.当溶液中c(HA-)=c(H2A)时,H2A 的第一步电离平衡常数
选项C 说法错误.将0.020 mol·L-1Na2A 溶液和0.010mol·L-1盐酸等体积混合后,混合溶液中溶质为等物质的量浓度的c(Na2A)=c(NaHA)=c(NaCl),该溶液中c(HA-)≈c(A2-),根据图知该溶液的pH=10,选项D 说法正确.答案为C.
点评根据酸碱中和滴定曲线计算水解常数,往往是根据曲线交点两种离子浓度相等时的pH计算.
4 水解常数的应用
水解常数大小不仅表示了盐的离子水解程度大小,反映了组成盐的酸或碱的相对强弱,还可以判断酸式盐溶液的酸碱性,另外根据水解常数还可以比较盐溶液中离子浓度大小.
例5已知常温下CN-的水解常数Kh=1.61×10-5,含等物质的量浓度的HCN 与NaCN 的混合c(CN-)_____c(HCN).
A.小于
B.等于
C.大于
D.无法判断
分析CN-水解的方程式为CN-+H2O⇌HCN+OH-,水解平衡常数为
含等物质的量浓度的HCN 与NaCN 的混合,HCN的电离程度小于CN-的水解程度,c(CN-)<c(HCN).答案为A.
点评知道了盐的水解常数,通过水解常数与电离常数的关系可以计算出电离常数的大小,相同浓度的盐和酸的混合溶液的酸碱性取决于水解常数和电离常数大小,即水解程度和电离程度大小.
总之,水解常数大小反映了酸或碱的相对强弱,影响水解常数的因素除了弱酸或弱碱的相对强弱外,还与溶液浓度、温度、另一离子的水解有关,计算水解常数可以利用水解常数与电离常数的关系、盐溶液的pH、酸碱中和滴定曲线.
(完)
