慢性间歇性低氧对OSAHS大鼠心肌细胞焦亡的影响
2023-03-17李瑜古丽娜孜吐拉洪陈玉岚沙热扎提依沙江王蒙蒙祖柏旦阿布汉阿丽亚阿不力孜
李瑜,古丽娜孜·吐拉洪,陈玉岚,沙热扎提·依沙江,王蒙蒙,祖柏旦·阿布汉,阿丽亚·阿不力孜
1 新疆医科大学第一附属医院干部保健中心综合内二科,乌鲁木齐 830000;2 新疆医科大学第一附属医院心血管病中心高血压科;3 新疆维吾尔自治区人民医院高血压中心
阻塞性睡眠暂停低通气综合征(OSAHS)是一种常见的睡眠障碍,其特征是反复发生夜间低氧血症、高碳酸血症和短暂性觉醒[1]。慢性间歇性低氧(CIH)是OSAHS 最根本的致病因素。CIH 可通过多种生物学途径导致心血管功能异常[2-4]。在OSAHS小鼠模型中,阻塞性呼吸3 h 将会导致全身性炎症,心室中炎性细胞浸润显著增加[5]。研究显示,细胞焦亡是新发现的一种伴随炎症反应的细胞程序性死亡,在心血管疾病发生发展中扮演着重要角色[6]。细胞焦亡与CIH 诱导心肌损伤的关系目前尚不清楚。2021 年6 月—8 月,本研究通过观察OSAHS 大鼠左室心肌组织焦亡相关蛋白(Caspase-1、GSDMD、NLRP3)的表达变化,探讨CIH 对OSAHS 大鼠心肌细胞焦亡的影响。
1 材料与方法
1.1 动物、试剂及仪器 雄性SD 大鼠16 只,8~10周龄,体质量180~260g,由新疆医科大学动物实验中心提供,动物许可证编号:SCXK(新)2018-0003。常温下,普通饲料饲养,自由饮水及进食,造模前适应性饲养时间为1周。本研究经新疆医科大学第一附属医院动物实验伦理委员会批准通过,审批号为IACUC-20210326-08。 Easy Ⅱ Protein Quantitative Kit (DQ111-01)购自北京全式金生物技术有限公司;RIPA裂解液(AR0105)、蛋白酶抑制剂(AR1178)购自武汉博士德生物工程有限公司;山羊抗兔IgG H&L(HRP)、山羊抗小鼠IgG H&L (HRP)购自英国Abcam公司;PVDFTransfer Membrane 0.45μm( IPVH00010)购自美国Millipore 公司;Tris(A600194-0500g)、SDS(A100227-0500g)、丙烯酰胺(A501033-0500g)、双丙烯酰胺(A600025-0250g)购自德国Sangon Biotech 公司;GSDMDC1 抗体(sc-393581)购自美国Santacruz公司;EvaGreen Express 2×qPCR MasterMix-Low Rox(MasterMix-LR/1051845151001)、5X All-In-One RT MasterMix (with AccuRT Genomic DNA Removal Kit)(G492)、TRIzol™ Reagent(15596026/229006)购自澳大利亚Abm 公司;M5 HiClear DL2000 DNA marker(MF025/18Ka2705)购自北京聚合美生物科技有限公司;琼脂糖(A610013-0250/A811BA0014)购自生工生物工程(上海股份有限公司)公司;DEPC(D60029-500ml/6635JK102)购自美国Amresco公司。重组Anti-pro Caspase-1+p10+p12 抗体[EPR16883](ab179515)、重组Anti-NLRP3 抗体[EPR23094-1] (ab263899)(ab282104)购自英国Abcam 公司。漩涡混合器(GL-88B)购自海门市其林贝尔仪器制造有限公司;台式离心机(Neofuge)购自上海力申科学仪器制造厂;酶标仪(xMarkTM)购自Bio-Rad(中国)公司;化学发光成像仪系统(Chemiscope 3000)购自上海勤翔科学仪器有限公司;移液器(Dragon lab)购自德国Eppendorf 公司;蛋白转膜仪(Mini-PROTEAN Tetra system)、PCR仪购自美国Bio-Rad公司;电子天平(CP324S)购自德国Sartorius 公司;高速冷冻离心机(Heraeus Multifuge X1R)购自赛默飞世尔科技公司;微量分光光度计(Nano-100)购自杭州奥盛仪器有限公司;凝胶成像系统(2500)购自上海天能科技有限公司;Real Time PCR instrument(7500 Fast)购自美国ABI公司
1.2 动物分组、模型制备 适应性饲养1 周后将大鼠随机分为对照组、OSAHS 组各8 只。将OSAHS 组置于间歇性低氧舱,每天10:00—18:00 向舱内循环充入氮气(浓度99.9%)并排除混合空气。充入氮气90 s,当舱内氧浓度达6.5%时维持30 s,随后60 s排出舱内气体,氧浓度上升到21%持续60 s,为1 个循环,每天持续8 h[7]。对照组置于常氧舱内,提供常氧空气。8 周后注射氯胺酮将大鼠处死,开胸取出心脏,将心尖部组织用2.5%的戊二醛固定,用于扫描电子显微镜检测;将剩余心脏组织迅速放入液氮中。
1.3 心肌细胞超微结构变化观察 将新鲜左室心肌组织切下3 块(大小1 mm×5 mm),放置于预冷的2.5%戊二醛溶液中固定。4 ℃保存至少24 h 后取出,PBS冲洗3次,置于1%锇酸溶液中固定至少1 h,再次漂洗,逐级乙醇脱水,树脂包埋,常规超薄切片(8 nm),用4%醋酸双氧铀和0.4%柠檬酸铅固定,由新疆医科大学电子显微镜中心的专业人员制备样品,用扫描电子显微镜进行观察。
1.4 左室心肌组织中Caspase-1、GSDMD、NLRP3 mRNA 表达检测 采用实时荧光定量PCR 法。取各组左室心肌组织约1 cm3置于预冷的冻存管,迅速置于-80 ℃冰箱保存。取大鼠左室心肌组织,液氮研磨,TRLzol 法提取总RNA,微量分光光度计测定RNA 浓度及260、280 nm 波长处吸光度值,RNA样本A260/A280在1.8~2.1。按照cDNA 反转录试剂盒说明书,将RNA 反转录为cDNA。将反转录得到的cDNA 置于-80 ℃保存。用实时荧光定量PCR 仪进行PCR 反应。反应体系:Eva Green2×qPCR MasterMix 10 μL,Forward Primer 0.6 μL,Reverse Primer 0.6 μL,cDNA 1 μL,RNase-free 水加至20 μL。反应条件:95 ℃预变性10 min,95℃变性15 s、60 ℃退火与延伸60 s共40个循环。以β-actin为内参。引物由上海生工生物工程有限公司设计合成,Caspase-1 上游引 物5'-CTGAGGGCAAAGAGGAAGCA-3',下 游 引物3'-CATGATCGCACAGGTCTCGT-5';GSDMD 上游引物5'-CCAGCATGGAAGCCTTAGAG-3',下游引物3'-CAGAGTCGAGCACCAGACAC-5';NLRP3 上游引物5'-TCTGTTCATTGGCTGCGGAT-3',下游引物3'-TAGCCGCAAAGAACTCCTGG-5';大 鼠 GAPDH 上游引物5'-CAGGGCTGCCTTCTCTTGTG-3',下游引物3'-GATGGTGATGGGTTTCCCGT-5'。
1.5 左室心肌组织中Caspase-1、GSDMD、NLRP3蛋白表达检测 采用Western blotting 法。取左室心肌组织加入液氮研磨,RIPA 裂解液提取总蛋白,用BCA 蛋白定量试剂盒测定蛋白浓度。经SDS-聚丙烯酰胺凝胶电泳分离蛋白,转移到PVDF膜上。使用含5%脱脂奶粉的封闭液,封闭转印膜1 h,与抗pro Caspase-1+p10+p12 抗体(1∶800)、GSDMDC1 抗 体(1∶500)、抗NLRP3 抗 体(1∶800)、β-actin(1∶1 000)4 ℃冰箱中共孵育过夜。次日TBST 洗膜,以HRP 标记的二抗(1∶5 000)室温孵育1 h。TBST 洗膜,将显色液A 液和B 液混合,加2 mL至膜上,用ChemiScope 3000 mini 化学发光仪检测、拍照。Image Lab 软件分析条带灰度值。目的蛋白相对表达量为目的蛋白灰度值/内参灰度值。
1.6 统计学方法 采用SPSS23.0 统计软件。符合正态分布的计量资料以±s表示,两组比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组心肌细胞超微结构变化比较 对照组心肌细胞膜完整、结构正常;OSAHS组心肌细胞膜完整性被破坏,表现为细胞膜表面欠光滑,形成裂隙、凹陷和大小不等的凸起,细胞膜表面有纤维组织附着,能够看到明显的泡状突起和焦亡小体流出。见图1。

图1 两组扫描电子显微镜下心肌细胞超微结构变化
2.2 两组左室心肌组织中Caspase-1、GSDMD、NLRP3 mRNA 表达比较 与对照组比较,OSAHS 组Caspase-1、NLRP3 mRNA 相对表达量高(P均<0.05),两组GDMDS mRNA 相对表达量比较差异无统计学意义(P>0.05),见表1。
表1 两组左室心肌组织中Caspase-1、GSDMD、NLRP3 mRNA表达比较(±s)
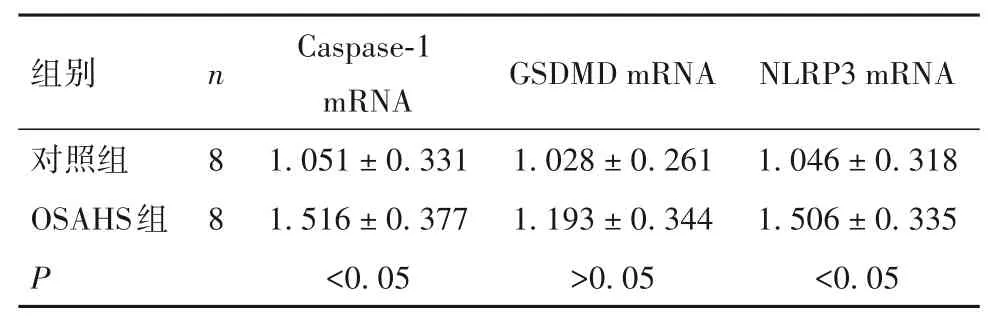
表1 两组左室心肌组织中Caspase-1、GSDMD、NLRP3 mRNA表达比较(±s)
组别对照组OSAHS组P n 8 8 Caspase-1 mRNA 1.051 ± 0.331 1.516 ± 0.377<0.05 GSDMD mRNA 1.028 ± 0.261 1.193 ± 0.344>0.05 NLRP3 mRNA 1.046 ± 0.318 1.506 ± 0.335<0.05
2.3 两组左室心肌组织中Caspase-1、GSDMD、NLRP3 蛋白表达比较 与对照组比较,OSAHS 组Caspase-1、GSDMD、GSDMD-N、NLRP3 蛋白相对表达量高(P均<0.05),见表2。
表2 两组左室心肌组织中Caspase-1、GSDMD、NLRP3蛋白表达比较(±s)
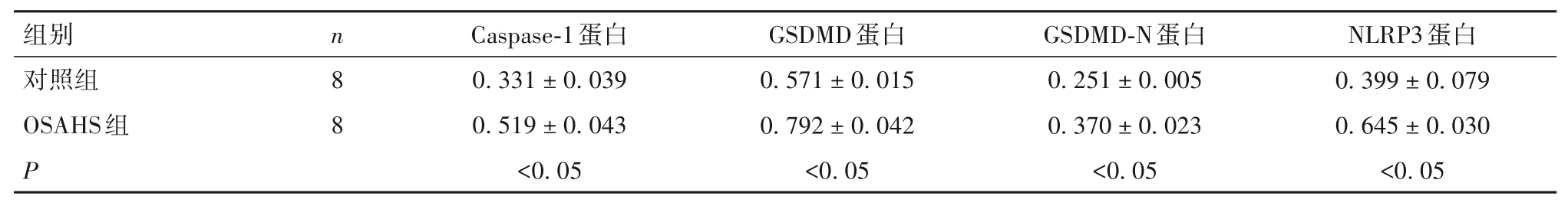
表2 两组左室心肌组织中Caspase-1、GSDMD、NLRP3蛋白表达比较(±s)
组别对照组OSAHS组P n 8 8 Caspase-1蛋白0.331 ± 0.039 0.519 ± 0.043<0.05 GSDMD蛋白0.571 ± 0.015 0.792 ± 0.042<0.05 GSDMD-N蛋白0.251 ± 0.005 0.370 ± 0.023<0.05 NLRP3蛋白0.399 ± 0.079 0.645 ± 0.030<0.05
3 讨论
OSAHS 病因及发病机制复杂,且极易诱发合并症,而在众多由OSAHS 引起的合并症中,心血管疾病是导致严重不良事件的重要原因[8]。OSAHS介导炎症级联反应的诱导和活化,而炎症级联反应又可以促进OSAHS 的发生发展,加剧心脏血管损伤,最终引发心血管系统并发症[9-10]。细胞焦亡是一种新的细胞死亡方式,其特征是形成膜孔,细胞溶解,释放促炎细胞因子和细胞内容物。本研究中,OSAHS组左心室发生心肌细胞细胞膜完整性被破坏,能够看到明显的泡状突起和焦亡小体,提示CIH可诱导心肌细胞发生焦亡。细胞焦亡是一种新型Caspase-1依赖的程序性细胞死亡。Caspase-1 最初被认为是IL-1β 转换酶,将IL-1β 和IL-18 的非活性前体加工成成熟的炎症细胞因子。Caspase-1 的激活不仅可以使炎症细胞因子活化,而且还可通过细胞膜破裂及促炎物质的释放致细胞快速死亡[6]。本研究发现,间歇性低氧大鼠左室心肌Caspase-1 表达上调,提示CIH 激活Caspase-1,使细胞膜破裂,促进细胞膜促炎物质释放。
GSDMD 是焦亡的下游效应物,由1 个功能性的N 端结构域和1 个自抑制的C 端结构域组成。在细胞焦亡过程中,GSDMD 被裂解成GSDMD-N 在细胞质膜上形成孔隙,细胞膜的物理完整性丧失,最终导致细胞肿胀和细胞膜裂解[11]。本研究发现,间歇性低氧大鼠左室心肌GSDMD 和GSDMD-N 的表达上调,亦从蛋白水平证实CIH 促进OSAHS 大鼠心肌细胞焦亡的发生。此结果提示CIH 激活的Caspase-1裂解了GSDMD,诱导心肌细胞焦亡。
细胞焦亡与细胞凋亡和自噬不同,是由炎症小体诱导的细胞死亡的一种炎症形式。NLRP3 是最典型的炎症小体,可介导细胞焦亡的过程[12]。其中经典焦亡通路中NLRP3 炎症小体组成的复合物可以活化下游的Caspase-1 和GSDMD,诱导细胞焦亡,从而促进炎症因子的成熟和分泌[13]。本研究显示,OSAHS 组Caspase-1、GSDMD、NLRP3 表达上调。提示OSAHS 大鼠NLPR3 小体活化,并通过激活Caspase-1 裂解GSDMD 参与了间歇缺氧诱导的心肌细胞焦亡。NLRP3 在心肌炎症相关的心血管疾病(冠状动脉粥样硬化、心肌缺血/再灌注、心肌病、心律失常等)中也发挥着关键的作用[14]。如在心肌梗死动物模型中,抑制NLRP3 炎症小体或凋亡相关斑点样蛋白可减少梗死面积,改善心功能[15-16]。高糖可促进NLRP3 炎症小体介导的细胞焦亡,并通过引起线粒体功能障碍而加重心肌再灌注损伤,而NLRP3 炎症小体抑制剂可减少氧自由基产生并显著减少心肌再灌注损伤[17]。本研究显示,CIH 增加了心肌组织中NLRP3 表达,提示CIH 诱导的焦亡可能与心肌炎症有关。
综上所述,CIH 可诱导心肌细胞焦亡。本研究不足之处在于未进行NLRP3 基因阻断,这是以后研究的方向。
