一种五羟色胺修饰的海藻酸钠可注射水凝胶的制备及性能研究
2023-03-16邓水明何昊东郭建峰
邓水明, 何昊东, 李 颖, 王 芳, 郭建峰
(中北大学 化学与化工学院, 山西 太原 030051)
0 引 言
原位可注射水凝胶因其贴合性好, 可使药物集中于伤口处和对周围组织侵入性小等特点而备受关注[1-2], 为增强其实用性, 研发一种价格便宜、 生物相容性好、 止血性能和伤口愈合能力满意的可注射水凝胶非常必要。 可注射水凝胶的结构与其交联方式密切相关。 目前, 可注射水凝胶常见的交联方式可分为化学交联和物理交联, 物理交联的可注射水凝胶虽然凝胶速率快, 但机械性能通常不高, 化学交联的可注射水凝胶可能存在胶凝时间较长的问题[3-4]。 此外, 生物降解性、 组织粘附性、 生物相容性也是可注射水凝胶需要考虑的问题[5]。 常作为水凝胶原材料的透明质酸不仅存在价格昂贵的问题, 而且也被证明会刺激伤口部位的肿瘤并致其增殖[6]。
海藻酸钠(Sodium Alginate, SA)因其无毒、 可生物降解、 免疫原性低、 生物相容性好且价格便宜, 已被广泛应用于生物医用领域[7-9]。 五羟色胺是人体内存在的天然成分, 不仅是潜在的止血及伤口愈合剂, 而且其作为交联剂形成的水凝胶具有良好的组织粘附性[10-11]。 辣根过氧化物酶(Horseradish Peroxidase, HRP)是一种高效而特异的生物催化剂, 能在H2O2配合下, 使海藻酸钠-五羟色胺聚合物交联形成水凝胶。 这种酶促交联方式不仅可以在温和的条件下使用, 而且可以使水凝胶具有可注射性, 所形成的水凝胶具有凝胶时间较短且可调节的特点, 被认为是安全且适合在生物医学上应用的交联方式[12]。
本文结合海藻酸钠、 五羟色胺在止血及伤口愈合方面的优势, 以及水凝胶复杂网络结构的物理屏蔽作用, 以海藻酸钠与五羟色胺为原料, 在辣根过氧化物酶和H2O2的催化下制备了一种新型可注射水凝胶, 研究了双氧水浓度对其凝胶时间、 溶胀度、 力学性能的影响, 制备的SAS水凝胶在生物医学方面具有潜在的应用价值。 同时, 海藻酸钠还具有易改性的特点, 海藻酸钠水凝胶也具有较强的物质包裹能力, 为以后进一步扩展其应用领域提供了条件[13]。
1 实验部分
1.1 实验用试剂与主要仪器
实验用试剂: 海藻酸钠(200 mPa·s~500 mPa·s)和辣根过氧化物酶(>300 u/mg)购自罗恩医药(中国·上海), 五羟色胺盐酸盐和1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride, EDC·HCl)以及N-羟基丁二酰亚胺(N-hydroxysuccinimide, NHS)购自毕得医药(中国·上海)。
实验用主要仪器: 傅里叶红外光谱仪, FTIR-6500, 天津溢东科技; 全波长酶标仪, Read Max 1900上海闪谱生物科技有限公司; 流变仪, MCR102, 奥地利Anton Paar; 磁力搅拌器, HJ-3, 金坛市杰瑞尔; 冷冻干燥机, CTFD-105, 青岛永合川创信; 扫描电子显微镜, 捷克TESCAN MIRA LMS; 万能试验机, INSTRON LEGEND2345。
1.2 海藻酸钠-五羟色胺(sodium alginate-serotonin, SAS)聚合物的合成
将2 g SA溶于pH值为5.5的缓冲液中, 配成质量浓度为50 mg/mL 的SA溶液; 将2.32 g EDC·HCl和3.86 g NHS分别加入SA溶液中搅拌1 h; 取定量的五羟色胺盐酸盐添加进SA溶液中, 在氮气保护下反应24 h; 反应物在蒸馏水中透析3 d(透析带截留分子量为3 500 Da); 冷冻干燥后得到SAS聚合物, 4 ℃下保存。
配制不同浓度的五羟色胺盐酸盐标准溶液, 测量其在280 nm处的吸光度A, 绘制标准曲线(R2=0.998 6), 得到式(1)。 由式(2)计算得到SAS中五羟色胺的质量分数wS。
A=1.417 1cNHS-0.001 7,
(1)
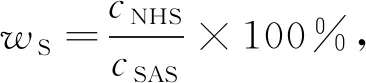
(2)
式中:A为五羟色胺的吸光度;cNHS为五羟色胺的质量浓度, mg/mL;cSAS为SAS聚合物的质量浓度, mg/mL。
1.3 SAS水凝胶的合成以及凝胶时间的测量
将1 g SAS溶于20 mL蒸馏水中得到SAS聚合物溶液, 将HRP加入SAS聚合物溶液中混合均匀; 分别用注射器取400 μL聚合物溶液和 100 μL H2O2在玻璃瓶中混合, 形成水凝胶。 打开磁力搅拌器并开始计时, 当磁力转子的转速明显改变时停止计时, 这个时间即为SAS水凝胶的凝胶时间。
1.4 流变分析
固定频率为1 Hz, 在应变控制扫描模式下(0.001%~1%)使用MC102流变仪测定水凝胶的储能模量和损耗模量, 通过计算水凝胶的平均储能模量得到其弹性模量[11]。
1.5 水凝胶的微观形态
冷冻干燥后的SAS水凝胶样品在液氮中骤冷后脆断, 对样品断面喷金处理后使用扫描电子显微镜观察其微观形貌, 电子加速电压为5 kV。
1.6 溶胀度(Q)测量
在室温下将干燥至恒重(w0)的水凝胶浸泡于磷酸盐(PBS)缓冲液(pH=7.4)中, 每间隔60 min测定水凝胶的质量(wt), 按式(3)计算溶胀度。
溶胀度=(wt-w0)/w0。
(3)
1.7 水凝胶对皮肤组织的粘附性
用猪皮在万能试验机上测定水凝胶的粘合强度, 分析SAS水凝胶对皮肤组织的粘附性。 将猪皮切成5 cm×1.5 cm的长方形, 2块猪皮的搭接长度为2 cm, 搭接区域均匀涂抹SAS水凝胶后将猪皮搭接在一起, 在室温条件下保持30 min。 用夹具固定好猪皮, 万能试验机拉伸速率设置为5 mm/min, 根据最大载荷和搭接面积计算水凝胶的粘合强度[14]。 SAS 水凝胶换为 SA-Ca2+水凝胶[15]重复以上操作, 比较SAS水凝胶和SA-Ca2+水凝胶的粘合强度。
将SAS水凝胶原位注射于破损的皮肤组织处, 观察其在破损皮肤组织中的填充情况, 并对比水凝胶在不同大小伤口的填充情况。
1.8 水凝胶的自愈与降解性
将水凝胶切开, 切口紧挨在一起放置一段时间, 用镊子夹起水凝胶观察是否自愈, 并用扫描电子显微镜(SEM)观察自愈处是否有裂纹。
室温下, 将SAS水凝胶在PBS缓冲液(pH=7.4)中浸泡8 h 使其达到溶胀平衡, 此时, 水凝胶的质量为初始质量wi, 测定浸泡5 d, 10 d, 15 d, 20 d, 25 d, 30 d时水凝胶的质量wr, 按式(4)计算其质量保留率。
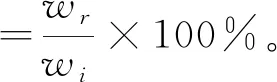
(4)
2 结果与讨论
2.1 SAS聚合物的合成与表征
SAS聚合物的合成过程如图1(a)所示, 在EDC和NHS作用下, 海藻酸的羧基与五羟色胺的氨基发生取代反应, 得到SAS聚合物。 通过分析SAS聚合物的傅里叶红外光谱图(见图1(b))发现, 与SA相比, SAS聚合物在1 027 cm-1和1 623 cm-1处出现了新峰, 表明SAS上成功引入吲哚基团[11]; 在1 290 cm-1处出现酰胺III的吸收峰, 表明五羟色胺成功嫁接到了SA链上。 分析SAS的紫外-可见光吸收光谱图(见图1(c))可知, SAS聚合物在280 nm附近出现吸收峰, 这也表明吲哚基团被成功引入[16]。 表1 为由式(1) 和式(2)计算得到的SA与五羟色胺在不同物质的量比时SAS中五羟色胺的质量分数。 该质量分数越高, 五羟色胺在SAS中的含量越高。 五羟色胺不仅可以充当水凝胶的交联剂, 还可以与生物分子中的亲核试剂作用而粘附在组织表面[17], 因此选择海藻酸钠与五羟色胺物质的量比为1∶3。
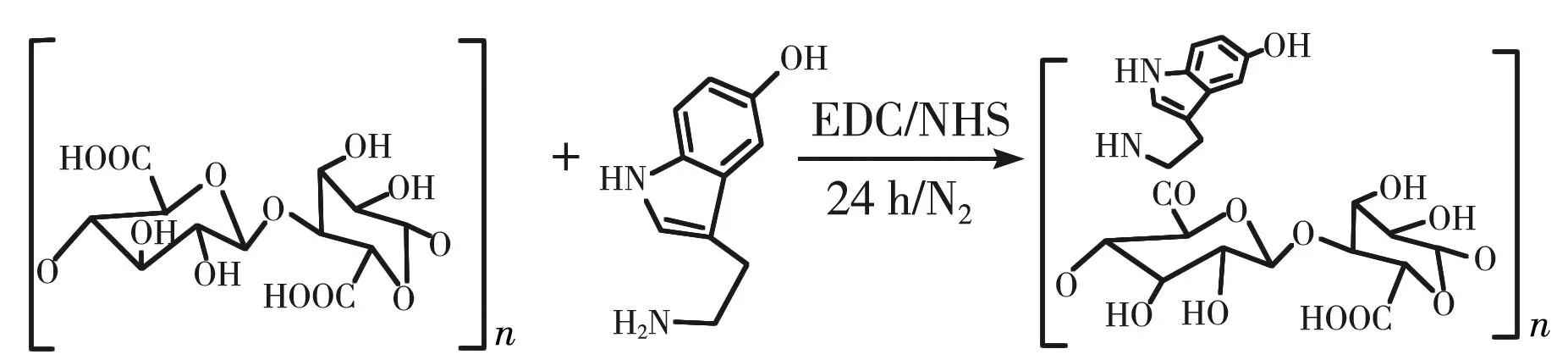
(a) SAS聚合物的合成过程

表1 海藻酸钠-五羟色胺聚合物中五羟色胺的质量分数
2.2 水凝胶的合成与凝胶时间测定
SAS聚合物溶液在H2O2和HRP的催化作用下形成水凝胶, 交联过程如图2 所示。 在H2O2和HRP催化作用下得到吲哚自由基, 生成的吲哚自由基之间相互作用形成共价键[18], 从而得到SAS水凝胶。
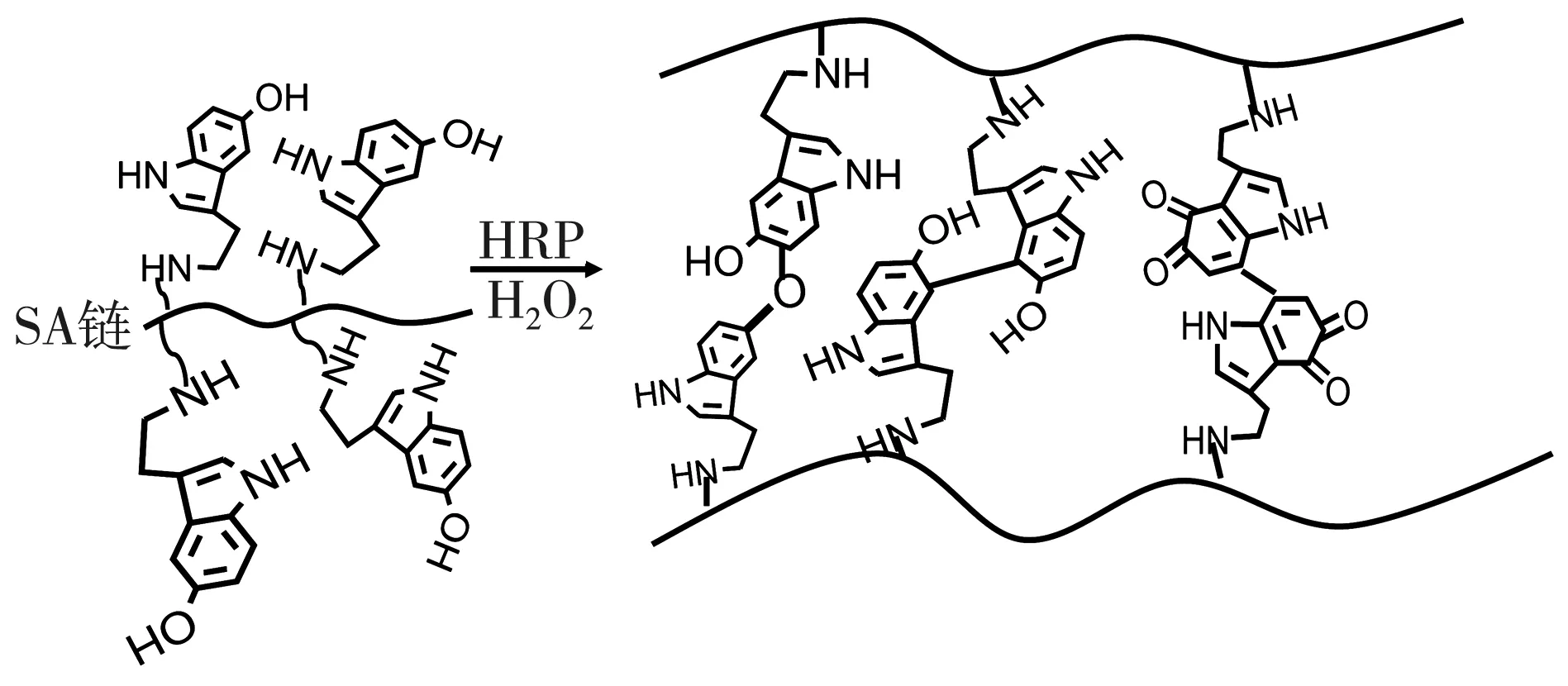
图2 水凝胶合成示意图
SAS聚合物溶液在不同浓度HRP和H2O2催化下的凝胶时间见图3。 由图3 可知, SAS聚合物溶液形成水凝胶的时间在40 s~85 s之间, 均在2 min内。 当H2O2的浓度不变时, 随着HRP质量浓度的升高, 凝胶时间明显缩短, 这是因为酶含量越高单位时间内的催化效率越高, 因而凝胶时间越短。 在HRP质量浓度不变的情况下, 随着H2O2浓度的增加, 凝胶时间先缩短后增加, 这可能是由于适当的H2O2浓度会加速聚合物的交联从而缩短凝胶时间, 而当H2O2浓度过大可能会导致HRP的活性降低, 从而延长水凝胶形成的时间。
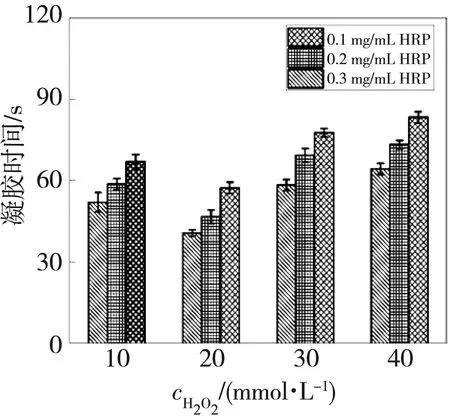
图3 SAS水凝胶的凝胶时间
2.3 流变分析
水凝胶(HRP 0.3 mg/mL,H2O210 mmol·L-1)在0.001% ~1%应变范围的储能模量(G′)和损耗模量(G″)见图4(a),不同H2O2浓度形成的水凝胶的弹性模量见图4(b)。 如图4(a) 所示, 在0.001%~1%应变范围内, 水凝胶储能模量始终大于损耗模量, 表明水凝胶形成稳定的交联结构[11]。 如图4(b) 所示, 双氧水浓度从 10 mmol·L-1增加到 40 mmol·L-1, SAS水凝胶弹性模量从 282 Pa提高到 513 Pa, 弹性模量随H2O2浓度的增加而升高, 弹性模量随H2O2浓度的增加而升高, 这是由于随着H2O2浓度的增加, 更多的吲哚自由基被氧化发生交联反应, 从而使水凝胶的力学性能得到提升。 这说明H2O2的浓度对SAS水凝胶的力学性能影响显著。
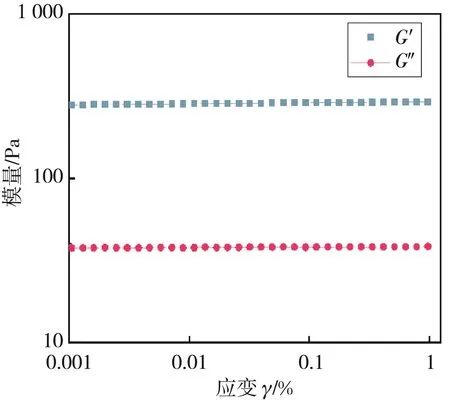
(a) 水凝胶的储能模量(G′)和损耗模量(G″)
2.4 水凝胶的形态及溶胀度
使用电子显微镜观察到的SAS水凝胶的微观形态如图5 所示, 水凝胶呈多孔网状结构且形状不规则。 该结构有利于吸收渗出物, 增加红细胞和血小板浓度, 加速血液凝固, 多孔结构也有利于细胞迁移和附着以及代谢废物的排出, 从而加快伤口愈合[19-21]。
不同H2O2浓度形成的水凝胶的溶胀度如图6 所示。 水凝胶的溶胀度随时间的延长而不断增加, 最终在420 min左右达到平衡。 当H2O2的浓度在10 mmol·L-1~40 mmol·L-1时, 溶胀度随着H2O2浓度的增加而逐渐下降, 这是由于随着H2O2浓度的增加, 所形成的水凝胶交联更加致密, 从而导致水凝胶的溶胀度降低。 H2O2的浓度在10 mmol·L-1~40 mmol·L-1之间时, 溶胀度为18 g/g~33 g/g, 这说明在此H2O2浓度范围内所形成的水凝胶均具有高溶胀度(Q>10 g/g)[22], 高溶胀度的水凝胶更加有利于吸附渗出液和浓缩凝血因子, 加速伤口部位的凝血。
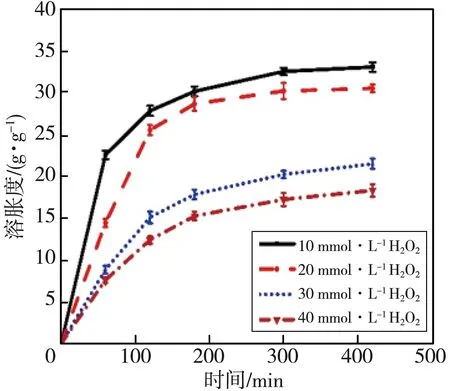
图6 不同双氧水浓度条件下SAS水凝胶的溶胀度
2.5 水凝胶的组织粘附
SAS水凝胶的粘合强度见图7。 SAS水凝胶的粘合强度远大于SA-Ca2+水凝胶,这说明SAS水凝胶的皮肤贴合能力要好于SA-Ca2+水凝胶。
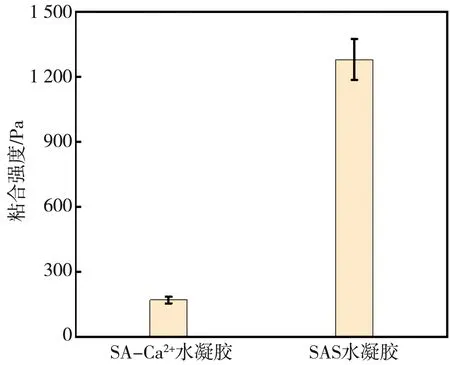
图7 SAS水凝胶的粘合强度
SAS水凝胶填充破损皮肤组织的情况如图8 所示。 SAS水凝胶原位形成于伤口处, 能很好地填充伤口(见图8(a))。 进一步扩大伤口, 水凝胶仍然能很好地填充伤口, 提起受损皮肤组织反复抖动后水凝胶依然较好地填充于皮肤伤口处,伤口未见明显裂开(见图8(b))。 这可能归因于五羟色胺氧化中间体与皮肤组织中的一些蛋白质发生反应, 从而提高了SAS水凝胶的组织粘附性。 SAS水凝胶干燥后, 水凝胶也很容易从皮肤上脱离, 不会损害皮肤组织。

(a) 水凝胶填充破损皮肤组织的情况
2.6 水凝胶的自愈与降解
SAS水凝胶自愈过程和切口自愈后的SEM图如图9 所示。 将水凝胶切开, 切口紧挨在一起放置一段时间后, 可以看到水凝胶自愈为一体, 将自愈后的水凝胶用镊子夹起, 愈合部分也没有裂开掉落(见图9(a)), 愈合处未见明显的大裂缝(见图9(b)), 表明SAS水凝胶具有良好的自愈能力, 这可能是由于水凝胶之间具有氢键与 π-π 堆积作用, 从而赋予SAS水凝胶自愈性[23]。

(a) SAS水凝胶自愈过程
SAS水凝胶的降解曲线如图10 所示。 由图10 可知, 随着时间的推移, SAS水凝胶的质量逐渐减少, 在降解30 d后, 其降解率超过80%, 说明SAS水凝胶具有生物可降解性。
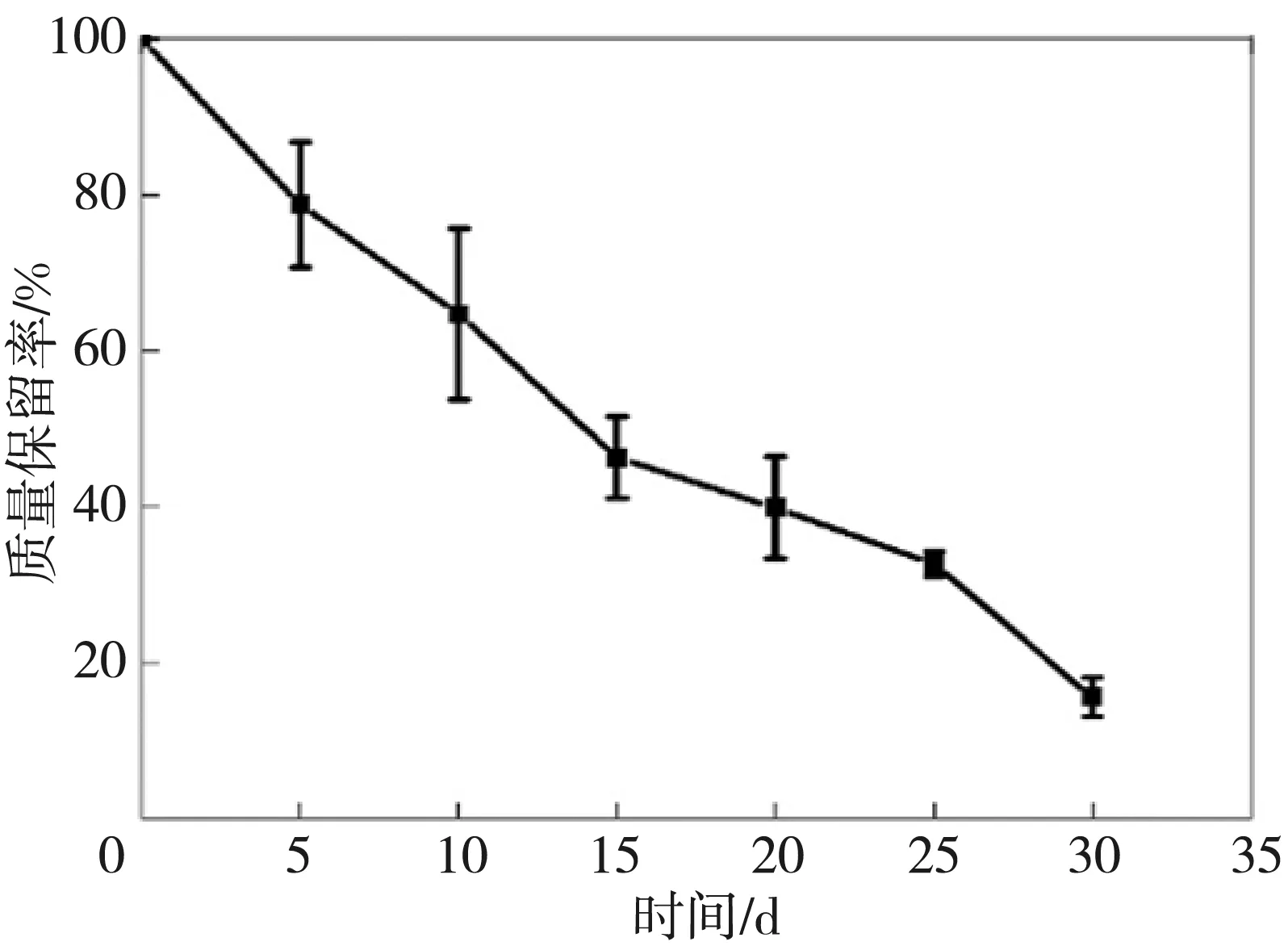
图10 SAS(0.3 mg/mL HRP, 20mmol·L-1 H2O2)水凝胶的降解曲线
3 结 论
本研究以海藻酸钠、 五羟色胺为原料, 在双氧水和辣根过氧化物酶的催化作用下成功制备了一种新型可注射SAS水凝胶。 SAS水凝胶能形成稳定的交联结构,弹性模量随双氧水浓度的增加而增加, 可以通过改变双氧水浓度来调节SAS水凝胶的性能, 达到更好的效果。 SAS水凝胶的凝胶时间随双氧水浓度的增加先降低后增大, 双氧水浓度为20 mmol·L-1时, 凝胶时间最短。 微观形态呈形状不规则的多孔网状结构, 表现出良好的溶胀性能,溶胀度随双氧水浓度的增加而下降。 SAS水凝胶不仅能很好地贴附于皮肤组织, 还具有良好的自愈能力和生物降解能力。
