山西黄河上游枯水期微塑料分布及附着微生物研究
2023-03-16吕岳骏李亚芸王舒淇高于涵李鑫丰蔡明娜
吕岳骏, 李亚芸, 王舒淇, 高于涵, 李鑫丰, 蔡明娜, 侯 彬, 卢 静
(中北大学 环境与安全工程学院, 山西 太原 030051)
0 引 言
微塑料(Microplastics, MPs), 是指粒径小于5 mm的高分子化合物[1]。 由于其比表面积大, 吸附污染物的能力强, 且具有体积微小的特点, 在环境中随风力、 水力运输迁移的范围更广, 对环境和生态圈食物链的危害程度更大、 更持久[2]。 目前, 已有大量关于MPs的污染研究的报道。 MPs最早在海洋中被发现[3], 研究者追溯海洋中MPs的来源时发现大部分MPs来自于内陆地表水, 内陆环境中的MPs首先进入地表水, 然后随地表水进入内陆河流, 最后汇入海洋[4-5]。 目前很多的MPs研究都集中在海洋[1-2,6], 内陆地表水的研究不是很多, 尤其是对世界排名前几的河流研究更少。 此外, MPs作为一种典型的非自然介质的生物栖息地, 其附着的微生物群落近年来也受到越来越多研究者关注[4,7-8]。
黄河作为世界第六大河流[9], 针对其中MPs分布情况的研究有报道但并不是很多, 且大多数研究集中在黄河下游[7,9-10]。 山西地处黄河中上游, 境内黄河流段长965 km, 几乎占黄河全长的1/5, 研究山西境内黄河流域中MPs 的污染情况对黄河水环境保护治理具有重要意义[11]。 然而, 关于山西省境内黄河流域中MPs的研究却鲜有报道。 龚喜龙等[12]研究了甘肃至山东黄河流域沉积物中的MPs情况, 但是其中只包括山西黄河流域中下游的沉积物, 山西黄河上游MPs的分布情况还未见报道。 关于黄河中MPs表面生物膜方面的研究更未见报道。 本文以山西境内黄河上游的河曲县和保德县黄河采样站点附近的水体和沉积物为研究对象, 观察MPs及其附着生物膜的表面形貌, 对MPs的形状、 颜色和粒径分布特征进行统计, 并分析了MPs的聚合物类型, 最后对MPs附着微生物菌群分类学组成进行分析, 旨在探究山西境内黄河上游MPs的分布特征及其表面附着微生物群落的组成。
1 实验部分
1.1 样品采集
在山西黄河上游的河曲县(H)、 保德县(F)共选择6个采样点, 如图1 所示, 于2021年12月7日选择河面水流平缓处采集样品。 每个采样点收集1 L水样装入无菌采样瓶中, 收集2 kg沉积物样装于铝箔袋中。 每个采样点采集3个平行样。
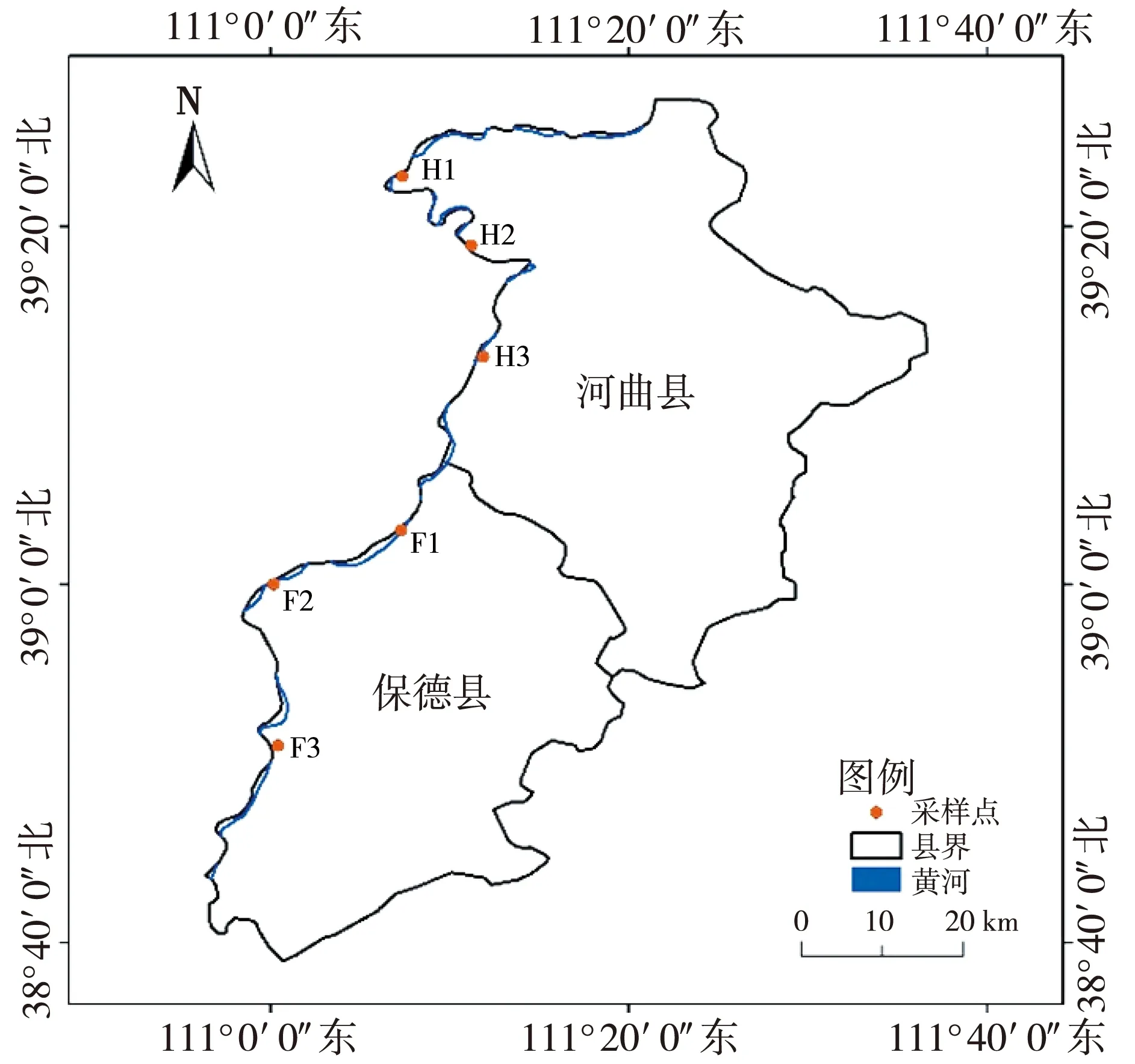
图1 采样点地理位置图
1.2 MPs的分离与富集
将肉眼可见的大块MPs挑出, 冲洗表面后收集冷冻保存, 用于后续生物膜研究实验。
对水样和干沉积物样分别用饱和氯化钠溶液(1.2 g/m3)浮选, 上清液进行真空抽滤, 将MPs收集在0.22 μm的水系混合纤维素微孔滤膜上, 然后用质量分数为30%的H2O2浸泡收集起来的MPs, 将样品放在恒温振荡器(HZ-9511KB, 温度60 ℃, 转速120 r/min)中消解36 h, 对消解后的样品进行真空抽滤, MPs被收集在0.22 μm水系混合纤维素微孔滤膜上, 将富集在滤膜上的MPs及滤膜一起置于50 ℃的烤箱中烘干, 等待显微镜检验[4,12]。
1.3 MPs及其附着微生物表面形貌的观察
利用金相显微镜(Leica DM18/MC190HD)对干燥后的疑似MPs的粒径梯度、 颜色、 形状进行分类统计。 利用扫描电子显微镜(SEM, 捷克TESCAN MIRA LMS, 加速电压3 kV)对MPs表面形貌以及MPs附着微生物表面形貌进行表征。 观察MPs附着生物膜的表面形貌时, 先将样品在质量分数为2.5%的戊二醛固定液中室温下固定12 h后用乙醇梯度脱水, 再将干燥后的MPs样品粘在扫描电镜样品台上, 用离子溅射镀膜仪在MPs表面喷金100 s。
1.4 MPs聚合物类型的鉴定
较大的MPs用傅里叶红外变换光谱仪(布鲁克, ALPHAⅡ)进行表征, 测试范围500 cm-1~4 000 cm-1, 分析MPs聚合物类型。
1.5 MPs附着微生物菌群分类学组成和分布
取水样和沉积物中的MPs样品各10 g, 加入50 mL~100 mL的PBS缓冲液或者无菌水, 在恒温振荡器(HZ-9511KB, 150 r/min ~200 r/min,25 ℃)中振荡30 min~60 min, 超声10 min, 再次振荡30 min ~60 min, 取上清液在8 000 r/min下离心分离, 收集沉淀并用液氮速冻, -80 ℃或液氮中长期保存。
选择扩增子项目文库类型标准细菌V3V4区(Miseq-PE250/Novaseq-PE250), 在Pacbio Sequuel平台对群落全长rDNA进行单分子测序。 对高通量测序的原始下机数据根据序列质量进行初步筛查, 运用QIIM软件(Quantitative Insights Into Microbial Ecology, v1.8.0, http://qiime.org/)对样品的操作分类单元(Operational Taxonomic Unit, OTU)进行划分, 对各样本在不同分类水平的具体组成进行分析。 MPs附着菌群分类学样本编号为: HW表示河曲水样中的MPs, HS表示河曲沉积物样中的MPs, BW表示保德水样中的MPs, BS表示保德沉积物中的MPs。
2 结果与讨论
2.1 MPs的表面形貌
通过SEM观察到的MPs的表面形貌见图2。 图2(a)~图2(c)(放大倍数为500倍)分别为河曲流域沉积物中的碎片状MPs, 保德流域沉积物中的薄膜状和纤维状MPs, 不同形状的MPs表面均存在明显划痕、 沟壑、 凹槽等风化痕迹, 这表明黄河流域中的MPs受到了水流冲刷、 泥沙摩擦、 生物侵蚀等作用。 保德流域沉积物中的碎片状MPs附着生物膜的表面形貌如图2(d)(放大倍数为5万倍) 所示, MPs表面明显存在微生物附着生长。 风化作用使MPs比表面积增大, 为各种异养生物的定植提供了有利条件[13-14]。
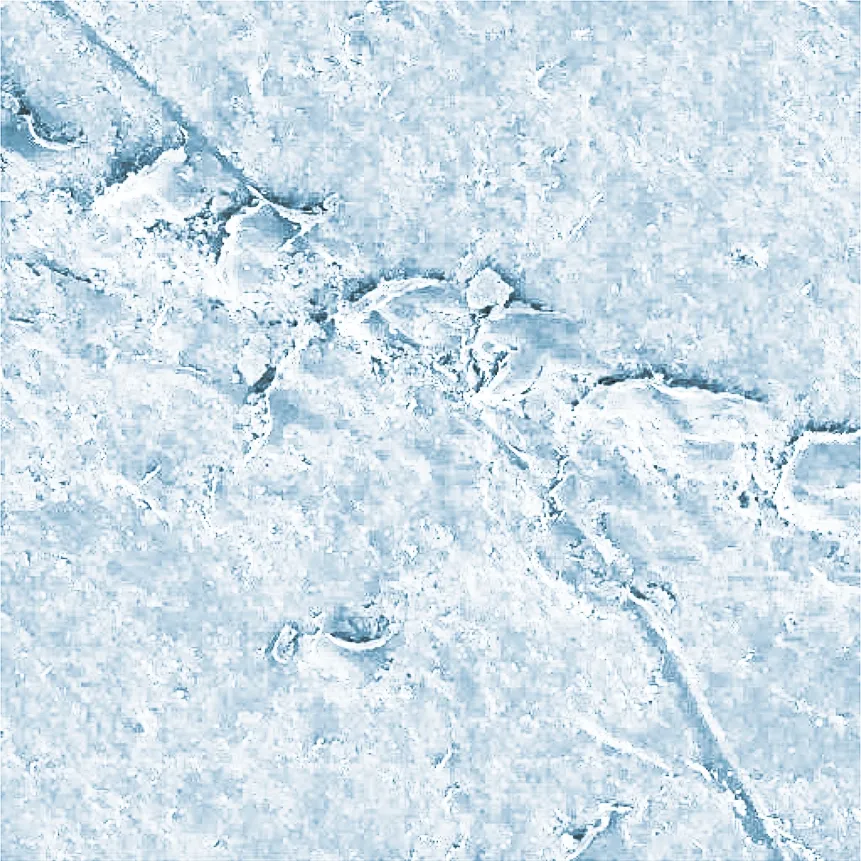
(a) 碎片状MPs
2.2 MPs的丰度
如图3 所示, 两地水体和沉积物中MPs的丰度分别为160 个/L~275 个/L和287 个/kg~480 个/kg。 其中, 河曲水体中MPs为平均丰度的193 个/L, 沉积物中MPs的平均丰度为405 个/kg; 保德水体中MPs的平均丰度为220 个/L, 沉积物中MPs的平均丰度337 个/kg。 图3 中纵坐标负值代表沉积物中MPs的丰度,读数取绝对值。河曲水体中MPs的平均丰度略低于保德水体中MPs的平均丰度, 而河曲沉积物中MPs的平均丰度略高于保德沉积物中MPs的平均丰度。 黄河流域不同研究区域水体和沉积物中MPs的分布特征如表1 和表2 所示, MPs的分布特征整体呈现下游高于上游的趋势。 本研究地处黄河中上游, 研究区域水体和沉积物中MPs的丰度比上游的高, 比下游的低, 符合黄河流域中MPs的分布特征整体呈现下游高于上游的趋势。 MPs会随水流在中游部分积累, 其余部分随水流进入下游, 且研究区域处于内陆地区, 相比下游沿岸靠海地区, 其人口密集程度较低, 受人类活动的影响程度较低, MPs的丰度较低[9,14]。
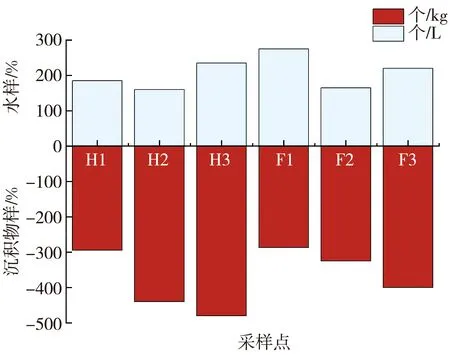
图3 河曲、 保德黄河流域中MPs的丰度
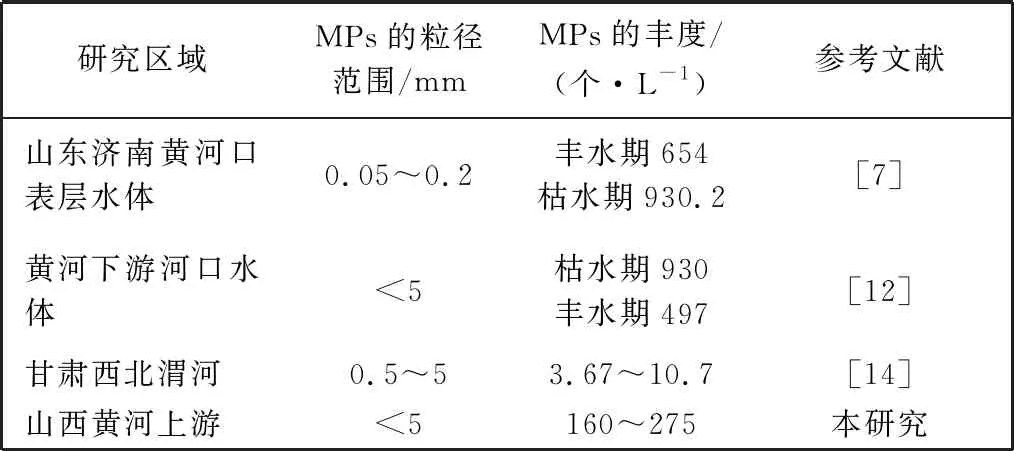
表1 黄河流域不同研究区域地表水中MPs的分布特征
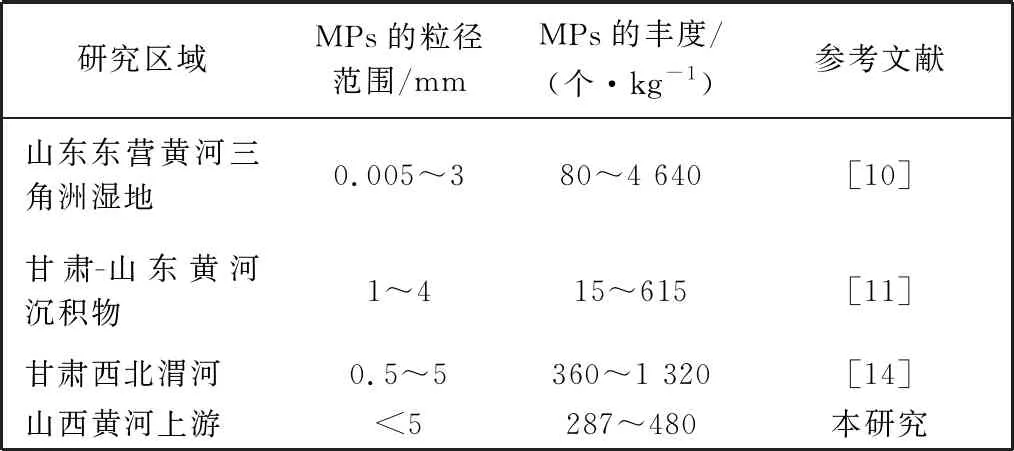
表2 黄河流域不同研究区域沉积物中MPs的分布特征
2.3 MPs的形状分布、 粒径梯度及颜色特征
样品中MPs的主要形状有薄膜状、 纤维状、 小球状和碎片状, 如图4 所示。 采样点的MPs形状分布如图4(b)所示, 碎片状MPs占比最大, 其次为纤维状MPs, 小球状和薄膜状MPs相对较少。 碎片状MPs主要来源于城市生活垃圾, 纤维状MPs主要来源于农业地膜、 包装袋、 服装纤维以及日常塑料绳破损, 小球状和薄膜状MPs主要来源于工业垃圾。 这与研究区域靠近城市, 周边工业区较少, 主要是生活垃圾和各种纤维垃圾的实际相符。

(a) MPs的金相显微镜图
两地流域MPs的粒径分布如图5 所示。 将MPs按粒径梯度划分为<0.1 mm、 0.1~0.5 mm、 0.5~1 mm、 1~5 mm 4类, 两地水体和沉积物中粒径<0.1 mm的MPs占比最多, 这与Han[9]、 牛学锐[10]、 Ding[14]等的研究结果类似, 一方面泥水冲刷对来源于上游水体的MPs颗粒撕裂程度更高[12], 另一方面MPs在水体和沉积物中各种作用下脆化、 断裂, 再加上其难降解的特点, 环境中微小体积MPs随着时间的推移不断积累, 整体呈现出环境中体积小的MPs占比更高的趋势[7,12]。
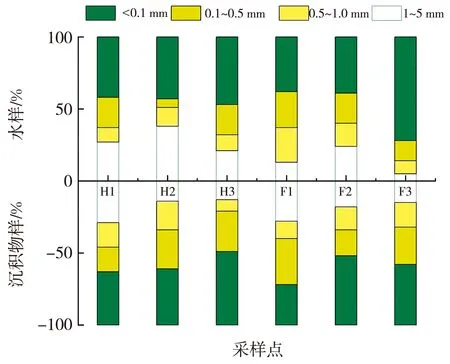
图5 河曲、 保德黄河流域MPs粒径分布
河曲/保德黄河流域MPs的颜色分布特征如图6 所示, 样品中白色MPs最多, 占比为 60%;蓝色 MPs占比最小,仅为10% 左右。
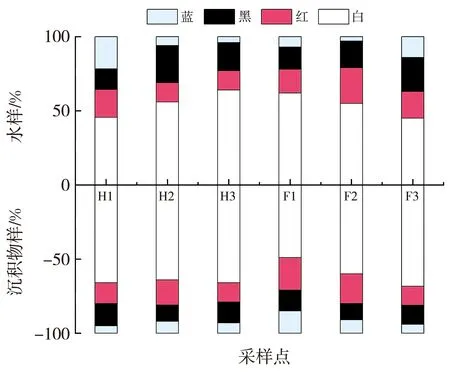
图6 河曲、 保德黄河流域MPs的颜色分布特征
2.4 MPs的聚合物类型
MPs样品的FTIR光谱图如图7 所示, 样品中纤维状MPs的聚合物成分主要为聚乙烯(Polyethylene, PE), PE主要用作农膜、 工业用包装膜、 药品与食品包装薄膜、 绳索、 过滤布、 包装布、 机械零件、 日用品、 建筑材料、 电线、 电缆绝缘、 涂层和合成纸等; 碎片状MPs的聚合物成分主要为聚丙烯(Polypropylene, PP), PP广泛应用于服装、 毛毯等纤维制品、 医疗器械、 汽车、 自行车、 零件、 输送管道、 化工容器等的生产, 也用于食品、 药品包装; 薄膜状和小球状MPs的聚合物类型主要为聚苯乙烯(polystyrene, PS)[12,15], PS经常被用来制作隔热板、 泡沫塑料制品、 一次性塑料餐具、 透明CD盒等。 城市生活垃圾未经合理处置, 其中的塑料垃圾经过农田灌溉、 风力、 雨水冲刷等污染迁移过程, 最终进入了河流。

(a) 聚乙烯
2.5 MPs附着微生物菌群分类学组成
通过高通量测序, 对12组样本进行OTU划分和分类地位鉴定, 如图8(a) 所示, 水体中MPs附着微生物OTU整体的数目高于沉积物中MPs表面的数目, 12组样本的相似度主要集中体现在属水平。 进一步在属水平上对两地12组样品展开分类学组成分析, 如图8(b), 图8(c)为属水平河曲、 保德两地12组样品的菌群分类学组成和分布图。
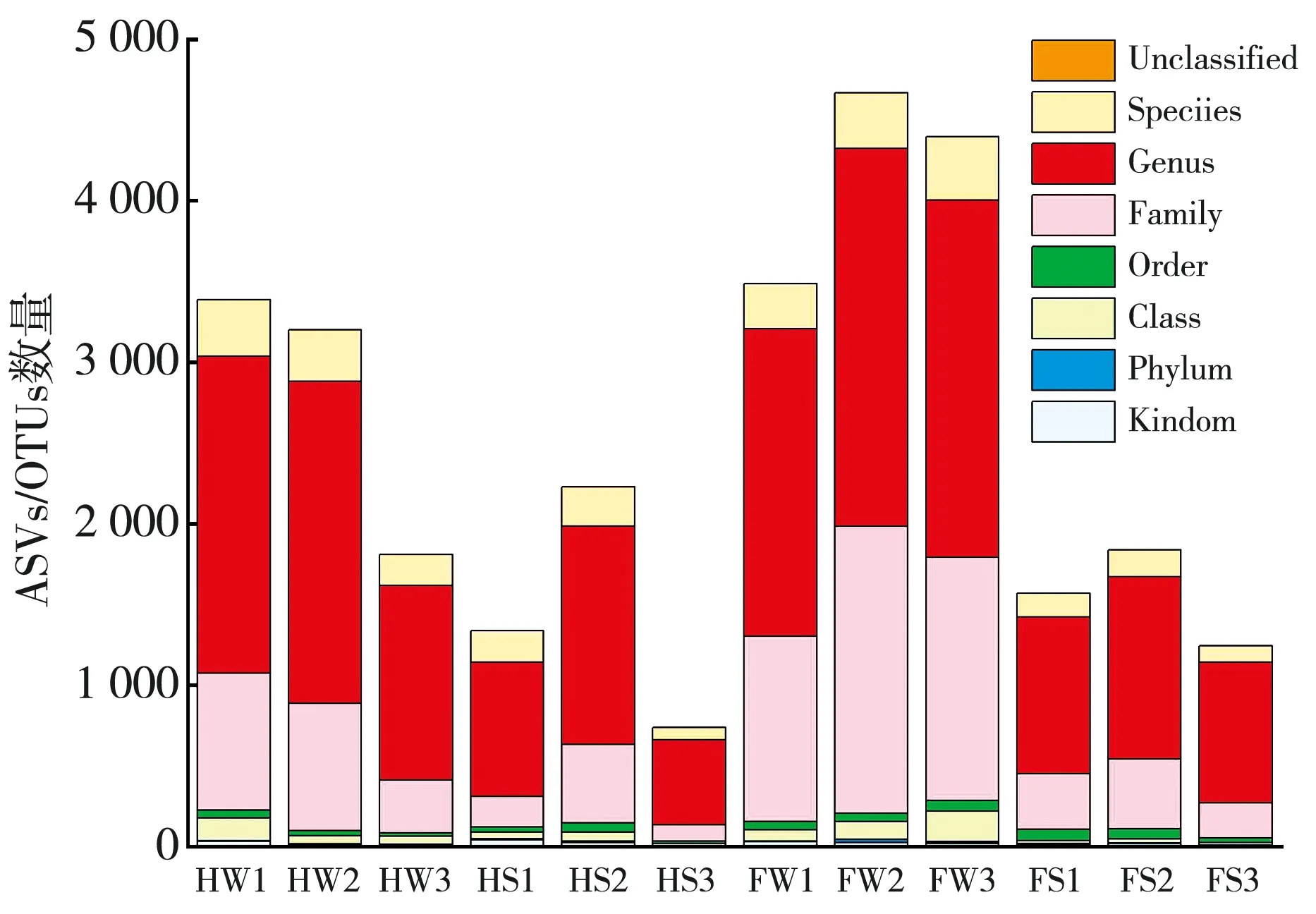
(a) 两地12组样本的OTU划分和分类地位鉴定结果统计图
分析图8(b)可知, 河曲水中MPs表面细菌群落主要有黄杆菌属(Flavobacterium)、 假单胞菌属(Pseudomonas)[16]、 弯杆菌属(Flectobacillus)、Limnohabitans、 红细菌属(Rhodoferax), 沉积物中MPs表面细菌群落主要有假单胞菌属(Pseudomonas)、 黄杆菌属(Flavobacterium)、 微小杆菌属(Exiguobacterium)、 嗜冷杆菌属(Psychrobacter)和节杆菌属(Arthrobacter)。 分析图8(c)可知, 保德水体中MPs表面细菌群落主要有Limnohabitans、 黄杆菌属(Flavobacterium)、 马赛菌属(Massilia)、 假单胞菌属(Pseudomonas)、 红细菌属(Rhodoferax), 沉积物中MPs表面细菌群落组成主要有节杆菌属(Arthrobacter)、 黄杆菌属(Flavobacterium)、 马赛菌属(Massilia)、 假单胞菌属(Pseudomonas)和嗜冷杆菌属(Psychrobacter)。
河曲水体中MPs表面黄杆菌属(Flavobacterium)是优势种、 沉积物中MPs表面假单胞菌属(Pseudomonas)是优势种, 保德水体中MPs表面的优势种是Limnohabitans、 沉积物中MPs表面的优势种是节杆菌属(Arthrobacter), 这些菌都是参与水环境碳氮循环的有益菌种, 对促进水体自净有积极作用[17]。 同时, 黄杆菌属(Flavobacterium)还可以抑制微囊藻的生长, 有助于水体富营养化的修复[18]; 节杆菌属(Arthrobacter)具有极强的环境适应性, 可以降解水体中的有机物和重金属[19]; 马赛菌属(Massilia)具有溶磷、 降解多环芳烃的功能[20]。 同一采样点水体和沉积物中的MPs表面的优势种不同, 不同采样点水体样本之间、 沉积物样本之间的优势种也不相同, 这可能是由于所处水体和沉积物环境的不同而表现出显著差异性[2,15], 同时沉积物高速沉降和再悬浮作用可能导致水体和沉积物间细菌群落发生剧烈交换[15], 水生微生物利用漂浮物、 悬浮物在不同区域中吸附转移是微生物常见的传播途径。
3 结 论
本研究对山西黄河上游流域中MPs的分布特征及其表面附着菌群分类学组成进行了表征, 结论如下:
1) 山西黄河上游水体和沉积物中MPs的丰度分别为160 个/L~275 个/L和287 个/kg~480 个/kg, 其中, 粒径<1 mm的MPs颗粒占比最大。 碎片状MPs占比最高, 其主要成分是PP; 纤维状次之, 主要成分是PE; 小球状和薄膜状MPs的主要成分是PS, 占比最小。 通过SEM观察到MPs表面存在划痕、 沟壑、 凹槽等风化痕迹, 且表面存在微生物附着生长。
2) 利用高通量测序技术表征MPs表面微生物菌群分类学组成, 两地流域中MPs表面普遍存在黄杆菌属(Flavobacterium)、 假单胞菌属(Pseudomonas)等, 除此之外, 水样中MPs表面还大量存在Limnohabitans、 红细菌属(Rhodoferax)等, 沉积物中MPs表面大量存在节杆菌属(Arthrobacter)、 马赛菌属(Massilia)、 嗜冷杆菌属(Psychrobacter)等。
