固定化白桦酸亲和整体柱的制备方法及其应用
2023-03-15黄小玲杨鸿雁单紫轩袁英才汪锦才郭嘉亮
黄小玲,杨鸿雁,单紫轩,袁英才,汪锦才,赖 亮,刘 正,郭嘉亮,*
1 暨南大学药学院,广州 510632;2 佛山科学技术学院,佛山 528000
23-羟基白桦酸(23-hydroxyl betulinic acid,23-HBA)是从传统中药毛茛科植物白头翁(Pulsatillachinensis)中分离得到的羽扇豆烷型五环三萜类化合物,同时在多种植物如白桦树(Betulapubescens)、滇刺枣(Ziziphusmauritiana)、夏枯草(Prunellavulgaris)、夹竹桃(Apocynaceae)等之中均有分布,尤其是桦木科植物中含量最丰富[1]。现代药理学研究表明其具有抗病毒、肿瘤细胞增殖抑制、抑制血管生成、联合增敏等一系列作用[2]。譬如,该类化合物作用机理独特、毒性极低、不良反应较小,是一类极具前途的抗HIV-1的候选化合物;又如,很多23-HBA类衍生物还可以通过抑制细胞生存和生长所需的特定酶(如鸟氨酸脱羧酶等),从而抑制多种肿瘤和癌细胞的生物活性,如直肠癌、肺癌、白血病、淋巴癌、前列腺癌、卵巢癌等[3,4]。因此,23-HBA被视为具有重要研究价值的先导化合物(leading compound)。
近年来,本课题组对衍生化23-HBA开展了系统研究,获得活性效果较佳的23-HBA的重要衍生物3,23-二乙酰基-17-乙酸白桦酸(下简称Derived-BA)。然而,目前此类23-HBA衍生物作用机制的研究还处于起步阶段,其靶标的有关研究尚鲜见报道,面临靶点不清、机理不明的困局。因此,开发一种有效、快捷、简便的方法,识别与鉴定天然产物的作用蛋白/酶靶点具有十分广泛和重要的应用前景。值得关注的是,近年有关药物靶蛋白的发现与研究具有多种技术手段;其中,基于亲和富集垂钓法(affinity enrichment fishing)的化学蛋白质组学技术能够利用或模拟生物分子之间的专一性作用,作为层析用固定相从复杂混合物中选择性分析和纯化特定物质,从而成为了当下研究小分子药物蛋白靶点的主要手段之一,具有高通量、低成本等的显著优势。迄今为止,亲和色谱法已成功应用于他克莫司[5]、环孢菌素[6]、甲氨喋呤[7]等多种药物靶蛋白的搜寻。通过制备键合23-HBA衍生物的新型亲和色谱柱,考察对从细胞或组织中提取出来的蛋白进行亲和筛选,从而发掘相应的靶点蛋白,有望为寻找和研究天然产物的靶点蛋白建立新思路与方法;同时,也为研究小分子天然产物与不同靶标的作用,提供了重要的研究平台。
在常见的亲和富集基质材料中,硅胶具有良好的色谱性能,但耐酸碱性差;树脂和琼脂糖适用的pH范围较宽,但机械强度差。整体柱(monolithic column)是由单体、交联剂、引发剂、致孔剂的混合物在色谱柱内通过原位聚合而成的连续床固定相,适合快速分析和流速梯度模式。与传统的填充柱相比,具有制备方法简单、易于改性、柱效高、渗透性好、反压低、传质速度快等优点;同时还具有可控制孔径的优点,在生物大分子的分离分析上具有很大的优势[8]。因此,发展基于耐酸碱性和生物兼容性好的新型聚合物整体材料亲和色谱,具有重要理论与实际意义。
有关键合23-HBA类化合物的有机聚合物整体柱,目前尚未见文献报道。本研究主要采用前文报道的“一锅法”[9,10],通过原位热聚合的方式,在100 μm I.D.(内径)的毛细管柱内制备了新型固定化23-HBA的目标聚合物整体柱poly(GMA-EDA-BA-co-EDMA);同时深入摸索制备该整体柱的组成和配比,并考察了其作用机理。
1 材料与方法
1.1 药品与试剂
3-(甲基丙基酰氧基)丙基三甲氧基硅烷(3-(triethoxysilyl)propyl methacrylate,γ-MAPS)、乙二醇二甲基丙烯酸酯(ethylene dimethacrylate,EDMA)、甲基丙烯酸缩水甘油酯(glycidyl-methacrylate,GMA)、邻苯二甲酸二甲酯购自美国Sigma公司;偶氮二异丁腈(2,2′-azobisisobutyronitrile,AIBN)、乙二胺(ethylenediamine,EDA)、正丙醇(n-propanol,Pro-OH)、1,4-丁二醇(1,4-butanedio,BDO)、甲苯、硫脲均购自阿拉丁化学试剂有限公司;甲醇和乙腈为色谱纯,水为三蒸高纯水;蛋白、酶等样品购自上海丽珠东风生化试剂公司或北京百泰生物技术公司;其它一般有机试剂购自广州化学试剂厂。
EDMA的前处理:将12 mL EDMA加入50 mL的分液漏斗中,然后加入等体积的质量分数5%NaOH溶液,充分震荡,静置分层,收取有机层,再加入等体积的质量分数5%NaOH溶液,如此反复碱洗三次;待此操作完成,有机层在用去离子水洗涤至中性;将洗涤后的EDMA用无水MgSO4干燥,置于4 ℃冰箱冷藏干燥24 h;干燥处理之后的EDMA用0.22 μm的有机膜过滤,存于4 ℃冰箱保存,备用。GMA处理方法同EDMA;生孔剂使用前减压蒸馏;偶氮二异丁腈长期不用需经重结晶处理。其他一般化学试剂未经纯化操作。
1.2 主要仪器
DK-S22水浴锅(上海精宏实验设备有限公司);高压泵(美国Haskel公司);LX-0.12/10A空气压缩机(上海鲁辛实业有限公司);T-50.1L溶剂过滤器(天津津腾实验设备有限公司);XL-30E SEM扫描电镜仪(荷兰Philips公司);SPD-15C紫外检测器(日本Shimadzu公司);DiNa-S、DiNa-2D 纳流泵(日本KYA Technologies公司);Unimicro TrisepTM色谱工作站(上海通微分析技术有限公司);20 nL 四通阀(美国Valco公司);PB-10 pH计(德国Sartorius公司);石英毛细管375 μm O.D.× 100 μm I.D.(永年锐沣色谱器件有限公司);KQ2200D超声仪(东莞科桥超声波设备有限公司);0.22 μm滤膜(天津博纳艾杰尔科技有限公司)。
1.3 实验方法
1.3.1 毛细管的预处理
石英毛细管的活化处理操作如前文所述,具体流程如下(见图1):首先用1 M 的NaOH溶液冲洗空的石英毛细管2~3 min,再将石英毛细管两端封口放在100 ℃的水浴锅中反应下2 h;准备去离子水冲洗石英毛细管并冲洗至pH=7,用甲醇冲洗石英毛细管30 min后,在高纯氮的条件下干燥4 h;按照Vγ-MAPS∶V甲醇=1∶1的比例配制灌入石英毛细管中,1 min后在60 ℃的水浴锅中反应12 h;最后用甲醇和去离子水各冲洗30 min并在高纯氮的环境下干燥12 h至吹干,毛细管预处理完成。
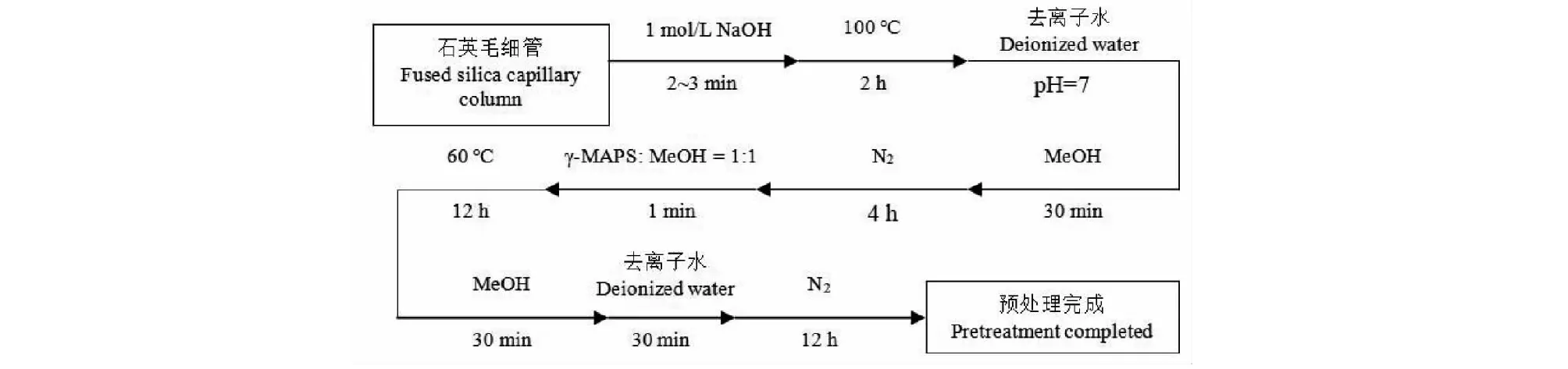
图1 熔融石英毛细管的预处理流程Fig.1 Pretreatment process of fused silica capillary column
1.3.2 Derived-BA的合成
Derived-BA通过23-HBA化学修饰合成得到。具体过程如下(见图2):将23-HBA(0.30 g,0.63 mmol)溶于12 mL干燥吡啶中,加入乙酸酐(1 mL),室温搅拌8 h;向反应液中加入25 mL乙酸乙酯,用10%稀盐酸调pH至4~5,分离有机层,用饱和食盐水洗涤(50 mL×3),无水硫酸钠干燥。过滤、浓缩,用V石油醚∶V乙酸乙酯= 10∶1的洗脱剂,通过硅胶(200~300目)柱层析分离得到白色泡沫状固体(0.32 g,91.4%),即为Derived-BA。EI-MS:m/z579.5 [M+Na]+;HR-ESI-MS:m/z579.365 2 [M+Na]+(calcd for 579.366 2,C34H52O6Na);1H NMR(400 MHz,CDCl3)δ:4.77(1H,s,H-29β),4.61(1H,s,H-29α),3.83(1H,d,J= 11.6 Hz,H-23β),3.68(1H,d,J= 11.6 Hz,H-23α),3.02(1H,m,H-3),2.06(3H,s,23-OAc),2.01(3H,s,3-OAc),1.95(1H,m,H-19),1.79(1H,m,H-18),1.69(s,3H,H-30),0.97(s,3H,H-26),0.93(s,3H,H-25),0.88(s,3H,H-24),0.80(s,2H,H-23);13C NMR(100 MHz,CDCl3)δ:40.6(t,C-1),23.1(t,C-2),74.5(d,C-3),40.6(s,C-4),56.3(d,C-5),17.9(t,C-6),36.9(t,C-7),42.3(s,C-8),50.5(d,C-9),38.0(s,C-10),20.9(t,C-11),21.1(t,C-12),38.3(d,C-13),46.9(s,C-14),30.6(t,C-15),32.1(t,C-16),65.4(s,C-17),49.2(d,C-18),48.0(d,C-19),150.3(s,C-20),29.6(t,C-21),34.3(t,C-22),29.6(q,C-23),14.5(q,C-24),16.0(q,C-25),16.5(q,C-26),12.8(q,C-27),181.5(s,C-28),19.3(q,C-29),109.7(t,C-30),171.0(s,C-1′),22.9(t,C-2′),170.6(s,C-1′′),22.6(t,C-2′′)。
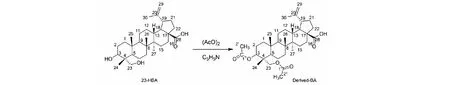
图2 Derived-BA的合成Fig.2 Synthesis of Derived-BA
1.3.3 EDA-BA的合成
3,23-O-二乙酰基-28-白桦酸胺乙基酰胺(EDA-BA)的合成方法如下(见图3):100 mL三口圆底烧瓶中分别加入Derived-BA(0.5 g,0.87 mmol)与乙二胺EDA(0.3 mL,5.4 mmol)混合于30 mL二氯甲烷中反应2 h,用V石油醚∶V乙酸乙酯= 4∶1的洗脱剂,通过硅胶柱层析得到白色泡沫状固体化合物EDA-BA(0.40 g,76.9%)。ESI-MS:m/z599.8 [M+H]+;1H NMR (400 MHz,CDCl3)δ:5.39(1H,s,H-1′),4.75(1H,s,H-29β),4.60(1H,s,H-29α),3.84(1H,d,J= 11.5 Hz,H-23β),3.68(1H,d,J= 11.5 Hz,H-23α),3.24(2H,t,H-2′),3.06(1H,m,H-3),2.39(1H,m,H-19),2.06(3H,s,23-OAc),2.01(3H,s,3-OAc),1.97(1H,m,H-18),1.68(3H,s,H-30),0.97(s,3H,H-26),0.87(s,3H,H-25),0.83(s,3H,H-24),0.74(s,3H,H-23);13C NMR(100 MHz,CDCl3,TMS)δ:40.5(t,C-1),23.1(t,C-2),74.4(d,C-3),40.5(s,C-4),55.6(d,C-5),17.9(t,C-6),36.9(t,C-7),40.7(s,C-8),50.6(d,C-9),38.0(s,C-10),20.8(t,C-11),21.1(t,C-12),39.3(d,C-13),42.4(s,C-14),30.6(t,C-15),32.10(t,C-16),65.4(s,C-17),48.0(d,C-18),46.8(d,C-19),150.6(s,C-20),29.6(t,C-21),34.3(t,C-22),29.6(q,C-23),13.0(q,C-24),14.5(q,C-25),16.5(q,C-26),12.8(q,C-27),171.0(s,C-28),19.3(q,C-29),109.3(t,C-30),170.9(s,C-1′),23.5(t,C-2′),170.6(s,C-1′′),23.1(t,C-2′′),39.8(t,C-1′′′),41.1(t,C-2′′′)。
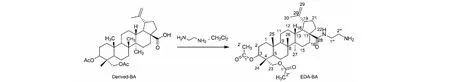
图3 EDA-BA的合成Fig.3 Synthesis of EDA-BA
1.3.4 整体柱poly(GMA-EDA-BA-co-EDMA)的制备
如图4所示,准确称量EDA-BA 9.7 mg、GMA 13.7 mg、Pro-OH 55.0 mg、BDO 45.0 mg,将反应混合液装入1 mL玻璃瓶中,超声混合均匀后放在60 ℃中反应1 h后加入EDMA与2.0 mg AIBN,将混合液超声脱气后灌入合适长度的预处理好的石英毛细管内,然后两端用硅胶塞封口,放入水浴60 ℃中反应12 h,有效长度18.0 cm;聚合完成以后用甲醇和水依次冲洗,去除相关未反应物、残留溶剂或其他可能低聚物。
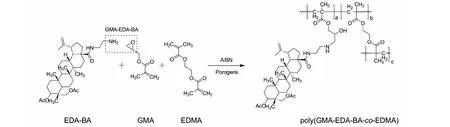
图4 poly(GMA-EDA-BA-co-EDMA)整体柱的制备Fig.4 Preparation of poly(GMA-EDA-BA-co-EDMA) monolithic column
1.3.5 色谱实验条件
流动相所用的溶剂均为色谱纯,样品溶剂为乙腈或者流动相;所有流动相使用前均超声脱气,并经过0.22 μm 滤膜过滤;检测波长为214、254以及280 nm。
2 结果与讨论
2.1 单体的合成
可聚合的衍生化白桦酸单体的合成如图3所示:以经过修饰的Derived-BA为原料,首先与乙二胺反应得到28位取代的EDA-BA。乙二胺的引入将形成一定链长的间隔臂,通过将乙二胺替换链长更长的丁二胺、己二胺均可以达到同样的效果,从而有望实现对间隔臂长度的控制;另外,由于牵涉含活泼氢化合物反应,反应之前对氨基化试剂乙二胺进行纯化也是影响本实验成败的关键内容之一。
由28位引入间隔臂是基于前期系统的构效关系研究,一般对28位的结构修饰将不会影响白桦酸衍生物的整体活性,这也提示了本研究方法需要基于对天然产物小分子的各个反应位点的构效关系探究。
在聚合过程中,EDA-BA容易与GMA 反应,得到28位取代的3,23-O-二乙酰基-28-甲基丙烯酸缩水甘油酯-白桦酸胺乙基酰胺单体(GMA-EDA-BA),然后直接与其他单体形成聚合物。此过程无需一一进行单体纯化,节省了GMA-EDA-BA单体的纯化时间、简化了反应步骤,凸显了“一锅法”的优越性。在此“一锅法”中,GMA还可被替换成其他含有活泼环氧基团并可发生开环反应的单体化合物,具有进一步拓展的空间。当目标天然产物小分子属于含活泼氢化合物时(如碱性化合物(如伯胺、仲胺、酰胺等)和酸性化合物(如羧酸、酚、醇等)),即可与环氧单体反应,然后进而与其它单体聚合形成聚合物,间接实现了天然产物小分子固定在相应的整体材料上,得到目标整体柱。可见,这种“一锅法”具有明确的广阔的适用范围和推广价值。
2.2 poly(GMA-EDA-BA-co-EDMA)整体柱的优化
优化步骤如前文所述,此处研究重点考察了在不同单体配比和不同生孔剂组成的条件下整体柱聚合的情况。EDA-BA能溶于甲醇、丙醇等,先后尝试了四种生孔剂系统:一元生孔剂MeOH、二元生孔剂MeOH/DMSO、MeOH/H2O、Pro-OH/BDO。结果表明以MeOH为生孔剂时,柱子聚合不均匀,出现脱壁的现象;以二元溶剂系统MeOH/DMSO、MeOH/H2O为生孔剂时,单体没有键合至毛细管内壁,证明三个生孔剂系统均功能性单体不能完全溶解,故得不到致密的聚合物;将生孔剂系统调整为Pro-OH/BDO(1∶1)后,可以保证所有单体的溶解度并最终得到孔道均匀致密的聚合物。考虑到 EDA-BA/GMA之间的作用情况,调节两者之间的比例,结果表明EDA-BA/GMA的质量比约为5∶7时聚合情况最为理想。进一步优化单体和交联剂的比例,如表1所示,B3为制备柱的最优条件。
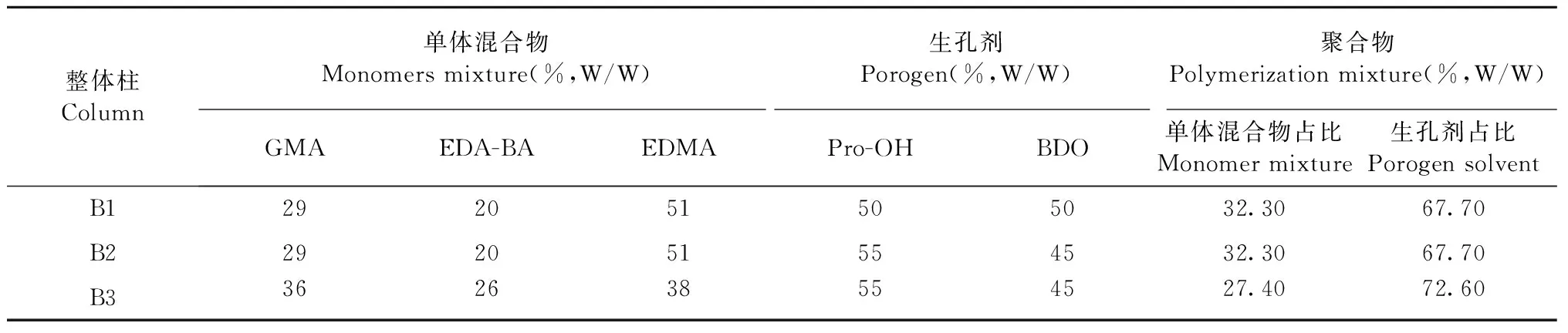
表1 制备 poly(GMA-EDA-BA-co-EDMA)整体柱的配比优化Table 1 Compositions of the polymerization mixtures used for the preparation of poly(GMA-EDA-BA-co-EDMA) monolithic columns and their porosities
2.3 poly(GMA-EDA-BA-co-EDMA)整体柱的表征
2.3.1 通透性的测试
通透性(K)是液相色谱柱一个很重要的参数,一般而言,K值可以通过液相色谱的方法,采用乙腈、水、甲醇等作为流动相,依据Bristow and Knox方程测得[11]:
其中u代表流动相的线性速度,η代表流动相的粘度[12],L代表柱子的色谱柱的有效长度,ΔP代表色谱柱背压。
如表2所示,在不同的流动相作用下,K值始终在一个数量级上面,这说明整体柱在不同极性强度的流动相体系下没有明显发生溶胀或皱缩,表明整体柱的骨架稳定。如表2所示,在不同的流动相作用下,K值始终在一个数量级上面,这说明整体柱在不同极性强度的流动相体系下没有明显发生溶胀或皱缩,表明整体柱的骨架稳定[12]。

表2 整体柱 poly(GMA-EDA-BA-co-EDMA)的通透性Table 2 Permeability of the poly(GMA-EDA-BA-co-EDMA) monolithic column
2.3.2 机械强度
采用微径液相色谱的方法,考察在不同的流动相条件下,线性流速与背压的关系。本文实验分别选择了水、乙腈/水(80∶20,V/V)作为流动相,考察在不同的流速条件下,线性流速与柱压的关系。实验结果显示,线性流速与柱压具有良好的线性关系(R2>0.99),表明poly(GMA-EDA-BA-co-EDMA)具有良好的机械强度(见图5)。
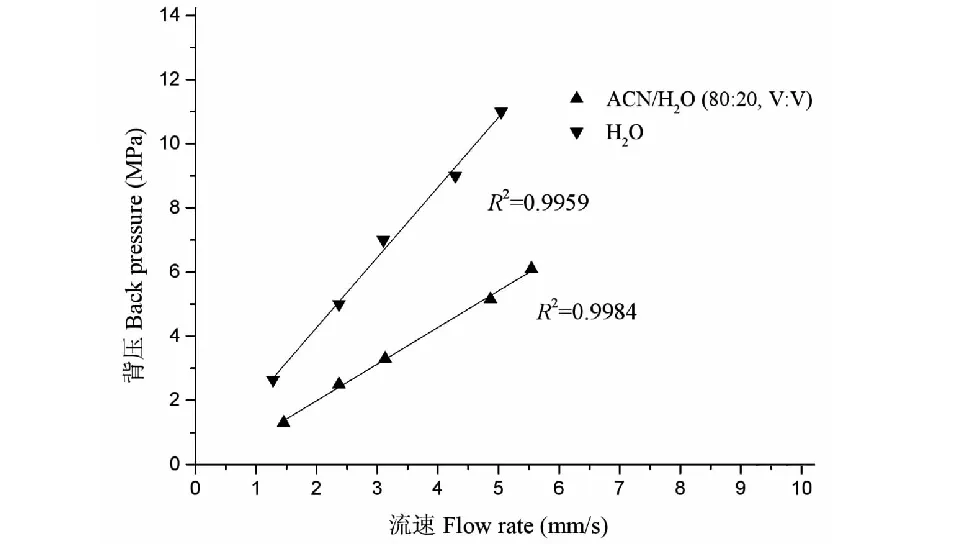
图5 线性流速与背压的关系Fig.5 The relationship between linear flow rate and backpressure
2.3.3 重现性
采用微径液相色谱的方法,测试标准样品保留时间或者保留因子的RSD值。反相色谱评价常选用乙腈/水体系,检测波长为254 nm(在此波长下乙腈等无紫外吸收)。本实验采用乙腈/水(50∶50,V/V)作为流动相,标准物为硫脲(thiourea)、邻苯二甲酸二甲酯 (dimethylphthalate)、苯甲醚(anisole)、萘(naphthalene),如下表3所示,各项保留因子的RSD均小于5%,表明重现性良好。
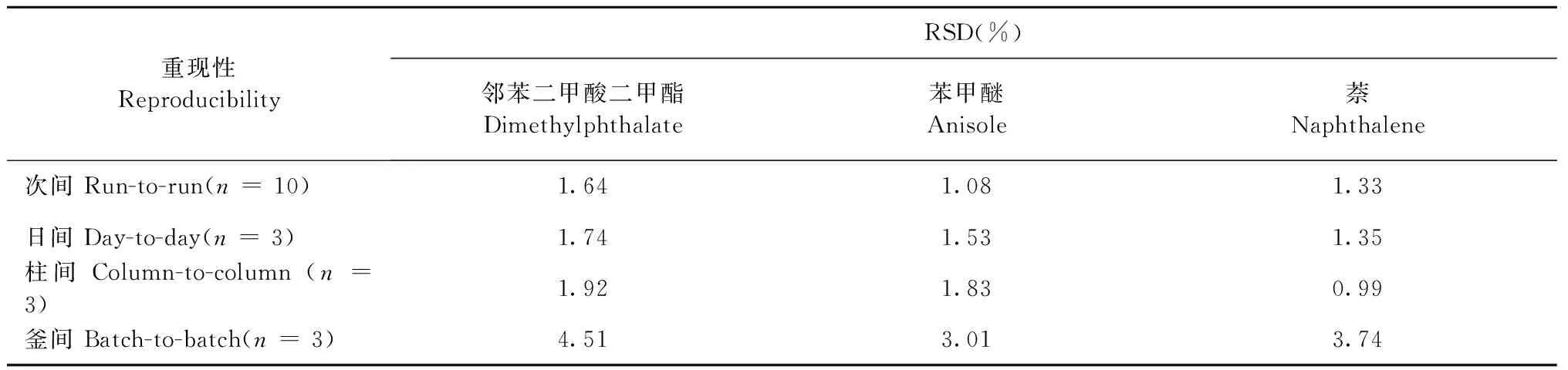
表3 poly(GMA-EDA-BA-co-EDMA)整体柱的保留重现性Table 3 Reproducibility of the poly(GMA-EDA-BA-co-EDMA) monolithic column
此处以硫脲为死时间标记物,四种组分均为中性物质,其中硫脲极性最强,邻苯二甲酸二甲酯和苯甲醚次之,萘极性最弱,用来衡量色谱柱的柱效,洗脱次序是硫脲、邻苯二甲酸二甲酯、苯甲醚、萘(见图6)。
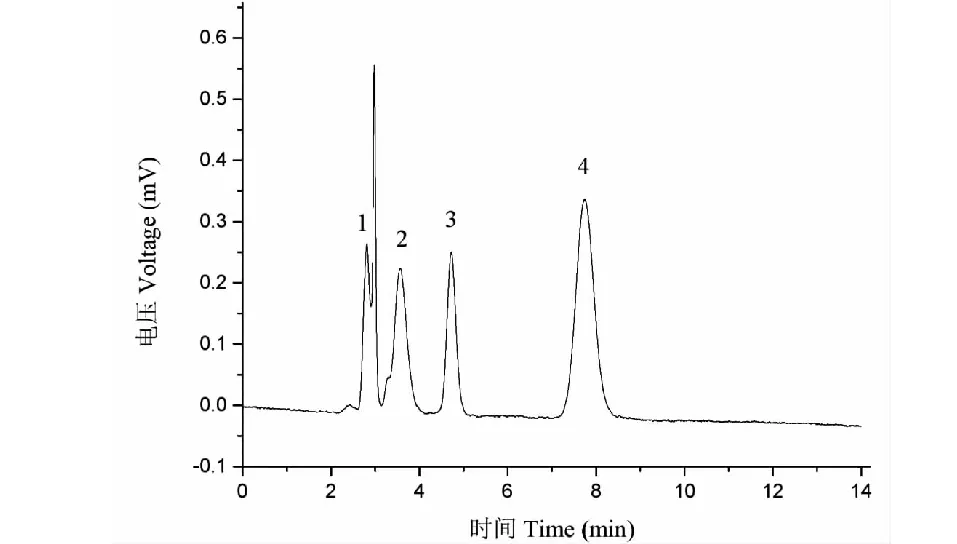
图6 poly(GMA-EDA-BA-co-EDMA)整体柱分离四个反相标样Fig.6 Separation of a test mixture on poly(GMA-EDA-BA-co-EDMA) monolithic column.注:分离条件:流动相为乙腈/水(50/50,V/V);流速为600 nL/min;进样量为20 nL;检测波长为214 nm;样品依此为:1.硫脲;2.邻苯二甲酸二甲酯;3.苯甲醚;4.萘。Note:Conditions:ACN/H2O (50/50,V/V);Flow rate:600 nL/min;Injection volume,20 nL;Detection wavelength:214 nm.Samples:1.Thiourea;2.Dimethylphthalate;3.Anisole;4.Naphthalene.
2.3.4 元素分析
为了考察poly(GMA-EDA-BA-co-EDMA)整体柱的实际组成,对其聚合物组成进行了元素分析测试。其中,C、O、H和N的含量分别是72.20%、13.36%、9.76%和4.68%,已知聚合物中N元素仅由EDA-BA分子提供,由此可确认白桦酸成功键合到固定相上。由此可见,结果均说明“一锅法”原位聚合制备的小分子天然产物键合的整体柱是可行而且可靠的,并有望应用于其他小分子药物、化合物及天然产物等制备对应的整体柱。
2.3.5 扫描电镜
如前所述,整体柱的微观结构同样通过扫描电子显微镜的方法获得。图7所示为表1中B3整体柱横切面的扫描电镜图。整体柱孔状结构明显,虽然聚合没有很紧密,但疏松的结构有助于下一步的应用。

图7 poly(GMA-EDA-BA-co-EDMA)整体柱的扫描电镜Fig.7 SEM photographs of poly(GMA-EDA-BA-co-EDMA) monolith
2.4 poly(GMA-EDA-BA-co-EDMA)的作用机理
有机聚合物整体柱poly(GMA-EDA-BA-co-EDMA)中的主要功能单体BA是五环三萜类化合物,从其化学结构可以初步推断该整体柱的主要分离机理,尤其从EDA-BA的化学结构可知,由于其是典型的五环三萜类化合物,同时疏水性乙酰基取代可提供游离氢的亲水性羟基,导致其主要表现为反相色谱的保留机制,而其28位上的氨基由于可以提供游离氢,提示可能存在微弱的亲水作用机理。
采用微径液相色谱的方法,测定poly(GMA-EDA-BA-co-EDMA)的保留机理。分离条件:柱尺寸为220 mm × 100 μm I.D.;流动相为 ACN/H2O;检测波长为214 nm;流速为600 nL/min;进样量为20 nL。以非极性化合物甲苯和极性化合物硫脲为测试化合物,乙腈、水为流动相。通过改变流动相中乙腈的含量,考察甲苯和硫脲的保留时间的变化。如图8所示,对于强极性的化合物硫脲,在反相 HPLC条件下通常作为死时间标记物,在poly(GMA-EDA-BA-co-EDMA)整体柱上,当乙腈的含量从30%增至50%时,硫脲的保留时间基本不变,而甲苯的保留时间显著降低;当乙腈的百分含量大于50%时,硫脲的保留时间有轻微的增长,甲苯的保留时间则有渐渐减少;两者的保留时间在乙腈的百分含量为80%~90%处交汇。实验结果表明poly(GMA-EDA-BA-co-EDMA)整体柱主要表现为反相作用机理。
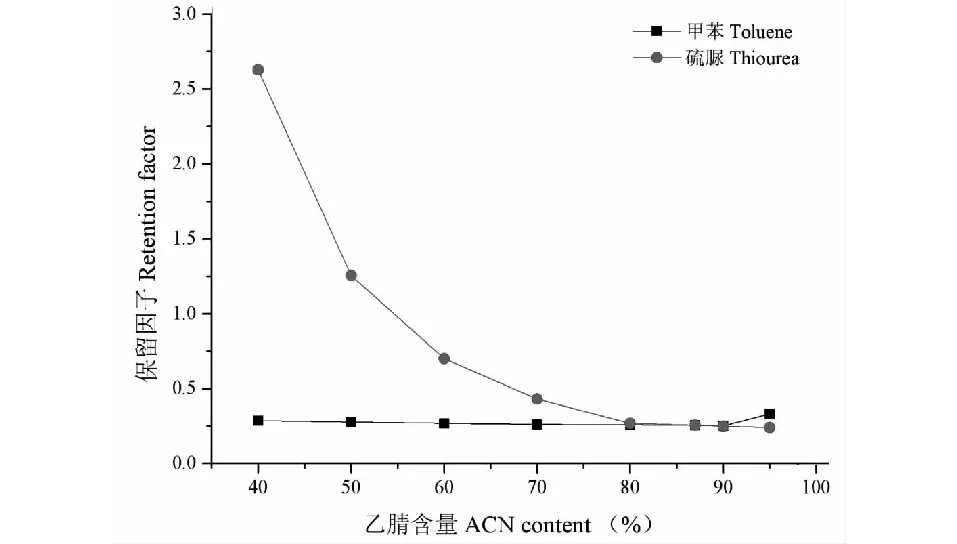
图8 poly(GMA-EDA-BA-co-EDMA)整体柱上乙腈含量与保留时间的关系Fig.8 Influence of ACN concentration on retention time on poly(GMA-EDA-BA-co-EDMA) monolithic column
2.5 poly(GMA-EDA-BA-co-EDMA)整体柱的应用
通过将不同类型常见蛋白与酶注入整体柱中,若形成明显的色谱保留,则提示整体柱对该类别蛋白的选择性。分离条件:缓冲液buffer A为Tri/HCl(25 mmol/L,pH 6.5),缓冲液buffer B为NaCl(50 mmol/L,pH 6.5);洗脱程序为0~8 min buffer A,8~20 min buffer B,20~25 min buffer A;流速为1 000 nL/min;检测波长为280 nm。由图9可见,当流动相为Tri/HCl缓冲盐(pH 6.5)时,多种蛋白包括胰蛋白酶(trypsin)、牛血清白蛋白(bovine albumin,BSA)、人血清白蛋白(human serum albumin,HSA)以及细胞色素C(cytochrome C)等在整体柱poly(GMA-EDA-BA-co-EDMA) 上未见显著保留,几乎都在死时间出峰;当流动相为强盐NaCl缓冲盐时,亲和作用力被破坏,α-葡萄糖苷酶(α-glucosidase)才开始出峰,在该色谱柱上形成了明显保留,提示其被整体柱特异性识别。文献调研发现,BA在治疗糖尿病上表现出良好功效,其中主要通过抑制α-淀粉酶和α-葡萄糖苷酶,从而减少多糖的水解和促进糖原合成来实现作用效果[13,14],由此提示,BA可能与α-葡萄糖苷酶形成亲和作用关系,进而获得明显的色谱保留效果。本研究为此整体柱的作用机制探索提供了可参考的科学依据,但在实际样品中的具体应用尚需要在后续工作中进一步推进。

图9 poly(GMA-EDA-BA-co-EDMA) 整体柱对不同蛋白的保留Fig.9 Comparison of interaction of poly(GMA-EDA-BA-co-EDMA) monolithic column with various proteins
3 结论
本文中对一种固定化天然产物小分子的亲和色谱柱制备方法进行探索,首先在基本不影响活性的28位上进行修饰,合成了带有活泼乙二胺基团的EDA-BA功能性单体(配体),与其他单体及交联剂通过“一锅法”制备 poly(GMA-EDA-BA-co-EDMA)的整体色谱柱。本研究的核心在于开发具有推广价值的固定化天然产物小分子的亲和色谱柱制备方法。“一锅法”在制备效率上具有很大的优势,不仅节省时间、减少单体化合物的纯化耗费,同时也保持了色谱柱的亲和作用力。不过,功能性单体(配体)的商业化程度的高低,决定了方法的进一步推广价值;就目前而言,还需要根据每一个小分子进行衍生化设计,存在一定的不足。至于该亲和色谱柱在复杂体系的实际应用以及推广,需在后续实验中进一步进行研究。
天然产物一直是新药发现的重要来源,将天然产物固定化制备对应的亲和色谱柱有助于天然产物的开发,因此成为了研究热点之一。本文为寻找和研究天然产物的靶点蛋白建立一种快速、有效、可行的方法;同时,也为探索小分子天然产物与不同靶标的作用,提供了重要的研究方法和研究平台,有望得到进一步的应用与推广。
