黄连种子内生细菌的分离鉴定及功能验证
2023-03-15向益青廖海浪钟芙蓉彭茂瑶马云桐
向益青,廖海浪,李 娜,钟芙蓉,彭茂瑶,马云桐*
1西南特色中药资源国家重点实验室;2成都中医药大学药学院,成都 611137;3四川省农业科学院经济作物育种栽培研究所,成都 611300
种子是植物的重要繁殖器官,在种质资源保存和农业生产中具有重要意义。种子内生菌与种子关系紧密,存在于种子的不同部位(种皮、胚、胚乳)以及种子的整个生长发育阶段[1]。不同来源种子中微生物分类群之间高度重叠,种子内发现的内生菌分属4门131属[2],其中变形菌门和γ-变形菌门是不同种子内的优势类群,而芽孢杆菌属、假单胞菌属、类芽孢杆菌属、微球菌属、葡萄球菌属、泛菌属等在不同植物种子内最为常见。丹参[3]、水稻[4]、紫花苜蓿[5]等种子内生菌种类丰富,携带大量功能基因,并通过直接或间接作用促进种子发育。种子内生菌具有多种与种子发育和萌发相关的生理功能,通过固氮、溶磷、产生植物激素、ACC 脱氨酶、产生铁载体、促进营养物质吸收等促进种子发育和植物生长[6],以及产生抗生素、产生水解酶(果胶酶、淀粉酶、纤维素酶等)、诱导防御机制等促进种子内部物质转化[7]、降低生物或非生物胁迫对植物的危害[8]。
黄连CoptischinensisFranch.为毛茛科黄连属多年生草本植物,以干燥根茎入药,是许多中成药的原料之一,人工栽培面积大。然而,黄连种子具有形态和生理后熟特性,自植株上脱落后需经历9个月的变温层积才能成熟萌发,且发芽率低;在贮藏中不耐脱水[9],给种子保存和质量控制以及黄连引种栽培等带来困难,进而影响药材产量和品质。课题组前期宏基因组研究发现,黄连种子具有丰富的内生菌,其可能参与氧化磷酸化、三羧酸循环、磷酸戊糖、糖酵解-糖异生等途径,这些途径与种子发育及植物生长联系密切,推测微生物在黄连种子后熟和萌发过程中可能发挥作用。
为深入挖掘黄连种子促生内生菌,本研究从黄连种子中通过平板分离获得可培养内生菌,16S rRNA对黄连种子内生菌进行鉴定,对获得的菌株进行溶磷、固氮和产IAA等促生特性测定,结合种子萌发实验进行内生菌促生功能验证。以期筛选有益于种子后熟和萌发的内生菌,旨在为揭示植物内生菌的促生机制和顽拗性种子后熟与萌发机制提供一定的理论依据,同时也为新型、高效的微生物菌肥的研究与开发奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验材料
黄连种子于2020年5月采自四川省峨眉山市龙池镇富有村黄连种植基地(E103.286,N29.454),经成都中医药大学马云桐教授鉴定为毛茛科植物黄连(CoptischinensisFranch.)的健康种子。采回种子保存于经灭菌处理后的湿润细沙中后熟,于2020年12月取后熟完成后的种子为本次实验材料。
1.1.2 供试培养基
内生细菌分离培养基:LB培养基,R2A培养基;溶磷实验培养基:以Ca3(PO4)2为磷源的无机磷培养基:PVK培养基[10](Pikovskaya medium),NBRIP培养基[11](National Botanical Research Institute′s phosphate growth medium),以植酸钙为磷源的有机磷培养基:植酸钙培养基[12];固氮实验培养基:Ashby无氮培养基[13];产铁载体实验培养基:CAS培养基[14](chrome azurol S assay medium)。
1.2 方法
1.2.1 黄连种子可培养内生细菌的分离纯化
取2 g黄连种子用清水洗净用75%乙醇浸泡30 s,然后用无菌水清洗2~3次,用2% NaClO溶液处理10 min,再用无菌水清洗5~8次,取最后一次清洗种子的无菌水20 μL涂布于培养基上,用于检测消毒是否彻底。接种内生细菌采用稀释涂布平板法,将表面消毒的种子取1 g放入已灭菌的研钵中再加入2 mL无菌水研磨,在将研磨后的液体稀释为1×10-1~1×10-7,涂布于LB和R2A培养基上,每种培养基3个重复,37 ℃倒置培养48 h。待分离培养基上单菌落长出后,在相应的新鲜平板上进行划线纯化,在37 ℃恒温培养箱中黑暗倒置培养48 h后,选择单菌落接种到相应的斜面培养基中(依次编号为ZZ-1~ZZ-X),待菌落长出后,放置于4 ℃冰箱中保存。
1.2.2 种子内生细菌的16S rRNA鉴定
采用16S rRNA方法对黄连种子内生菌进行分子生物学鉴定。按照细菌基因组DNA 提取试剂盒说明书提取分离菌株DNA,采用通用引物27F(5′-AGTTTGATCMTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACT-3′)(引物由北京擎科生物有限成都分公司合成)对提取的内生细菌DNA进行PCR扩增。50 μL PCR扩增体系:1×TSE101mix 45 μL,上下游引物各2 μL,DNA模板1 μL。PCR扩增程序:98 ℃预变性3 min,98 ℃变性3 min,55 ℃退火10 s,72 ℃延伸10 s,循环数为39次,72 ℃充分延伸5 min,4 ℃停止反应。1%的琼脂凝胶糖电泳检测PCR扩增产物。将合格的产物送至北京擎科生物有限成都分公司测序。获得的序列拼接后再用BLAST软件在线(https://www.ncbi.nlm.nih.gov/)进行同源性比对,确定各分离菌株分类地位。菌株间的进化树和聚类分析使用建树软件MAGE 7完成,比对方法clustal W,建树方法Maximum Likelihood,设定bootstrap为1 000。
1.2.3 黄连种子内生细菌功能研究
溶磷功能研究:待测菌株在LB培养基上活化,取直径约0.5 cm的菌盘接种于PVK培养基、NBRIP培养基和植酸钙培养基上,每株重复3次,37 ℃培养7 d。观察有无溶磷圈产生,以接种直径约0.5 cm的空白LB培养基为对照组。
固氮功能研究:待测菌株在LB培养基上活化,取直径约0.5 cm的菌盘接种于Ashby无氮培养基,37 ℃培养7 d,观察其生长情况和菌落周围是否出现透明圈,如出现透明圈则该菌株具有固氮能力,以接种直径约0.5 cm的空白LB培养基为对照组。
产铁载体功能研究:待测菌株在LB培养基上活化,取直径约0.5 cm的菌盘接种于CAS培养基,37 ℃培养7 d,观察其生长情况,观察菌落周围是否出现黄色圈,如出现黄色圈则该菌株具有产铁载体功能,以接种直径约0.5 cm的空白LB培养基为对照组。
产IAA功能定性测定:参考Liu等[15]的方法将供试菌株接种于100 mL LB液体培养基(加入0.5 g/L色氨酸)。置于30 ℃摇床,180 r/min 震荡培养4 d。取菌悬液10 000 r/min离心5 min,取离心后上清液1 mL于10 mL EP管中,同时加4 mL比色液(30 mL浓H2SO4,1.5 mL 0.5 mol/L FeCl3,50 mL蒸馏水),标准对照在比色液中加入1 mL 50 mg/L的吲哚乙酸标准品,空白对照加入1 mL LB液体培养基和4 mL比色液。所有EP管于室温避光放置30 min后观察,颜色变红者表示能够分泌IAA,依据颜色变化分为深红、粉红和微红及无颜色变化4个等级。
产IAA功能定量测定:供试菌株培养条件同上。然后将菌悬液10 000 r/min离心5 min,取上清液1 mL加入4 mL比色液,避光静置30 min,于530 nm下比色,记录OD值。标准曲线的绘制采用分析纯的IAA梯度稀释制备,以OD值为纵坐标,IAA浓度为横坐标,代入上述样品OD值,计算内生菌产生IAA的量。
1.2.4 黄连种子内生细菌促生功能的验证
选择IAA分泌量超过100 mg/L的细菌作为实验菌株,所选菌种接种于LB液体培养基,37 ℃,180 r/min培养24 h。调节菌悬液浓度为1×108CFU/mL,种子表面消毒后用菌悬液浸泡1 h,对照组用无菌水浸泡1 h,再接种于琼脂糖培养基上,每个平板20粒种子,每种细菌3个重复。每3 d观察一次,记录种子发芽(以种子裂口且长出1 cm的芽为标准)情况,连续观察15 d。内生细菌对种子萌发的影响按以下公式计算。
发芽率=
(15 d种子发芽数/种子总数)×100%
(1)
发芽势=
(前3 d发芽种子数/种子总数)×100%
(2)
1.2.5 数据处理
用Excel 2018软件计算平均值和标准差,用SPSS 26软件进行单因素方差分析比较组间差异,以P<0.05为差异有统计学意义。
2 结果与分析
2.1 黄连种子内生细菌分离纯化及分子生物学鉴定
从黄连种子中共分离得到细菌57株(编号为ZZ-1~ZZ-57),其中29株可培养菌株(编号见表1)通过16S rRNA基因序列比对成功,分别属于厚壁菌门、变形菌门和拟杆菌门中的芽孢杆菌属Bacillus、变杆菌属Metabacillus、赖氨酸芽胞杆菌属Lysinibacillus、普里斯特氏菌属Priestia、寡养单胞菌属Stenotrophomonas、微杆菌属Microbacterium、无色杆菌属Achromobacter、类芽孢杆菌属Paenibacillus、泛菌属Pantoea、假芽孢杆菌属Fictibacillus、欧文氏菌属Erwinia、黄杆菌属Flavobacterium、布鲁菌属Brucella。其中分离得到的芽胞杆菌属和寡养单胞菌属菌株最多,各占总鉴定菌株的24.14%。
2.2 黄连种子内生细菌功能研究
2.2.1 溶磷特性
对29株黄连种子内生细菌进行溶磷特性测定(见表1),所有菌株在PVK培养基上均无透明圈形成;在NBRIP培养基上菌株ZZ-24菌落周围形成透明圈,表明其可降解无机磷;菌株ZZ-22和ZZ-24在以植酸钙为底物的培养基上形成透明圈,表明ZZ-22和ZZ-24具有溶有机磷能力;ZZ-7等27株细菌在NBRIP培养基和植酸钙培养基上均无溶磷圈形成,说明其无溶磷能力(见图1)。
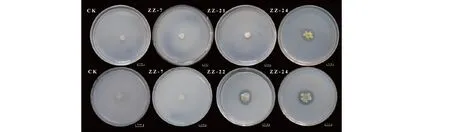
图1 黄连种子内生菌溶磷特性(比例尺:1 cm) Fig.1 Phosphorus-dissolving characteristics of endophytic bacteria strains from seeds of C.chinensis (scale:1 cm)注:上排为NBRIP培养基,下排为植酸钙培养基。Note:The top row is NBRIP medium,the bottom row is calcium-phyticacids medium.

表1 可培养菌株促生长特征Table 1 Growth-promoting characteristics of cultivable strain
2.2.2 固氮特性
对29株黄连种子内生细菌进行固氮功能研究(见表1),结果显示有9株内生细菌(ZZ-23、ZZ-26、ZZ-30、ZZ-36、ZZ-37、ZZ-38、ZZ-39、ZZ-44、ZZ-51)在Ashby无氮培养基上形成大小不一的透明圈(见图2),表明其具有固氮能力;ZZ-11和ZZ-21等20株细菌在Ashby无氮培养基无透明圈形成,则其无固氮能力。

图2 黄连种子内生菌固氮特性(比例尺:1 cm) Fig.2 Nitrogen-fixing characteristics of endophytic bacteria strains from seeds of C.chinensis (scale:1 cm)
2.2.3 产铁载体特性
对29株黄连种子内生细菌进行固氮功能研究(见表1),结果显示菌株ZZ-4、ZZ-22在CAS培养基上出现黄色晕圈,表明ZZ-4和ZZ-22有产铁载体的作用(见图3);ZZ-6等27株细菌在CAS培养基上未出现黄色晕圈,表明其无产铁载体能力。

图3 黄连种子内生菌产铁载体特性(比例尺:1 cm) Fig.3 Siderophore production by endophytic bacteria strains from seeds of C.chinensis (scale:1 cm)
2.2.4 产IAA特性
对29株黄连种子内生细菌进行IAA测定(见表1),菌株ZZ-4、ZZ-6、ZZ-11、ZZ-21、ZZ-24和ZZ-29细菌菌液和比色液反应成不同程度的红色,说明其具有产IAA能力(见图4)。测定以上6株细菌所产IAA含量,其产量分别是66.90、103.25、64.52、166.90、203.57、177.86 mg/L,产量最高的是菌株ZZ-24,最低是菌株ZZ-11,其中菌株ZZ-6、ZZ-21、ZZ-24和ZZ-29的IAA产量超过100 mg/L。

图4 黄连内生菌产IAA特性 Fig.4 Production of indoleacetic acid by endophytic bacteria strains from seeds of C.chinensis
2.3 功能菌株16S rRNA分析
通过16S rRNA序列比对获取29株黄连种子内生细菌及与其相似性高的同源菌株(见表2),基于16S rRNA序列构建的发育系统树如图5所示。结果表明,ZZ-4菌株与Ba.toyonensisstrain FORT 02的序列聚于一支且序列相似性达100%;ZZ-22菌株与Ba.subtilisstrain GUCC 8聚为一支,相似度为100%;ZZ-24菌株与Pr.megateriumstrain 5A1-13相似度为100%,一般认为16S r RNA基因序列相似性≥97%的原核生物为同一个种[16],因此,将既能产铁载体又产IAA的ZZ-4菌株鉴定为Ba.toyonensis;将既具有溶磷功能又产铁载体的ZZ-22菌株鉴定为Ba.subtilis;将既能溶磷又可分泌IAA的ZZ-24菌株鉴定为Pr.Megaterium。ZZ-21和ZZ-29菌株与A.spaniusstrain F20Cu-1聚于一支且序列相似性都超过99%,故将具有产IAA能力的ZZ-21和ZZ-29菌株鉴定为A.spanius。ZZ-6菌株与L.fusiformisstrain ZLynn800-25聚为一支,ZZ-11与Me.niabensisstrain LewisBac8聚为一支,相似性分别为99.93%、99.78%,因此将ZZ-6和ZZ-11菌株鉴定为L.fusiformis、Me.niabensis。ZZ-36、ZZ-37、ZZ-38、ZZ-39均被鉴定为S.rhizophila,且都具有固氮能力。菌株ZZ-23、ZZ-26、ZZ-30、ZZ-44、ZZ-51都具有固氮能力分别与Ba.amyloliquefaciensstrain JX-6、Ba.toyonensisstrain WS2-2、Ba.amyloliquefaciensstrain LE7、Br.Thiophenivoransstrain DSM 7216、Er.Billingiaestrain LMG 2613相似度为100%、99.93%、100%、99.92%、99.86%,其被鉴定为:Ba.amyloliquefaciens、Ba.toyonensis、Ba.amyloliquefaciens、Br.thiophenivoran、Er.Billingiae。

图5 16S rRNA系统发育进化树Fig.5 Phylogentic tree based on 16S rRNA

表2 内生细菌16S rRNA基因序列与NCBI数据库比对结果Table 2 Comparison of 16S rRNA gene sequence of endophytic bacteria with NCBI
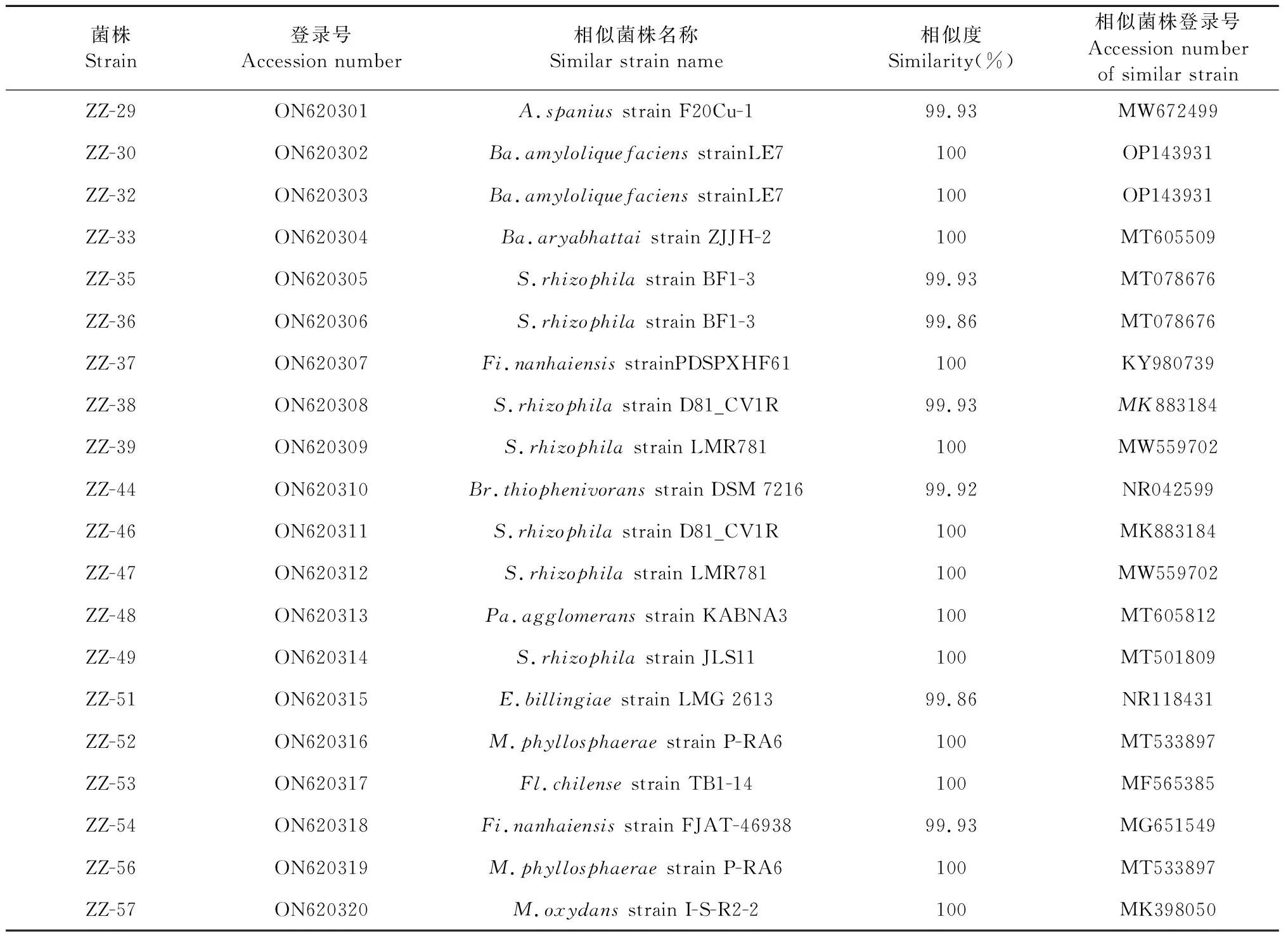
续表2(Continued Tab.2)
2.4 产IAA内生细菌促生长功能验证
为验证产IAA内生菌的促生长功能,用IAA产量超过100 mg/L的内生细菌(ZZ-6、ZZ-21、ZZ-24、ZZ-29)菌液处理黄连种子,结果见表3,其中ZZ-24和ZZ-29菌株对发芽率有显著促进作用,与对照组相比分别提高13.34%和10%。ZZ-24和ZZ-29对种子的发芽势有较显著的影响,菌株ZZ-6和ZZ-21与对照组相比无显著影响。
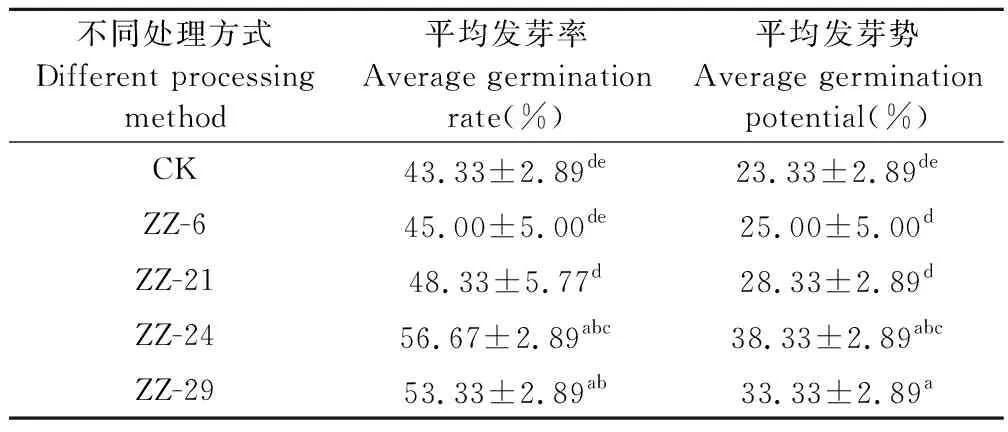
表3 不同内生细菌对种子萌发的影响Table 3 Effects of different endophytic bacteria on seed germination
3 讨论与结论
Truyens等[2]发现在不同植物的种子中芽孢杆菌属和假单孢杆菌属为优势类群,同时类芽孢杆菌属、微球菌属、葡萄球菌属、泛菌属和不动杆菌属在种子内生菌中也十分常见。本研究以黄连种子为对象,共分离鉴定出29株分布于13个属的内生细菌,其中优势菌为芽孢杆菌属和寡养假单孢杆菌属。促生特性研究表明黄连种子内生菌具有产IAA、溶磷、固氮和产铁载体的功能,其中部分内生细菌同时具有多种促生功能,如Ba.toyonensisZZ-4能产IAA和铁载体,Pr.megateriumZZ-24能产IAA并具有溶磷功能。种子萌发实验进一步验证具有促生功能的黄连种子内生细菌多分布于芽孢杆菌属。Gagne-Bourgue等[17]的研究结果表明芽胞杆菌具有产IAA、细胞分裂素和溶磷特性,Lu等[18]测定出亳菊中的巨大芽孢杆菌BN7能够解磷、解钾和产IAA。因此,芽孢杆菌属可能在黄连种子后熟和萌发过程中发挥重要作用,在农业生产中具有较大的开发利用价值。
磷在土壤中大致以不溶性的无机磷和有机磷形式存在,仅小部分磷溶于土壤中可以被植物吸收利用[19],植物中具有溶磷能力的内生菌可将难以被植物吸收的磷转为易吸收的形式,从而促进植物生长发育[20]。Xie等[21]从植物根际土中分离得到的PseudomonasbrassicacearumH9 具有较高解磷活性的细菌,其菌悬液对小麦种子和黄瓜种子的萌发具有显著促进作用。此外,种子萌发和幼苗生长受IAA的调控,适量的外源IAA可以促进种子萌发和植物根部发育[22];Xu等[23]从番茄种子和水稻种子中分离出3株能产IAA的内生细菌,其在番茄、水稻、油菜和萝卜等植物的根、茎、叶中定殖,并对幼苗有不同程度的促生长作用。Khalaf等[24]从瓜类种子中得到56株可以分泌生长素的内生细菌,其中芽孢杆菌属和肠杆菌属为优势属。田菁种子中可产生生长素内生细菌的IAA分泌量范围是1.29 ~25.47 mg/L,Ba.velezensisSC60 IAA产量最高,且显著促进胚根发育和提高种子活力[25]。本实验获得6株可分泌IAA的内生细菌,其中ZZ-6、ZZ-21、ZZ-24、ZZ-29分泌量超过100 mg/L,且既能溶磷又高产IAA的Pr.megateriumZZ-24对黄连种子的促生效果显著。进一步的种子内生菌多种促生特性的探索和多功能内生菌的挖掘有助于解析内生菌在种子发育与萌发过程中的作用机制。
黄连种子中存在多种促生内生细菌,优势菌多分布于芽孢杆菌属,既能溶磷又高产IAA的Pr.megateriumZZ-24对黄连种子有较好的促生能力,表明其具有潜在的研究和开发利用潜力。具有多种促生能力的内生菌可能在黄连种子长时间的后熟过程中发挥作用,可能是黄连种子能够完成后熟并成功萌发的重要因素。
