基于网络药理学和实验验证探讨光甘草定治疗去势抵抗性前列腺癌的作用机制
2023-03-15谭武宾蒋湘勇李铁求
谭武宾,周 松,康 海,蒋湘勇,毛 正,杨 科,李铁求*
1湖南省人民医院(湖南师范大学附属第一医院),长沙 410002;2长沙县人民医院(湖南省人民医院星沙院区),长沙 410100
前列腺癌(prostate cancer,PCa)是老年男性生殖系统肿瘤中最常见的恶性肿瘤,许多早期对雄激素剥夺治疗有效,但大多数终将从激素敏感性前列腺癌进展为去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC)[1,2]。CRPC是一种致死率较高、且具有高度侵袭性的前列腺癌,有超过84%的CRPC患者会发生转移,其生存中位数只有20个月左右[3,4]。虽然近几年新型化疗药、内分泌药物的出现,但这些化疗药物存在诸多副作用,且内分泌药物存在耐药的问题,使得药物作用时间缩短。因此,寻找新的药物对延缓去势抵抗的过程以及治疗CRPC具有重要意义。
光甘草定(glabridin)是一种从甘草中提取出的异黄酮类化合物,具有广泛的生物学活性,如抗炎、抗氧化、抗肿瘤、神经保护、抗骨质疏松症等[5]。据报道,光甘草定在乳腺癌中[6]、肝癌[7]、胃癌[8]、宫颈癌[9]中表现出良好的抑制肿瘤细胞增殖、诱导凋亡的作用。然而,光甘草定对CRPC的分子机制尚未完全明确。网络药理学是依托系统生物学,将药理学、计算机科学和信息网络相结合的方式,为复杂疾病的药物发现和选择提供了新的思路[10]。为进一步探究光甘草定对CRPC的作用机制,我们采用网络药理学、分子对接以及细胞实验的方法探讨其作用机制,为今后的药物基础研究和临床应用提供参考。
1 材料与方法
1.1 药物治疗靶点的预测
利用多个中药数据库尽可能全面收集光甘草定治疗靶点,截止时间为2021年10月25日,在HERB数据库(http://herb.ac.cn/)、TCMIO数据库(http://tcmio.xielab.net/)、TCMSP数据库(https://tcmsp-e.com/)输入“Glabridin”收集靶点,在PharmMapper数据库(http://www.lilab-ecust.cn/pharmmapper/index.html)中上传光甘草定的mol2格式文件,选择“Human Protein Targets Only (v2010,2241)”预测治疗靶点,在BATMAN-TCM数据库(http://bionet.ncpsb.org.cn/batman-tcm/index.php/Home/Index/index)中输入光甘草定的“PubChem_CID/InChI”进行预测,收集“Score cutoff>= 20”的预测靶点,在Swiss Target Prediction数据库(http://www.swisstargetprediction.ch/)输入光甘草定的“SMILES”预测治疗靶点,利用Uniprot数据库(https://www.uniprot.org/)进行靶点的校正并去重。
1.2 疾病相关基因的收集
在DisGeNET数据库(https://www.disgenet.org/)中输入关键词“castration resistant prostate cancer”,去除重复靶基因后收集CRPC相关的靶基因。随后,利用韦恩图工具(http://bioinformatics.psb.ugent.be/webtools/Venn/)将光甘草定治疗靶点映射到CRPC靶基因中获得药物-疾病共同靶点。通过建立各靶点节点、类型文件,依次输入到Cytoscape 3.7.2软件中构建药物-靶点-疾病网络图。
1.3 蛋白互作网络分析及核心靶点的筛选
将以上共同靶点蛋白输入到“STRING”数据库(https://string-db.org/)中,Organism选择“Homo sapiens”,最低交互分数“minimum required interaction score”设置为0.400,将结果以 TSV格式下载保存,运行Cytoscape 3.7.2软件,导入下载文件,使用CytoHubba插件进行网络拓扑学分析,获得各靶点之间的连接度(degree值),根据degree值大小获得光甘草定治疗CRPC的核心靶点,并在软件中通过调节各节点颜色、大小等步骤制作蛋白-蛋白互作分析(PPI)网络图。
1.4 GO基因本体和KEGG通路富集分析
使用R studio中的bitr函数进行蛋白ID与基因ID的转换,注释包为 “org.Hs.eg.db”包,将ID名称转换为标准的基因编号(ENTREZ ID),并使用“clusterProfiler”“ggplot2”软件包(R 3.6.3 for Windows)进行GO功能富集分析,包括生物学过程(biological process,BP)、细胞学组分(cytological component,CC)、分子生物学功能(molecular function,MF)和KEGG通路富集分析[11]。设置P<0.01为具有统计学意义的富集结果,将结果以柱形图和气泡图展示。
1.5 分子对接分析方法
在PDB数据库(https://www.rcsb.org/)下载相应的蛋白的PDB文件,TCMSP数据库(https://tcmsp-e.com/)下载光甘草定的mol2格式文件,运用PyMOL2.4.0软件对受体蛋白进行去水、去配体等操作,AutoDockTools-1.5.6软件对蛋白进行加氢以及计算电荷处理等处理,将受体蛋白和配体小分子分别转化为pdbqt格式,利用插件“autogrid”及“autodock”进行活性位点对接,对接过程中使用Lamarckian genetic algorithm(LGA)算法。计算结合能(binding energy)(kJ/mol)来评估成分小分子与蛋白之间的结合活性,一般小于-5.0 kJ/mol的对接结合能被认为具有良好的结合相互作用。最后运用PyMOL2.4.0软件展示其结构模式。
1.6 体外细胞实验方法
1.6.1 主要药物、试剂、仪器及细胞株
光甘草定(Glabridin,货号:HY-N0393,纯度:99.87%,购自美国MCE公司);CCK8试剂盒(货号C0038)购自上海碧云天公司;1640培养基(货号C11875500BT)、胎牛血清(货号42F7180K)、胰酶(货号25200072)购自美国Gibco公司;膜联蛋白V-FITC凋亡检测试剂盒(货号640914)购自美国Biolegend公司;DAPI染色液(货号MBD0015)购自上海Sigma公司;Akt(货号60203-2-Ig)、磷酸化Akt(货号66444-1-Ig)、PI3K(货号60225-1-Ig)、GAPDH(货号60004-1-Ig)抗体购自湖北Proteintech公司;磷酸化PI3K抗体(货号ab182651)购自Abcam(中国上海);流式细胞仪来自美国贝克曼库尔特有限公司,CO2培养箱来自美国赛默飞世尔科技公司;人前列腺癌细胞(PC-3)购自湖南丰晖细胞库,细胞置于1640培养基培养,培养环境:含有5% CO2的37 ℃饱和湿度的培养箱。
1.6.2 药物溶液配置
取光甘草定(分子式:C20H20O4)5mg于500 μL离心管中,在超净台下操作,加入308 μL二甲基亚砜(dimethyl sulfoxide,DMSO)溶解,制备成50 mmol/L的浓缩溶液,保存在-20 ℃冰箱中。
1.6.3 细胞增殖实验
取生长状态良好的细胞,经胰酶消化、离心、重悬细胞,调整细胞密度为4×104个/mL,接种到96孔板中,每孔加入100 μL细胞悬液。继续培养24 h,待细胞完全贴壁后将细胞分为4个实验组和1个空白组,每组设置3个复孔,实验组每孔加入含有药物浓度梯度的培养基100 μL(25、50、75、100 μmol/L),空白组加入不含药物的培养基。培养24 h后弃除旧培养基,每孔加入CCK8 10 μL,继续培养2 h,在酶联免疫监测仪上测定各孔在450 nm波长处的光吸收值。
1.6.4 细胞凋亡检测
将细胞以每孔5×105个/mL的密度接种到6孔板中,继续培养24 h后,视细胞生长情况(贴壁状态)时弃除原来的培养基,设定药物处理组(72 μmol/L)和空白对照组(0 μmol/L),每组安排6个复孔,依次向每孔加入2 mL相应的药物浓度培养基,空白对照组即加入不含药物培养基。继续培养24 h,取每组的3个复孔细胞进行流式细胞术实验,胰酶消化、离心、洗涤、重悬细胞,调节其浓度为1×107个/mL,然后取100 μL细胞悬浮于5 mL流式管中,加入5 μL Annexin V-FITC混匀后,加入5 μL Propidium Iodide混匀,于室温避光孵育15 min,使用流式细胞仪检测各组细胞凋亡情况。接着取对数生长的细胞接种到24孔板中,调整细胞密度为4×104个/mL,观察细胞80%贴壁后加入1 mL含有药物浓度(0、72 μmol/L)的培养基继续培养24 h,用PBS洗涤2次后用4%甲醛固定5 min,加入稀释的DAPI染液(1 μg/mL),室温下避光染色20 min后用PBS洗涤3次,于荧光显微镜下观察细胞形态变化。
1.6.5 目标通路相关蛋白的表达检测
将细胞以每孔5×105个/mL的密度接种到6孔板上,用含有药物浓度(0、72 μmol/L)的培养基继续培养24 h后离心收集细胞,用细胞裂解液 RIPA裂解细胞,用 BCA 法测定蛋白浓度,根据蛋白质的相对分子质量大小,制备分离胶和5%的浓缩胶进行蛋白电泳分离,然后将蛋白质转移到PVDF膜上,在室温下,用5%脱脂奶粉封闭PVDF膜1 h。然后,添加以下稀释的一抗:PI3K(1∶1 000)、p-PI3K(1∶500)、Akt(1∶1 000)、p-Akt(1∶2 000)、GAPDH(1∶5 000),在4 ℃下孵育过夜。用PBST洗膜5次后,加入相应的二抗并在室温下培养60 min,再次洗膜5次。均匀地滴加体积1∶1的ECL A和B混合液在膜上,将胶片暴露在暗盒中开始曝光,曝光结束后保存并导出图片,用图像分析软件Image J对图像进行灰度分析。
1.7 统计学分析
应用SPSS 25统计软件分析处理数据,应用GraphPad Prism 8.0软件进行作图分析,计量资料以(Mean±SD)表示,多组均数比较使用单因素方差分析,两组均数比较采用成组t检验,P<0.05认为差异具有统计学意义。
2 结果
2.1 药物治疗靶点以及疾病靶基因收集结果
通过检索和收集,在HERB数据库收集到26个,TCMIO数据库收集到7个,TCMSP数据库收集到24个,在PharmMapper数据库收集到136个,在BATMAN-TCM数据库收集到28个,在Swiss Target Prediction数据库收集到100个,去重后得到248个药物治疗靶点。
在DisGeNET数据库中共收集到683个具有代表性靶基因。将以上获得光甘草定的248个预测靶点蛋白通过韦恩图工具映射至CRPC的靶基因中获得55个药物-疾病共同靶点,我们将这一部分称之为关键靶点蛋白/靶基因(见图1)。将以上关键靶点以及药物、疾病制作成节点信息,导入Cytoscape软件中,绘制药物-靶点-疾病网络图(见图2)。

图1 光甘草定与CRPC关键靶点韦恩图Fig.1 Venn diagram of glabridin and CRPC key targets

图2 药物-靶点-疾病网络图Fig.2 Drug-target-disease network diagram
2.2 蛋白-蛋白相互作用网络分析结果
将以上55个关键靶点蛋白输入到“STRING”数据库中“Multiple proteins”窗口中,Organism选择“Homo sapiens”,最低交互分数“minimum required interaction score”设置为0.400,PPI网络分析得出,该网络共有55节点,440条边,平均节点度值(average node degree):16.0,PPI富集P值(PPI enrichmentP-value)<1.0e-16,将结果以TSV格式输出保存。将文件导入Cytoscape软件中,使用CytoHubba插件进行拓扑学分析,计算度值(degree值),并绘制PPI分析网络图(见图3A),取度值大小排名前10的蛋白作为核心靶点蛋白,并根据度值大小,取排名前20制作条形图(见图3B)。

图3 关键靶点蛋白PPI分析情况Fig.3 PPI analysis of key target proteins注:网络图中节点越大、颜色越深表示连接度值越高。Note:In the network diagram,the larger the node and the darker the color,the higher the connectivity value.
2.3 GO基因本体和KEGG通路富集分析结果
使用R studio中的“clusterProfiler”软件包对以上55个靶基因进行GO富集分析和KEGG通路富集分析,GO分析富集到847个具体差异的条目(P< 0.01),其中779条BP涉及对类固醇激素的反应(response to steroid hormone)、蛋白激酶B信号(protein kinase B signaling)、对营养水平的反应(response to nutrient levels)、蛋白激酶B信号的正向调节(positive regulation of protein kinase B signaling)等,16条CC涉及转移酶复合物(transferase complex)、膜筏(membrane raft)、膜微结构域(membrane microdomain)、膜区(membrane region)等,52条MF涉及组蛋白脱乙酰酶结合(histone deacetylase binding)、跨膜受体蛋白酪氨酸激酶活性(transmembrane receptor protein tyrosine kinase activity)、蛋白丝氨酸/苏氨酸激酶活性(protein serine/threonine kinase activity)、跨膜受体蛋白激酶活性(transmembrane receptor protein kinase activity)等,图4展示了GO富集分析每一类别具有差异的前10个条目。KEGG分析富集到105个具有差异的信号通路(P< 0.01),包括磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)信号通路(PI3K-Akt signaling pathway)、蛋白聚糖在癌症中的作用(proteoglycans in cancer)、前列腺癌(prostate cancer)、化学致癌-受体激活(chemical carcinogenesis-receptor activation)、内分泌的抵抗(endocrine resistance)、甲状腺激素信号通路(thyroid hormone signaling pathway)、乳腺癌(breast cancer)、卡波西肉瘤相关疱疹病毒感染(kaposi sarcoma-associated herpesvirus infection)等,图5展示了富集具有差异的前20个通路。
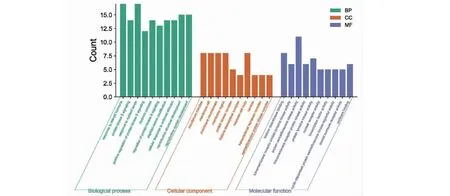
图4 关键靶基因GO富集分析条目柱形图(前10)Fig.4 Histogram of key target gene GO enrichment analysis items (top 10)

图5 关键靶基因的KEGG通路富集分析气泡图(前20)Fig.5 Bubble diagram of KEGG pathway enrichment analysis of key target genes (top 20)
2.4 分子对接结果
选择度值排名前10的核心靶点蛋白(AKT1、TP53、ESR1、EGFR、ALB、SRC、MAPK1、CASP3、MTOR、AR)与光甘草定进行分子对接,运行AutoDock软件分别与光甘草定共进行10次分子对接。具体对接结合能结果见表1,由表可知,所有对接结合能均<-5 kJ/mol,其中光甘草定与蛋白AKT1结合能最低,其次是SRC、TP53、EGFR,对接结合能越低表明光甘草定与这些靶点结合亲和力越高,提示其有更大可能作用于以上靶点,影响靶点蛋白的结构和功能,进而调控相应的信号通路。图6展示了光甘草定与各核心靶点的对接结构图,由图可知,光甘草定与核心靶点均有氢键相连,特别是AKT1蛋白,光甘草定与该蛋白的TRP-50残基有苯环共轭π键相连,与VAL-270、HIS-207、LEU-210、ALA-212等残基有氢键相连,说明光甘草定小分子与各核心靶点结合紧密,进而表明,光甘草定抗CRPC可能是通过调节以上核心靶点来实现。

表1 光甘草定与核心靶点分子对接结合能Table 1 Docking and binding energy of glabridin and core target molecules

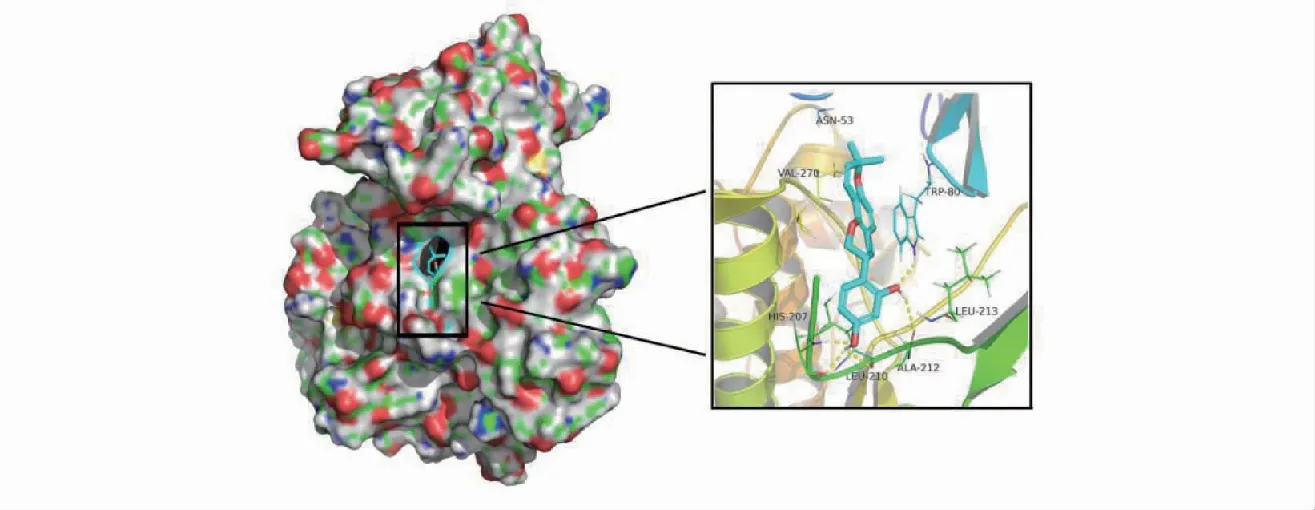
图6 甘草定与核心靶点的分子对接情况Fig.6 Molecular docking of glabridin with the core target
2.5 光甘草定抑制前列腺癌PC-3细胞增殖
通过细胞增殖CCK8实验观察不同浓度的光甘草定处理PC-3细胞24、48 h后的细胞活力情况,结果发现与对照组相比,光甘草定对PC-3细胞呈现出明显的抑制增殖作用(P<0.05),在50~100 μmol/L范围内,细胞增殖抑制率在24 h内可达50%以上,计算24、48 h时间点的半数有效抑制浓度IC50分别为72、66.9 μmol/L(见图7)。
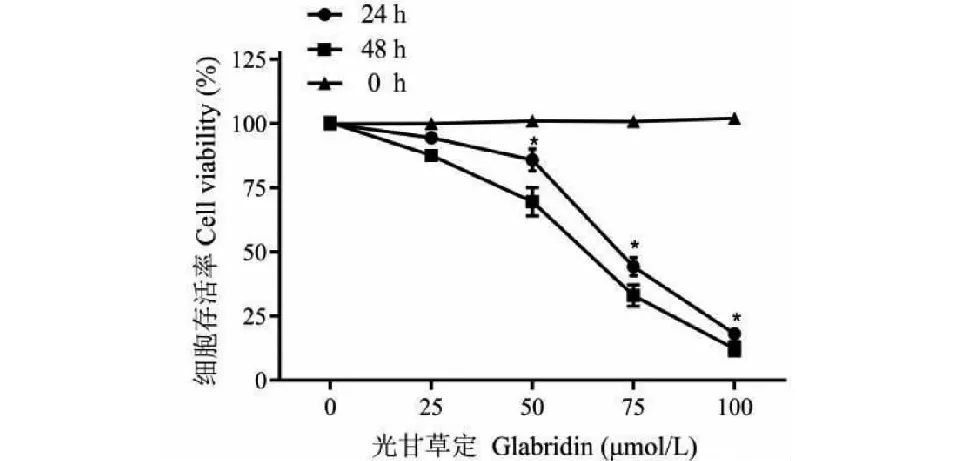
图7 CCK8法检测不同浓度光甘草定对PC-3细胞的存活率的影响Fig.7 Effects of different concentrations of glabridin on the survival rate of PC-3 cells detected by CCK8 method注:与空白组比较,*P<0.05。Note:Compared with blank group,*P<0.05.
2.6 光甘草定诱导前列腺癌PC-3细胞凋亡
通过流式细胞术测定细胞凋亡率的变化,如图8A所示,药物处理组和对照组的细胞凋亡率分别为(6.9±0.31)%、(2.87±0.23)%,药物处理组细胞凋亡率高于对照组(P<0.05)。通过显微镜下观察细胞凋亡形态变化,光甘草定处理后的细胞数量变少、体积变小、形态皱缩、细胞破裂增加。进一步通过荧光显微镜(200×)下观察DAPI染色后细胞核形态变化,光甘草定处理后部分细胞核出现折缝样改变且染色质浓缩,呈现出荧光表达增强(见图8B)。结果表明,光甘草定在一定程度上可诱导PC-3细胞凋亡。
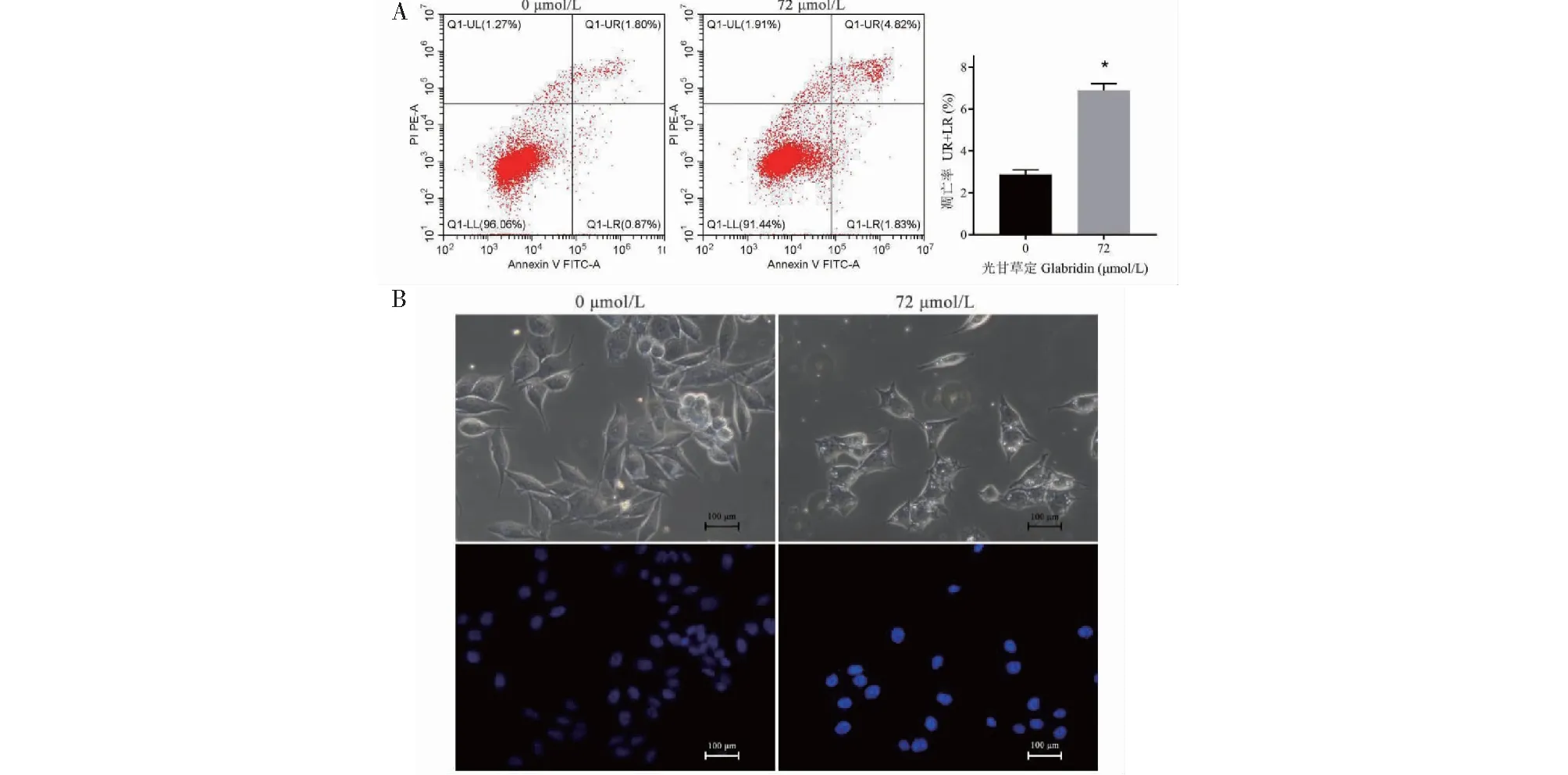
图8 光甘草定作用PC-3细胞24 h后细胞凋亡情况的变化Fig.8 Apoptotic changes of PC-3 cells treated with glabridin for 24 h注:图8A:LL为活细胞,LR为早期凋亡细胞,UR为晚期凋亡和死亡细胞,UL为碎片及损伤细胞,常规凋亡率可计算UR+LR;与空白组比较,*P<0.05。Note:Fig.8A:LL is living cells,LR is early apoptotic cells,UR is late apoptotic and dead cells,UL is debris and injured cells.The common apoptosis rate can be calculated as UR+LR;compared with blank group,*P<0.05.
2.7 光甘草定抑制蛋白AKT的磷酸化
通过Western blot方法检测该通路相关蛋白(PI3K、AKT、p-PI3K、p- AKT)的表达情况。结果显示,72 μmol/L光甘草定作用于PC-3细胞24 h后,磷酸化的AKT蛋白的表达较未处理组相比显著降低(P<0.05),总的AKT的表达量未发生明显变化,但磷酸化的PI3K蛋白和总的PI3K蛋白变化不明显(见图9)。结果表明光甘草定能明显抑制AKT蛋白的磷酸化水平,这提示光甘草定可能通过调节PI3K/AKT信号通路相关蛋白的活性发挥抗肿瘤作用。

图9 光甘草定作用PC-3细胞后PI3K、AKT、p-PI3K、p- AKT表达的变化。Fig.9 Changes in protein expression levels of PI3K,AKT,p-PI3K,p- AKT in PC-3 cells after treated with glabridin注:与空白组相比,*P<0.05。Note:Compared with blank group,*P<0.05.
3 讨论与结论
近年来,中医药治疗前列腺癌,特别是在CRPC上取得显著的进展,中医药结合手术或者化学治疗具有缩小瘤体、降低PSA、减少复发、延长其生存时间等效果[12-14]。不少研究报道提示甘草中的活性成分对CRPC的抑瘤作用显著,Gioti等[15]研究发现光果甘草提取物(GGE)单独或与阿霉素联合使用对雄激素非依赖性前列腺癌细胞(PC-3细胞)均具有抗增殖作用,并能够促进自噬相关基因如LC3A、ULK1和AMBRA1的表达增强。Zhang等[16]研究发现异甘草素可抑制前列腺癌细胞(PC-3和22RV1)增殖,诱导细胞凋亡,阻滞G2/M细胞周期,并通过体内动物实验发现其可抑制PC-3异种移植瘤的生长。甘草表现出良好的抗CRPC活性,而甘草中的光甘草定是众多的黄酮类化合物中备受关注之一,具有良好的抗肿瘤活性,对于CRPC的作用机制值得我们去进一步挖掘。
与传统药理学相比,网络药理学为新药研发提供了全新的视角,为了更好地了解光甘草定对CRPC的作用机制,我们运用网络药理学的方法,通过TCMIO数据库、TCMSP数据库、PharmMapper数据库等数据库共收集到683个光甘草定作用靶点,通过韦恩图工具获得55个光甘草定作用于去势抵抗性前列腺癌的关键靶点,通过PPI蛋白互作网络分析得到AKT1、TP53、ESR1、EGFR、ALB等10个核心靶点。GO富集分析显示光甘草定主要通过调节蛋白磷酸化、氧化反应以及细胞周期等方面调控细胞代谢和细胞凋亡。分子对接进一步显示,光甘草定与10个核心靶点具有较好的对接活性,预测光甘草定可能通过调控这些核心靶点蛋白的表达,进而达到抗肿瘤作用。在这些核心靶点中,AKT1蛋白的对接活性最高。AKT1是PI3K/AKT信号通路中重要调控因子之一,参与肿瘤的多种生物学过程。在前列腺癌中,基于基因组和转录组谱发现,有多达42%的原发性前列腺癌和100%的转移性前列腺癌样本检测出PI3K/AKT通路成分的遗传变异和基因表达失调[17]。在早期有研究中提出,AKT亚型(AKT1、AKT2)可能促进前列腺癌从雄激素敏感阶段转变为激素难治阶段[18]。在CRPC患者治疗的基础研究中,有研究报道,在AKT1/2敲除的去势抵抗性前列腺癌动物模型中发现,肿瘤在体内和体外转移灶明显减少[19]。可见,抑制AKT1的表达,有可能可改善CRPC患者的生存预后,应用AKT1抑制剂可能是CRPC患者一种有潜力的治疗方法。我们的研究在理论上提出光甘草定可能是一种AKT1抑制剂,但光甘草定能否成为有效的AKT1抑制剂应用于CRPC患者还有待今后进一步实验论证。
KEGG通路富集结果显示,PI3K/AKT信号通路、蛋白聚糖在癌症、前列腺癌,化学致癌-受体激活、内分泌抵抗、表皮生长因子受体酪氨酸激酶抑制剂抵抗等105个相关信号通路(P<0.01)。其中,最令人关注的是磷脂酰肌3-激酶(PI3K)/丝氨酸-苏氨酸蛋白激酶(AKT)信号通路。PI3K/AKT信号通路参与调控细胞代谢、生长、增殖、分化以及蛋白质合成等方面,在人类许多肿瘤中均检测到PI3K/AKT信号通路的突变。研究数据表明,有高达70%~100%的晚期前列腺癌患者会发生PI3K通路的调控失调[20]。并且发现,在激素敏感性前列腺癌向去势抵抗性前列腺癌进展过程中,PI3K/AKT信号通路扮演着重要角色,其作用机制可能与雄激素受体(AR)信号通路相关调节有关,该信号通路成分可作为CRPC潜在的生物标志物[21]。目前,PI3K/AKT信号通路相关的抑制剂比如AZD5363等已进入临床试验阶段,并且取得可观的疗效[22]。研究该通路相关的抑制剂对CRPC的治疗具有重大价值。
我们进一步通过CCK8法发现光甘草定可明显抑制PC-3细胞的增殖,流式细胞术和DAPI染色实验发现其可诱导细胞凋亡,镜下观察到细胞数量减少、形态皱缩。对于抗肿瘤的药物浓度的筛选,我们发现其IC50稍高,考虑与分子对接采取的是半柔性对接方式有关,相比柔性对接,半柔性对接计算的结合能偏低[23]。再者光甘草定作为天然抗氧化剂,其具有较强的抗氧化作用,但低剂量的天然抗氧化剂在抗肿瘤实验中未表现出较好的抗肿瘤活性,而高剂量对细胞产生毒性作用,其具体机制有待进一步探索[24,25]。结合网络药理学预测的KEGG信号通路结果,我们预测光甘草定对PC-3细胞的抑制作用可能主要与PI3K/AKT信号通路有关,进一步通过Western Blot实验研究光甘草定对PC-3细胞PI3K/AKT信号通路相关蛋白表达的影响,结果发现光甘草定可明显抑制AKT蛋白的磷酸化过程。在我们的实验中观察到光甘草定能显著抑制磷酸化的AKT蛋白的表达,但是对磷酸化的PI3K蛋白表达抑制作用没有预期效果,经反复调整蛋白上样浓度和比例,严格规范操作后,该蛋白仍未明显显影,考虑原因可能与p-PI3K蛋白本身质量问题,效价不高有关。但是由于本次研究经费有限,未再更换其他产品的蛋白,在今后的实验中,我们将对该通路更多的相关蛋白进行分析,以验证我们的设想。
综上,本研究通过网络药理学分析并预测光甘草定对去势抵抗性前列腺癌的潜在作用机制,并通过分子对接以及体外细胞实验进一步分析验证,结果表明光甘草定可抑制PC-3细胞增殖、诱导凋亡,其机制与AKT蛋白磷酸化过程有关,故我们推测,其发挥抗CRPC的作用机制可能主要通过调控PI3K/AKT信号通路相关蛋白的磷酸化。本研究不仅为探究光甘草定治疗去势抵抗性前列腺癌的分子机制提供了研究思路,而且为甘草中黄酮类化合物的抗肿瘤药物研发和临床应用提供了一种有效方法。
