香蕉种苗中枯萎病菌和细菌性软腐病菌实时荧光PCR检测
2023-03-14梁基校陈东利齐欣林鸿生张景欣杨祁云王飞钊蒲小明
梁基校 陈东 利齐欣 林鸿生 张景欣 杨祁云 王飞钊 蒲小明


摘要:香蕉枯萎病菌和細菌性软腐病菌复合侵染且潜伏期较长,建立香蕉种苗病害早期监测的分子检测方法非常重要。本文基于尖孢镰刀菌古巴专化型1号生理小种(Fusarium oxysporum f. sp. cubense race 1,FOC1)基因组Contig 438区间(35631~37693 bp)(GenBank: AMGP01000438.1)设计特异扩增引物qFOC1-F/-R、4号生理小种(Fusarium oxysporum f. sp. cubense race 4,FOC4)基因组Contig 195区间(4028~6126 bp)(GenBank: AMGQ01000195.1)设计特异扩增引物qFOC4-F/-R,同时以香蕉细菌性软腐病菌Dickeya zeae的促旋酶B 亚单位基因(Subunit B of gyrase gene)(GenBank: JQ284039)序列设计特异扩增引物qgyrB-F/-R。qPCR检测结果显示:实时荧光检测引物扩增特异性强。通过拟合曲线方程分析得到:检测香蕉枯萎病菌的DNA浓度最低限为3 pg·μL-1,细菌性软腐病菌的菌液浓度最低限灵敏度为70 cfu·mL-1,检测灵敏度较高,结果稳定可靠。因此,本研究建立的实时荧光PCR检测方法可有效应用于检测香蕉种苗中的香蕉枯萎病菌和细菌性软腐病菌,确保种苗的安全生产。
关键词:尖孢镰刀菌古巴专化型1号菌;尖孢镰刀菌古巴专化型4号菌;玉米迪基氏菌;实时荧光PCR;检测
中图分类号:S432.1 文献标志码:A
Detection of Fusarium Wilt and Bacterial Soft Rot of Banana Seedlings by Real-Time Fluorescence Quantitative PCR
LIANG Jixiao2, CHEN Dong3, LI Qixin2, LIN Hongsheng5, ZHANG Jingxin1, YANG Qiyun1, WANG Feizhao4*, PU Xiaoming1*
(1Institute of Plant Protection, Guangdong Academy of Agricultural Sciences/Key Laboratory of Green Prevention and Control on Fruits and Vegetables in South China,Ministry of Agriculture and Rural Affairs/Guangdong Provincial Key Laboratory of High Technology for Plant Protection, Guangzhou, Guangdong 510640, China; 2Institute of Agricultural Science Research of Yangdong District in Yangjiang City, Yangjiang, Guangdong 529900, China; 3Boluo County Supply and Marketing Cooperative Association, Boluo, Guangdong 516100, China; 4Guangdong Tianhe Agricultural Materials Co., Ltd., Guangzhou, Guangdong 510080, China; 5Shanwei Supply and Marketing Zhonghe Agricultural Technology Service Co., Ltd , Haifeng, Guangdong 516400, China)
Abstracts: Establishing a molecular detection method for early monitoring of banana seedling diseases is important because of mixed infection and long incubation of banana Fusarium wilt and bacterial soft rot pathogens. The specific amplification primers of qFOC1-F/-R were designed based on the sequences of the contig 438 (35631-37693 bp) (AMGP01000438.1) in the DNA of Fusarium oxysporum f. sp. cubense race 1 (FOC1) and qFOC4-F/-R based on the contig 195 (4028-6126 bp) (AMGQ01000195.1) in the DNA of F. oxysporum f. sp. cubense race 4 (FOC4). Based on sequence of subunit B of gyrase gene of banana Fusarium wilt pathogen (GenBank: JQ284039), Dickeya zeae, the primers of qgyrB-F/-R were designed. The results of qPCR showed that the specificity of primers amplification was very strong. Curve-fitting equation analysis showed that: the minimum limit of DNA concentration for detection of F. oxysporum f. sp. cubense was 3 pg·μL-1, and the sensitivity detection of D. zeae was 70 cfu·mL-1; with high sensitivity if the detection, the results were stable and reliable. Therefore, the qPCR detection method developed in this study is effective to detect banana Fusarium wilt and bacterial soft rot pathogens of banana seedlings to ensure the safe production of seedlings.
Keywords: Fusarium. oxysporum f. sp. cubense race 1; Fusarium. oxysporum f. sp. cubense race 4; Dickeya zeae; real-time fluorescence quantitative PCR; detection
香蕉枯萎病和細菌性软腐病已成为香蕉种植过程的主要土传病害,且这两种病害复合侵染,具有较长的潜伏期,给香蕉种植带来非常大的风险。目前香蕉种植户主要通过购买香蕉苗移栽的方式进行生产,所以种苗病害的检测与监测非常重要,是阻遏香蕉土传病害为害的重要屏障。
香蕉枯萎病和细菌性软腐病均为系统性侵染病害,已发病的植株采用常规PCR[1-2]很容易检出,但对于初期侵染及种苗带菌采用常规PCR难检测到病菌;实时荧光定量PCR[3-4]具有更高的灵敏度,是目前香蕉病害早期诊断和种苗带病菌检测的有效手段。基因组信息比较发现:尖孢镰刀菌古巴专化型1号生理小种(Fusarium oxysporum f. sp. cubense race 1,FOC1)基因组Contig 438区间(35631~37693 bp)(GenBank: AMGP01000438.1)[5]和4号生理小种(Fusarium oxysporum f. sp. cubense race 4,FOC4)基因组Contig 195区间(4028~6126 bp)(GenBank: AMGQ01000195.1)[5]存在160bp插入序列差异,基于尖孢镰刀菌古巴专化型1号和4号生理小种的基因特定片段序列差异以及香蕉细菌性软腐病菌基因组[6] 中的促旋酶的B亚单位蛋白基因(gyrB, GenBank: JQ284039)[7] 等设计特异引物来扩增特异基因片段,并建立了实时荧光PCR方法检测种苗是否带病菌,为香蕉种苗的土传病害预警预防提供技术支撑。
1 材料与方法
1.1 供试菌株
供试的香蕉枯萎病菌为尖孢镰刀菌古巴专化型1号生理小种FOC1和尖孢镰刀菌古巴专化型4号生理小种FOC4,香蕉细菌性软腐病菌为玉米迪基氏菌(Dickeya zeae MS1),以上菌株均由广东省农业科学院植物保护研究所提供。
1.2 特异性引物设计
基于尖孢镰刀菌古巴专化型1号生理小种基因组Contig 438区间(35631~37693 bp)(GenBank: AMGP01000438.1)[5]设计特异扩增引物qFOC1-F/-R、4号生理小种基因组Contig 195区间(4028~6126 bp)(GenBank: AMGQ01000195.1)[5]设计特异扩增引物qFOC4-F/-R,且两片段存在160bp插入差异序列,即设计扩增引物FOC-F/-R;同时以香蕉细菌性软腐病菌(D. zeae)的促旋酶B亚单位基因(Subunit B of gyrase gene)(GenBank: JQ284039)[7]序列设计特异扩增引物gyrB-F/-R和qgyrB-F/-R。引物序列及片段大小如表1所示。
1.3 菌株基因组提取
香蕉枯萎病菌株于PDA液体培养基中,26~28 ℃培养72 h,过滤取菌丝体,液氮磨成粉末,采用CTAB法[8]提取真菌基因组DNA,采用Thermo NanoDrop ND-2000C超微量紫外/可见分光光度计(美国)测定DNA浓度,?20 ℃保存备用。
香蕉细菌性软腐病菌株于LB培养中,32 ℃培养24 h,适当菌液浓度用作PCR模板。
1.4 引物特异性扩增
以DNA为模板,使用定性和定量特异引物进行PCR扩增,条件为94 ℃预变性2 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸15 s,35个循环;72 ℃ 延伸10 min;将扩增产物用2%琼脂糖凝胶电泳检测,观察电泳条带是否有非特异性条带。
1.5 实时荧光PCR扩增条件
实时荧光PCR扩增体系如下:模板0.5 μL,引物F为0.5 μL,引物R为0.5 μL,Takara 2x TB Green? Fast qPCR Mix 10 μL,补足水至20 μL;仪器BIO-RAD C1000 TouchTM Thermal Cycler反应程序如下:95 ℃反应2 min,95 ℃下15 s,59 ℃下30 s,然后72 ℃下35 s,40个循环。
1.6 检测限分析
香蕉枯萎病菌1号生理小种和4号生理小种提取的DNA采用超纯水稀释成系列浓度,即 3×10-1 μg·μL-1、3×10-2 μg·μL-1、3×10-3 μg·μL-1、 3×10-1 ng·μL-1、3×10-2 ng·μL-1、3×10-3 ng·μL-1、 3×10-4 ng·μL-1;香蕉细菌性软腐病菌菌液采用超纯水稀释成系列浓度,即7×106 cfu·mL-1、 7×105 cfu·mL-1、7×104 cfu·mL-1、7×103 cfu·mL-1、 7×102 cfu·mL-1、7×101 cfu·mL-1、7×100 cfu·mL-1。
采用引物qFOC1-F/R扩增尖镰孢菌古巴专化型1号生理小种DNA,采用引物qFOC4-F/R扩增尖镰孢菌古巴专化型4号生理小种DNA,采用引物qgyrB-F/R 扩增香蕉细菌性软腐病菌菌液;DNA和菌液稀释成系列浓度作为qPCR扩增体系模板,每处理重复4次,根据Ct值与对应模板菌体量,拟合函数方程,计算检测最低灵敏度。
1.7 种苗场抽检
在广州市番禺和南沙随机选取了5个香蕉种苗场,每个苗场随机抽取30棵苗,取香蕉苗基部球茎组织,切碎后用液氮磨成粉末,采用CTAB法[18]提取总DNA,-20 ℃保存备用。普通PCR采用方法1.3扩增样品DNA,实时荧光PCR采用方法1.4扩增样品DNA,并分析种苗检出病菌情况。
2 结果与分析
2.1 引物特异性扩增
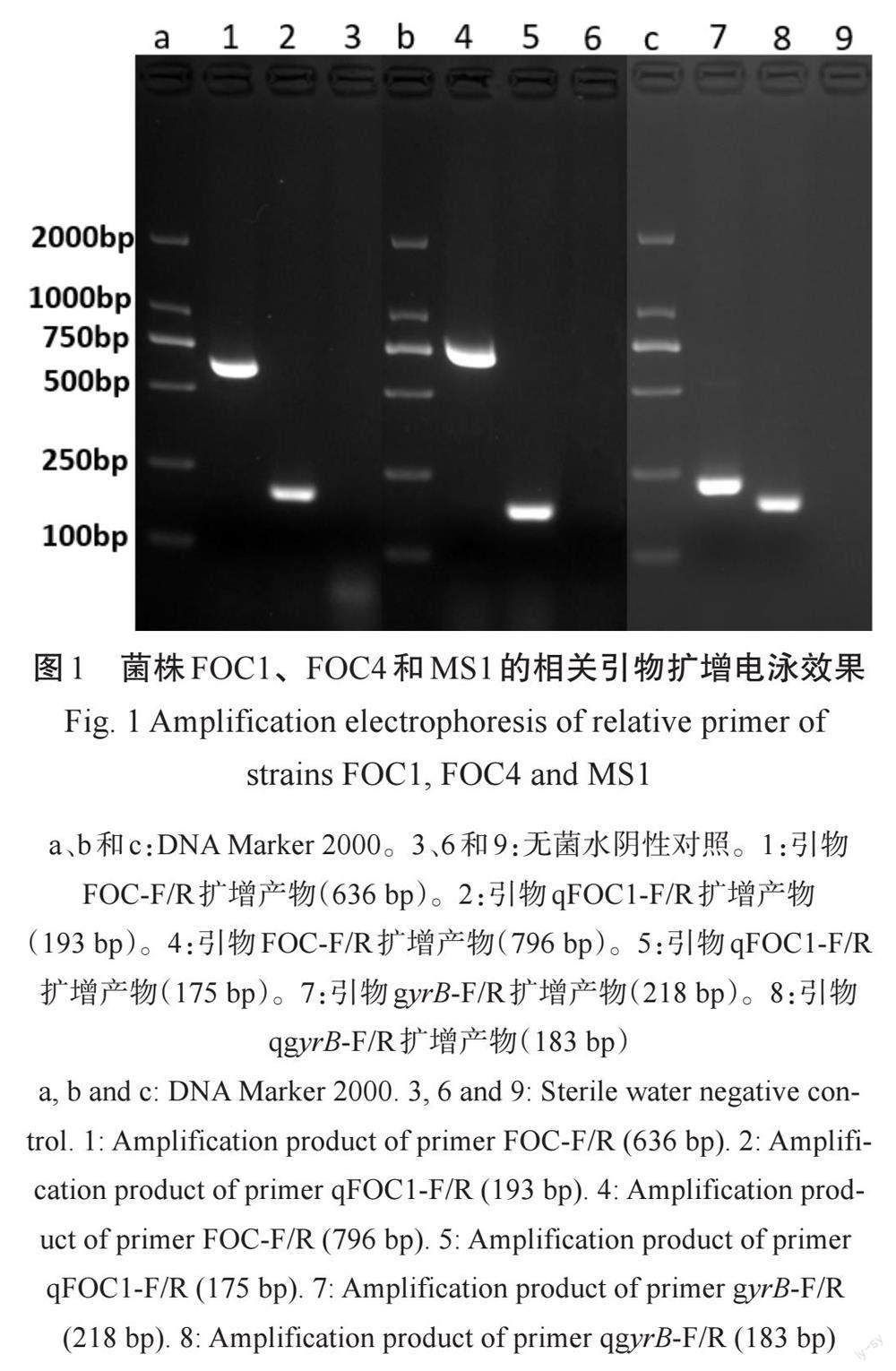
香蕉枯萎病菌与细菌性软腐病菌的定量PCR检测引物扩增效果特异,无非特异性条带出现,可作为定量PCR检测的特异引物(图1)。
2.2 尖镰孢菌古巴专化型1号生理小种的分子检测
由图2可知,实时荧光定量PCR检测分析说明,扩增曲线和溶解曲线峰形单一,准确性较高。依照定量PCR的Ct值(Y)与DNA浓度(X),拟合曲线方程(图3):Y=-1.54ln(X)+16.772, R2=0.9967,FOC1的DNA浓度检测最低限值为 3 pg·μL-1。
2.3 尖镰孢菌古巴专化型4号生理小种的分子检测
由图4可知,实时荧光定量PCR检测分析说明,扩增曲线和溶解曲线峰形单一,准确性较高。依照定量PCR的Ct值(Y)与DNA浓度(X),拟合曲线方程(图5):Y= -1.406 ln(X)+18.455, R2=0.9943,FOC4的DNA浓度检测最低限值为 3 pg·μL-1。
2.4 香蕉细菌性软腐病菌分子检测
由图6可知,实时荧光定量PCR检测分析说明,扩增曲线和溶解曲线峰形单一,准确性较高。依照定量PCR的Ct值(Y)与菌浓度(X),拟合曲线方程(图7):Y=-1.522ln(X)+ 41.851, R2=0.9986,菌浓度检测最低限值为70 cfu·mL-1。
2.5 种苗检测
采样实时荧光PCR检测方法分析广州番禺和南沙5个香蕉种苗场的抽检种苗的带病菌情况,结果如表2所示。5个种苗场有4个种苗场都分别检出了香蕉种苗带香蕉枯萎病菌、香蕉细菌性软腐病菌或两种病害病原菌同时检出,说明这些种苗场存在病害传播风险;只有香蕉两种病害病原菌均未检出的裕星种苗场符合无毒种苗生产要求。结果也表明:普通PCR分析方法均无法检测到带病菌情况,说明了本文建立的针对于香蕉枯萎病和细菌性软腐病的实时荧光PCR方法能有效用于种苗病害检测与监测。
3 讨论与结论
本研究建立的实时荧光PCR检测方法具有较高的灵敏度,相比较对应的普通PCR检测方法,香蕉枯萎病菌1号和4号生理小种DNA的检测灵敏度由100 pg·μL -1提高到3 pg·μL -1,灵敏度提高33.3倍;香蕉细菌性软腐病菌的检测菌浓度灵敏度由1.0×103 cfu·mL-1提高到70 cfu·mL-1,灵敏度提高14.3倍;在香蕉种苗场种苗抽检中,该实时荧光PCR检测方法可有效准确检测出种苗带病菌情况。
实时荧光PCR技术在普通PCR扩增中设计更小片段扩增产物,并在体系中添加荧光染料或荧光标记的分子探针,利用荧光信号强度间接分析靶标DNA含量,更适用于香蕉病害病原菌低含量的检测[9]。与常规PCR方法比较,实时荧光定量PCR可实时观测结果,也可以定量计算菌量,且实时荧光定量PCR方法还具有更高的特异性和灵敏度[4],比普通的 PCR方法灵敏度高100倍左右[10]。实时荧光PCR可以更准确可靠地定量和定性检测植物组织和土壤中的尖孢镰刀菌及其他病原菌[11-13]。豆亚亚等[14]建立实时荧光PCR检测方法对的香蕉软腐病菌的菌悬液的检测灵敏度可达到 4.0×102 cfu·mL-1,比常規PCR高100倍;而本文建立的方法对香蕉软腐病菌的菌悬液的检测灵敏度比豆亚亚等报道结果提高了5.7倍,检测灵敏度明显更高。LIN等构建了实时荧光方法定量检测发病香蕉组织中香蕉枯萎病4号生理小种,检测基因组DNA最低限达100 pg·μL-1,检测灵敏度明显提高[15]。魏森等[16]建立了一套较准确检测土壤 FOC4数量的实时荧光定量PCR技术,其检测孢子下线可达400个/g;饶雪琴等[17]采用实时荧光PCR分析了FOC1和 FOC4菌量在‘巴西蕉植株和根际土壤中具有明显不同的时空分布;YANG等[18]建立的TaqMan 探针实时荧光检测方法,灵敏度可达10 pg·μL-1。AGUAYO等[3]基于致病相关基因构建了香蕉枯萎病4号生理小种探针实时荧光检测方法,灵敏度达103 pg·μL-1;而本文建立的方法对香蕉枯萎病基因组DNA的检测灵敏度达到3 pg·μL -1,检测灵敏度和效率大幅度提高。
本文建立的香蕉枯萎病菌和细菌性软腐病菌的实时荧光PCR检测方法可有效用于香蕉种苗检疫和田间香蕉病害早期诊断,有效防控香蕉枯萎病和细菌性软腐病为害,及早发现及早干预,优化合理种植计划,保护种植户利益和促进农业安全生产。
参考文献
[1] 杨腊英, 郭立佳, 汪军, 等. 香蕉枯萎病菌SIX2基因序列及特异性分析[J]. 植物保护, 2016, 42(5): 118-124.
[2] 吕伟成, 张绍升, 林志远. 一步双重PCR 检测香蕉枯萎病菌生理小种[J]. 中国农学通报, 2009, 25(1): 237-240.
[3] AGUAYO J, MOSTERT D, FOURRIER-JEANDEL C, et al. Development of a hydrolysis probe-based real-time assay for the detection of tropical strains of Fusarium oxysporum f. sp. cubense race 4 [J]. PLoS ONE, 2017, 12(2): e0171767. DOI: 10.1371/journal.pone.0171767.
[4] 馬月萍, 戴思兰, 马艳蓉. 荧光定量PCR 技术在植物研究中的应用[J]. 生物技术通报, 2011(7): 37-45.
[5] GUO L J, HAN L J, YANG L Y, et al. Genome and transcriptome analysis of the fungal pathogen Fusarium oxysporum f. sp. cubense causing banana vascular wilt disease [J]. PLoS ONE, 2014, 9(4): e95543. DOI: 10.1371/journal.pone.0117621.
[6] ZHANG J X, LIN B R, SHEN H F, et al. Genome sequence of the banana pathogen Dickeya zeae strain MS1, Which causes bacterial soft rot [J/OL]. Genome Announcements, 2013, 1(3): e00317-13. DOI: 10.1128/genomeA.00317-13.
[7] MARRERO G, SCHNEIDER K L, JENKINS M, et al. Phylogeny and classification of Dickeya based on multilocus sequence analysis [J]. International Journal of Systematic & Evolutionary Microbiology, 2013, 63(9): 3524-3539.
[8] 吴发红, 黄东益, 黄小龙, 等. 几种真菌DNA提取方法的比较[J]. 中国农学通报, 2009, 25(8): 62-64.
[9] HEID C A, STEVENS J, LIVAK K J, et al. Real time quantitative PCR[J]. Genome Research, 1996, 6(10): 986-994.
[10] 陈长军, 李俊, 赵伟, 等. 利用实时荧光定量 PCR 技术检测油菜菌核病菌[J]. 植物病理学报,2011,41 (5):516–525.
[11] 董超, 方香玲. 植物病原真菌尖孢镰刀菌检测与定量研究进展[J]. 草地学报, 2021, 29(7): 1599-1604.
[12] 刘泽弦, 王蓓蓓, 陶成圆, 等. 香蕉根围土壤尖孢镰刀菌与养分特征及相关性[J]. 土壤学报, 2023, 60(4): 1134-1145.
[13] 洒荣波,晁强, 王晓辉, 等. 杨树枯萎病菌实时荧光定量PCR检测方法的建立及应用[J].山东农业科学, 2019,51(2): 131-135.
[14] 豆亚亚, 阮小蕾, 袁月, 等. 利用实时荧光 PCR 方法检测香蕉软腐细菌[J]. 园艺学报, 2012, 40(2): 380-388.
[15] LIN Y H, SU C C, CHAO C P, et al. A molecular diagnosis method using real-time PCR for quantification and detection of Fusarium oxysporum f. sp. cubense race 4[J]. European Journal of Plant Patho-logy, 2013, 135(2): 395-405
[16] 魏森,陈汉清,曾涛,等. 土壤中香蕉枯萎病菌 FOC4 的实时荧光定量 PCR检测[J]. 基因组学与应用生物学, 2019, 38(8): 3548-3553.
[17] 饶雪琴, 唐瑞, 李华平. 香蕉枯萎病菌 1 号和 4 号生理小种在‘巴西蕉植株及根际土壤中的时空分布[J]. 华南农业大学学报, 2023, 44(4): 563-569.
[18] YANG L L, SUN L X, RUAN X L, et al. Development of a single-tube duplex real-time fluorescence method for the rapid quantitative detection of Fusarium oxysporum f. sp. Cubense race 1 (FOC1) and race 4 (FOC4) using TaqMan probes[J]. Crop Protection, 2015, 68: 27-35.
责任编辑:谢红辉
基金项目:广东省现代农业产业绿色发展共性关键技术研发创新团队建设项目(2022KJ112);广东省烟草科技项目(201802,201908,202201);广东丝苗米跨县集群产业园(汕尾市)项目(2022—2023);博罗蔬菜产业科技支撑项目(2022—2023)。
第一作者:梁基校(1981—),男,本科,农艺师,专业为农学,E-mail:53570050@qq.com。
*通信作者:蒲小明(1981—),男,博士,研究员,研究方向为农作物病虫害综合防控,E-mail:pxm1981@126.com; 王飞钊(1988—),男,硕士,农艺师,研究方向为农药研究与应用,E-mail:wangfz@gd-tianhe.com。
收稿日期:2023-09-01
