活性炭负载吡啶氯化铜催化乙炔氢氯化反应
2023-03-14王金雨陈超群郭廷会
王金雨,张 莹,陈超群,张 丽,刘 红,郭廷会
(1.沈阳化工大学化学工程学院,沈阳 110142;2.沈阳化工股份有限公司)
聚氯乙烯(PVC)是一种广泛用于建筑材料、工业品和日用品的树脂材料。2019年全球聚氯乙烯消费总量达到47 Mt,而中国聚氯乙烯的产能为25.18 Mt[1]。氯乙烯单体(VCM)是生产 PVC 的原料,其生产方法主要分为乙炔法和乙烯法,前者以煤为原料,后者以石油为原料。由于我国煤炭多,石油资源相对紧张,因此采用乙炔法制取氯乙烯单体是比较适合我国资源结构的工艺路线。乙炔法利用乙炔和氯化氢在固体催化剂上进行加成反应(乙炔氢氯化)来制取氯乙烯单体,目前工业上主要采用负载氯化汞的活性炭作为该反应的催化剂,但该催化剂中的活性组分氯化汞容易挥发,对人体和环境有巨大危害[2-3]。2017年水俣公约正式生效后,研发无汞催化剂已成为行业内急需解决的问题,也成为国内外科研工作者的研究热点。
在乙炔氢氯化无汞催化剂的研究中,就活性组分来说,主要分为贵金属、非贵金属和非金属3种。早期的研究中使用贵金属的较多,特别是以金元素为代表的单一或复合催化剂,如Zhao Jia等[4]制备的 Au/AC催化剂、Wang Shengjie等[5]制备的 Au-Cu/C 催化剂、Zhang Haiyang等[6-7]制备的Au-La双金属催化剂及Au-Co-Cu三金属催化剂等。这类催化剂虽然具有活性高的优点,但是由于易失活且价格较高,导致难于大规模工业应用。近年来,相对便宜的钌和铜等金属元素受到了研究者的重视。Han You等[8]制备了Ru/AC催化剂,在170℃、乙炔体积空速为90 h-1的条件下运行48 h,乙炔转化率保持在95%以上。Zhang Haiyang等[9]制备了Ru-Co-Cu三元催化剂,乙炔转化率达到99%。Jin Yunhe等[10]制备了Ru-K/SAC催化剂,在170℃、乙炔体积空速为180 h-1、氯化氢与乙炔的物质的量比为1.1的条件下,乙炔转化率为93.4%。这类非金基催化剂活性较低,通常需要较高的活性组分含量或对其进行不同方法的改性才能获得较好的催化性能。
研究表明,采用离子液体、有机磷、有机氮等配体对非贵金属催化剂进行改性可以提高其活性和稳定性。如,Shang Shanshan等[11]采用羧酸离子液体改性的方法制备了Ru@IL/AC催化剂,Li Yu等[12]制备了咪唑离子液体改性的钌基催化剂,Li Hang等[13]制备了磷改性的铜基催化剂。另外,有文献报道采用掺氮掺硼的非金属催化剂催化乙炔氢氯化反应,也可以取得良好的反应结果。如Dai Bin等[14]制备的掺硼石墨烯催化剂和Li Xingyun等[15]采用不同氮源改性制备的催化剂等。对含氮催化剂的研究结果表明,吡啶氮具有较好的吸附氯化氢和稳定铜原子、抑制高价铜被还原的能力,因而具有较好的催化效果。
鉴于铜基催化剂具有较低的价格和相对较好的活性,以及吡啶氮良好的改性效果,本研究首先制备吡啶氯化铜,然后采用浸渍法将其负载在活性炭上,作为乙炔氢氯化反应的催化剂,进行催化性能测试和催化剂结构表征,分析该催化剂催化机理及其失活的原因。
1 实 验
1.1 原料及试剂
乙炔(C2H2),纯度不小于99.9%,购自沈阳虹呈气体有限公司;氯化氢(HCl),纯度不小于99.9%,购自山东淄博万利达特气有限公司;柱状活性炭(AC),颗粒密度为692 g/L,购自宁夏国宁活性炭有限公司;无水乙醇、吡啶、CuCl2·2H2O和95%乙醇,均购自天津市恒兴化学试剂制造有限公司;气相色谱测试用高纯氢气和氮气,购自沈阳顺泰特种气体有限公司;乙炔和氯乙烯标准混合气,购自大连安瑞森特种气体化学品有限公司。
1.2 催化剂表征
利用日本电子株式会社生产的JSM-6360LV型扫描电镜(SEM)在200 k V下进行催化剂形貌表征;利用北京尼高力公司生产的NEXUS型傅里叶变换红外光谱(FT-IR)仪进行红外测试;利用德国布鲁克公司生产的D8型X射线衍射(XRD)仪以10(°)/min的扫描速率,在2θ 为10°~90°之间进行催化剂物相分析;利用德国耐驰公司生产的STA449C型热重分析仪(TG)在空气氛围下,从室温升至1 200℃进行催化剂热稳定性测试;利用美国ThermoFischer公司生产的ESCALAB Xi+型X射线光电子能谱(XPS)仪进行催化剂能谱测试,以确定催化剂中元素种类、价态信息及含量;利用贝士德仪器科技(北京)有限公司生产的3 H-2000PM2型比表面仪进行催化剂比表面积、孔体积和孔径测定。利用日本麦奇克拜尔有限公司生产的Bel Maxll型化学吸附仪在10℃/min的升温条件下进行乙炔和氯化氢气体的程序升温脱附(TPD)测试。
1.3 催化剂制备
首先将活性炭进行酸洗、水洗,以除去杂质。其步骤为:将活性炭放入1 mol/L的盐酸溶液中,保持70℃密封浸渍5 h,然后冷却过滤,用去离子水清洗,最后在140℃下干燥18 h。
吡啶氯化铜的制备:取0.4 g CuCl2·2H2O溶解于200 m L无水乙醇中,再将0.81 g吡啶加入到100 m L 95%乙醇中,然后将两者同时倒入一个烧杯中得到沉淀。经过滤,将沉淀放入烘箱中于70℃下干燥17 h[16],即得到吡啶氯化铜,记为P-CuCl2。
称取制备好的吡啶氯化铜0.64 g,将其溶解于20 m L的1 mol/L盐酸中。称取3.62 g活性炭,浸渍在上述溶液中,于70℃的水浴加热锅中密闭加热4 h。然后将活性炭取出,用蒸馏水洗净,放入烘箱中于140℃条件下干燥18 h,制成吡啶氯化铜表观负载量(w)为15%的活性炭负载吡啶氯化铜催化剂,记为P-CuCl2/AC。
为了进行比较,同时制备了活性炭负载的氯化铜催化剂。称取0.88 g CuCl2·2 H2O,将其溶解于20 m L的1 mol/L盐酸中,加入5 g除杂后的活性炭,制成氯化铜表观负载量(w)为15%的活性炭负载氯化铜催化剂[17],记为CuCl2/AC。
1.4 催化剂性能评价
利用固定床反应器对所制备的催化剂在乙炔氢氯化反应中的活性进行评价,试验装置如图1所示。来自钢瓶的乙炔和氯化氢气体经过干燥和计量后,在预混器中混合后进入反应器,反应器为内径8 mm的不锈钢管。反应器内装入2 g催化剂。氯化氢与乙炔的进料物质的量比为1.05,乙炔的体积空速为100 h-1。反应器外采用管式炉加热,催化剂床层内部装有热电偶铠套,反应温度设定为330℃。反应开始前用氮气吹扫反应管路,再换成氯化氢气体活化催化剂,活化时间为30 min,然后通入乙炔气体进行反应。
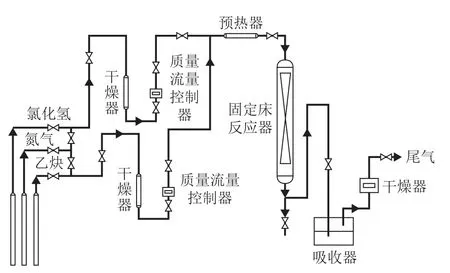
图1 乙炔氢氯化反应装置流程示意
反应后的混合气进入安捷伦7890N型气相色谱仪进行组分分析[18]。色谱柱为GDX-301,色谱检测条件为:高纯氢气作载气,柱箱温度为100℃,进样口温度为110℃,检测口温度为120℃,检测器为热导型检测器。氯乙烯和乙炔的相对校正因子利用其标准混合气测定。由文献[19]可知,高沸点杂质中质量分数98%以上为1,1-二氯乙烷,因此本研究中高沸点杂质以1,1-二氯乙烷计,且由文献[20]可以得到其与乙炔的相对校正因子。催化剂的性能以乙炔转化率和氯乙烯选择性作为评价指标,由式(1)和式(2)计算。
式中:XC2H2为乙炔转化率,%;SVCM为氯乙烯选择性,%;AC2H2,AVCM,AEDC分别为产物中乙炔、氯乙烯和1,1-二氯乙烷在色谱图中的峰面积;MC2H2,MVCM,MEDC分别为乙炔、氯乙烯和1,1-二氯乙烷的相对分子质量;fVCM/C2H2、fEDC/C2H2分别为氯乙烯和1,1-二氯乙烷与乙炔的相对质量校正因子。
2 结果与讨论
2.1 催化剂表征
以新鲜催化剂为研究对象,进行CuCl2/AC,PCuCl2/AC,P-CuCl2的红外光谱、XRD及TPD表征。
2.1.1 红外光谱
图2为CuCl2/AC,P-CuCl2/AC,P-CuCl2的红外光谱。由图2可以看出,在波数为1 000~1 200 cm-1、3 000~3 106 cm-1范围内,P-CuCl2/AC与CuCl2/AC的吸收峰出现了差异,前者的吸收强度高于后者。由文献[21-22]可知,该区域恰好为吡啶的特征吸收峰范围。其中,波数为3 000 cm-1和3 106 cm-1处的吸收峰为吡啶分子面内环变形振动吸收峰;波数为1 060 cm-1和1 218 cm-1处的吸收峰为吡啶分子骨架上的C—H变形振动吸收峰。P-CuCl2/AC与CuCl2/AC两种催化剂在红外吸收光谱上的差别主要是由于吡啶分子引起的,这表明两种催化剂具有不同的分子结构。

图2 CuCl2/AC,P-CuCl2/AC,P-CuCl2 的红外光谱
2.1.2 XRD
图3为CuCl2/AC、P-CuCl2/AC的XRD图谱。其中,2θ在20°~30°之间的衍射峰为活性炭的特征峰,2θ在40°~50°之间的衍射峰为铜物种的衍射峰。由图3可见,CuCl2/AC催化剂比P-CuCl2/AC催化剂的衍射峰更尖锐,这表明铜物种在P-CuCl2/AC催化剂中的分散性更好[23]。两种催化剂中铜物种的晶相差异,可能产生不同的催化效果。

图3 CuCl2/AC、P-CuCl2/AC的 XRD图谱
2.1.3 TPD
图4为乙炔和氯化氢气体在CuCl2/AC和P-CuCl2/AC催化剂上的TPD曲线。对脱附曲线进行积分得到表1所示气体脱附参数。脱附曲线下面积越大表示催化剂对气体的吸附量越多,脱附温度越高表示催化剂与气体结合力越强。
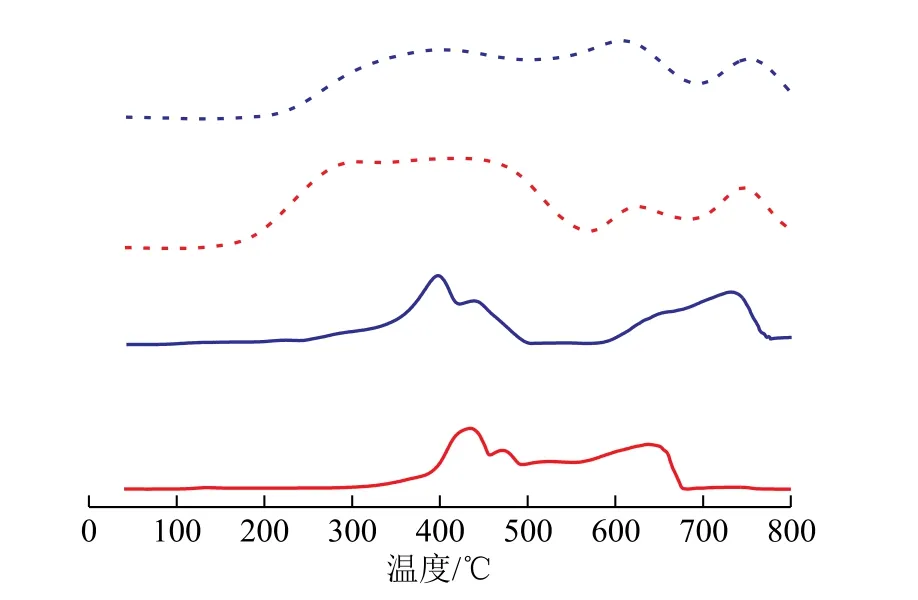
图4 P-CuCl2/AC和CuCl2/AC上氯化氢和乙炔的TPD曲线

表1 CuCl2/AC和P-CuCl2/AC催化剂上乙炔和氯化氢的脱附数据
从图4可以看出:随着温度的升高,吸附在CuCl2/AC和P-CuCl2/AC催化剂上的乙炔和氯化氢均会发生脱附。从表1可以看出:CuCl2/AC催化剂上乙炔和氯化氢的相对脱附量分别为265.93和266.06,而P-CuCl2/AC催化剂上两者的相对脱附量分别为127.77和155.74,说明 CuCl2/AC催化剂对乙炔和氯化氢的吸附量高于P-CuCl2/AC催化剂;CuCl2/AC催化剂对两种气体吸附量相差无几,但是P-CuCl2/AC对氯化氢的吸附量高于其对乙炔的吸附量。根据文献[24]可知,催化剂活性中心吸附更多的氯化氢有利于改善活性中心的微观环境,这样能使到达活性中心的乙炔尽快转化成氯乙烯,从而提高乙炔转化率,并可以减少因多个吸附态的乙炔聚合而生成积炭的量,进而延缓催化剂失活。
从表1还可以看出,P-CuCl2/AC催化剂上乙炔和氯化氢的开始脱附温度明显高于CuCl2/AC催化剂上的,表明P-CuCl2/AC催化剂与乙炔和氯化氢之间具有更强的结合力,生成的吸附态分子更稳定。这种差别与催化剂中铜物种是否与吡啶分子结合有关。此外,CuCl2/AC催化剂上氯化氢和乙炔开始脱附温度分别为116.9℃和142.7℃,后者高于前者,表明CuCl2/AC催化剂与乙炔形成的吸附态分子更稳定;而在P-CuCl2/AC催化剂上氯化氢和乙炔的开始脱附温度分别为302.0℃和250.6℃,前者高于后者,表明P-CuCl2/AC催化剂与氯化氢形成的吸附态分子更稳定。这些结果表明,相对于乙炔,P-CuCl2/AC催化剂对氯化氢的吸附量更多,两者的结合力也更强。
2.2 催化剂的性能
新鲜催化剂CuCl2/AC和P-CuCl2/AC催化乙炔氢氯化反应的性能比较如图5所示。由图5可见:CuCl2/AC和P-CuCl2/AC作用下的乙炔转化率分别为39%~52%和55%~64%,后者高于前者;随着反应时间的延长,两种催化剂上乙炔的转化率均略有降低;两种催化剂上氯乙烯的选择性均大于95%。
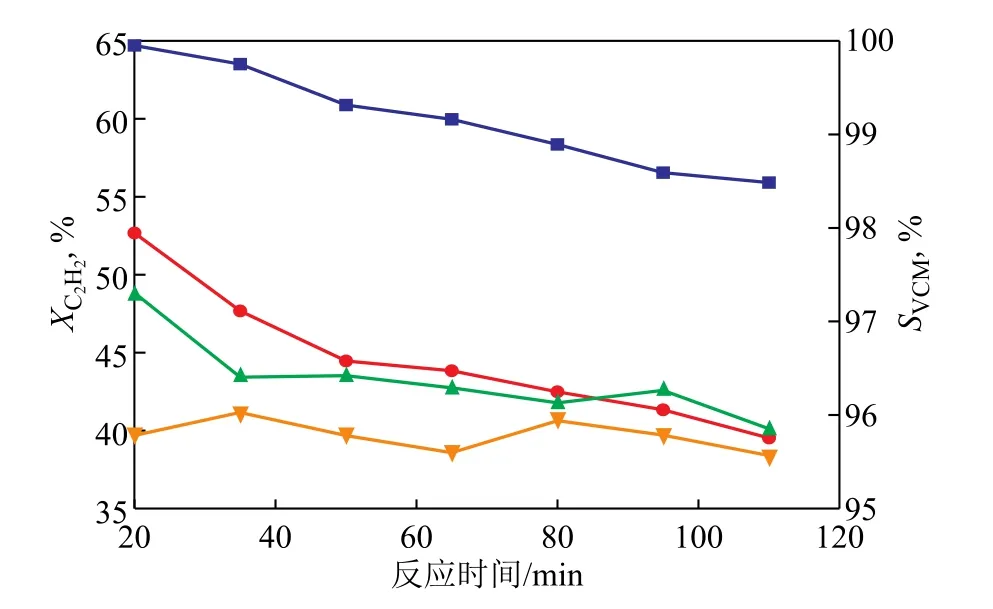
图5 CuCl2/AC和P-CuCl2/AC催化乙炔氢氯化反应的性能比较
2.3 催化机理及失活原因分析
为了考察CuCl2/AC和P-CuCl2/AC的催化机理及失活原因,对反应前后催化剂的物种、孔结构和积炭情况进行考察。
2.3.1 活性组分分析
反应前后CuCl2/AC、P-CuCl2/AC催化剂中铜元素的XPS图谱如图6所示。反应前后催化剂中不同价态铜的结合能及比例如表2所示。
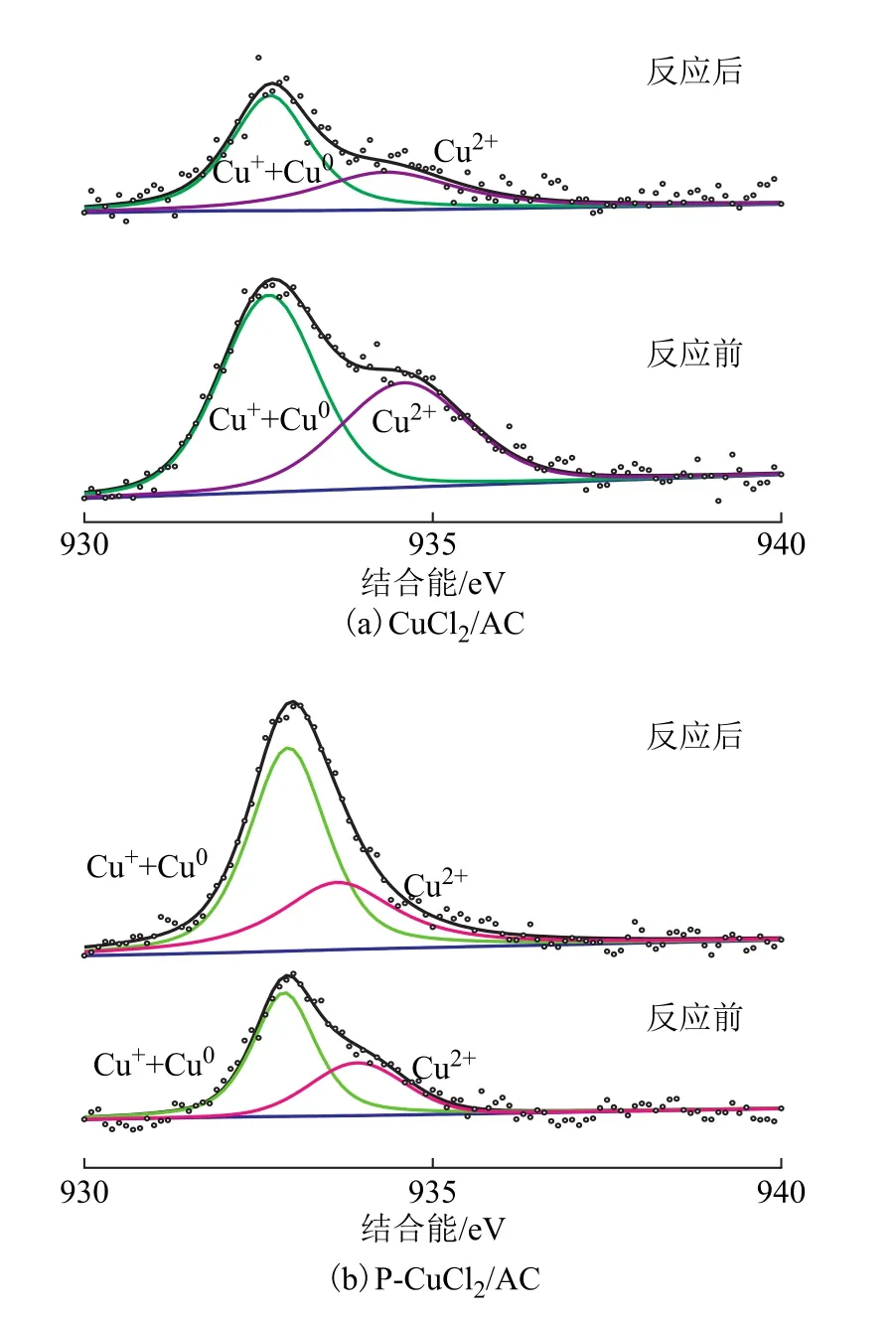
图6 反应前后 CuCl2/AC和 P-CuCl2/AC催化剂中铜元素的XPS图谱
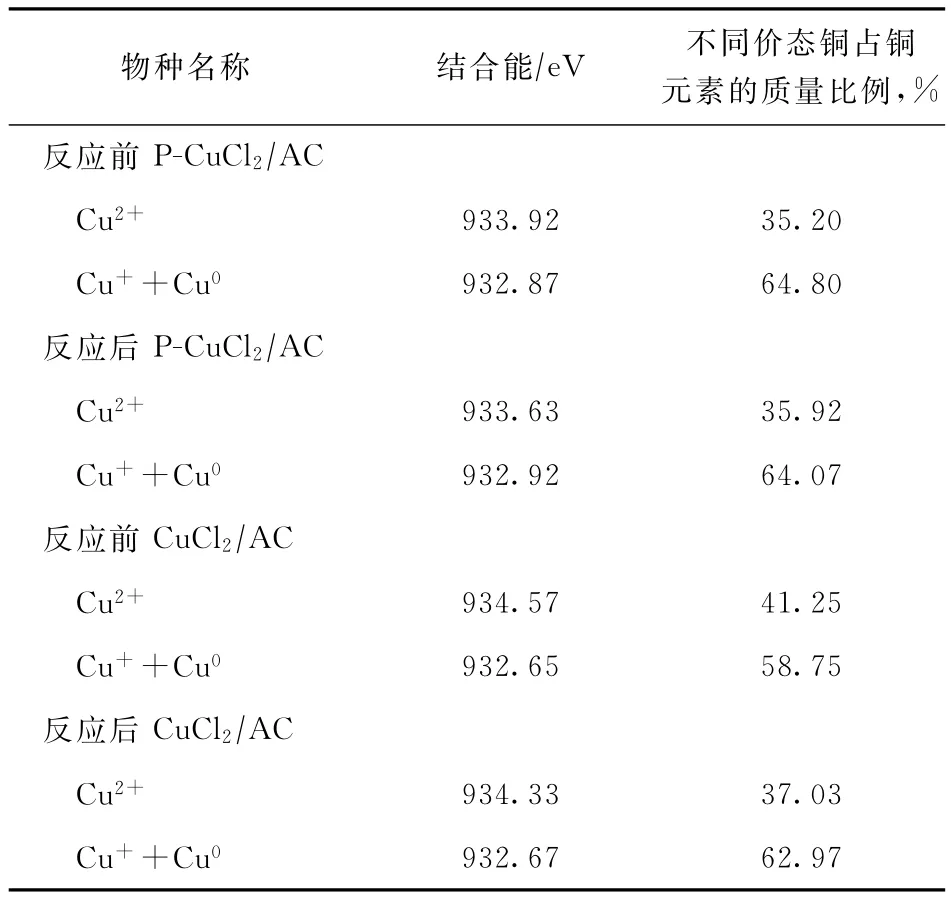
表2 反应前后 CuCl2/AC和 P-CuCl2/AC催化剂中铜元素的赋存状态
从图6和表2可知,反应前后的P-CuCl2/AC和CuCl2/AC催化剂中均存在 Cu2+,Cu+,Cu0物种。从反应前的P-CuCl2/AC和CuCl2/AC催化剂中Cu2+的结合能大小可以看出,结合吡啶分子后,Cu2+的结合能略有降低,这是由于铜原子与含孤对电子的氮原子形成了配位作用,电子云密度增加,铜失去电子的能力增强。这表明与吡啶配位后的Cu2+更活泼,更容易参与反应过程,从而可以更好地起到催化作用。从反应前后P-CuCl2/AC和CuCl2/AC催化剂中各铜物种的比例可知:对于CuCl2/AC催化剂,反应后催化剂中Cu2+的比例是明显下降的,而Cu+和Cu0的总比例是增加的,这表明在反应过程中CuCl2/AC催化剂中的Cu2+发生了明显的还原反应;而对于P-CuCl2/AC催化剂来说,反应后Cu2+的比例略微增大,这表明由于吡啶的配位作用,使得P-CuCl2/AC催化剂中的Cu2+更稳定。结合图5中催化剂的性能及文献[25-27]可以推测,P-CuCl2/AC催化剂较好的催化性能可能归因于催化剂中Cu2+较低的结合能和良好的稳定性,这是该催化剂中铜原子与吡啶分子络合的结果。对吡啶氯化铜分子和氯化铜分子进行计算,得到各原子的静电势(1 kcal/mol≈4.2 kJ/mol)及键长数据,如图7所示。从图7可以看出,在吡啶氯化铜分子中铜原子和两个氮原子的静电势均为正值,这3个原子可以形成一个较大的容易得到电子的区域,因此使得吡啶氯化铜分子更具有亲电性,从而更易与亲电的氯化氢产生较强的作用;而在氯化铜分子中,尽管铜原子的静电势高于吡啶氯化铜中的铜原子,但其缺少两个静电势为正的氮原子与其构成一个较大的易得电子区域,因而不能与氯化氢产生较强的作用。另一方面,吡啶氯化铜分子中Cu—Cl键键长约为2.199 nm;而在氯化铜分子中Cu—Cl键键长约为2.200 nm,吡啶氯化铜分子中较短的Cu—Cl键更不容易断裂,从而稳定了高价态的铜原子,在反应过程中防止了Cu2+被更多地还原,因此具有较优的催化性能。

图7 P-CuCl2和CuCl2分子模型
2.3.2 催化剂结构分析
为进一步考察反应过程中催化剂活性随反应时间的延长而降低的原因,对反应前后催化剂的形貌和结构进行表征。图8为反应前后P-CuCl2/AC催化剂的SEM照片。表3为反应前后P-CuCl2/AC催化剂的结构参数。

图8 反应前后P-CuCl2/AC催化剂的SEM照片

表3 反应前后P-CuCl2/AC催化剂的结构参数
从图8可以看出:反应前催化剂的孔道分布均匀,孔道较大;反应后的催化剂孔道表面存在较多的小颗粒物质,致使孔道表面粗糙,孔道变小。从表3可以看出,与反应前相比,反应后催化剂的比表面积、孔体积和孔径均有所减小,推测是由反应过程中催化剂积炭所引起[28-29]。
2.3.3 催化剂积炭分析
图9为反应后P-CuCl2/AC和CuCl2/AC催化剂的热重分析曲线。从图9可以看出:两者在温度低于150℃时都有轻微的失重,这是由催化剂表面的水分和小分子脱除造成的;在温度为150~350℃时催化剂出现缓慢失重,主要是由在反应过程中产生的积炭燃烧造成的;当温度高于350℃时,催化剂迅速失重,是由活性炭本身的燃烧造成的[30-33]。
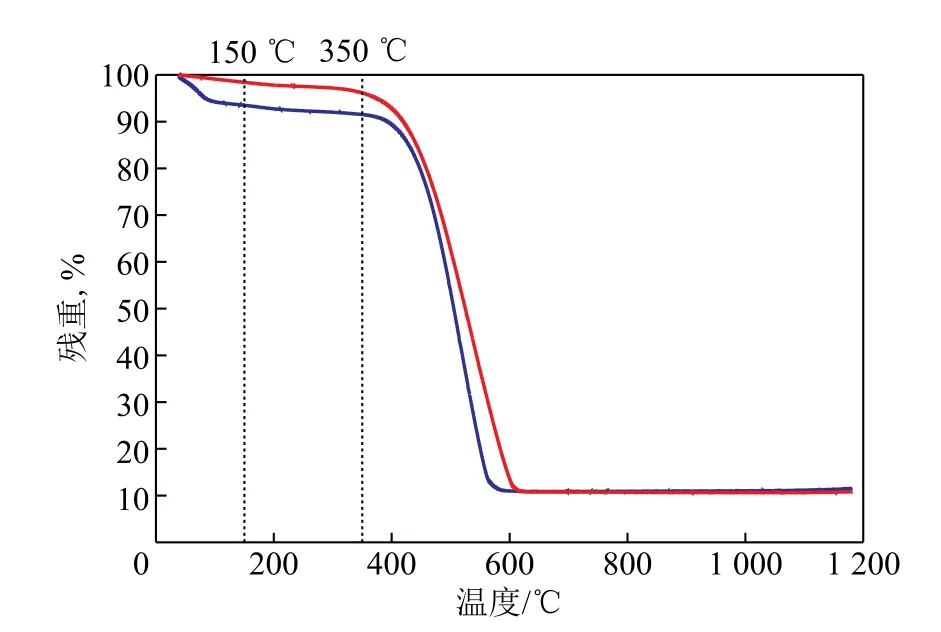
图9 反应后CuCl2/AC和P-CuCl2/AC催化剂的热重曲线
对图9中反应后P-CuCl2/AC和CuCl2/AC热重数据进行计算,可以得到两者在150~350℃之间的质量损失分别为3.93%和9.07%。由此可以看出,在反应过程中P-CuCl2/AC催化剂上的积炭量明显低于CuCl2/AC催化剂。这可能是因为P-CuCl2/AC催化剂对氯化氢的吸附能力高于其对乙炔的吸附能力(见图4),由于催化剂活性中心吸附有更多的氯化氢,致使到达活性中心附近的乙炔能够快速参与氢氯化反应生成氯乙烯,从而减少了其聚合成环并最终导致积炭现象的发生几率。而相比之下,CuCl2/AC催化剂对氯化氢和乙炔的吸附能力相当,在催化剂活性中心附近这一小微观环境中,没有过量的吸附态氯化氢分子存在,致使吸附态的乙炔成环并最终导致积炭现象发生的几率增大。从图4和图9可知,引入吡啶基团后,催化剂对氯化氢气体的吸附性能得到提高,减少了其在反应过程中的积炭量,从而有利于延长其使用寿命。
3 结 论
(1)活性炭负载的吡啶氯化铜催化剂对乙炔氢氯化反应的催化性能优于活性炭负载的氯化铜催化剂,乙炔转化率可达64%,氯乙烯选择性大于95%。
(2)相较于活性炭负载的氯化铜催化剂,吡啶氯化铜催化剂中的吡啶基团能够降低Cu2+的结合能并能够降低其被还原的比例,这是吡啶氯化铜催化剂催化效果高于氯化铜催化剂的主要原因。
(3)吡啶氯化铜催化剂对氯化氢的吸附能力高于其对乙炔的吸附能力,这有利于改善催化剂活性中心附近的微观反应环境,有利于乙炔进行氢氯化反应,减少积炭的发生。
