康莱特注射液联合化疗治疗晚期肺癌的疗效及对患者免疫功能、肿瘤标志物的影响
2023-03-14杨华杨建明陈洁
杨华,杨建明,陈洁
武穴市第一人民医院呼吸与危重症医学科,湖北 黄冈 435400
近年来,中国的工业化进程较快,再加上空气污染等原因,中国肺癌的发生率一直呈逐年升高的趋势[1]。由于早期肺癌多无明显的临床症状,多数患者确诊时已处于晚期[2]。晚期肺癌的恶性程度较大,手术治疗已无法根治,因此,临床多通过紫杉醇和顺铂等进行化疗,可延长生存期,有效杀灭肿瘤细胞,进而达到稳定病情的目的[3]。但化疗对人体造成的伤害较大,治疗后极可能出现肿瘤转移或复发,影响患者的远期预后,安全性欠佳,部分患者难以接受[4]。康莱特注射液是一种在中药中提取的制剂,增效减毒的作用明显[5]。为进一步提高晚期肺癌患者的生活质量,本研究探讨康莱特注射液联合化疗治疗晚期肺癌的疗效及对患者免疫功能、肿瘤标志物的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2019年4月至2021年10月武穴市第一人民医院收治的肺癌患者。纳入标准:①符合《中华医学会肺癌临床诊疗指南(2018版)》[6]中肺癌的诊断标准;②病理学检查确诊为肺癌,临床分期为Ⅲ~Ⅳ期;③年龄18~90岁。排除标准:①对康莱特注射液过敏;②存在化疗禁忌证;③合并严重精神疾病,认知功能障碍。根据纳入和排除标准,本研究共纳入96例晚期肺癌患者,依据治疗方法的不同分为对照组和观察组,每组48例,对照组患者给予紫杉醇+顺铂化疗,观察组患者给予紫杉醇+顺铂化疗联合康莱特注射液治疗。对照组中,男28例,女20例;年龄(56.24±4.26)岁;临床分期:Ⅲ期20例,Ⅳ期28例;分化程度:高分化12例,中分化16例,低分化20例;淋巴结转移28例,无淋巴结转移20例;病理类型:小细胞肺癌12例,非小细胞肺癌36例。观察组中,男30例,女18例;年龄(56.31±4.32)岁;临床分期:Ⅲ期24例,Ⅳ期24例;分化程度:高分化10例,中分化15例,低分化23例;淋巴结转移30例,无淋巴结转移18例;病理类型:小细胞肺癌10例,非小细胞肺癌38例。两组患者性别、年龄、分化程度、淋巴结转移情况、临床分期和病理类型比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准通过,所有患者均知情同意。
1.2 治疗方法
对照组患者给予紫杉醇+顺铂化疗:第1天,紫杉醇85 mg/m2静脉滴注,每天1次;第1~3天,顺铂25 mg/m2静脉滴注,每天1次。观察组患者给予紫杉醇+顺铂化疗联合康莱特注射液治疗,紫杉醇+顺铂化疗方案同对照组,康莱特注射液200 ml缓慢静脉滴注,每天1次,化疗第1天给药。两组患者均以3周为1个疗程,持续治疗2个疗程。
1.3 观察指标和评价标准
①依据实体瘤疗效评价标准(response evaluation criteria in solid tumor,RECIST)[7]评估两组患者的临床疗效:完全缓解(complete response,CR),肿瘤病灶完全消失,持续时间≥4周;部分缓解(partial response,PR),所有可测量目标病灶的直径总和与基线相比减少≥30%,持续时间≥4周;疾病稳定(stable disease,SD),所有可测量目标病灶的直径总和与基线相比减少<30%或增大<20%;疾病进展(progressive disease,PD),所有可测量目标病灶的直径总和与基线相比增大≥20%或出现新病灶。疾病控制率(disease control rate,DCR)=(CR+PR+SD)例数/总例数×100%。②治疗前后,比较两组患者血清肿瘤标志物水平,包括癌胚抗原(carcinoembryonic antigen,CEA)、神经元特异性烯醇化酶(neuron specific enolase,NSE)、糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)。③治疗前后,比较两组患者外周血T淋巴细胞亚群水平,包括CD3+、CD4+,计算 CD4+/CD8+。④比较两组患者的不良反应发生情况,包括白细胞减少、消化道反应、血小板减少、肝肾功能损伤。⑤采用上门、电话或微信随访等方法对两组患者进行为期5个月的随访,记录两组患者的无病生存率和总生存率。
1.4 统计学方法
采用SPSS 20.0软件对所有数据进行统计分析,正态分布计量资料以均数±标准差(±s)表示,组间比较采用两独立样本t检验,组内比较采用配对t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效的比较
观察组患者的DCR为91.67%(44/48),高于对照组患者的75.00%(36/48),差异有统计学意义(χ2=4.800,P=0.028)。(表1)

表1 两组患者的临床疗效[ n(%)]
2.2 血清肿瘤标志物水平的比较
治疗前,两组患者血清CEA、NSE、CA19-9水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者血清CEA、NSE、CA19-9水平均明显低于本组治疗前,且观察组患者血清CEA、NSE、CA19-9水平均明显低于对照组,差异均有统计学意义(P<0.01)。(表2)

表2 治疗前后两组患者血清肿瘤标志物水平的比较
2.3 T淋巴细胞亚群水平的比较
治疗前,两组患者CD3+、CD4+水平和CD4+/CD8+比较,差异均无统计学意义(P>0.05)。治疗后,两组患者CD3+、CD4+水平和CD4+/CD8+均明显低于本组治疗前,但观察组患者CD3+、CD4+水平和CD4+/CD8+均明显高于对照组,差异均有统计学意义(P<0.01)。(表3)
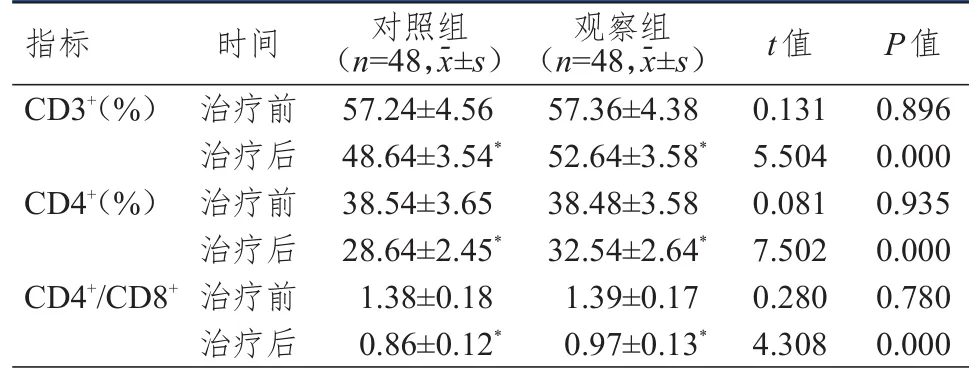
表3 治疗前后两组患者 T淋巴细胞亚群水平的比较
2.4 不良反应发生情况的比较
观察组患者的不良反应总发生率为25.00%(12/48),低于对照组患者的45.83%(22/48),差异有统计学意义(χ2=4.554,P=0.033)。(表4)

表4 两组患者的不良反应发生情况[ n(%)]
2.5 远期疗效的比较
随访5个月,观察组患者的无病生存率为83.33%(40/48),高于对照组患者的64.58%(31/48),差异有统计学意义(χ2=4.174,P=0.041);观察组患者的总生存率为95.83%(46/48),高于对照组患者的83.33%(40/48),差异有统计学意义(χ2=4.937,P=0.026)。
3 讨论
肺癌起病较为隐匿,早中期肺癌主要采用手术治疗,但该时期患者多无典型症状,导致部分患者确诊时病情已进展至晚期,失去了手术治疗的最佳时机,只能选择化疗[8]。既往临床主要通过化疗治疗该病,可有效杀灭肿瘤细胞,减轻肿瘤负荷,但化疗会对免疫系统造成一定的损伤,且不良反应明显,极易影响患者的远期预后[9]。随着医疗技术的不断进步,化疗期间与其他增效减毒的药物联合治疗,可在保障治疗效果的同时减轻肺癌患者的不良反应[10]。
康莱特注射液是临床常见的抗肿瘤制剂,主要成分为薏苡仁油,能够诱导肿瘤细胞凋亡,有助于将细胞周期阻断于G2/M期,可抑制肿瘤细胞有丝分裂[11]。康莱特注射液联合化疗治疗肺癌,可发挥增效减毒的作用,在一定程度上提高化疗效果,减轻化疗不良反应,有助于延长患者的生存期,近远期疗效显著[12]。本研究结果显示,观察组患者的DCR为95.83%,高于对照组患者的75.00%;随访5个月的无病生存率、总生存率分别为83.33%、95.83%,均高于对照组患者的64.58%、83.33%。这与郭海荣等[13]的研究结果一致,该研究显示,观察组患者的DCR为87.50%(35/40),高于对照组的67.50%(27/40),表明康莱特注射液联合化疗治疗晚期肺癌的效果显著。
现代药理学研究结果发现,康莱特注射液进入人体后,可直接参与调控肿瘤基因表达相关的信号通路,下调细胞因子的表达,从而抑制细胞增殖,达到灭活肿瘤细胞的作用[14-15]。本研究结果显示,治疗后,两组患者血清CEA、NSE、CA19-9水平均明显低于本组治疗前,且观察组患者血清CEA、NSE、CA19-9水平均明显低于对照组。结果表明,化疗联合康莱特注射液治疗晚期肺癌患者,可有效抑制肿瘤细胞增殖,降低肿瘤标志物水平。单纯紫杉醇+顺铂化疗的不良反应较为明显,可能会影响患者的肝肾功能,导致其白细胞减少和血小板减少,影响患者的免疫功能[16-17]。CD3+、CD4+、CD4+/CD8+均是反映人体免疫功能的重要指标,一旦该类指标异常降低,表明患者的免疫功能受损[18-19]。康莱特注射液进入人体后能够激活机体自然杀伤细胞的活性,进一步增强巨噬细胞的吞噬功能,且该药减毒作用显著,可在一定程度上降低化疗不良反应,从而减轻化疗药物对机体免疫系统的损伤,不仅能避免患者发生严重的不良反应,还能帮助改善患者的免疫功能,有助于进一步提高治疗的安全性[20]。本研究结果显示,治疗后,两组患者CD3+、CD4+水平和CD4+/CD8+均明显低于本组治疗前,观察组患者 CD3+、CD4+水平和 CD4+/CD8+均明显高于对照组;观察组患者的不良反应总发生率为25.00%,低于对照组患者的45.83%。这与赵强芳等[21]的研究结果相似,该研究结果显示,治疗后,观察组患者的CD4+、CD8+水平和CD4+/CD8+均高于对照组,表明化疗联合康莱特注射液治疗肺癌的安全性较高,可有效改善晚期肺癌患者的免疫功能。
综上所述,化疗联合康莱特注射液治疗晚期肺癌的疗效显著,可明显改善患者的免疫功能,降低血清肿瘤标志物水平,改善预后。
