LHFPL3-AS1 靶向miR-515-5p 对胃癌顺铂耐药细胞增殖、迁移和侵袭的影响
2023-03-14朱婷婷厉挺赵叶芳
朱婷婷,厉挺,赵叶芳
绍兴第二医院内镜中心,浙江绍兴 312000
化疗是胃癌的重要治疗手段之一,术前和术后联合化疗在提高胃癌患者生存率方面具有良好疗效。顺铂是临床应用最普遍的化疗药物,但其耐药性仍是胃癌患者有效化疗和改善预后的最大障碍[1]。探讨胃癌顺铂耐药的机制对克服胃癌化疗耐药具有重要意义。研究发现肿瘤组织中大量长链非编码RNA(long noncoding RNA,lncRNA)表达异常,lncRNA可调控不同信号通路进而影响肿瘤细胞的增殖、转移、耐药和凋亡,是肿瘤治疗和化疗增敏的潜在靶点[2-3]。研究报道lncRNA LHFPL3-AS1 在黑色素瘤中表达上调,可抑制黑色素瘤干细胞凋亡[4]。LHFPL3-AS1 下调可明显抑制口腔鳞癌细胞的增殖和转移,抑制顺铂耐药[5]。然而,LHFPL3-AS1 在胃癌中的具体作用尚不清楚。靶基因预测显示miR-515-5p 是LHFPL3-AS1 的潜在靶点。既往研究证实上调miR-515-5p 可显著降低胃癌细胞活力,抑制集落形成和侵袭能力[6]。miR-515-5p 通过靶向Notch1 明显抑制视网膜母细胞瘤细胞增殖,增强药物敏感性[7]。基于上述背景,本研究探讨LHFPL3-AS1 靶向miR-515-5p 对胃癌顺铂耐药细胞恶性行为的影响,旨在为克服胃癌顺铂耐药提供有效靶标。
1 材料与方法
1.1 细胞与试剂
胃癌亲本细胞 HGC-27 及耐药细胞 HGC-27/DDP、人正常胃黏膜细胞GES-1(中国典型培养物保藏中心);PrimeScript 逆转录试剂盒、SYBR Premix Ex TaqⅡ试剂盒(大连Takara 生物公司,批号:20181123);细胞计数试剂盒(CCK-8)(南京恩晶生物科技公司,批号:20190510);荧光素酶报告载体、miRNA 模拟物(mimic)、miRNA 抑制物(inhibitor)、小干扰RNA(si-RNA)(广州锐博生物公司,批号:20171105、20190326、20180611、20171025);Transwell 小室(北京优尼康生物公司,批号:20180520);兔源E 钙黏蛋白(E-cadherin)多克隆抗体(AF6759)、辣根过氧化物酶标记山羊抗兔IgG(A0208)、兔源甘油醛-3-磷酸(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体(AF1186)、兔源N 钙黏蛋白(N-cadherin)多克隆抗体(AF0243)(上海碧云天生物公司,批号:20160520、20180326、20171104、20180718)。
1.2 方法
1.2.1 细胞培养 GES-1 细胞、HGC-27 细胞、HGC-27/DDP 细胞用含10%胎牛血清的RPMI-1640 培养基,在含5%CO2、37℃、饱和湿度培养箱中培养。胰酶消化80%融合度细胞,隔日换液,每3 天换液一次。收集对数期细胞进行实验。取 5×103个HGC-27 或HGC-27/DDP 细胞接种96 孔板,细胞贴壁后用含不同浓度(0~12μmol/L 或0~500μmol/L)顺铂的培养液孵育细胞48h,随后加入CCK-8 溶液(10μl/孔),37℃孵育2.5h,酶标仪检测450nm 处各孔的吸光度(A)。细胞存活率(%)=(A实验孔–A空白孔)/(A对照孔–A空白孔)×100%。计算HGC-27、HGC-27/DDP细胞的IC50值。
1.2.2 LHFPL3-AS1 和miR-515-5p 表达检测 采用实时定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-qPCR)检测细胞中LHFPL3-AS1 和miR-515-5p 表达。TRIzol 试剂提取GES-1、HGC-27 和HGC-27/DDP 细胞的总RNA,取1μg 总RNA 按照PrimeScript 逆转录试剂盒说明书合成cDNA,使用SYBR Premix Ex TaqⅡ试剂盒进行RT-qPCR 反应。GAPDH 作为LHFPL3-AS1 的内参,U6 作为miR-515-5p的内参,2-△△CT法计算LHFPL3-AS1 和miR-515-5p 相对水平。LHFPL3-AS1上游引物5′-GTGAAGTCATGGGAAGGCAAG-3′,下游引物5′-CCCTCTCTGCCTGCAACTTAG-3′;GAPDH 上游引物5′-CATCAAGAAGGTGGTGAAGCAG-3′,下游引物5′-CGTCAAAGGTGGAGGAGTGG-3′;miR-515-5p上游引物5′-TTCTCCAAAAGAAAGCACTTTCTG-3′,下游引物5′-CTCGCTTCG GCAGCACA-3′;U6 上游引物5′-GCGCGTCGTGAAGCGTTC-3′,下游引物5′-GTGCAGGG TCCGAGG-3′。
1.2.3 实验分组 实验一:取 1×104个对数期HGC-27/DDP 细胞接种24 孔板,分为对照(Con)组(未转染 HGC-27/DDP 细胞)、si-NC 组、si-LHFPL3-AS1 A 组(转染si-LHFPL3-AS1 干扰序列A)、si-LHFPL3-AS1 B 组(转染si-LHFPL3-AS1干扰序列 B)和 si-LHFPL3-AS1 C 组(转染si-LHFPL3-AS1 干扰序列C),转染采用Lipofectamine 2000 试剂,转染48 h 后,收集细胞,RT-qPCR 分析LHFPL3-AS1 相对水平以筛选合适的干扰序列进行后续实验。实验二:取1×104个对数期HGC-27/DDP细胞接种24 孔板,用Lipofectamine 2000 在40%汇合细胞中分别转染 si-LHFPL3-AS1、miR-515-5p mimic、si-NC、miR-NC、si-LHFPL3-AS1+miR-515-5p inhibitor,转染 48h 收集细胞,RT-qPCR 分析LHFPL3-AS1 或miR-515-5p 相对水平以验证转染效果。HGC-27/DDP 细胞共分为si-NC 组、si-LHFPL3-AS1 组、miR-NC 组、miR-515-5p mimic 组、si-LHFPL3-AS1+miR-515-5p inhibitor 组。未转染HGC-27/DDP 细胞计为对照(Con)组。
1.2.4 双荧光素酶报告实验 根据预测的miR-515-5p结合位点将 LHFPL3-AS1 野生型(wt)序列或LHFPL3-AS1 突变型(mut)序列分别克隆到pmirGLO荧光素酶报告载体中构建重组载体wt-LHFPL3-AS1、mut-LHFPL3-AS1。在HGC-27/DDP 细胞中分别共转染重组载体与miR-515-5p mimic 或miR-NC。通过双荧光素酶报告检测系统评估转染48h HGC-27/DDP 细胞的相对荧光素酶活性。
1.2.5 HGC-27/DDP 细胞活力检测 采用CCK-8 法检测HGC-27/DDP 细胞活力。Con 组、si-NC 组、si-LHFPL3-AS1 组、miR-NC 组、miR-515-5p mimic组、si-LHFPL3-AS1+miR-515-5p inhibitor 组各取5×103个细胞接种96 孔板,随后加入CCK-8 溶液(10μl/孔),37℃孵育2.5h,酶标仪检测450nm 处各孔的吸光度(A),计算细胞存活率。
1.2.6 平板克隆实验 Con 组、si-NC 组、si-LHFPL3-AS1 组、miR-NC 组、miR-515-5p mimic 组、si-LHFPL3-AS1+miR-515-5p inhibitor 组各取3×102个细胞接种6 孔板,适时更换培养液。在培养箱孵育至出现肉眼可见的细胞克隆时,取出6 孔板,弃去培养液。用磷酸盐缓冲液冲洗6 孔板2 次,分别用4%多聚甲醛、0.5%结晶紫进行固定和染色。显微镜下计数克隆数(大于50 个细胞)。
1.2.7 HGC-27/DDP 细胞迁移和侵袭的检测 采用Transwell 实验检测HGC-27/DDP 细胞迁移和侵袭能力。用无血清细胞培养液按照1 ∶8 比例稀释Matrigel,取50μl 加入Transwell 小室上室,4℃过夜备用。用无血清培养基重悬Con 组、si-NC 组、si-LHFPL3-AS1 组、miR-NC 组、miR-515-5p mimic组、si-LHFPL3-AS1+miR-515-5p inhibitor 组HGC-27/DDP 细胞,取200μl 细胞悬液加入到上室,取500μl 细胞培养液(补充10%胎牛血清)加入到24孔板下室。37℃孵育24h 后,穿膜细胞采用4%多聚甲醛固定,随后用0.1%结晶紫染色。显微镜下统计侵袭细胞数。迁移实验时Transwell 板不涂基质胶。
1.2.8 蛋白质印迹法检测E-cadherin 和N-cadherin蛋白表达 用RIPA 裂解缓冲液提取Con 组、si-NC组、si-LHFPL3-AS1 组、miR-NC 组、miR-515-5p mimic 组、si-LHFPL3-AS1+miR-515-5p inhibitor 组HGC-27/DDP 细胞总蛋白。蛋白定量后,进行SDS-PAGE 和湿法转膜。25℃下5%脱脂牛奶封闭膜2h,加入1 ∶800稀释的E-cadherin、1 ∶600稀释的N-cadherin、1 ∶2000稀释的GAPDH 的一抗4℃孵育过夜。然后将膜与1 ∶1000稀释的山羊抗兔IgG二抗25℃孵育2h。用增强化学发光试剂进行显色反应,Image J 6.0 软件检测蛋白表达水平。
1.3 统计学方法
采用SPSS 20.0 软件对数据进行统计分析。实验独立重复3 次,计量资料采用均数±标准差(±s)表示,两组间数据比较采用独立样本t检验,多组间数据比较采用单因素方差分析和 SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 HGC-27 和HGC-27/DDP 对顺铂的敏感性
用不同浓度的顺铂处理 HGC-27 和 HGC-27/DDP 细胞,随着顺铂浓度增加,HGC-27 和HGC-27/DDP 细胞的存活率逐渐降低,HGC-27/DDP细胞的 IC50(236.20μmol/L)高于 HGC-27 细胞(5.83μmol/L),见图1。

图1 不同浓度顺铂对HGC-27 和HGC-27/DDP 细胞存活率的影响
2.2 LHFPL3-AS1 和miR-515-5p 在不同细胞中的表达
与GES-1 细胞比较,HGC-27 和HGC-27/DDP细胞中LHFPL3-AS1 相对水平显著升高(P<0.05),miR-515-5p 相对水平显著降低(P<0.05),见图2。与Con 组、si-NC 组比较,si-LHFPL3-AS1 A/B/C 组HGC-27/DDP 细胞LHFPL3-AS1 相对水平显著降低(P<0.05),选择 LHFPL3-AS1 相对水平较低的si-LHFPL3-AS1 C 进行实验。与Con 组、si-NC 组比较,si-LHFPL3-AS1 组HGC-27/DDP 细胞miR-515-5p相对水平显著升高(P<0.05);miR-515-5p mimic 组HGC-27/DDP 细胞miR-515-5p 相对水平显著高于miR-NC 组(P<0.05);与si-LHFPL3-AS1 组比较,si-LHFPL3-AS1+miR-515-5p inhibitor 组 HGC-27/DDP 细胞miR-515-5p 相对水平显著降低(P<0.05),见图3。

图2 GES-1、HGC-27 和HGC-27/DDP 细胞中LHFPL3-AS1、miR-515-5p 表达
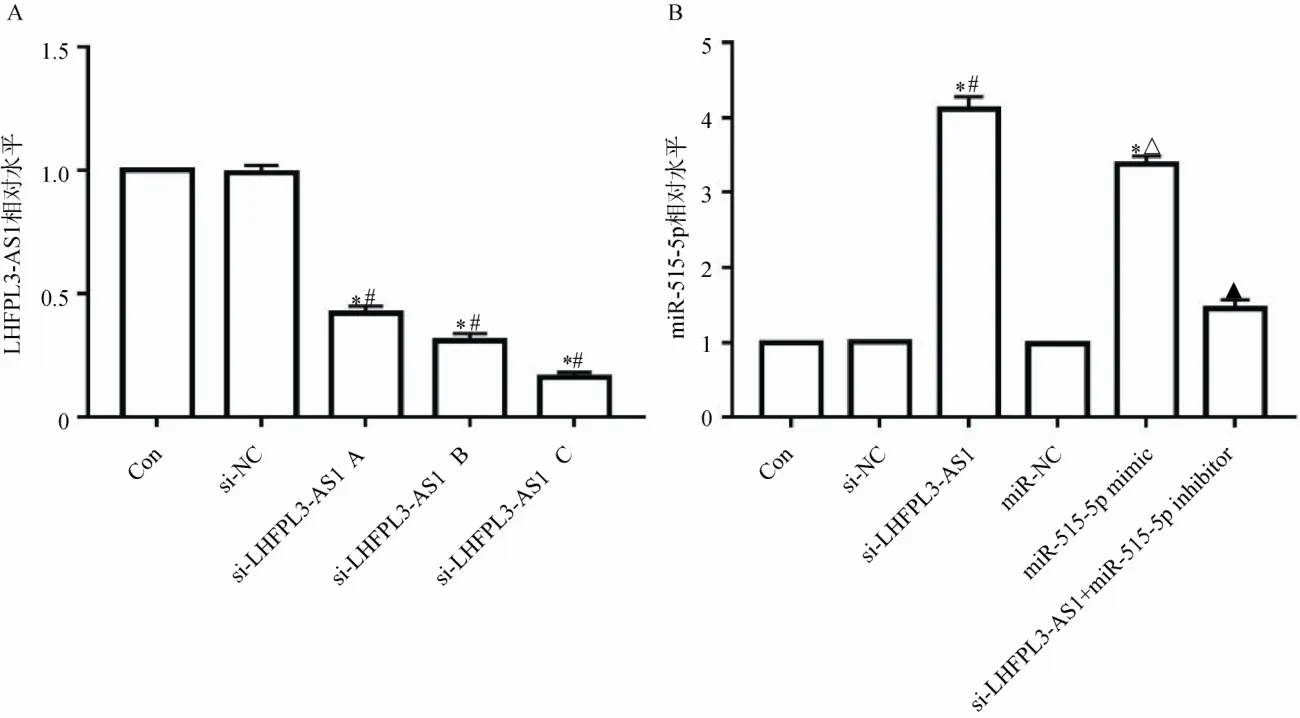
图3 各组HGC-27/DDP 细胞中LHFPL3-AS1、miR-515-5p 表达
2.3 LHFPL3-AS1 靶向miR-515-5p
DIANA Tool 数据库预测显示LHFPL3-AS1 与miR-515-5p 序列之间存在特异结合位点,见图4A。与wt-LHFPL3-AS1 共转染,转染miR-515-5p mimic后 HGC-27/DDP 细胞相对荧光素酶活性与转染miR-NC 比较显著降低(P<0.05);与mut-LHFPL3-AS1 共转染,转染miR-515-5p mimic 与转染miR-NC相比HGC-27/DDP 细胞相对荧光素酶活性差异无统计学意义(P>0.05),见图4B。
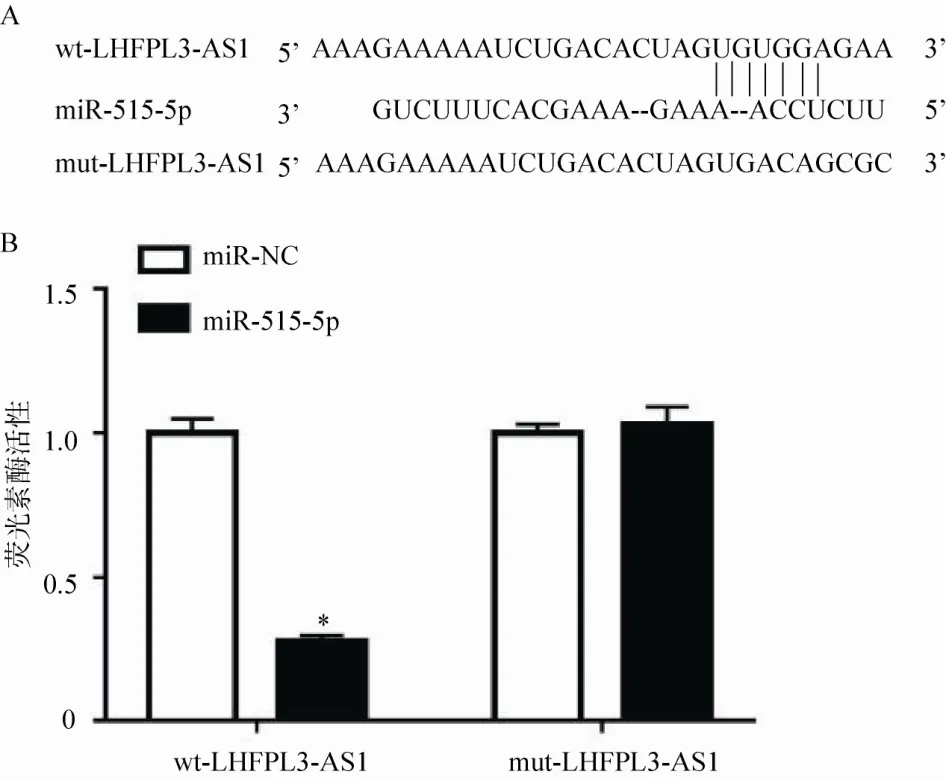
图4 LHFPL3-AS1 和miR-515-5p 的互补序列及荧光素酶活性检测
2.4 各组HGC-27/DDP 细胞的增殖活性
si-LHFPL3-AS1 组HGC-27/DDP 细胞克隆形成数、存活率均显著低于Con 组和si-NC 组(P<0.05);miR-515-5p mimic 组HGC-27/DDP 细胞克隆形成数、存活率显著低于miR-NC 组(P<0.05);si-LHFPL3-AS1+miR-515-5p inhibitor 组HGC-27/ DDP 细胞克隆形成数、存活率显著高于si-LHFPL3-AS1组(P<0.05),见表1。
表1 各组细胞的存活率、克隆形成数比较(±s)

表1 各组细胞的存活率、克隆形成数比较(±s)
注:与Con 组比较,*P<0.05;与si-NC 组比较,#P<0.05;与miR-NC 组比较,△P<0.05;与si-LHFPL3-AS1 组比较,▲P<0.05
2.5 各组细胞的迁移和侵袭能力
si-LHFPL3-AS1组HGC-27/DDP细胞的E-cadherin蛋白表达显著高于Con 组和si-NC 组(P<0.05),N-cadherin 蛋白表达、迁移数、侵袭数显著低于Con组和 si-NC 组(P<0.05);miR-515-5p mimic 组HGC-27/DDP 细胞的E-cadherin 蛋白表达显著高于miR-NC 组(P<0.05),N-cadherin 蛋白表达、迁移数、侵袭数显著低于miR-NC 组(P<0.05);si-LHFPL3-AS1+miR-515-5p inhibitor 组 HGC-27/DDP 细胞的E-cadherin 蛋白表达显著低于 si-LHFPL3-AS1 组(P<0.05),N-cadherin 蛋白表达、迁移数、侵袭数显著高于si-LHFPL3-AS1 组(P<0.05),见图5、表2。
表2 各组细胞的迁移、侵袭数比较(±s)

表2 各组细胞的迁移、侵袭数比较(±s)
注:与Con 组比较,*P<0.05;与si-NC 组比较,#P<0.05;与miR-NC 组比较,△P<0.05;与si-LHFPL3-AS1 组比较,▲P<0.05

图5 各组细胞的迁移、侵袭和E-cadherin、N-cadherin 蛋白表达
3 讨论
顺铂耐药是限制胃癌患者化疗效果的重要因素,明确胃癌顺铂耐药的机制将有助于开发新的治疗策略提高胃癌化疗敏感性。近年来,lncRNA 在胃癌化疗耐药中的作用受到广泛关注。研究发现,胃癌顺铂耐药细胞中lncRNA 带有血小板凝血酶敏感蛋白样模体的解联蛋白金属蛋白酶9 基因反义2(ADAMTS9-AS2)表达降低,其过表达可增强顺铂对耐药细胞的毒性作用,抑制顺铂耐药[8]。lncRNA NUTM2A-AS1 明显增强胃癌细胞的存活、侵袭和耐药能力,促进胃癌发生和耐药[9]。敲减lncRNA 浆细胞瘤转化迁移基因1(plasmacytoma variant ectopic 1,PVT1)可抑制耐药蛋白表达,抑制肿瘤生长,削弱胃癌细胞对顺铂的耐药性[10]。本研究发现HGC-27/DDP 细胞对顺铂的IC50值高于亲本细胞HGC-27,提示LHFPL3-AS1 表达改变可能与胃癌顺铂耐药有关。转染si-LHFPL3-AS1 干扰LHFPL3-AS1 表达可降低HGC-27/DDP 细胞存活率,并导致克隆形成、迁移和侵袭能力减弱。上皮间质转化(epithelial-mesenchymal transition,EMT)是肿瘤转移的先决条件,通过EMT 肿瘤细胞获得更强的迁移和侵袭能力[11]。先前的研究表明LHFPL3-AS1 在黑色素瘤中具有促增殖、促侵袭和促EMT 功能,E-cadherin 是上皮表型标志物,其减少和丢失表明EMT 发生变化,同时间质表型标志物N-cadherin 表达增加预示EMT 发生[12-13]。本研究中干扰LHFPL3-AS1 明显抑制N-cadherin 蛋白表达,促进E-cadherin 蛋白表达。以上研究说明干扰LHFPL3-AS1 对HGC-27/DDP 细胞增殖、迁移和侵袭均有抑制作用。
lncRNA 主要通过结合miRNA 在癌症进展中发挥调控作用[14-15]。本研究发现HGC-27 和HGC-27/DDP 细胞中miR-515-5p 相对水平低于GES-1,且证实LHFPL3-AS1 和miR-515-5p 存在相互作用。miR-515-5p 已被证实与胃癌生长和糖酵解有关[16]。miR-515-5p 作为LINC00673 的下游靶点对胃癌细胞增殖和迁移有抑制作用[17]。环状RNA 0032821 通过下调miR-515-5p 促进胃癌细胞增殖、迁移、侵袭和奥沙利铂耐药[18]。本研究发现miR-515-5p 过表达抑制N-cadherin 蛋白表达,促进E-cadherin 蛋白表达,降低HGC-27/DDP 细胞存活率、克隆形成、迁移和侵袭能力。抑制 miR-515-5p 表达还可减弱干扰LHFPL3-AS1 对HGC-27/DDP 细胞生物学行为的影响,这表明LHFPL3-AS1 至少通过靶向miR-515-5p调控HGC-27/DDP 细胞的增殖、迁移和侵袭。
总之,干扰LHFPL3-AS1 通过上调miR-515-5p可抑制胃癌细胞HGC-27/DDP 的增殖、迁移和侵袭。这些发现有助于改善胃癌细胞顺铂耐药现状,提示LHFPL3-AS1 和miR-515-5p 可能是克服胃癌顺铂耐药的潜在有效靶点。
