蛹虫草提取物对肾阳虚模型大鼠睾丸CYP19/CaM/CaMKⅡ信号的影响
2023-03-13陈思源王思雨祁明媛李垄坡徐仪昕张婷姚紫研赵洪庆
陈思源王思雨祁明媛李垄坡徐仪昕张 婷姚紫研赵洪庆*
(1.湖南中医药大学,长沙 410208;2.湖南炎帝生物工程有限公司,湖南 株洲 412000)
肾阳虚是临床最为常见的证型之一,由于患者素体阳虚、年老肾亏、久病伤肾等因素引起肾阳气衰竭,以腰膝酸软、畏寒肢冷、夜尿频多、精神萎靡、性欲减退等为主要特征,严重影响患者的生活质量。西医针对单一症状进行治疗,存在副作用多、依赖性、成瘾性及停药复发等缺点,中医药立足整体,辨证论治,能够系统调节机体肾阳虚相关症状,疗效独特,从天然产物中开发安全有效的补肾阳产品,将具有重要的临床价值及广阔的市场前景。
蛹虫草又名北冬虫夏草、北虫草,为麦角菌科、虫草属真菌,是由子实体与菌核组成的复合体,其性平味甘,具有补肺益肾、止血化痰、延缓衰老的功效[1]。现代药理研究表明,蛹虫草的活性成分主要包括虫草素、虫草酸、甾醇类及虫草多糖,具有增强免疫力、抗病毒、抗肿瘤、抗氧化、神经保护、性功能保护等作用,因其与冬虫夏草具有类似的活性成分与临床疗效,能够改善患者的肺肾气虚证及疲劳综合征,补肾壮阳,且蛹虫草易于培育,成本相对较低,近年来已逐渐成为冬虫夏草的替代品,应用广泛,具有很强的开发价值[2-3]。然而,目前关于蛹虫草的基础研究较少,其能否改善肾阳虚模型大鼠的肾阳虚状态,相关机制如何,尚未有相关报道,需要进一步的相关基础研究进行深入探讨。
芳香化酶基因CYP19是细胞色素P450超基因家族中的重要成员,主要分布于中枢神经系统及卵巢、睾丸等生殖系统相关组织中。研究表明,CYP19能够通过调控下游信号编码芳香化酶P450arom基因,后者能够催化睾酮转化为雌激素,是雌激素体内合成的关键酶和限速酶,与下丘脑-垂体-性腺(hypothalamic-pituitary-gonadal axis, HPG)轴功能密切相关[4-5]。钙调蛋白/钙调蛋白依赖的蛋白激酶Ⅱ(calmodulin/calmodulin kinase Ⅱ, CaM/CaMKⅡ)是CYP19潜在的下游信号,能够调节HPG轴功能,并与睾丸间质细胞的完整性密切相关[6]。本研究拟建立肾阳虚大鼠模型,明确蛹虫草通过增加体内CYP19的表达,进而抑制CaM/CaMKⅡ激活,从而调控HPG轴发挥补肾阳功效的作用机理。该机制的证实将首次明确CYP19/CaM/CaMKⅡ信号介导大鼠肾阳虚病理状态及蛹虫草的功效特点与潜在机制,将为蛹虫草的开发应用提供重要理论支撑。
1 材料和方法
1.1 实验动物
SD大鼠60只,雄性,SPF级,7周龄,体重200~220 g,购自湖南斯莱克景达实验动物有限公司[SCXK(湘)2019-0004],质量合格证号(430727201101573875),饲养于湖南中医药大学实验动物中心[SYXK(湘)2019-0009]。动物饲养室温度(22±2)℃,湿度(60±5)%,12 h明暗交替,适应性喂养3 d后开始实验。实验过程均符合实验动物3R原则,经湖南中医药大学实验动物伦理委员会审查通过(LLBH-202009140001)。
1.2 主要试剂与仪器
蛹虫草由湖南炎帝生物工程有限公司提供,将蛹虫草粉末用10倍量水浸泡30 min,提取两次,第一次100℃浸提120 min,提取液过200目筛,药渣继续加水浸提60 min后过200目筛,合并滤液,于60~80℃减压浓缩至相对密度1.18~1.25,冷冻干燥48 h得蛹虫草提取物;睾丸片由江西泽众制药股份有限公司生产,国药准字H36022006,生产批号:20200103,规格:36片(每片0.2 g),人用剂量为2.4 g/d;腺嘌呤(北京索莱宝科技公司,批号:20200514);大鼠促性腺激素释放激素(gonadotropinreleasing hormone, GnRH)、黄体生成素(luteinizing hormone, LH)、睾酮(testosterone, T)、雌二醇(estradiol, E2)ELISA试剂盒(江苏菲亚生物科技公司,批号:FY3396-A、FY3676-A、FY3452-A、FY3450-A);CYP19、CaM、CaMKⅡ一抗(英国Abcam公司,批号:ab106168、ab134901、ab134041);β-tubulin一抗(美国Proteintech公司,批号:10094-1-AP);BCA蛋白定量试剂盒、RIPA组织裂解液、RNA提取液(武汉赛维尔生物科技公司,批号:G2026、G2002、G3013);DAB试剂盒、荧光定量PCR试剂盒(武汉博士德生物公司,批号:AR1022、MK1613)。
ME204型万分之一精密天平购自瑞士梅特勒托利多公司;OML-QPA型生物组织切片机购自湖北欧美莱科技公司;NP-B1型全自动生物组织包埋机、NP-P3型组织摊烤片机购自孝感市诺普电子科技公司;NanoDrop One超微量分光光度计、MK3型全自动酶标仪购自美国Thermo公司;Primo Star型光学显微镜购自德国Zeiss公司;Gel Doc XR+型凝胶成像分析仪、CFX型荧光定量PCR仪购自美国Bio-Rad公司。
1.3 实验方法
1.3.1 动物处理
根据动物体重将60只大鼠随机分为正常组、模型组、蛹虫草提取物高剂量组、蛹虫草提取物中剂量组、蛹虫草提取物低剂量组、睾丸片组,每组10只。除正常组外,其余组均采用腺嘌呤(200 mg/kg)灌胃的方法建立肾阳虚大鼠模型[7-8],连续42 d,正常组灌胃等体积蒸馏水。从造模第15天起开始给予受试药,依据《中药药理研究方法学(第3版)》中人与大鼠体表面积系数换算大鼠用药剂量[9],蛹虫草提取物高、中、低剂量组给药剂量分别为0.72、0.36、0.18 g/kg(临床等效2、1、0.5倍剂量),睾丸片组灌胃给予睾丸片水溶液,给药剂量为0.216 g/kg(临床等效剂量),正常组和模型组给予等体积蒸馏水,灌胃体积均为10 mL/kg,每天给药1次,连续28 d。末次给药后,检测大鼠在体功能指标,完成后麻醉大鼠,剪开腹腔,游离腹主动脉进行采血,解剖分离双肾、睾丸、附睾、精囊腺组织,万分之一精密天平称重,保存于4%多聚甲醛溶液中,其中睾丸组织保存于特定睾丸组织固定液中,用于分子生物学实验的睾丸组织置于液氮中冷冻保存。
1.3.2 指标检测
(1)一般指标观察
观察各组大鼠行为状态、毛发、二便、饮水饮食、垫料潮湿等情况,称重,检测体温,并采用旷场箱(80 cm×80 cm×40 cm)评价动物的自主活动情况,旷场箱底部均匀划分为25个方格,动物从中心放入,其自由活动30 s后记录4 min内水平跨格数及垂直站立数的总和。
(2)脏器指数
将组织分离后于万分之一分析天平上称重,计算脏器指数=脏器重量(mg)/体重(g)。
(3)ELISA实验
采血后将血液静置1 h,3000 r/min离心15 min,取上清液,得到血清样本。采用ELISA试剂盒检测大鼠血清GnRH、LH、T、E2水平,操作过程严格按照试剂盒说明书进行。根据标准曲线计算各组样本中目的因子的含量。
(4)HE染色
组织充分固定后,石蜡包埋,以5 μm厚度连续切片,梯度乙醇脱水、浸蜡、水化、冲洗,采用苏木精-伊红进行染色,完成后将切片固定,中性树脂封片,显微镜下进行图像采集,观察各组大鼠肾、睾丸、附睾、精囊腺的病理形态并进行拍照分析。
(5)免疫组化染色
取充分固定的睾丸组织,石蜡包埋,切片、脱水、浸蜡、水化、冲洗,滴加山羊血清于37℃封闭30 min,按说明书对一抗进行稀释,采用稀释后的一抗4℃孵育过夜;次日采用PBS缓冲液洗涤切片3次,反应增强液孵育10 min后用二抗继续孵育15 min;洗涤3次,DAB显色液显色5 min后用苏木精复染15 s,脱水,透明,封片。于显微镜下选取视野进行拍摄,应用Image J软件分析目的蛋白的积分光密度(IOD)值。
(6)Western blot实验
切取100 mg睾丸组织,加入1 mL组织裂解液冰上充分匀浆,离心取上清液,检测上清液中总蛋白含量。制备分离胶和浓缩胶,将蛋白煮沸变性后上样,上样量为50 μg,80 V恒压电泳,转膜,脱脂奶粉封闭2 h,加入按说明书稀释后的一抗,4℃孵育过夜。次日用TBST液洗涤条带3次,每次15 min,加入二抗继续孵育4 h,洗涤条带3次,滴加混合显影液,将条带置于凝胶成像仪中显影。应用Image J软件分析条带灰度值,目的蛋白的相对表达量为目的蛋白条带灰度值除以内参蛋白(β-tubulin)灰度值。
(7)RT-qPCR实验
切取100 mg睾丸组织,按照RNA提取试剂盒说明书提取组织总RNA,以mRNA为模板,利用逆转录酶将RNA逆转录成cDNA,再以cDNA为模板进行PCR扩增,反应体系为:95℃、10 min预变性,95℃、15 s变性,60℃、30 s退火延伸,40个循环。采用经典2-ΔΔCT法(Liva法)根据内参基因GAPDH的表达分析目的基因mRNA的表达水平。引物由武汉赛维尔公司合成,其中CYP19引物序列(NM_017085.2):上游 5’-GCTGGACACTTCTAACAC GCTCTT-3’,下 游 5’-CTCCTTTGTCAGGTCTCC ACGT-3’,片段长度298 bp;GAPDH引物序列(NM_017008.4):上游 5’-CTGGAGAAACCTGCCAA GTATG-3’,下游5’-GGTGGAAGAATGGGAGTTGCT-3’,片段长度138 bp。
1.4 统计学方法
采用SPSS 19.0软件进行数据分析。本研究实验数据均以平均数±标准差(±s)表示,采用单因素方差分析,多重比较方差齐时用LSD检验法,方差不齐时用Tambane’sT检验法,P<0.05为差异有显著性。
2 结果
2.1 蛹虫草提取物对模型大鼠一般指标的影响
正常组大鼠行为活动、饮水摄食均正常,有明显的探索欲,毛色光亮整洁,垫料较干净,大便成形;模型组大鼠外形消瘦,垫料明显潮湿,大便稀薄不成形,体温降低(P<0.01),自主活动次数显著减少(P<0.01);蛹虫草提取物组大鼠行为活动较正常,毛色亮洁,垫料较脏,潮湿程度一般,大便基本成形,高剂量组体温升高(P<0.05),自主活动次数增加(P<0.05)。见表1。
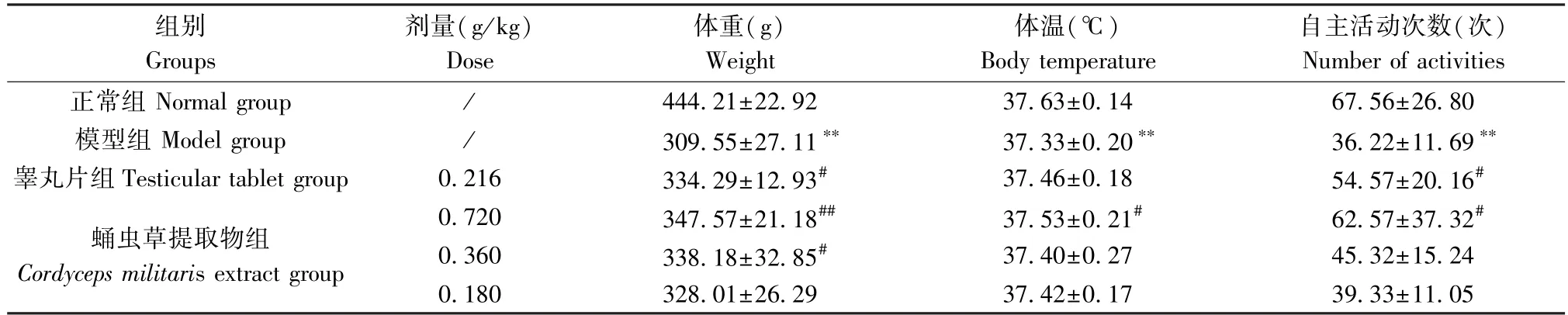
表1 蛹虫草提取物对模型大鼠体重、体温及自主活动次数的影响 (n=10)Table 1 Effects of Cordyceps militaris extract on body weight, body temperature and the number of voluntary activities in model rats
2.2 蛹虫草提取物对模型大鼠脏器指数的影响
与正常组相比,模型组大鼠肾脏指数、睾丸指数显著增加(P<0.01),精囊腺指数降低(P<0.01);与模型组相比,蛹虫草提取物高剂量组肾脏指数与睾丸指数显著降低(P<0.05),精囊腺指数增加(P<0.05),同时,中剂量组与低剂量组肾脏指数均显著降低(P<0.05)。见表2。
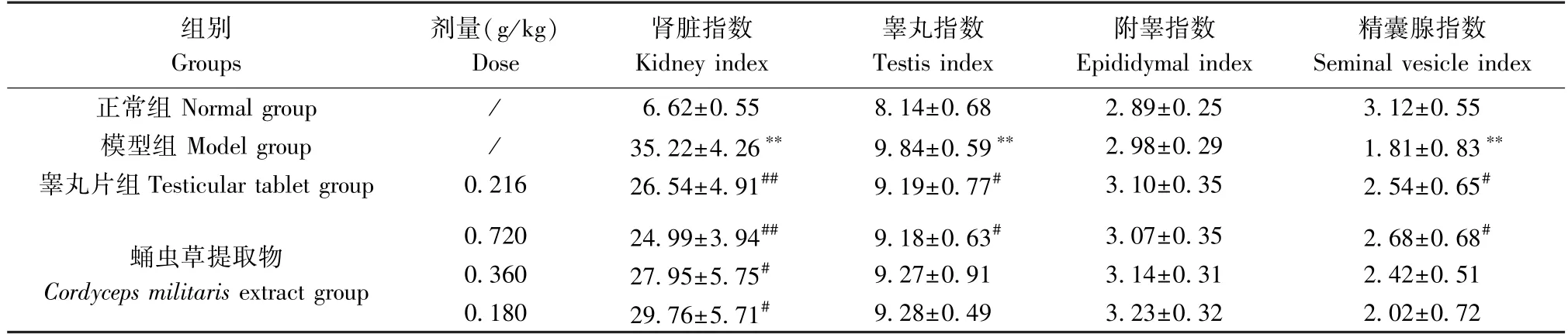
表2 蛹虫草提取物对模型大鼠脏器指数的影响 (mg/g, n=10)Table 2 Effects of Cordyceps militaris extract on the organ index of model rats
2.3 蛹虫草提取物对模型大鼠血清因子水平的影响
与正常组相比,模型组血清GnRH、LH、T含量均显著降低(P<0.01),E2含量无显著变化;与模型组相比,蛹虫草提取物高剂量组GnRH、LH、T含量均升高(P<0.05),睾丸片组仅睾酮含量显著升高(P<0.01)。见表3。
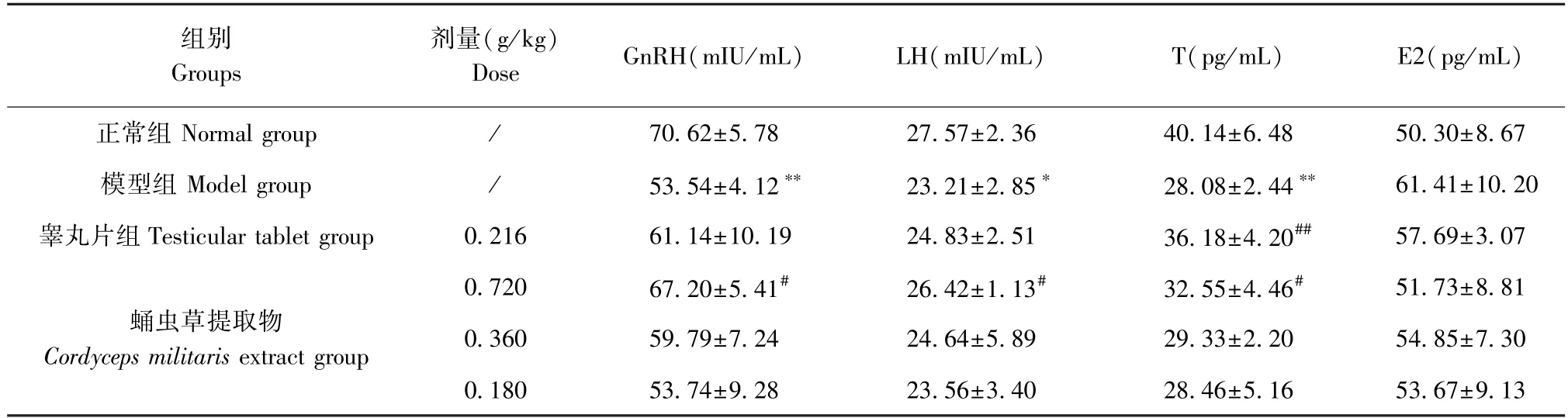
表3 蛹虫草提取物对模型大鼠血清因子的影响 (n=6)Table 3 Effects of Cordyceps militaris extract on serum factors in model rats
2.4 蛹虫草提取物对模型大鼠组织病理形态的影响
正常组大鼠肾组织肾小球形状规则,轮廓清晰,未观察到炎性细胞的浸润;睾丸生精小管基膜完整且厚,基膜内可见排列整齐、致密且结构正常的生精细胞及支持细胞,生精小管管腔内可见大量精子;附睾管腔结构清晰,管壁细胞排列紧密整齐,管壁较厚;精囊腺腺腔内有许多皱襞,表面为假复层柱状上皮,内含有丰富的分泌颗粒、脂肪滴及脂褐素;模型组肾小球体积增大,基底膜明显扩张,通透性增加,伴有大量炎性细胞的浸润,部分大鼠可见明显的腺嘌呤代谢物结晶累积;睾丸生精小管基膜变薄,基膜内生精细胞排列紊乱,数量减少,生精小管腔内间隙增大,精子数量减少;附睾部分管腔拉伸变形,管壁变薄,部分管壁破裂,偶可见碎片,管腔内精子数量下降;精囊腺腺腔皱襞萎缩变薄,通透性增加,内含物丰度减少。经药物治疗后,各脏器损伤有不同程度的缓解,以蛹虫草提取物高剂量组效果最佳。见图1。
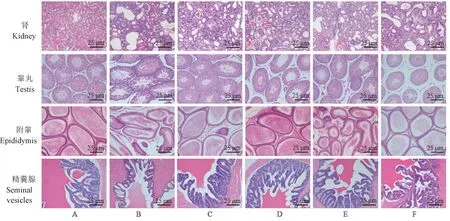
图1 蛹虫草提取物对模型大鼠组织形态的影响 (HE染色)Figure 1 Effects of Cordyceps militaris extract on the tissue morphology of model rats (HE staining)
2.5 蛹虫草提取物对模型大鼠睾丸CYP19、CaM、CaMK Ⅱ阳性表达的影响
与正常组相比,模型组睾丸组织CYP19平均光密度值显著下降(P<0.01) ,CaM、CaMK Ⅱ显著增加(P<0.01);与模型组相比,蛹虫草提取物高剂量组CYP19平均光密度值升高(P<0.01),CaM、CaMK Ⅱ降低(P<0.01),中剂量组CYP19表达增加(P<0.05),CaM降低(P<0.01)。见图2、表4。
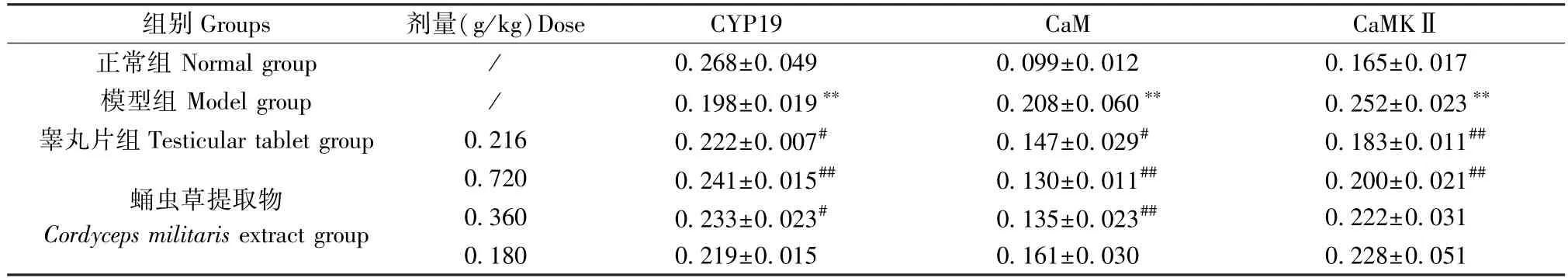
表4 蛹虫草提取物对模型大鼠睾丸CYP19、CaM、CaMKⅡ平均光密度值的影响 (n=4)Table 4 Effects of Cordyceps militaris extract on the average optical density of CYP19, CaM and CaMKⅡ in the testis of model rats
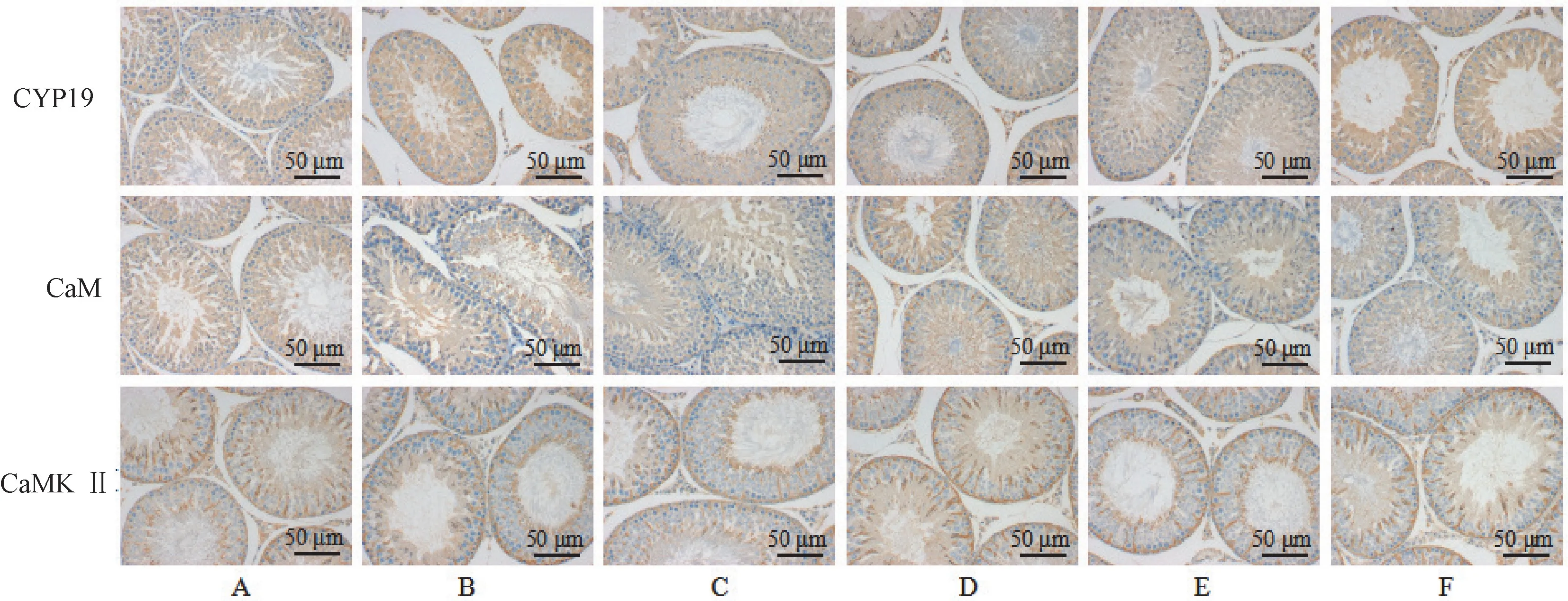
图2 各组大鼠睾丸CYP19、CaM、CaMKⅡ阳性表达情况 (免疫组化)Figure 2 The positive expression of CYP19, CaM and CaMKⅡ in testis of rats in each group (immunohistochemistry)
2.6 蛹虫草提取物对模型大鼠睾丸CYP19、CaM、CaMK Ⅱ蛋白表达的影响
与正常组相比,模型组大鼠睾丸CYP19蛋白表达显著降低(P<0.01),CaM、CaMK Ⅱ显著增加(P<0.01);经睾丸片或高剂量蛹虫草提取物干预治疗后,模型大鼠CYP19、CaM、CaMK Ⅱ蛋白表达均得到有效逆转(P<0.01、P<0.05),中剂量组对CYP19、CaMK Ⅱ表达也有显著作用(P<0.05)。见图3、表5。
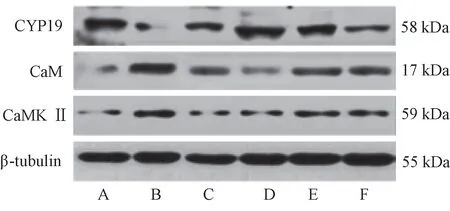
图3 各组大鼠睾丸CYP19、CaM、CaMK Ⅱ蛋白电泳图Figure 3 Electrophoresis of CYP19, CaM and CaMKⅡ proteins in testis of rats in each group
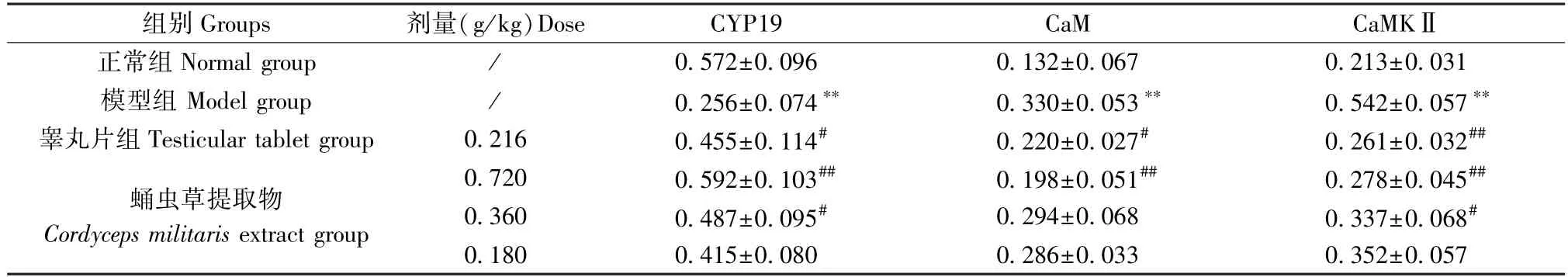
表5 蛹虫草提取物对模型大鼠睾丸CYP19、CaM、CaMKⅡ表达的影响 (n=4)Table 5 Effects of Cordyceps militaris extract on the expression of CYP19, CaM and CaMKⅡ in the testis of model rats
2.7 蛹虫草提取物对模型大鼠睾丸CYP19 mRNA表达的影响
与正常组相比,模型组睾丸CYP19 mRNA表达显著降低(P<0.01) ;与模型组相比,睾丸片组和蛹虫草提取物高剂量组CYP19 mRNA水平显著升高(P<0.05)。见表6。
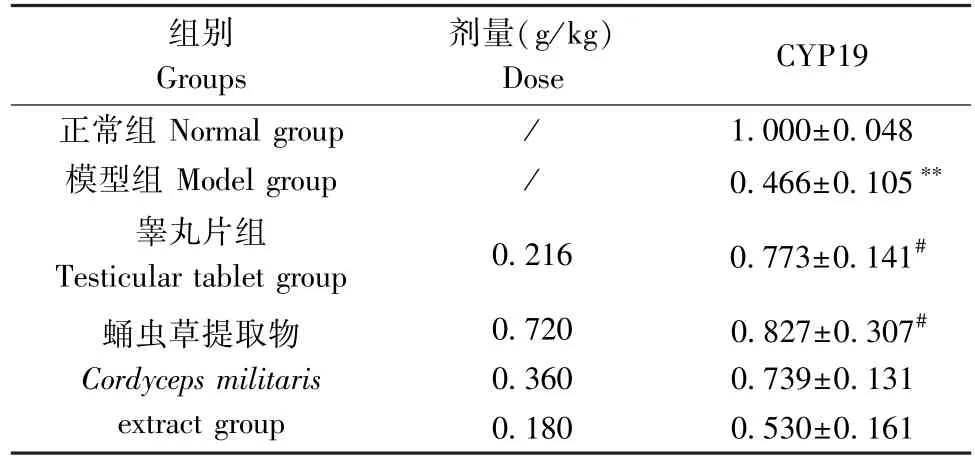
表6 蛹虫草提取物对模型大鼠睾丸CYP19 mRNA表达的影响 (n=4)Table 6 Effects of Cordyceps militaris extract on the expression of CYP19 mRNA in the testis of model rats
3 讨论
《中华本草》中记载,虫草入肺肾二经,既能滋肺阴,又能补肾阳,主治肾虚,阳痿遗精,腰膝酸痛,病后虚弱等。现代药理研究证实,蛹虫草具有肾保护作用。Sun等[10]研究表明,蛹虫草通过影响Toll样受体4/核因子κB(toll-like receptor 4/nuclear factor κB, TLR4/NF-κB)氧化还原信号通路改善慢性肾疾病;Cai等[11]发现蛹虫草通过调控沉默信息调节因子1(silent information regulator 1, SIRT1)介导的自噬改善大鼠肾性高血压损伤和肾纤维化;李冰等[12]研究发现蛹虫草提取物能够同时发挥降血糖和肾保护作用,减缓糖尿病大鼠肾病程进展;此外,蛹虫草对慢性肾衰、肾小球肾炎、肺肾气虚证等病证也有一定的治疗作用[13-15]。蛹虫草肾保护作用主要与虫草素以及多糖类成分有关。Kopalli等[16]明确来源于药用真菌蛹虫草的虫草素能够减轻自然衰老大鼠体内炎症介导的肾和睾丸组织损伤;虫草素还具有补肾益精、改善性功能的功效[17],蛹虫草多糖则是蛹虫草治疗糖尿病肾病的主要有效成分[18]。然而,目前关于蛹虫草对肾阳虚模型动物的研究仅限于小鼠的在体功能及组织病理变化[19],未涉及相关机制,对于蛹虫草的开发有一定局限。本研究旨在建立肾阳虚大鼠模型,通过予以不同剂量的蛹虫草提取物干预,研究其补肾阳的功效及潜在作用机理。
肾阳虚病理模型主要包括大剂量激素造模、化学药物诱导损伤、手术造模、自然衰老等,其中应用最广泛的是激素造模中的氢化可的松致肾阳虚模型及药物造模中的腺嘌呤致肾阳虚模型,且两者原理均是通过影响机体内分泌轴的功能而引起肾阳虚症状[20-21]。腺嘌呤是核酸的主要组成成分之一,当机体摄入大剂量腺嘌呤时,在酶的作用下转变成极难溶解于水的2,8-二羟基腺嘌呤,沉积于肾小管,导致肾功能低下,同时其具有毒性作用,使肾组织中与糖、脂肪、蛋白质代谢有关的多种酶活性受到抑制,影响肾组织的能量代谢[22]。经文献调研及前期预实验摸索,本研究采用200 mg/kg剂量的腺嘌呤造模,发现大鼠外形消瘦、皮毛无光泽、活动减少、体温降低、尿量明显增多、大便稀溏,表现出典型的肾阳虚症状,模型建立成功。
HPG轴是机体三大功能轴之一,主要负责调控机体生殖功能。中医认为肾主生殖,肾与生殖系统功能关系密切,肾虚与HPG轴功能异常亦密切相关[23]。HPG轴通过下丘脑分泌GnRH,作用于垂体释放促卵泡生成素 (follicle-stimulating hormone, FSH) 、LH,该类激素的合成分泌又进一步作用于性腺组织,调节睾酮、雌二醇等性激素的分泌并反馈于下丘脑,从而调节机体生殖功能[24]。肾阳虚通常伴随着生殖功能的衰退,性激素分泌紊乱,在雄性中主要表现为睾酮分泌不足。本研究发现,模型大鼠体内GnRH、LH、睾酮含量均显著下降,雌二醇含量有上升趋势,同时肾、睾丸、附睾、精囊腺等与生殖相关的组织均存在明显损伤,而蛹虫草提取物能够上调HPG轴相关激素的水平,恢复HPG轴功能,缓解生殖组织的损伤状态。
CYP19是细胞色素P450超基因家族中19号家族的唯一成员,负责编码芳香化酶P450arom基因,后者与性腺激素的合成分泌密切相关。一方面,CYP敲除的雄性小鼠不能产生雌激素,导致生精细胞发育受阻,精子数量及活性明显降低,小鼠生殖功能低下甚至完全不育[25];另一方面,睾丸组织CYP19的过表达会导致雌激素产生过多,也可引起不育[26]。CYP19基因主要通过cAMP依赖性蛋白激酶信号在转录水平进行调节,对于维持雌雄激素间的平衡、保证机体的正常生理功能具有重要意义[27]。CaM/CaMKⅡ信号通路是cAMP依赖性蛋白激酶信号传导系统的重要组成部分。CaM是一种钙结合蛋白,静息态下无生物活性,在胞内Ca2+增加时,CaM会结合形成Ca2+/CaM复合物,并通过激活其特异性激酶CaMKⅡ发挥生物学活性[28-29]。CaM与垂体-靶腺轴的分泌功能密切相关,可以作用于HPG轴的不同环节、不同层次,并通过不同的途径对其进行着复杂而精细的调节作用。研究表明,CaM表达增加可以通过线粒体途径引起睾丸细胞凋亡,抑制CaMKⅡ能够缓解内质网应激和氧化损伤,提高睾丸间质细胞的完整性[30]。本研究发现,模型大鼠睾丸组织CYP19 mRNA和蛋白表达均显著降低,CaM、CaMKⅡ表达显著增加,证实CYP19通过CaM/CaMKⅡ信号通路介导大鼠生殖损伤,而蛹虫草提取物则能明显逆转该趋势。
综上,蛹虫草提取物能够调节HPG轴功能,缓解肾、睾丸等组织损伤,发挥补肾阳功效,其机制可能与调控CYP19/CaM/CaMKⅡ信号有关。本研究首次阐明蛹虫草补肾阳的潜在机理,有助于进一步开发应用,下一步继续挖掘其功效作用及潜在靶点。
