线粒体铁蛋白调控上皮-间质转化对非小细胞肺癌细胞顺铂耐药的影响
2023-03-13赵峻秀霍明洋陈振宇白雪松马洪波郗艳丽
赵峻秀霍明洋陈振宇白雪松马洪波郗艳丽*
(1.吉林医药学院公共卫生学院,吉林 吉林 132013; 2.延边大学基础医学院,吉林 延边 133002)
肺癌是全球致死率最高的恶性肿瘤,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)大约能占肺癌总数的80%~85%[1-2]。多数肺癌患者确诊时已处于临床晚期,临床上缺少疗效显著的治疗药物,生物靶向药物的针对性强,很多患者因基因配型不符而错失最佳治疗机会。此外,许多肺癌患者对临床常用的化疗或放射疗法存在耐药,导致肺癌患者的5年生存率较低,仅有4%~17%[3]。顺铂(cisplatin,DDP)是临床上常用的抗肿瘤药物,抗癌谱广,与多种抗肿瘤药物有协同作用、且无交差耐药[4],但顺铂的单独长期使用会造成患者耐药[5]。研究发现,肺癌患者的顺铂耐药可能诱导上皮-间质转化(epithelial-mesenchymal transition,EMT)过程,抑制肺癌细胞的EMT过程,可能会有效抑制肺癌细胞的耐药与侵袭[6]。持续性铁过载能促进胰腺癌细胞发生EMT过程[7]。在乳腺癌细胞中,通过抑制膜铁转运蛋白的表达可以促使细胞内铁浓度升高,进而导致EMT发生[8]。由此推测,铁过载可能与肿瘤细胞的耐药及EMT过程有关。线粒体铁蛋白(ferritin mitochondrial,FtMt)是一种定位在线粒体上、与铁代谢密切相关的蛋白,具有组织受限性表达的特点,由于其mRNA上缺乏铁依赖的、能翻译调控铁反应元件的共有序列,所以它的翻译不受铁反应元件(iron resposive element,IRE)-铁调节蛋白(iron regulatory protein,IRP)机制的调控,而该机制被认为是调控细胞铁稳态的重要机制[9-10]。已证实FtMt参与了线粒体中的铁调节并维持线粒体内铁稳态[11],但目前关于FtMt在肺癌细胞耐受顺铂及EMT过程中的作用尚不清楚。为此,本研究通过比较顺铂耐药细胞株A549/DDP与非耐药细胞株A549之间FtMt表达水平、EMT过程及相关信号通路的差异,探索FtMt与顺铂耐药和EMT之间的关系,为进一步了解肺癌的发病机制提供实验依据。
1 材料和方法
1.1 细胞
人非小细胞肺癌A549细胞株(中国科学院典型培养物宝藏委员会细胞库);人非小细胞肺癌顺铂耐药细胞株A549/DDP(长春晶美生物工程有限公司)。
1.2 主要试剂与仪器
胎牛血清(以色列BI);RPMI-1640培养基(美国Hyclone);凋亡检测试剂盒(南京诺唯赞生物科技有限公司);线粒体铁蛋白一抗(Ferritin mitochondrial,FtMt)、E-钙黏蛋白、N-钙黏蛋白、βactin、HRP-Goat Anti-Rabbit IgG、HRP-Goat Anti-Mouse IgG(武汉三鹰生物技术有限公司);cDNA合成试剂盒(北京康润诚业生物科技有限公司);BeyoFastTMSYBR Green qPCR Mix和线粒体提取试剂盒(碧云天生物技术);顺铂(cisplatin,DDP)(美国sigma);引物(生物工程上海股份有限公司)。
NBS Galaxy 170S二氧化碳培养箱(德国,Eppendorf);Epoch 多功能酶标仪(美国BioTek);C6流式细胞仪(美国BD);7500 FastPCR仪(美国ABI);Mastercycler nexus gradient梯度PCR仪(德国Eppendorf);IX73活细胞工作站(日本奥林巴斯);Mini-Protean电泳槽、Mini Trans-Blot转印槽和Gel Doc XR凝胶成像系统(美国Bio-Rad)。
1.3 实验方法
1.3.1 细胞凋亡检测
A549细胞以2×105个/孔接种于6孔板,在含有10%胎牛血清、1%青霉素和链霉素的RPMI-1640培养液(完全培养液)中,37℃、5% CO2培养箱中培养过夜。A549/DDP细胞培养于富含10%胎牛血清、1%青霉素和链霉素、2 μg/mL DDP的RPMI-1640培养液(完全培养液)中,37℃、5% CO2培养箱中培养。按如下分组给予受试物处理:对照组加入2 mL的不完全培养液(不含血清,其余同完全培养液),给药组分别加入相同体积的1.0、2.5和5.0 μg/mL的顺铂溶液(不含血清,其余同完全培养液)。37℃、5% CO2培养箱中培养24 h,消化并收集细胞,离心去上清,向沉淀中加入预冷的PBS洗涤细胞1次,加入195 μL Annexin V-FITC结合液重悬细胞。加入5 μL Annexin V-FITC和10 μL的PI染色液,混匀,室温避光孵育20 min,立即上机检测。实验重复3次。
1.3.2 细胞周期检测
细胞处理同1.3.1。处理终点后,用1×PBS洗3次,消化并收集细胞,1000 r/min离心3 min,弃上清,向沉淀中加入70%冷乙醇,4℃固定过夜,PBS洗涤,RNaseA 在37℃孵育30 min。1000 r/min离心3min,弃上清,加入0.5 mL、10 μg/mL的PI溶液,室温避光反应30 min。PBS洗去未结合染色液,立即上机检测。实验重复3次。Modfit软件分析结果。
1.3.3 蛋白表达检测
A549和A549/DDP细胞接种于6孔板,37℃、5% CO2培养24 h后,用1×PBS洗3次,每孔加入100 μL细胞裂解液,冰浴10 min,待细胞裂解完全,移入1.5 mL EP管中,100℃变性15 min,3000 r/min离心5 min后,取上清进行Western blot检测Ecadherin和N-cadherin的表达水平。按照线粒体提取试剂盒说明书步骤,提取线粒体,检测FtMt蛋白表达水平。通过Image Lab 软件对蛋白印迹进行分析,以β-actin为内参计算蛋白的相对含量。
1.3.4 mRNA表达水平检测
细胞处理同1.3.1。处理终点后,胰蛋白酶消化收集细胞,1000 r/min离心5 min,去上清留沉淀,加入1 mL TRIzol,冰浴15 min以充分裂解,加入0.2mL氯仿并剧烈摇荡15 s,12 000 r/min离心15min,留取上清,加入0.5 mL异丙醇,静置10 min,12 000 r/min离心10 min,弃上清后加入1 mL、75%预冷乙醇,7500 r/min离心5 min后弃上清,37℃干燥后,加入20 μL DEPC水融解。用提取的RNA作为模板,按照试剂盒说明书的步骤合成cDNA,并进行Real-time PCR检测。以GAPDH为内参,反应条件为:95℃ 2 min,95℃ 15 s,60℃ 15 s,共进行35个循环。扩增后采用2-ΔΔCt法计算目的基因的相对表达量。引物序列参照PrimerBank,见表1。

表1 引物序列Table 1 Primer sequences
1.3.5 细胞迁移检测
细胞以2×105个/皿接种30 mm培养皿,待细胞贴壁后,用20 μL枪头在培养皿底部画一条直线,制备出细胞划痕区域。加入不完全培养液洗净划痕区域残留的细胞脆片,分别加入2 mL不同浓度的顺铂溶液,置于活细胞工作站,观察细胞迁移情况。观察时间为24 h。每个实验重复3 次,利用Image J 软件统计分析划痕区域的宽度。宽度=24 h划痕区域的宽度/0 h划痕区域的宽度。
1.4 统计学方法
SPSS 16.0 软件进行数据处理,所有数据均用平均数±标准差(±s)表示,各组间均数比较采用单因素方差分析(One-way ANOVA),组间两两比较采用最小显著差法(LSD)检验,检验水准α=0.05,P<0.05表示差异有显著性。
2 结果
2.1 细胞凋亡的比较
结果显示,随着顺铂给药剂量的增加,细胞凋亡率和坏死率逐渐增多。5.0 μg/mL顺铂组A549细胞早期凋亡、晚期凋亡和坏死率均显著高于0、1.0和2.5 μg/mL顺铂组(P<0.05)。1.0和2.5 μg/mL顺铂组A549细胞早期凋亡、晚期凋亡和坏死率虽高于0 μg/mL顺铂组,但比较差异无统计学意义(P>0.05)。1.0、2.5和5.0 μg/mL顺铂组A549细胞之间早期凋亡、晚期凋亡和坏死率比较,差异无统计学意义(P>0.05)。1.0、2.5和5.0 μg/mL顺铂组A549/DDP早期凋亡率显著高于0 μg/mL顺铂组(P<0.05)。5.0 μg/mL顺铂组A549/DDP早期凋亡率显著高于1.0和2.5μg/mL顺铂组(P<0.05)。5.0 μg/mL顺铂组A549/DDP细胞晚期凋亡率显著高于0 μg/mL顺铂组(P<0.05)。与A549细胞5.0 μg/mL顺铂组比较,A549/DDP细胞的早期凋亡率、晚期凋亡率和坏死率显著降低(P<0.05)。与A549细胞1.0 和2.5 μg/mL顺铂组比较,A549/DDP细胞的坏死率显著降低(P<0.05)。见表2和图1。

图1 不同浓度顺铂处理下A549和A549/DDP细胞凋亡率及坏死率的流式图Figure 1 Flow cytometry of apoptosis rate and necrosis rate of A549 and A549/DDP cells under different concentrations of cisplatin

表2 A549和A549/DDP细胞凋亡率及坏死率的比较(%)Table 2 Comparison of apoptosis rate and necrosis rate between A549 and A549/DDP cells
2.2 细胞周期的比较
与0 μg/mL顺铂组比较,5.0 μg/mL顺铂组A549细胞G0/G1期显著降低(P<0.05);2.5和5.0 μg/mL顺铂组A549细胞S期显著升高(P<0.05)。5.0 μg/mL顺铂组A549细胞G2/M期显著低于0、1.0和2.5 μg/mL顺铂组(P<0.05)。各剂量组A549细胞凋亡率之间比较有显著差异(P<0.05)。1.0和2.5 μg/mL顺铂组A549/DDP细胞G2/M期显著高于0 μg/mL顺铂组;5.0 μg/mL顺铂组A549/DDP细胞G2/M期显著低于0、1.0和2.5μg/mL顺铂组。5.0 μg/mL顺铂组A549/DDP细胞凋亡率显著高于0、1.0和2.5μg/mL顺铂组(P<0.05)。2.5和5.0 μg/mL顺铂组A549/DDP细胞G0/G1期显著高于A549细胞(P<0.05)。0 μg/mL顺铂组A549/DDP细胞S期显著高于A549细胞(P<0.05),G2/M期显著低于A549细胞(P<0.05)。5.0 μg/mL顺铂组A549/DDP细胞S期显著低于A549细胞(P<0.05)。1.0、2.5和5.0 μg/mL顺铂组A549/DDP细胞凋亡率显著低于A549细胞(P<0.05)。见表3和图2。
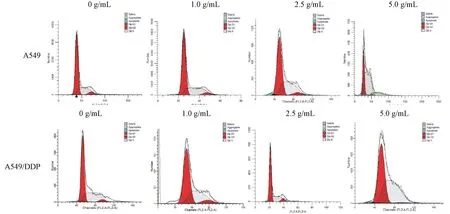
图2 不同浓度顺铂处理下A549和A549/DDP细胞周期的流式图谱Figure 2 Flow cytometry of A549 and A549/DDP cell cycles under different concentrations of cisplatin

表3 A549和A549/DDP细胞周期的比较(%)Table 3 Comparison of cell cycle between A549 and A549/DDP
2.3 E-cadherin和N-cadherin表达水平的比较
由结果可知,与A549细胞比较,A549/DDP细胞中E-cadherin表达水平虽降低,但比较差异无统计学意义(t=1.919,P>0.05);A549/DDP细胞中N-cadherin表达水平显著升高,比较差异有统计学意义(t=4.162,P<0.05)。见图3。
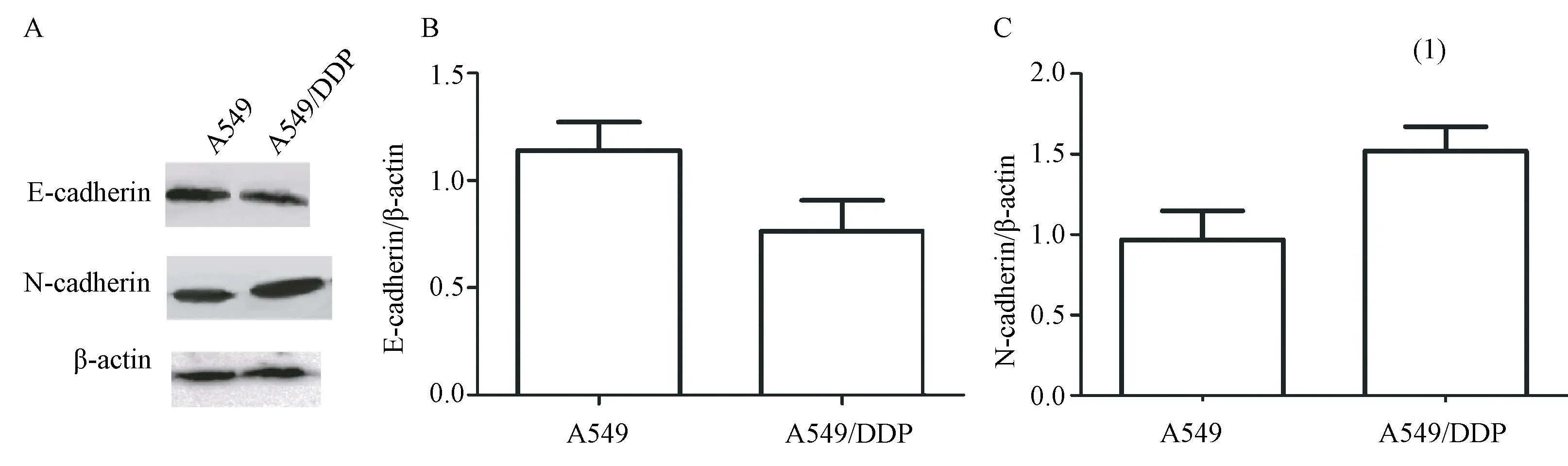
图3 A549和A549/DDP细胞E-cadherin和N-cadherin的表达水平Figure 3 Expression levels of E-cadherin and N-cadherin in A549 and A549/DDP cells
2.4 EMT信号通路的比较
结果显示,与A549细胞比较,A549/DDP细胞中E-cadherin mRNA水平降低,但比较差异没有统计学意义(t=0.570,P>0.05);A549/DDP细胞中N-cadherin、snail、slug和vimentin的mRNA水平显著升高(t=8.469,t=8.768,t=5.793,t=7.118,P<0.05);Twist的mRNA水平虽然显著升高,但比较差异无统计学意义(t=2.819,P>0.05)。见图4。

图4 A549和A549/DDP细胞EMT信号通路的比较Figure 4 Comparison of EMT signaling pathways in A549 and A549/DDP cells
2.5 细胞迁移的比较
由结果可知,与A549细胞比较,A549/DDP细胞伤口划痕区域面积显著升高(t=6.745,P<0.05),表明A549/DDP细胞迁移的速度显著快于A549细胞。见图5。

图5 A549和A549/DDP细胞迁移的比较Figure 5 Comparison of A549 and A549/DDP cell migration
2.6 FPn、DMT1、hepcidin和TfR1的mRNA水平比较
由图6可知,与A549细胞比较,A549/DDP细胞中DMT1 mRNA水平虽降低,但比较差异无统计学意义(t=2.112,P>0.05)。FPn、hepcidin和TfR1 mRNA水平显著升高,且比较差异有统计学意义(t=5.385,t=2.893,t=5.611,P<0.05)。
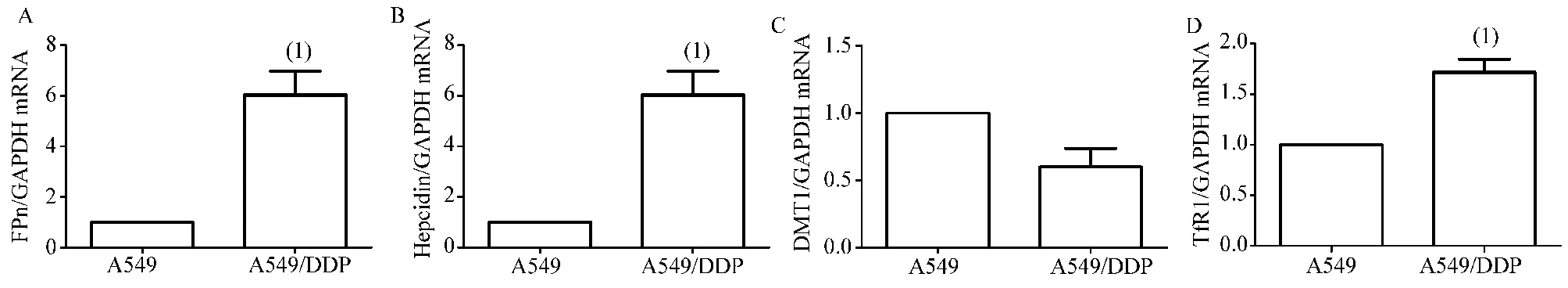
图6 A549和A549/DDP细胞中FPn、DMT1、铁调素和TfR1的mRNA水平Figure 6 mRNA levels of FPn, DMT1, hepcidin and TfR1 in A549 and A549/DDP cells
2.7 FtMt表达水平的比较
由结果可知,与A549细胞比较,A549/DDP细胞中FtMt蛋白表达水平显著升高(t=2.804,P<0.05)。见图7。

图7 A549和A549/DDP细胞中FtMt的表达水平Figure 7 Expression level of FtMt in A549 and A549/DDP cells
3 讨论
NSCLC是常见的恶性肿瘤之一,临床对于NSCLC的治疗往往采用以铂类为基础的化学联合治疗,部分患者治疗2~3年后对铂类会产生继发性耐药[12]。耐药细胞具有更强的侵袭转移特性,晚期NSCLC患者常死于铂类耐药后的广泛转移,寻找NSCLC铂类化疗耐药机制一直是医学界研究的热点[13]。构建铂类耐药的肺癌细胞系将有利于探寻其耐药机制。在本研究中,购买了一株肺癌顺铂耐药细胞株A549/DDP,在深入探讨肺癌耐药机制之前,首先验证了购买的A549/DDP细胞的顺铂耐药性。通过研究发现,A549/DDP细胞与A549细胞经顺铂处理后,A549/DDP细胞的存活率显著高于A549细胞,凋亡率和坏死率显著低于A549细胞。这表明A549/DDP细胞是顺铂耐药细胞系。
研究证实,顺铂可通过与肿瘤细胞DNA结合形成交叉键,从而抑制其复制[14]。当DNA受损后,细胞停滞在G0/G1期,此时细胞发生修复,容易使化疗药物无效[15]。若细胞周期大量停滞在G2/M期,细胞周期调控系统会发生失衡,可诱发肿瘤细胞失控性生长[16]。本研究结果显示,1.0~5.0 μg/mL顺铂处理后,A549细胞的细胞周期主要停留在G0/G1期和G2/M期,随着顺铂给药剂量的增加,A549细胞停留在G0/G1期和G2/M期的细胞数量逐渐降低,即在1.0~5.0 μg/mL范围内,A549细胞未发生顺铂耐药,细胞凋亡率随着顺铂给药剂量增加而增加。顺铂可以更好地与肺癌细胞DNA稳定结合,抑制肺癌细胞的自我修复,从而诱导肺癌细胞A549发生凋亡。1.0~5.0 μg/mL顺铂处理后,随着顺铂给药浓度的增加,进入G0/G1期和G2/M期的A549/DDP细胞数量先升高后降低。在顺铂低剂量给药条件下(1.0~2.5 μg/mL),其诱导的A549/DDP细胞凋亡率升高的不十分显著,此时A549/DDP细胞发生了顺铂耐药;当顺铂给药剂量增加到5.0 μg/mL时,其诱导的A549/DDP细胞凋亡率显著升高,此时A549/DDP细胞的耐药性因顺铂给药剂量的增加而得到缓解。但在临床治疗中,顺铂给药剂量的增加,可能会导致出现肝肾组织毒性,引起严重的副作用。因而在临床治疗中,顺铂给药剂量不能随意增加,顺铂的耐药性亦不能得到有效的控制。
EMT是指在特定生理病理条件下,具有极性的上皮细胞失去极性,向间质细胞表型转化,使其具有运动能力且能在细胞基质间自由运动,具有间质表型的细胞对化学药物的敏感性降低,但向周围组织及远端器官侵袭、迁移的能力增强[17]。E-cadherin的减少和N-cadherin的升高是EMT发生的重要标志,此时细胞间的粘附能力下降,运动能力和粘附能力增强[18]。波形蛋白(vimentin)是细胞间质表型的重要标志,能使细胞的空间结构发生变化,增加细胞的迁移与侵袭能力[19]。机体内参与调控EMT过程的关键转录因子包括锌指蛋白、snail、slug、twist等,其中snail、slug和twist的研究最为多见[20]。Snail、slug、ZEB1、E12/E47和SIP1均是转录抑制因子snail超家族的成员,该家族成员的结构非常相似,C-末端含有锌指DNA结合区域,N-末端含有SNAG结构域[21]。Snail、slug与EMT的进展有关[22]。下调snail和slug水平,可以逆转EMT过程[23]。Twist与恶性肿瘤转移密切相关,在NSCLC肺癌组织中高表达。减少twist的表达可通过抑制N-钙黏蛋白表达抑制癌细胞侵袭[24]。Twist作为碱性螺旋-环-螺旋转录因子的家族成员,是多种肿瘤的不良预后因子[25]。大量研究表明,EMT过程与肺癌的获得性耐药有关,抑制肺癌细胞的EMT过程,可能会有效抑制肺癌细胞的耐药与侵袭[26]。本研究结果显示,A549/DDP细胞迁移速度显著快于A549细胞,且A549/DDP细胞中的E-cadherin表达水平和mRNA水平低于A549细胞,N-cadherin和vimentin蛋白的表达水平和mRNA水平显著高于A549细胞,参与EMT过程的snail、slug和twist的mRNA水平高于A549细胞。这一结果表明,A549/DDP细胞不仅存在顺铂耐药,还具备较高的细胞侵袭和迁移能力,即肺癌细胞的顺铂耐药与EMT过程有关,肺癌细胞发生顺铂耐药,预示着其可能会同时发生远端转移。
FtMt是一种由染色体5q23.1上无内含子基因编码的线粒体定位的铁存储蛋白,具有与铁蛋白重链同源结构,该结构有助于在FtMt的壳结构中储存铁[11,27-28]。FtMt主要在高耗氧量和高代谢活性的细胞中表达,如精母细胞、神经元和心肌细胞。FtMt会随着线粒体中铁的增加而增加,但在肝和脾中的FtMt表达相对较低,而这两个部位的细胞质内储存了大量的铁。FtMt的水平似乎与线粒体丰度的相关性大于铁代谢的相关性[29]。FtMt作为铁库,储存铁的能力大于细胞质铁蛋白[30-31]。FtMt增加时会促进铁从胞质向线粒体重新分布,加入铁螯合剂后,这种作用会增强。FtMt对铁的强烈储存作用解释了为什么大多数细胞一直保持低水平的FtMt[31]。目前关于FtMt在肺癌细胞中的表达情况研究较少,本课题组之前研究发现,在肺癌细胞A549中检测到了FtMt mRNA的表达,通过给予顺铂后,线粒体中FtMt mRNA水平下调[32]。这提示FtMt在肺癌细胞中可能有重要作用,但具体机制尚不十分清楚。本研究发现,A549/DDP细胞中的FtMt蛋白表达水平显著高于A549细胞,这提示在肺癌细胞耐受顺铂的过程中,存在着FtMt蛋白表达水平的变化,FtMt在肺癌细胞耐受顺铂过程中可能发挥了重要作用,但具体作用机制有待进一步研究。
铁转运蛋白(ferroportin,FPn)、二价金属离子转运蛋白1(divalent metal transporter 1,DMT1)和转铁蛋白受体1(transferrin receptor1,TfR1)均是细胞中负责参与铁运输的重要信号因子。其中,FPn是目前唯一已知的铁输出蛋白,而铁调素是一种铁稳态调节激素,可以与FPn结合,以防止铁外流[33-34]。在本研究中,A549/DDP细胞中DMT1和FPn mNRA水平显著高于A549细胞,这提示A549/DDP细胞中的铁代谢比A549细胞活跃。
组织可以通过TfR1从血液中吸收转铁蛋白结合铁,DMT1可介导内吞小泡上转铁蛋白-TfR1复合物上的铁进入细胞浆[35]。当铁负荷时TfR1和DMT1表达会下调[36]。在本研究中,A549/DDP细胞中DMT1 mRNA水平虽低于A549细胞,但比较差异无统计学意义。这提示DMT1可能不是造成A549/DDP与A549细胞中铁代谢差异的主要基因。而A549/DDP细胞中TfR1 mRNA水平显著高于A549细胞,提示TfR1参与了肺癌顺铂耐药细胞的铁代谢,TfR1的高表达可能是肺癌顺铂耐药细胞中铁代谢紊乱的重要机制之一。此外,Nie等[31]研究发现,细胞转染FtMt以后,细胞中的TfR1的表达水平会升高,这一结论与我们的结果相似。
综上所述,肺癌细胞的顺铂耐药与EMT过程有关,肺癌细胞发生顺铂耐药的同时可能也发生了侵袭和转移。肺癌细胞顺铂耐药过程中,存在着FtMt蛋白表达水平的变化,提示FtMt在肺癌细胞耐受顺铂过程中可能发挥了重要作用。铁代谢紊乱可能与肺癌细胞顺铂耐药有关。但具体作用机制有待进一步研究。下一步会通过构建过表达载体或敲除载体进一步评价FtMt在EMT和顺铂耐药过程中的作用,为非小细胞肺癌发病机制的探讨提供更多的实验数据。
