大豆蛋白凝胶制备及其影响因素的研究进展
2023-03-12朱秀清邓筱琪王喜泉李玉玲夏晓雨
朱秀清,邓筱琪,朱 颖, ,王喜泉,李玉玲,夏晓雨,4
(1.哈尔滨商业大学食品工程学院,黑龙江省谷物食品与谷物资源综合加工重点实验室,黑龙江哈尔滨 150076;2.东北农业大学食品工程学院,黑龙江哈尔滨 150030;3.哈尔滨中央红集团股份有限公司,黑龙江哈尔滨 150010;4.黑龙江省农业科学院大豆研究所,黑龙江哈尔滨 150086)
大豆分离蛋白(soybean protein isolate,SPI)具有优质、廉价的特点且功能特性广泛,在许多行业被广泛使用[1]。大豆粉碎后经低温脱脂、碱溶酸沉工艺后提取即可得到SPI,SPI中大豆蛋白含量达到88%以上[2]。大豆分离蛋白具有许多功能特性,如凝胶性[3−6]、乳化性[7−8]、持水性[9]、持油性[10]以及溶解性等。SPI的功能特性与其中7S(β-conglycinin)和11S(glycinin)组分密切相关。因此,探究蛋白质组成结构的构效关系是研究与开发大豆分离蛋白产品的基础。
近些年来,大豆蛋白制品越来越丰富,应用十分广泛,其中蛋白凝胶制品受关注度最高。蛋白凝胶是指大豆蛋白经变性后与相邻的蛋白分子之间通过化学作用力形成的一类三维网络结构,也可与转谷氨酰胺酶、硫酸钙(CaSO4)等相互作用形成蛋白凝胶制品。蛋白凝胶作为包埋不稳定小分子活性物质(维生素、益生菌等)的载体,其凝胶特性也是蛋白质最重要的功能特性[11]。影响大豆蛋白凝胶形成的因素可分为两大类:内在因素和外在因素。其中内在因素主要是大豆蛋白的组成(7S蛋白、11S蛋白以及两种蛋白存在的浓度和比例、盐离子浓度以及多糖、脂质与蛋白之间的相互作用等);而外部环境因素则是物理、化学及生物等前处理方式引起大豆蛋白改性导致的凝胶性改变(如热处理、超声波处理、高压处理、挤压处理、菌诱导和酶水解等)[12−13]。研究表明:在不同因素影响下大豆蛋白产生凝胶,天然大豆蛋白聚集体的稳定性较差,其结构在持续发生解离,变性蛋白聚集体的稳定时间一般为一周左右,这表明蛋白质在变性时形成了更加持久稳定的化学键以维持聚集体,从而提高蛋白凝胶制品的稳定性[2]。
凝胶的形成是多种因素共同作用的结果,各因素的变化会导致形成具有不同性质差异的凝胶。本文主要通过综述前人对蛋白质凝胶形成机理及稳定性的研究,对大豆蛋白构象及组成、多糖、脂质间的相互作用等内在影响因素,以及物理、化学、生物等前处理加工方式进行深入探讨及解析。
1 蛋白质凝胶成胶机理
蛋白质凝胶的形成是一个复杂的过程,包含蛋白质变性、解离、聚集和凝胶化等多个物理化学反应,目前普遍认为加热是蛋白质胶凝过程中必不可少的步骤[14]。蛋白质分子受热导致蛋白质变性,天然蛋白质的构象发生改变,蛋白质的二、三、四级结构遭到破坏,使蛋白质分子从天然的折叠状态舒展开,内部隐藏的活动位点以及功能性基团暴露(包括巯基或疏水基团),然后通过疏水、静电及氢键、巯基二硫键等交换反应进行相互作用,使分子间进行交联,形成可逆的蛋白质聚集体,导致粒径增大。当聚集体的浓度足够时,分子间发生进一步的聚集,形成三维网络状结构,即蛋白凝胶形成[15−17]。而当蛋白质的浓度较低时,聚集可能会导致蛋白质发生沉淀。除热处理外,还有加酸、加酶、加盐以及离子诱导等方式均可形成蛋白质凝胶[18−21],其中加酸通过改变体系pH,影响蛋白所带净电荷数,从而改变蛋白存在的点和环境,影响凝胶的形成;加盐或离子诱导则是通过改变蛋白与蛋白间或蛋白与环境间的静电斥力,影响蛋白分子量的分布和蛋白粒径的大小,从而影响凝胶的形成,大豆蛋白冷凝胶通常就是通过添加盐、植酸等凝固剂形成的,见图1。
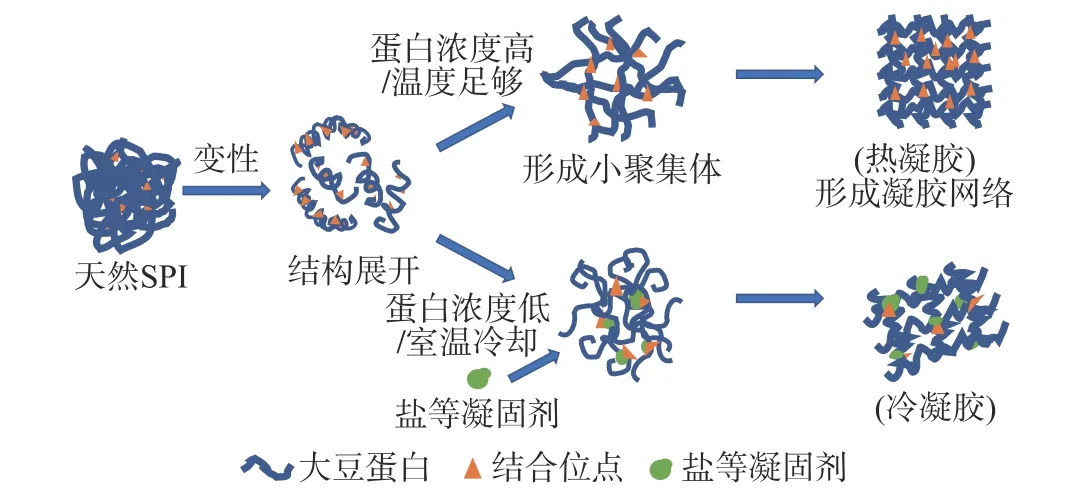
图1 大豆蛋白热、冷凝胶形成机理Fig.1 Soy protein hot and cold gel formation mechanism
李云[22]通过加热、加酸及加酶三种不同的处理方式,制备了5种具有不同功能特性的大豆蛋白聚集体,将其与天然大豆蛋白混合后制成热凝胶,结果表明添加少量的蛋白聚集体可提高大豆蛋白的凝胶性质,但过量的蛋白聚集体则会使大豆蛋白的凝胶性降低。Yang等[23]发现,低pH处理能够明显提高SPI的疏水性和糖基化能力,增强凝胶粒子在溶液中的稳定性。因此,蛋白聚集对凝胶质构的影响主要是在微观形态上对相分离程度和胶凝速度产生影响。
2 7S、11S蛋白组成对蛋白凝胶的影响
按照溶解特性,可将大豆蛋白分为球蛋白与清蛋白,其中球蛋白大约占总蛋白质含量的90%。根据蛋白质在缓冲液(pH7.6,0.5 mol/L)中的沉降系数不同,又可将大豆球蛋白分为四个组分,分别是:2S(15%)、7S(34%)、11S(41.9%)和 15S(9.1%)[24]。2S 组分包含:Bowman-Birk 和 Kunitz 型胰蛋白酶抑制剂、细胞色素C等[15]。7S组分主要是β-伴大豆球蛋白,但也包含γ-伴大豆球蛋白、脂肪氧合酶、α-淀粉酶和凝集素[25]。11S蛋白和15S蛋白分别是大豆球蛋白和它的聚合体。研究表明,不同比例的7S蛋白与11S蛋白会影响大豆蛋白质的凝胶性,通过调节二者比例可以形成具有不同凝胶特性的大豆蛋白凝胶[26]。因此,亚基组成比例对大豆蛋白功能性的影响一直是相关学者研究的重点。
2.1 7S蛋白组成对大豆蛋白凝胶的影响
7S球蛋白是一种三聚体共轭型的糖蛋白(150~200 kDa),由α亚基(72 kDa)、α′亚基(76 kDa)和β亚基(53 kDa)三种亚基组成,该三种亚基通过氢键及疏水相互作用力随机排列组合在一起,形成平面三角形紧密堆积成7S蛋白分子[27−29],并形成七种不同的存在形式:βββ、ββα′、ββα、βαα′、βαα、ααα′和ααα[30−32]。不同亚基组成导致蛋白质凝胶化效果不同,同时亚基间的相互作用也会影响蛋白质凝胶的稳定性。
7S球蛋白的α′亚基(76 kDa)与α亚基(72 kDa)分子质量极其相似,通常作为一个对象进行研究。在研究α´与α亚基对大豆蛋白的凝胶特性的影响中,该两种亚基均表现出了与凝胶特性的显著相关性。袁德保等[31]探讨了大豆蛋白α、α´、β与碱性亚基各亚基间的热聚集凝胶化行为机制,结果指出α、α´和β亚基对蛋白的热聚集反应均起到抑制作用,其中α、α′亚基抑制效果强于β亚基。Mohamad等[33]对比完整7S蛋白与缺失α′亚基的7S蛋白制备的内脂豆腐凝胶,缺少α′亚基的豆腐凝胶硬度较高,故推断7S蛋白α′亚基对内脂豆腐硬度和凝胶强度产生了明显的负作用。
2.2 11S蛋白组成对大豆蛋白凝胶的影响
11S球蛋白是一种六聚体型的非糖蛋白(300~380 kDa),由酸性亚基A(35~37 kDa)和碱性亚基B(20 kDa)通过二硫键作用组成11S球蛋白单体[34−35]。Utsumi等[36]根据11S球蛋白酸性亚基和碱性亚基的N-端氨基酸序列将11S球蛋白亚基区分为以下五个主要的亚基:A1aB1b、A1bB2、A2B1a、A3B4和A5A4B3。
11S蛋白凝胶形成是11S蛋白亚基相互作用的结果。Nakamura等[37]揭示了11S蛋白凝胶形成的机理(图2):在短时加热过程中(约15 s),蛋白质分子形成包含6个11S蛋白亚基的线状聚集体Ⅰ(链Ⅰ),此时线状聚集体Ⅰ中的蛋白亚基仍是球状;接着线状聚集体Ⅰ发生自身聚集,形成长度较长的直链聚集体Ⅱ(链Ⅱ),直链聚集体Ⅱ进一步与自身发生聚集形成长度更长的直链型聚集体或与线状聚集体Ⅰ形成支链型聚集体,统称聚集体Ⅲ(链Ⅲ),该聚集体Ⅲ即为构成11S蛋白凝胶网络结构的基本单位。
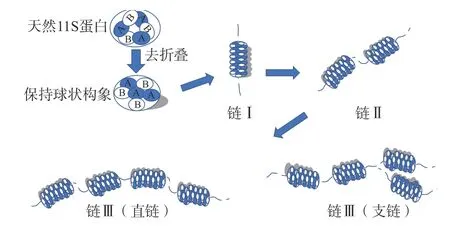
图2 11S大豆球蛋白凝胶化形成聚合物过程Fig.2 11S soybean globulin gel forming polymer process
James等[38]通过选取11S球蛋白完整以及缺失11SA4亚基的大豆来制备豆腐,结果表明11SA4亚基缺失对豆腐凝胶组织结构及硬度具有积极影响,因此缺失该亚基可以提高豆腐的凝胶硬度以及保水能力。Yang等[39]探讨不同蛋白含量大豆蛋白11SA4亚基的缺失与其中7S和11S蛋白水平的相关性关系时发现,11SA4亚基的缺失与大豆蛋白凝胶的保水力呈正相关。在蛋白质含量较高时选择性去除11SA4亚基可以提高凝胶组织硬度和保水能力。这和James的研究结果相似。Bainy等[40]在对蛋白质亚基组成与大豆分离蛋白的凝胶特性的相关性研究中发现:11S球蛋白的A3亚基的存在阻碍了凝胶网状结构的形成。Tezuka等[41]的研究证实,大豆中11S蛋白A1和A2亚基含量较多更易发生聚集。综上所述,11S蛋白的亚基组成对蛋白凝胶的性质有显著影响。
2.3 7S和11S蛋白比例对大豆蛋白凝胶的影响
7S伴大豆球蛋白主要影响蛋白凝胶的黏性和弹性,11S大豆球蛋白影响的则是蛋白凝胶的硬度和咀嚼性。两种蛋白的影响效果并不是独立的,在Yang等[39]的研究中发现11SA4亚基的缺失会引起7S蛋白的代偿性积累。因此,应综合分析7S和11S蛋白对凝胶性的影响。截止目前,可以确定两种蛋白的占比不同形成的凝胶性质有显著差异。Ji等[42]发现11S蛋白占比较高时形成的豆腐凝胶具有较强的硬度和内聚力。Nakamura等[37]的研究得出了相似的结论:在相同的条件下对比11S和7S蛋白形成的凝胶,发现11S蛋白凝胶的强度要强于7S蛋白凝胶。为探讨两种蛋白形成凝胶的差异来源,单独加热两种组分,7S蛋白不会生成凝胶或只形成透明且较为柔软的凝胶,11S蛋白则形成硬度和黏弹性较高的凝胶。通过对其结构进行对比分析发现,产生这种差异的原因是11S蛋白在形成凝胶的过程中形成了较多的二硫键[43]。
随着研究的不断深入,更多的实验数据表明,在加热过程中7S蛋白和11S蛋白的变性温度不同,7S蛋白的变性温度高于11S蛋白[44]。加热凝胶化过程中向11S蛋白中加入分离的7S蛋白可防止11S蛋白及其亚基的热聚集,而当两种蛋白共同加热凝胶化时,11S的B亚基和7S的β亚基通过静电力优先缔合[45−46]。He等[47]证实了这个结论,当加热温度高于11S蛋白的变性温度后,11S蛋白的AB亚基均会发生不同程度的变性解离,解离后的肽链B会通过静电相互作用与7S的β亚基形成可溶性的复合物B-β,或与自身通过疏水相互作用形成致密且体积更大的聚集体,而酸性亚基A与α、α´亚基则通过二硫键相互作用形成寡聚体或单体(图3)。这种聚集体B-β被认为是大豆蛋白凝胶强度较大的直接原因。王洪晶[25]的研究证实了这个结论,他发现可溶性的蛋白聚集体会增强蛋白凝胶的物化性质,而不溶性的蛋白聚集体则会破坏蛋白凝胶的物化性质。在凝胶过程中,蛋白亚基间的共价作用使不溶性的蛋白聚集体无法解离或充分伸展,因而阻碍凝胶的形成。
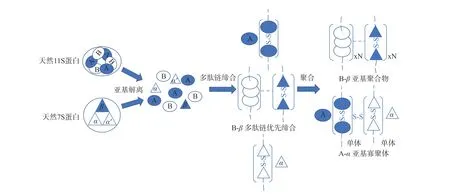
图3 7S与11S蛋白热处理过程中的相互作用Fig.3 7S and 11S proteins interaction in the process of heat treatment
综上所述,11S、7S两种蛋白组分均会对蛋白凝胶产生影响。当只有11S蛋白存在时,形成了含有较多二硫键的蛋白凝胶,故其凝胶硬度明显强于只有7S蛋白存在时形成的凝胶。当两种组分同时存在时,11S蛋白碱性亚基B与7S蛋白β亚基形成可溶性聚合物,这种聚合物以沉淀的形式聚集,而A亚基与α亚基形成的单体或寡聚体以不溶性聚合物的形式聚集在上清液中,故认为B-β聚合物会对蛋白凝胶硬度产生直接影响。随着体系中11S蛋白组分含量的提高或7S蛋白组分含量的降低,蛋白质凝胶的物化性质随之提高。因此选择具有特定蛋白组分的专有大豆品种进行大豆蛋白的加工研究可能是日后大豆蛋白加工研究的新基础。
3 内在因素对大豆蛋白凝胶的影响
3.1 蛋白浓度对大豆蛋白凝胶的影响
蛋白质在不同浓度具有不同的热稳定性,这种性质是蛋白浓度对凝胶产生影响的重要原因之一。Yang等[39]的研究发现,大豆蛋白含量与蛋白凝胶质地的硬度间具有正相关效应。Elise等[48]的研究得到类似的结论,在豆浆酸化形成凝胶过程中,蛋白质浓度不会对凝胶形成的pH产生影响,但会显著影响凝胶硬度,蛋白浓度为7%的豆浆形成凝胶其硬度显著强于4%形成的凝胶。这是因为随蛋白质浓度的增加,蛋白质分子之间的距离缩短,蛋白质分子间碰撞机会增多,因而更容易发生聚集,形成更加密集的三维网络结构。
Tian等[49]研究在相同条件下(pH7,0 mmol/L NaCl),7S蛋白的溶液浓度从0.5 mg/mL 增大到10 mg/mL,7S蛋白的净电荷显著增加,蛋白间的静电斥力增大,促进7S蛋白结构的展开和重排。其次,在蛋白质浓度较高的条件下,蛋白质热聚集体的相对分子质量更大,并且凝胶开始形成的温度降低。Su等[3]在对大豆分离蛋白-蛋清复合凝胶进行研究时发现,复合凝胶的硬度、弹性和持水性会随着蛋白质浓度的增加而增加。综上,当蛋白浓度增加,形成的凝胶具有更好的弹性和持水性,这对凝胶的性能具有积极的影响。
3.2 盐离子浓度对大豆蛋白凝胶的影响
蛋白质溶液中加入一定浓度盐离子后,会影响体系的pH和凝胶形成时间[50]。7S和11S蛋白的变性温度随着盐浓度增加逐渐升高,影响蛋白质凝胶的形成。随着盐离子浓度增加,7S蛋白形成凝胶的时间延长,得率降低,但凝胶的稳定性增加[51]。
盐离子可促进蛋白质分子的聚集。王逢秋节等[52]发现添加MgCl2显著地改变了豆腐凝胶的整体特性,形成质地均匀且致密地豆腐凝胶。Chen等[53]的研究发现体系中加入低浓度的盐离子可以屏蔽蛋白质分子间的静电斥力,内部的酸、碱性亚基暴露,蛋白质间的相互作用增强而发生聚集。Tang等[19]的研究得出了类似结论,在pH2.0,温度为80 ℃的条件下对大豆7S蛋白体系添加NaCl,随着NaCl浓度的增加,大豆7S蛋白的纤维数量、长度增加,对形成凝胶有积极作用。Geng等[54]证实了以上结论,通过添加盐离子(磷酸盐)改变蛋白体系内的离子强度,离子强度的改变引起离子的静电屏蔽效应,改变蛋白聚集体间排斥力,有利于蛋白解离后的重聚集,促进凝胶的形成。
盐离子浓度与大豆蛋白凝胶地形成密切相关,形成的凝胶其凝胶微观结构以及凝胶强度等凝胶特性都与盐离子浓度呈高度依赖性。盐诱导形成的大豆冷凝胶制品如MgCl2卤水豆腐等已被广泛应用于食品领域。
3.3 其他内在因素对大豆蛋白凝胶的影响
除上述因素外,大豆组成体系中还存在脂质、多糖等物质,也会对蛋白凝胶产生不同程度的影响。脂质作为蛋白凝胶的颗粒填充物,对凝胶的质构等特性也起着重要作用。不同脂肪浓度和含量的差异,对蛋白凝胶有显著影响。
研究表明脂质会与蛋白质聚集体之间进行相互作用,促进蛋白质凝结,增强蛋白凝胶的硬度,使其具有更紧密的蛋白网络[55]。Dian等[56]通过向SPI中添加不同类型和浓度的脂肪制成凝胶,添加的脂肪作为填充物改善了凝胶的硬度和性能,添加无水乳脂的SPI其凝胶性能优于添加棕榈油硬脂和添加大豆油的SPI凝胶,当无水乳脂添加浓度为2%时最佳。李菊芳[57]将磷脂添加到大豆蛋白粉中制成凝胶,结果表明磷脂的复合对凝胶硬度、内聚性、弹性均产生重要影响。这表明脂质在一定程度上有助于大豆蛋白凝胶网络的形成,适量的脂质会改善大豆蛋白的凝胶特性,而脂质添加量过量或不足都会造成蛋白凝胶性质的减弱。
多糖通过与蛋白质之间的相互作用来改变蛋白凝胶化行为。Zhao等[58]向SPI中添加不同种类的多糖后采用硫酸钙诱导形成凝胶,其中添加了魔芋胶的蛋白凝胶结构最为致密,实验发现魔芋胶通过增强氢键使蛋白凝胶的断裂应力增强,促进胶凝形成,增强凝胶强度。Wang等[59]研究发现凉粉草多糖富含羟基和羧基,可以促进大豆蛋白进一步聚集,使添加了凉粉草多糖的大豆蛋白凝胶具有良好的凝胶特性及流变学特性。
4 外在因素对大豆蛋白凝胶的影响
目前学术研究上常用于蛋白加工的前处理方式有热处理、超声处理、高压均质处理、挤压预处理等物理方式,还有通过酶改性,以及菌类诱导等生物改性方法。前处理一般通过改变蛋白的二、三级结构从而使蛋白变性。
4.1 热处理对大豆蛋白凝胶的影响
大豆蛋白的热变性被认为是形成凝胶的先决条件。热处理会导致大豆蛋白发生不可逆变性,内部隐藏的疏水基团暴露出来并参与疏水相互作用,蛋白二、三级结构被破坏,肽链展开后发生重折叠形成新的蛋白结构,这是大豆蛋白形成凝胶所必需的。
加热温度对大豆蛋白凝胶的影响主要是基于不同加热温度下,大豆蛋白具有不同的变性程度,而蛋白质变性是凝胶形成的必要条件。在加热过程中,大豆蛋白亚基发生解离和重排。Lakshmanan[60]与Nik 等[61]均证明大豆蛋白在约60~70 ℃和85~90 ℃表现出两个峰值变性温度,分别对应7S和11S的变性温度。Nagano等[62]研究温度对7S和11S蛋白动态流变性质的影响,随着加热温度的升高,蛋白质凝胶形成所需的时间减少,得率增加。Renkema等[63]测定了76~94 ℃内不同温度下蛋白质的变性程度与凝胶弹性模量相关性,结果表明在变性温度范围内随温度的升高,蛋白质变性程度增大,凝胶的弹性模量也越大,硬度越强。Wu等[64]将加热温度从85 ℃提高到100 ℃,大豆蛋白凝胶的破碎力增加了3倍,形成了结构更坚硬的大豆蛋白凝胶。加热时间同样对大豆蛋白的变性具有重要影响,将加热时间从30 min延长到120 min,凝胶的破碎力增加了三分之一,但继续延长加热时间凝胶的破碎力反而下降。Zhang等[18]对比其他方法变性SPI制备形成的蛋白凝胶,发现热湿变性SPI形成的凝胶具有更紧密的凝胶网络结构以及更高的表面疏水性。这表明热变性对SPI的凝胶性是具有正效应的,热处理是一种相对安全且有效的处理手段。
4.2 超声预处理对大豆蛋白凝胶的影响
超声波是一种频率高于20000 Hz的声波,近年来广泛运用于食品的物理加工领域,尤其是蛋白、膳食纤维、多糖及各种食品功能成分的改性与提取中。Hu等[65]在实验中发现超声波可通过破坏非共价相互作用改变聚集体的粒径、表面疏水性、自由巯基含量等,改变蛋白质间的二硫键、疏水作用力等化学作用力,从而获得物化性质各异的大豆蛋白凝胶。王小英等[66]研究了超声波对大豆蛋白组分的改性作用,发现在蛋白浓度为12.5 mg/mL时在超声功率为700 W的条件下处理20 min,大豆蛋白的NSI(nitrogen solubility index,NSI)值提高为原来的5.9倍。超声处理后的大分子组分明显增多,小分子组分降低,使蛋白质发生聚集行为。Zhao等[67]在研究中证实了蛋白质的聚集行为,超声-热处理使大豆蛋白的平均粒径减小,表面疏水性和游离巯基含量均增加,改变了SPI的二、三级结构,具体表现为SPI中的α-螺旋和β-折叠有序结构增多,微观结构比未超声处理的SPI凝胶更加致密,形成了结构均匀、致密的改性蛋白凝胶。
Tian等[68]的研究发现,超声处理不仅可以提高SPI凝胶的生成速度,还增强了凝胶的储能模量、凝胶强度和持水性。研究中发现超声处理会破坏蛋白体系中的非共价相互作用,导致肽键断裂,从而引起结构改变,暴露其中的作用位点,达到促进凝胶点快速形成,加速凝胶形成的效果。Huang等[69]的研究发现超声通过空化效应产生的剪切力能有效减小蛋白聚集体的尺寸,使较大的蛋白聚集体解离成初级聚集体,大豆蛋白的二、三级结构发生改变。Ogemdi等[70]证实了这个观点,认为较长时间的高强度超声(High Intensity Ultrasound, HIU)处理,其超声空化效应只改变SPI的二、三级结构,增强蛋白溶解性和表面疏水性,提高凝胶性能,但并不会影响蛋白质氨基酸的组成,因此超声后的大豆蛋白被认为是更适用于应用的食品成分。
但超声处理也会对SPI凝胶产生负面作用。刘冉等[71]采用不同功率的超声波对SPI凝胶进行处理发现,低功率的超声波会减弱SPI凝胶的形成能力;高功率的超声波会使SPI发生降解,影响蛋白质分子间的交联,延迟凝胶的形成时间;只有中功率(200~600 W)的超声波处理通过改变SPI的黏弹结构,使SPI发生更为有序的交联作用,能明显提高SPI的凝胶性能。
4.3 高压均质预处理对大豆蛋白凝胶的影响
高压均质(High-pressure homogenization,HPH)处理具有高剪切力、高压力作用,可以改变蛋白质原有的刚性二级结构。适度改变蛋白间的相互作用力,可改变蛋白的空间构象,是一种安全、有效的物理方法。吕博等[72]研究表明,经高压均质处理,随均质压力的上升(0~40 MPa),大豆分离蛋白内部疏水基团暴露,展开的多肽链里暴露的官能团经疏水相互作用聚集形成致密的三维凝胶网络结构,其凝胶特性和溶解性均得到了显著改善。
Wang等[73]发现,随着高压均质压力上升为200 MPa时,大豆蛋白的游离巯基含量显著增加,随着压力进一步上升,游离巯基含量降低,破坏了蛋白质分子间的疏水性结构区域,改变了分子间的作用力平衡,使蛋白大分子热聚集体转为小分子的聚集体,热致凝胶的凝胶性能下降。同样的,Kang等[74]的研究中发现,高压均质会导致大豆蛋白变性,其中它们的解离缔合行为会引起大豆球蛋白中7S/11S组分的变化。Bi等[75]研究了均质压力对大豆蛋白凝胶特性的影响,发现高压均质能够增加SPI中凝胶形成的活性位点,提高SPI的凝胶形成能力,缩短SPI酸诱导凝胶的形成时间。
因此可以发现,高压均质是通过高剪切、高压改变蛋白聚集体二、三级结构和蛋白分子构象使蛋白变性,经高压均质处理会缩短SPI形成凝胶的时间,同时也会增强蛋白凝胶的凝胶特性,使其具有更强的粘弹性、持水性和凝胶强度,形成结构更为致密均匀的凝胶。
4.4 挤压预处理对大豆蛋白凝胶的影响
除以上物理方法外,挤压也是常用的大豆蛋白物理改性方法之一,广泛应用于食品加工中。挤压技术是通过在挤压过程中热效应产生的高温、高压和高剪切力破坏大豆蛋白的天然结构,暴露出分子内部的疏水基团,在疏水相互作用、氢键、二硫键等的共同作用下形成分子量较大的蛋白质聚集体。
随着挤压加工温度的升高,蛋白质的溶解性变差[76]。Silva等[77]发现在挤压过程中游离巯基和总巯基含量增加,而二硫键含量下降。Fang等[78]研究了高湿环境下大豆蛋白挤压技术,发现在该环境下挤压,由于机械能的增加,由二硫键等化学键链接的聚合体解聚会导致大豆蛋白分子链伸展,蛋白溶解性增加。但Zheng等[79]发现,虽然高温、高剪切的环境能改变蛋白的溶解度及分子量分布,但过高的螺杆转速和温度(高于150 ℃)会破坏已形成的蛋白聚集体结构,导致蛋白再次展开。
由于挤压使蛋白内部埋藏的酶切位点暴露,有利于酶进行反应,因此挤压技术也常作为前处理手段与酶法相结合对蛋白凝胶进行改性。Ma等[80]发现挤压-酶解处理能显著改善大豆蛋白的空间结构和功能性质。在我们之前的研究中也将挤压技术与酶解法相结合研究大豆分离蛋白的功能性质,发现挤压处理后进行酶水解,对大豆分离蛋白的结构性质具有积极影响[81]。这些结果表明挤压技术可以作为一种有效的蛋白改性手段应用于食品工业中。
4.5 酶法对大豆蛋白凝胶的影响
传统的“碱溶酸沉”法制备SPI通常因为加工过程及工艺参数的差异,导致SPI发生变性,其凝胶性质受到不同程度的破坏,所以通常对SPI进行改性。酶法修饰SPI与其他物理、化学改性方法相比较,具有高安全性、高专一性及作用方式温和的特点,是近几年的研究热点。酶法修饰大豆蛋白是通过限制性水解肽键,改变蛋白质二、三级结构,使分子量显著降低,其内部的官能团暴露量增加,提供更多的反应位点,催化凝胶形成的过程[82]。
4.5.1 TG酶 转谷氨酰胺酶(Transglutaminase,简称TG酶或TGase)是一种催化酰基转移反应的转移酶,其催化作用可以明显改善凝胶强度、保水能力以及流变性,同时反应条件温和、反应速度快、生成的凝胶产物具有更复杂稳定且不可逆的凝胶结构,有关学者关于TG酶对SPI凝胶的影响研究也最为广泛和深入。TG酶影响SPI凝胶性是通过催化蛋白质的多肽发生分子间或分子内的共价交联作用,形成高分子的聚合物来改变蛋白质的疏水性,从而形成结构致密的凝胶[83]。TG酶的作用机理具体可分为氨基导入交联、共价交联作用以及脱酰氨基反应三类[84−85],其中氨基导入交联是TG酶途径糖基化的反应作用原理;共价交联作用形成高分子聚合物改变SPI的溶解性、乳化性、起泡性、凝胶性等性质;脱酰氨基反应则是改变蛋白的疏水相互作用从而改变蛋白凝胶性[86]。
Qin等[87]进一步研究发现TG酶作用后,可以诱导分子间二硫键的形成,蛋白质的无规卷曲增多,折叠结构打开,同时改变了蛋白凝胶的流变性。Zhang等[88]报告在鸡蛋-大豆分离蛋白复合凝胶中,TG酶的主要作用是使复合凝胶中的SPI发生交联化,显著提高复合凝胶的凝胶硬度。但TG酶对蛋白凝胶的影响并不全是积极的。Luo等[89]的研究中指出,TG酶前处理显著影响大豆分离蛋白的凝胶化行为,且高度依赖于凝胶反应过程中TG酶的酶浓度。低浓度(1或3 U/蛋白质)的TG酶前处理能增强SPI凝胶硬度,但高浓度(5 U/蛋白质)TG酶前处理会导致蛋白质过度交联,形成粗糙的凝胶结构,破坏凝胶强度。
综上,TG酶法是一种高效、绿色的蛋白质改性法。添加适量的TG酶可以促使蛋白质进一步交联形成具有更高硬度的凝胶。目前TG酶法改性现已广泛应用于改善多种食物蛋白凝胶的功能特性和质构特性中。
4.5.2 其他蛋白酶 除TG酶外,还有其他蛋白酶都对SPI凝胶有改性作用,如碱性蛋白酶、胰蛋白酶、胃蛋白酶、中性蛋白酶、木瓜蛋白酶等。酶改性蛋白的功能特性与蛋白酶种类呈强烈相关性。在之前的研究中采用碱性蛋白酶对SPI进行酶解,在酶解后SPI水解成小分子肽,形成多肽聚集体,其柔韧性和乳化性得到改善[81]。Tian等[68]选取碱性蛋白酶进行酶解,得到了类似的结论,这表明碱性蛋白酶与蛋白乳化性相关程度更高,会抑制蛋白的凝胶行为。赵新淮等[90]将SPI分别经胰蛋白酶和中性蛋白酶酶解后,对比发现胰蛋白酶处理后的SPI凝胶性得到显著改善,原因是中性蛋白酶的催化反应位点比胰蛋白酶多,水解程度较大,降低了蛋白质-蛋白质间的相互作用,故形成的凝胶较弱。余留印[91]的研究发现木瓜蛋白酶酶解处理SPI可以有效降低蛋白质的分子量,适度的酶促水解可使蛋白分子内部的非极性氨基酸残基暴露,增强蛋白分子间的疏水相互作用,改善凝胶结构。
4.6 微生物因素对大豆蛋白凝胶的影响
近年来,研究人员发现在乳酸菌发酵过程中经过酸化、蛋白质水解、风味形成以及代谢产物的生产过程,该过程中能够形成乳酸,可降低体系的pH,从而促使蛋白质变性加快,聚集形成凝胶。Yang等[92]发现乳酸菌发酵诱导SPI形成凝胶能够显著提高了大豆蛋白凝胶的硬度和保水能力,且凝胶特性对发酵所用的乳酸菌具有依赖性,不同乳酸菌诱导的SPI凝胶具有各自的特殊性。微生物的接种量同样也会影响凝胶的性质。李良等[93]通过植物乳杆菌发酵制备蛋白凝胶,发现接种量2%~4%时,蛋白凝胶强度随接种量的增加而增强;接种量4%~6%时,凝胶强度无显著差异;接种量大于6%时蛋白凝胶强度反而降低。这是由于乳酸菌接种量少时,微生物的产酸能力弱,形成凝胶所需的时间较长;而当接种量过高时,会影响蛋白质之间的聚集,凝胶性降低。
5 总结及展望
近几十年,国内外学者对大豆分离蛋白分子结构及凝胶特性进行了广泛而深入的研究。大豆蛋白凝胶的形成是一个复杂的过程,受到许多因素共同影响。由于天然大豆蛋白聚集体结构无规则,二硫键含量低,因此其凝胶特性较差,在凝胶食品中的发展与应用一直受到制约。目前可通过物理、化学、生物等手段使天然大豆蛋白结构展开,内部疏水基团暴露,表面疏水性增加,蛋白与蛋白间的非共价相互作用增强,而非共价相互作用是凝胶网络的“骨架”,因此凝胶性得以提高。但从内在因素角度分析,大豆蛋白组分(7S、11S)差异对凝胶特性的研究尚未深入,蛋白质亚基对功能特性的表达机制尚不明晰。在今后的研究中,可在基于挤压、酶解、超声等物化改良手段上,将提高蛋白凝胶性与大豆蛋白组分差异性联系起来,并对其机理进一步深入研究后,转向应用研究,选择性培育具有特定蛋白质亚基组成的大豆品种并进行相关功能性研究,进而制备具有高凝胶性的大豆蛋白凝胶产品。
