天然低共熔溶剂提取米糠酯酶工艺优化及其纯化与酶学性质研究
2023-03-12李淑婷邓媛元魏振承唐小俊赵志浩周鹏飞张名位
李淑婷,邓媛元,魏振承,张 雁,唐小俊,刘 光,李 萍,赵志浩,周鹏飞, ,张名位,
(1.广东省农业科学院蚕业与农产品加工研究所,农业农村部功能食品重点实验室,广东省农产品加工重点实验室,广东广州 510610;2.天津科技大学食品科学与工程学院,天津 300457)
米糠是稻谷碾制精米过程的副产物,占稻米总重的6%~8%。米糠中含有稻米总营养的64%,具有极高的营养价值[1],除了碳水化合物(34.1%~52.3%)、油脂(15%~22%)、蛋白质(10%~16%)、膳食纤维(7%~11.4%),米糠还含有一系列生物活性化合物,如γ-谷维素、生育酚、植物甾醇和角鲨烯等,是一种优质食品原料,具有广阔的应用潜力[2−3]。然而,大多数米糠仅被用作家禽饲料、低成本固体燃料或直接丢弃,只有少量的被制成米糠油,造成一定的资源损失、环境污染等问题[4]。而导致这种情况主要原因之一是由于高活性脂质水解酶类的存在易使米糠发生酸败劣质,难以作为食品原料用于食品加工生产,因此许多研究者都在关注米糠脂质水解酶类的研究。
酯酶[5]属于脂质水解酶类,类似于脂肪酶,是具有催化酯键裂解和形成功能的水解酶类,归属于α/β-折叠水解酶类家族。酯酶具有广泛的底物范围、高稳定性、高活性、不依赖辅助因子、拥有高度的区域和立体选择性等优势。另外,不同来源酯酶其酶学性质如稳定性、底物特异性、最适pH或温度等存在较大差异,因此酯酶在精细化工[6]、食品医药[7−9]、化妆品[10]等领域有着多样化的应用。目前报道采用缓冲液体系、硫酸铵沉淀法等方式对米糠酯酶进行分离提取,这些工艺不同程度上存在操作复杂、酶易失活等问题,因此寻找一种高效、绿色且能保持米糠酯酶高活性的提取方法显得尤为迫切[11−16]。
天然低共熔溶剂(Natural deep eutectic solvents,NADES)的概念最早于2011年由Choi等提出,是由糖类、有机酸类、氨基酸、醇类和胺类等生物体内代谢产物充当氢键供体(HBD)或氢键受体(HBA),并按照一定比例混合制备而成的均匀稳定液体。相比传统溶剂,NADES具有挥发性低、不易燃、安全无毒、可生物降解等优势[17−18],在天然物质的分离与提取[19−20]、生物催化[7,18,21]等方面具有潜在的应用价值。因此,本文合成了10种NADES,通过单因素实验和响应面法优化探索米糠酯酶的最佳提取参数,进一步纯化获得高纯度米糠酯酶,并研究其酶学特性,为天然低共熔溶剂在开发米糠资源利用方面提供参考。
1 材料和方法
1.1 材料与仪器
米糠 广东海纳农业有限公司;氯化胆碱、L-脯氨酸、无水苹果酸、DL-乳酸、乙醇酸、木糖醇、尿素、乙酰胺 均为国产分析纯,上海阿拉丁生化科技股份有限公司;乙二醇、甘油 分析纯,天津市大茂化学试剂生产厂;对硝基苯酚(p-NP)乙酸酯(C2)、p-NP丁酸酯(C4)、p-NP己酸酯(C6)、p-NP辛酸酯(C8)、p-NP癸酸酯(C10)、p-NP月桂酸酯(C12)、p-NP肉豆酸酯(C14)、p-NP棕榈酸酯(C16) 上海西格玛奥德里奇公司。
MILLI-Q超纯水处理系统 Millipore公司;SQP电子天平 赛多利斯科学仪器(北京)有限公司;N-1300V-WB旋转蒸发仪 上海爱郎仪器有限公司;CytationTM5酶标仪 美国Bio Tek 公司;AKTA Pure蛋白纯化仪 美国GE公司;水平/垂直蛋白电泳仪 上海天能科技有限公司;SH10A水分计 上海菁海仪器仪表有限公司; pH计 梅特勒-托利多仪器有限公司。
1.2 实验方法
1.2.1 天然低共熔溶剂的制备 采用加热法[22]制备NADES,具体过程是按照特定摩尔比准确称取一定质量的HBA和HBD,混合后在90 ℃下加热至形成稳定的透明液体,10种溶剂具体组成如下表1所示。
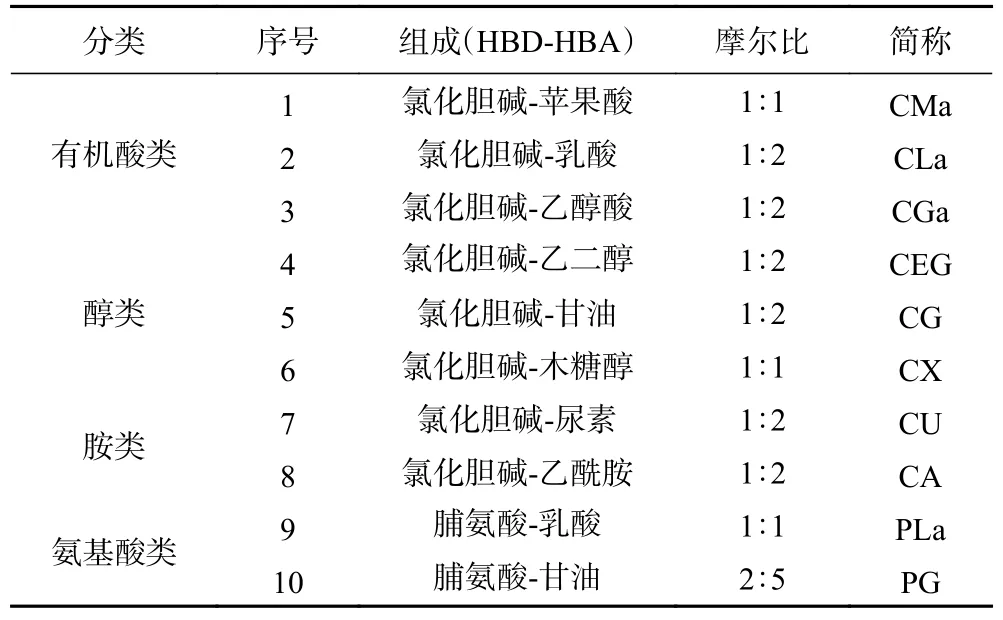
表1 天然低共熔溶剂的制备Table 1 Preparation of NADES
1.2.2 NADES和提取方式的筛选 参考文献[23−24]中的提取方式稍作调整,对照组模式体系为米糠4 g,与30 g蒸馏水混合均匀,用1 mol/L NaOH 调pH至10.0。实验组模式体系为4 g米糠和30 g 10种NADES分别混合均匀。然后将体系在50 ℃提取2 h后,10000 r/min离心5 min,收集上清液待测,按照1.2.4方法测定米糠酯酶的水解活力。同时研究了体系在超声和水浴搅拌两种处理方式对米糠酯酶提取的影响,6种处理方法具体过程如下:方法1-水浴(50 ℃)提取2 h;方法2-超声(50 ℃、180 W)提取2 h;方法3-先水浴提取30 min,再超声提取30 min,循环操作2次;方法4-先超声提取30 min,再水浴提取30 min,循环操作2次;方法5-先水浴提取60 min,再超声提取60 min;方法6-先超声提取60 min,再水浴提取60 min。每组实验平行操作3次,按照米糠酯酶活力最高筛选出合适的 NADES与提取方法进行后续优化实验。
1.2.3 标准曲线绘制 配制100 μg/mLp-NP 的标准母液,依次稀释成5、10、20、40、60、80 μg/mL,在405 nm处测定吸光值。以p-NP 浓度为横坐标、对应吸光值为纵坐标进行线性回归,回归方程为y=27.08x+0.0015,其拟合度为R2=0.999,在5~80 μg/mL浓度范围内线性良好。
1.2.4 米糠酯酶水解活力的测定 米糠酯酶水解活力的测定采用p-NP 法[25]。具体测定方法为:在 96孔板中依次加入 80 μL 0.1 mol/L pH7.0 的磷酸盐缓冲液和10 μL 10 mmol/L C8溶液,40 ℃预热10 min,加入10 μL 待测液,反应 5 min后,使用 100 μL 1%SDS 溶液终止反应,在405 nm处测量吸光值。根据A405nm在p-NP 标准曲线上获得产物pNP 的释放量并计算酶活力,以一定条件下底物每分钟被水解生成1 μmolp-NP 所需要的酶量即为一个酶活力单位,用U表示。在同等条件下实施对照实验。
1.2.5 提取米糠酯酶单因素实验与响应面优化
1.2.5.1 提取米糠酯酶单因素实验 经过1.2.2筛选综合考量,选取最适的NADES以及提取方式进行米糠酯酶的提取。单因素实验主要考察料液比(米糠:NADES,g/g)、NADES体系的含水量、提取时间和提取温度等实验因素,各组实验除变量条件外,称取4 g 米糠和30 g NADES混合均匀,NADES体系的含水量为4%,50 ℃恒温水浴提取2 h,收集上清液待测。分别改变提取操作过程中的料液比(1:30、2:30、3:30、4:30、5:30、6:30、7:30、8:30、9:30 g/g)、NADES体系的含水量(0、1%、2%、3%、4%、5%、15%)、提取时间(1、2、3、4、5 h)和提取温度(40、50、60、70、80 ℃)等实验条件。按照1.2.4方法测定米糠酯酶的水解活力。以米糠酯酶的酶活力为指标,考察提取条件变化对米糠酯酶提取效率的影响。
1.2.5.2 响应面试验优化提取米糠酯酶提取条件根据单因素实验结果,选取提取时间(A)、提取温度(B)和PG含水量(C)进行三因素三水平的响应面分析,对米糠酯酶提取的工艺条件进一步优化,实验因素及水平设计见表2。
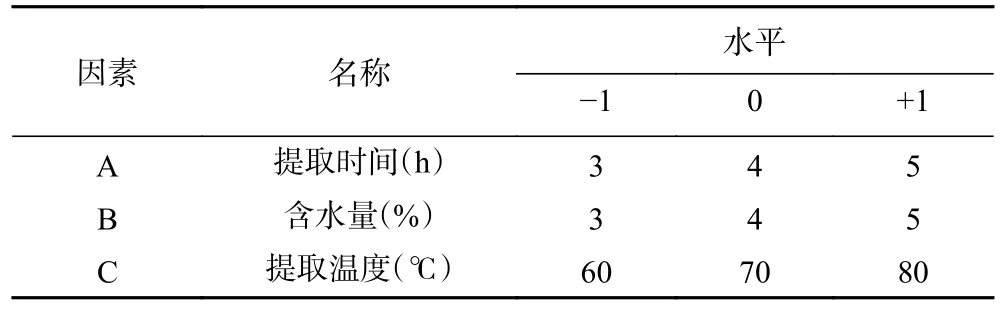
表2 BBD的因素及水平Table 2 Box-Behnken design factors and levels
1.2.6 米糠酯酶的纯化 米糠经NADES提取后,离心,上层提取物使用20 mmol/L Tris-HCl(pH7.0)于4 ℃过夜透析(10 kDa),收集透析袋样品用0.45 μm膜过滤。采用AKTA蛋白纯化仪、阴离子交换树脂HiTrapTMCaptoTMDEAE分离纯化,收集纯化过程中的馏分。采用碧云天蛋白测定试剂盒测定蛋白纯化样品浓度。通过 Bio-Red 垂直电泳仪分析纯化酶,电泳结束后考马斯亮蓝 R-250 染色,经脱色液脱色至蛋白条带清晰,再用凝胶成像系统对结果进行分析。
1.2.7 米糠酯酶酶学性质测定
1.2.7.1 米糠酯酶底物选择性 具体操作按照1.2.4进行,使用纯化后的米糠酯酶水解10 mmol/L不同烷烃碳链长的对硝基苯酚酯(C2、C4、C6、C8、C10、C12、C14、C16),结果以所测样品最大酶活力的百分比表示,以确定其最适底物。
1.2.7.2 米糠酯酶的最适温度及温度稳定性 具体操作按照1.2.4进行,测试的温度范围为30~80 ℃,结果以所测样品最大酶活力的百分比表示,确定其最适温度。为测定其温度稳定性,将样品分别在30~80 ℃孵育1 h,然后在40 ℃、pH8.0的50 mmol/L Tris-HCl缓冲液的条件下测定其残存酶活,结果以未经热处理所测酶活力的百分比表示。
1.2.7.3 米糠酯酶的最适pH及其稳定性 具体操作按照1.2.4进行,测试pH范围是4.0~10.0。所用缓冲液体系为50 mmol/L 柠檬酸钠缓冲液(pH4.0~5.0)、50 mmol/L磷酸盐缓冲液(pH6.0~7.0)、50 mmol/L Tris-HCl 缓冲液(pH8.0)和50 mmol/L Gly-NaOH 缓冲液(pH9.0~10.0)。结果以所测样品最大酶活力的百分比表示,确定其最适pH。为测定其pH稳定性,将等体积的缓冲液(pH4.0~10.0)与待测液混合均匀,40 ℃下孵育1 h后,测定其残存酶活,结果以未经缓冲液孵育时所测的酶活力的百分比表示。
1.2.7.4 米糠酯酶的有机溶剂及NADES耐受性具体操作按照1.2.4进行,将待测液与不同溶剂(甲醇、乙酸乙酯、正丁醇、氯仿、甲苯、正己烷、PG和CG)等体积混合,40 ℃下孵育30 min,测定其残存酶活,结果以不使用有机溶剂时所测酶活力的百分比表示。
1.3 数据处理
实验均进行三次平行实验。响应面试验设计和数据处理采用Design expert 10;利用Origin 9.0软件绘图,实验结果以平均值±标准差表示。所有数据通过SPSS 22 进行单因素方差的Duncan 检验,图中字母大小写表示不同数据组的分析,不同字母表示存在显著性差异(P<0.05)。
2 结果与分析
2.1 NADES及提取方法的筛选
不同的NADES具有不同的极性、溶解性等物理化学性质,对米糠酯酶的提取效果会存在差异[20]。如图1所示,传统水提法得到的粗酶催化活性最低,而10种NADES对提取过程中米糠酯酶的催化活性一定的维持效果,其中氨基酸类NADES效果最佳,其它三类NADES表现次之。这可能是氯化胆碱中氯离子与氢键供体具有更强的氢键结合能力[21],对米糠酯酶活性有一定的抑制作用,因此氯化胆碱类NADES(有机酸类:CMa、CLa、CGa,多元醇类:CEG、CG、CX,胺类:CU、CA)提取得到的米糠酯酶的催化活性要低于非氯化胆碱类NADES(氨基酸类:PLa、PG)。另外,同类型的NADES对米糠酯酶的提取表现也存在差异,如 CLa 溶剂表现要比 CMa溶剂效果好(提取方法 1),CG 和 CX 的表现比 CEG好(提取方法 1)。这是由于“渗透调节物质”乳酸、甘油和木糖醇等小分子在稳定生物大分子结构、作为米糠酯酶的保护物质等方面起着重要作用[26]。综上所述,相比水溶液提取方式,NADES提取体系能更好地维持米糠酯酶活性,且NADES组分对其活性的影响也是显著的。比较而言,PG溶剂作为提取米糠酯酶的最佳溶剂。
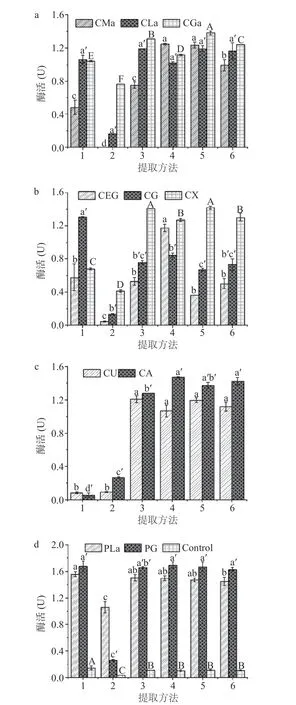
图1 不同NADES及提取方法对米糠酯酶提取的影响Fig.1 Effect of different NADES and extraction methods on rice bran esterase
在此基础上,研究了不同提取方法(如搅拌、超声和超声辅助水浴搅拌等)对PG溶剂提取米糠酯酶的影响。结果显示超声处理2 h(提取方法 2)后待测液中基本无水解活力,可能原因是提取过程米糠与NADES接触不充分,导致米糠中酯酶未溶出,未能提取到米糠酯酶;而搅拌(提取方法1)、超声与水浴处理的顺序及其时间不同(提取方法 3~6)对PG溶剂提取米糠酯酶的效果没有显著差异(P>0.05),最后考虑操作简便性,选择处理方式 1 即恒温水浴搅拌2 h 对米糠酯酶进行提取。因此,提取方式选择恒温水浴处理,选择PG溶剂进行米糠酯酶的提取。
2.2 天然低共熔溶剂提取米糠酯酶的单因素实验
2.2.1 料液比对米糠酯酶提取的影响 首先考察了料液比对米糠酯酶提取的影响,模式反应混合物为30 g PG 溶剂与一定质量的米糠混匀,在50 ℃下恒温水浴搅拌提取2 h。由图2 可知,随着米糠量不断增加,米糠酯酶的催化活性也随之升高(P<0.05)。这可能是随着米糠量增加,酶蛋白的提取量增加,从而使酶活力增加。当米糠物料增加到9 g后,体系搅拌困难,故料液比不作为进一步优化实验的考虑因素,最终选择米糠/PG=9:30(g/g)的料液比用于提取米糠酯酶。
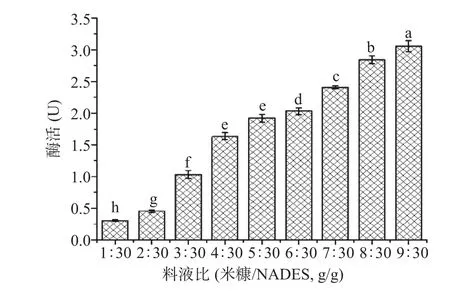
图2 料液比(米糠/ NADES)对米糠酯酶提取的影响Fig.2 Effect of solid-liquid ratio (rice bran/NADES) on extraction of rice bran esterase
2.2.2 天然低共熔溶剂的含水量对米糠酯酶提取的影响 PG溶剂的含水量是影响米糠酯酶提取效果的重要因素。PG含水量不同,其粘度和极性发生变化[20],从而影响米糠酯酶的催化活性。本文共考察了不同含水量的PG溶剂对提取米糠酯酶的影响。图3表明当含水量从0%增加到5%时,米糠酯酶的催化活性维持在(1.60±0.03)~(1.85±0.04)U,当 PG 含水量增加到15%时,米糠酯酶活性为(0.66±0.03)U,这可能是 PG溶剂中过高的含水量破坏了 NADES 紧密连接的超分子网络结构[27],从而使米糠酯酶的提取效果变弱,催化活性大幅度丧失。故选择3%~5%含水量的PG混合溶剂进一步优化。
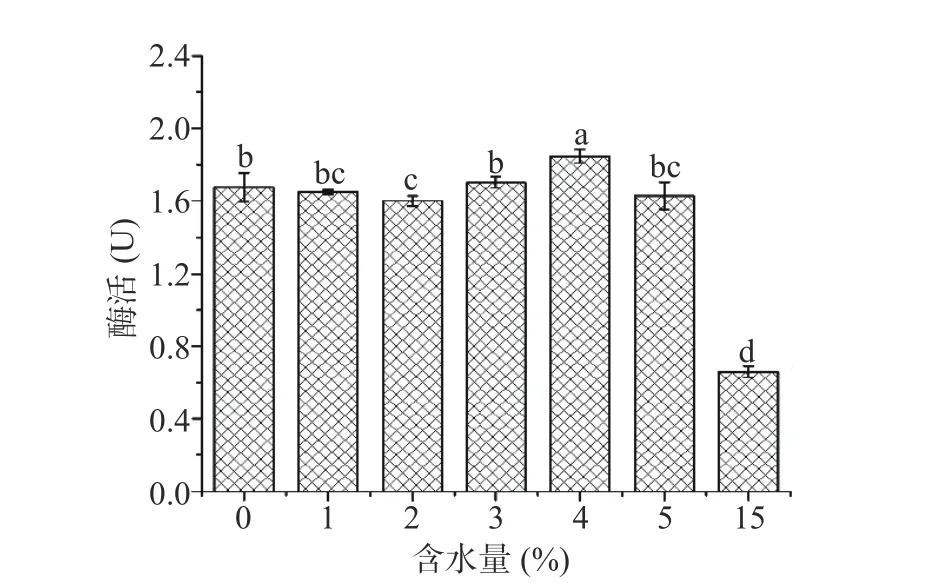
图3 含水量对米糠酯酶提取的影响Fig.3 Effect of water content on extraction of rice bran esterase
2.2.3 提取时间对米糠酯酶提取的影响 提取时间关联目标物质是否充分溶出,并影响米糠酯酶在提取溶剂中的催化活性。本文在料液比 9:30、PG 含水量为4%的条件下,考察了处理时间对米糠酯酶提取的影响,结果如图4 所示。在较短时间内(0.5 h)待测液中米糠酯酶的催化活性能达到(1.55±0.05)U,且4 h内活性均能维持良好的水平,持续5 h后米糠酯酶活性显著丧失,酶活达到(1.27±0.04)U,可能原因是过长的提取时间作用下影响酶的稳定性,导致酶活性丧失[28],故选取3~5 h的提取时间进一步优化。
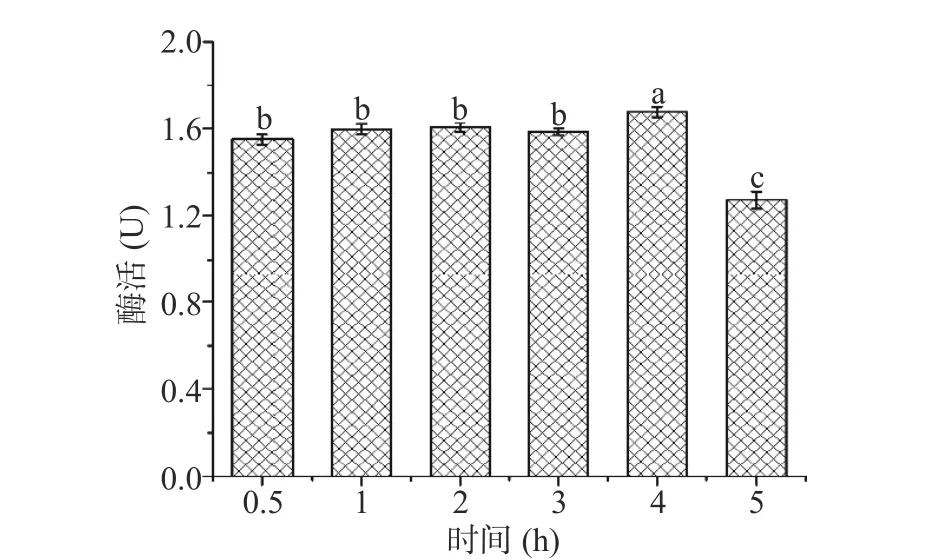
图4 提取时间对米糠酯酶提取的影响Fig.4 Effect of extraction time on rice bran esterase extraction
2.2.4 提取温度对米糠酯酶提取的影响 NADES在料液比9:30 g/g、PG含水量为4%、提取时间为4 h时,研究了不同温度下对米糠酯酶提取的影响,结果如图5所示。随温度从40 ℃升高至70 ℃,米糠酯酶的催活性均维持在较高水平,之后温度达到80 ℃,米糠酯酶活性为(1.36±0.01)U,其活力开始显著下降(P<0.05),说明 PG 体系能在较宽温度范围内很好的保持酶活性,故选择60~80 ℃的提取温度进一步优化。
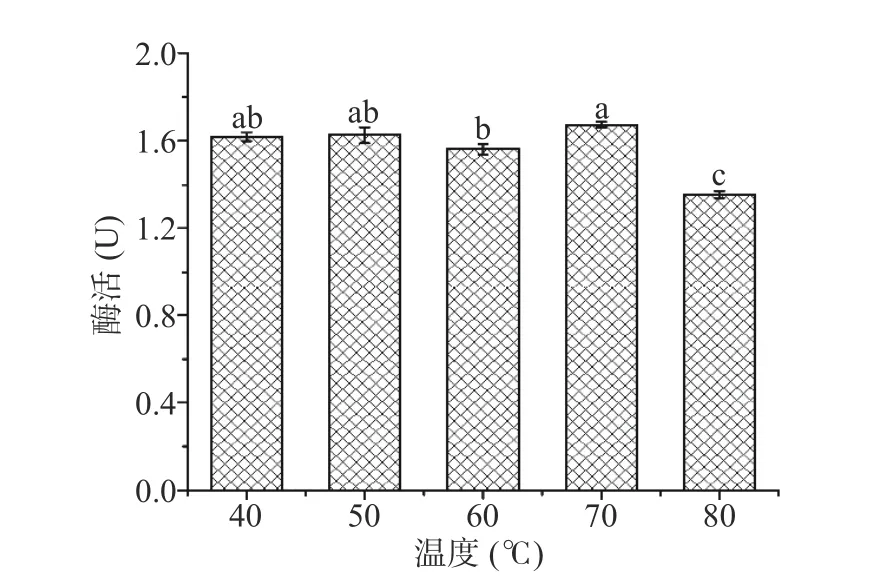
图5 提取温度对米糠酯酶的影响Fig.5 Effect of extraction temperature on rice bran esterase
2.3 天然低共熔溶剂提取米糠酯酶的响应面优化试验
2.3.1 统计分析和模型拟合 根据单因素实验结果,确定提取时间(A)、含水量(B)、提取温度(C)3个水平,设定3因素3水平、5次中心平行的实验方案。实验设计及米糠酯酶活力的响应值见表3。经拟合回归后,得到米糠酯酶活力相对于各因素实际值的二次响应面回归方程为:Y(U) = 0.64×A+0.19×B+0.33×C−0.092×AB+0.000053×AC+0.0041×BC−0.043×A2−0.012×B2−0.0023×C2−11.10,其显著性与方差分析结果见表4。回归方程分析表可知,酯酶活力的回归模型P<0.0001,表明回归方程具有很高的可靠性、结果有效。R2和校正系数R2Adj分别为 0.9995 和 0.9988,失拟项P= 0.06773>0.05相对于纯误差不显著,表明模型拟合度高,即实际值和预测值之间的高度一致,实验结果误差对实验结果影响较小。在所有考察的因素中,提取时间、含水量、提取温度对米糠酯酶的提取影响显著,其中,对提取米糠酯酶的活力影响最大的是提取时间、提取温度,其次是含水量。
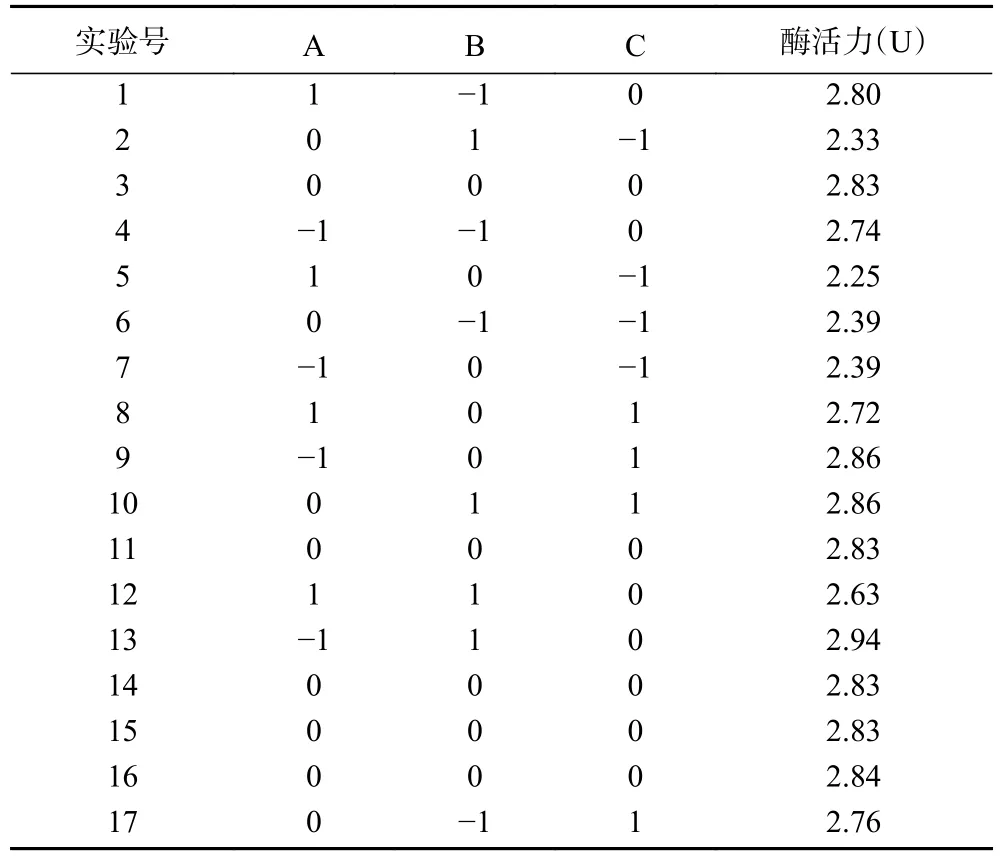
表3 响应面试验设计与响应值Table 3 Response design and results of experiment
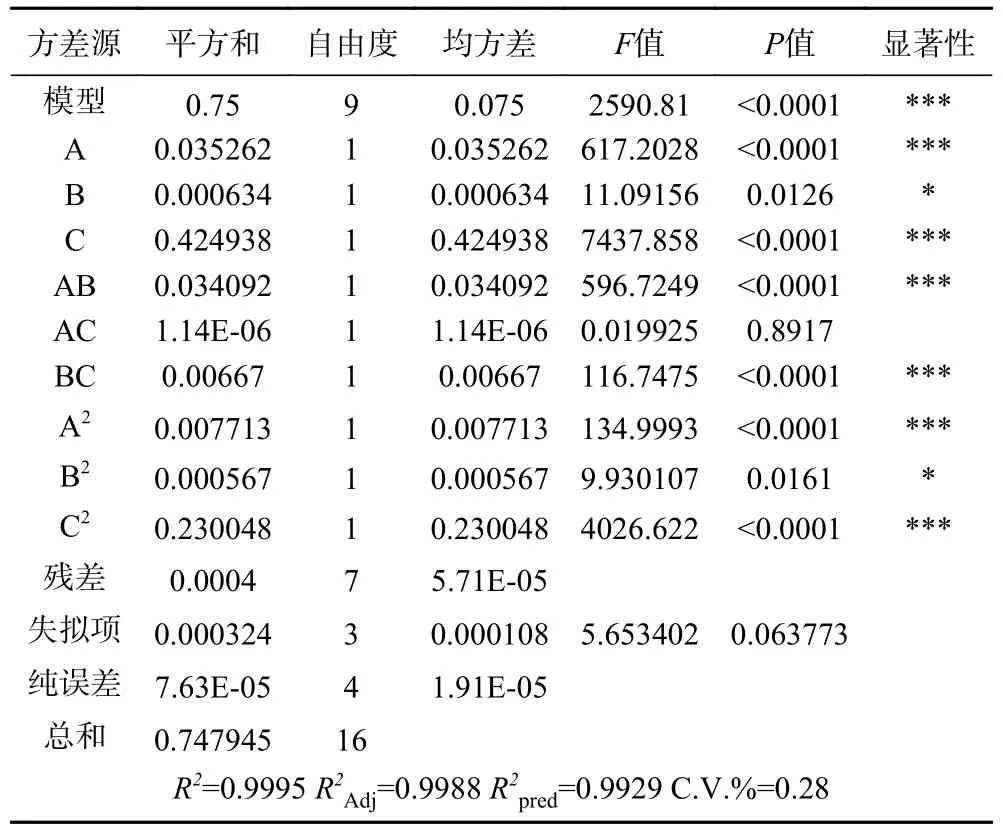
表4 响应值的回归方程分析Table 4 Analysis of variance (ANOVA) for hydrolysis activity
2.3.2 各因素交互影响分析 分别构建了三维响应面图和等高线图,以描绘两个显著性影响因素对米糠酯酶活力的影响及交互作用大小。如图6所示,A和B、B和C的交互作用对米糠酯酶的酶活提有非常显著影响,且 A 与B 之间响应曲面倾斜度最高,说明提取时间和 PG 含水量之间的交互作用对米糠酯酶的提取影响最大,PG 含水量和提取时间之间的交互作用次之。根据等高线图,B(PG 含水量)与 A(提取时间)相比,沿A(提取时间)方向的等高线密度高,故提取时间比 PG 含水量对结果的显著性高;B(PG 含水量)与C(提取温度)相比,沿C(提取温度)方向的等高线密度高,故提取温度比 PG 含水量对结果的显著性高,说明在极低含水量(3%~5%)条件下,提取温度和提取时间对酶活影响更大。以米糠酯酶活力最大为标准,使用Design expert 10 软件拟合方程和方差分析结果拟合各因素的最优提取工艺为:提取时间3.023 h,温度73.734 ℃,含水量4.976%,所得的米糠酯酶活力的预测值为3.012 U。
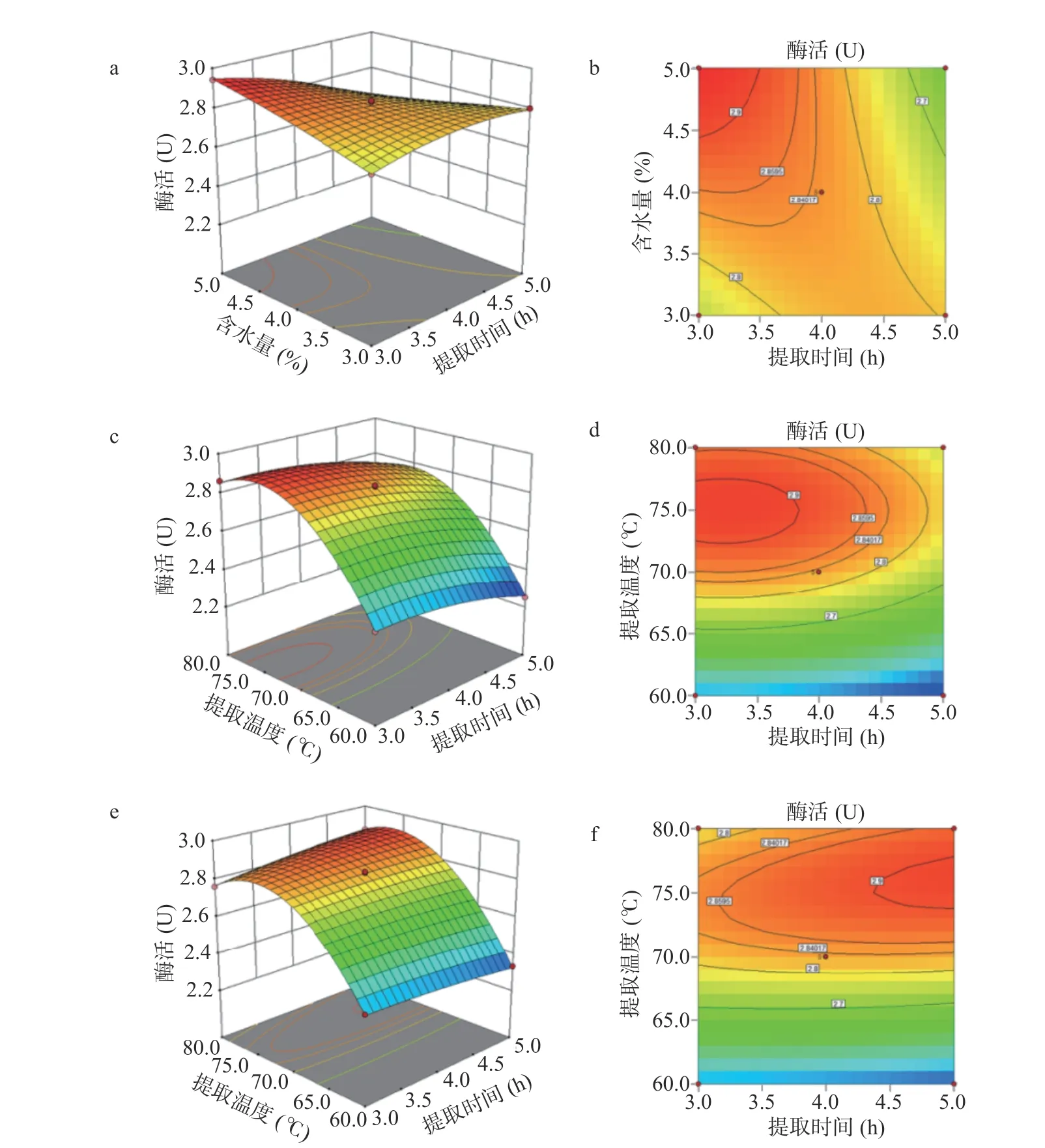
图6 米糠酯酶活力的因素交互作用Fig.6 Response surface of interaction with various factors for rice bran esterase activity
2.3.3 验证实验 考虑到实际操作性,后续验证实验最终选取提取时间为3.0 h,温度74.0 ℃,PG的含水量为5.0%。在最佳实验条件下,进行三次平行实验,得到 PG 体系提取的米糠酯酶的酶活力为(2.96±0.02)U,误差为0.07%。说明模型拟合的条件及预测值良好,可以用于进行米糠酯酶的提取。
2.4 天然低共熔溶剂提取米糠酯酶的纯化
NADES 富集相通过透析、阴离子交换柱 DEAE纯化后,可以得到3个蛋白峰(图7a)。馏分用 SDSPAGE 蛋白质电泳分析结果如图7b所示,在30% 洗脱液洗脱条件(泳道4)下,可以得到纯度更高的条带,其分子量约为35 kDa,结果与 Yu 等[29]报道的一致。纯化后的米糠酯酶纯度为1.74倍,回收率为69.40%(表5)。
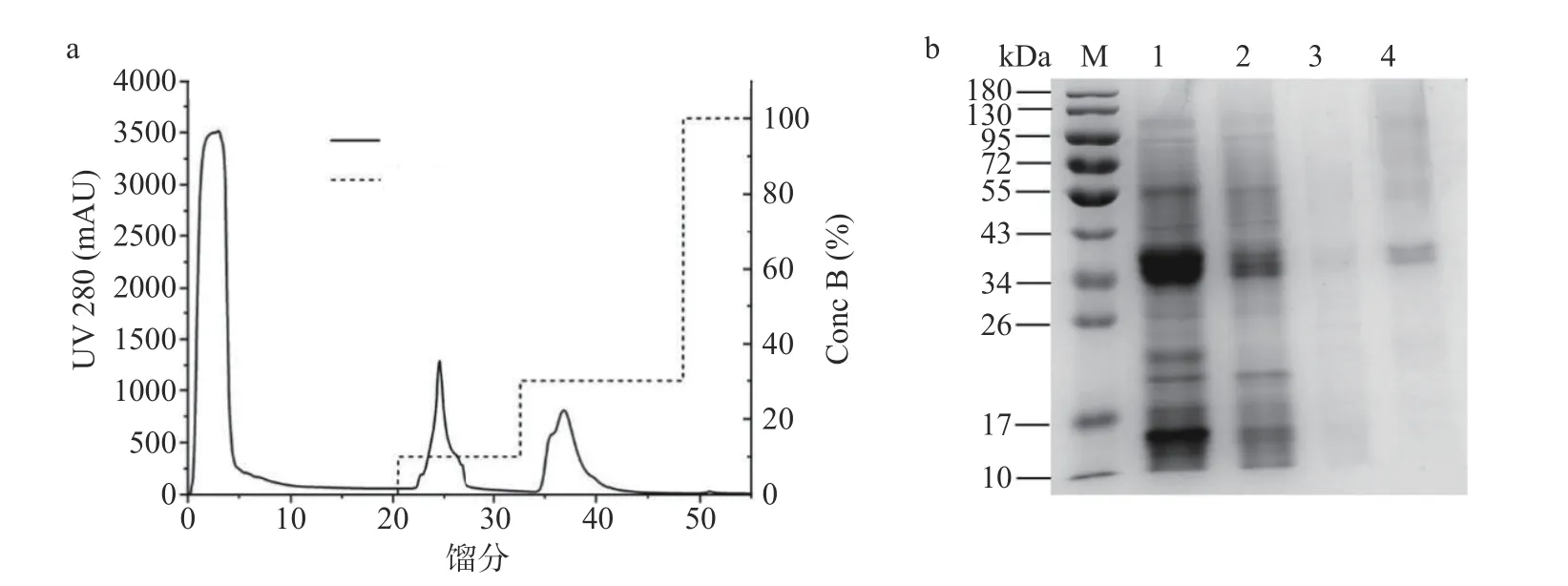
图7 米糠酯酶纯化的谱图Fig.7 Purification spectra of rice bran esterase

表5 米糠酯酶的纯化Table 5 Purification of rice bran esterase
2.5 天然低共熔溶剂提取米糠酯酶的酶学特性
2.5.1 底物选择性 为探究该酶的底物选择性,选用碳链长度在2~16的pNP 底物,测定酶活力,结果如图8所示。该酶最易水解C2底物,水解C6时仍有C2催化活性的48.41%,但对长链底物C10的水解能力只是C2的10.47%,对于碳链更长的酯(C12~C16),水解能力小于5%。由于该酶对于短链底物的催化活性显著高于长链底物,具有典型的酯酶底物选择性,因此该水解酶类为米糠酯酶。
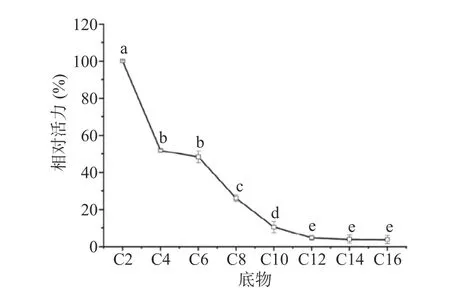
图8 不同烷烃碳链长的对硝基苯酚酯对样品相对酶活力的影响Fig.8 Effect of p-nitrophenol ester with different alkane carbon chain length on the relative enzyme activity of samples
2.5.2 最适温度和温度稳定性 温度是影响酶活力的重要参数。在最适温度下,米糠酯酶表现出最佳活力,温度升高酶因变性而丧失活力。本文探究了米糠酯酶在30~80 ℃下的酶活力,以及在不同温度下孵育1 h的热稳定性,结果如图9所示。当温度由30 ℃上升至40 ℃,米糠酯酶活力增加,且在40 ℃表现出最佳活性。温度继续升高,米糠酯酶活性迅速降低。米糠酯酶在不同温度下保温1 h后,相较于未经热处理组,米糠酯酶活力在30~40 ℃时活性没有显著变化(P>0.05),表明在低温条件下米糠酯酶具有良好的热稳定性。温度高于40 ℃酶活力逐渐丧失,至80 ℃时残存酶活约为40%。由此可知,米糠酯酶在温度为40 ℃表现出最佳水解酶活,且在低温(<40 ℃)时具有良好的稳定性。
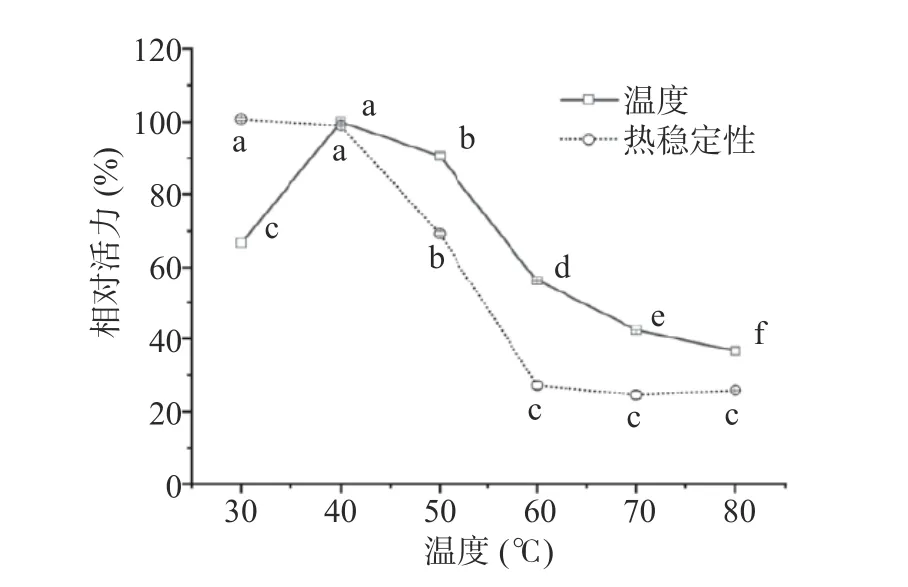
图9 不同孵育温度对样品相对酶活力的影响Fig.9 Effect of different incubation temperature on relative enzyme activity of samples
2.5.3 最适pH和pH稳定性 pH 是影响酶活性的重要影响因素。过酸或过碱可以使酶的空间结构破坏,引起酶活性部位构象的改变,进而影响酶的活性;另外,pH改变会影响底物的解离状态或活性部位有关基团的解离,从而影响底物和酶分子的结合或催化,使酶活力降低。本文探讨了米糠酯酶在pH4~10范围内的活性变化,以获取其最适pH及pH稳定性,结果如图10所示。米糠酯酶的最适pH为8.0,pH的降低或升高,其活性显著降低(P<0.05),在pH<7或pH10时,活力急剧下降,表明其为弱碱性酯酶。米糠酯酶在 pH7~9 (中性或弱碱性)时最稳定,强酸或强碱均显著降低活性(P<0.05),但在酸性条件下米糠酯酶显得更不稳定。故米糠酯酶为中性或弱碱性酶,在pH为8.0时表现出最佳水解酶活。
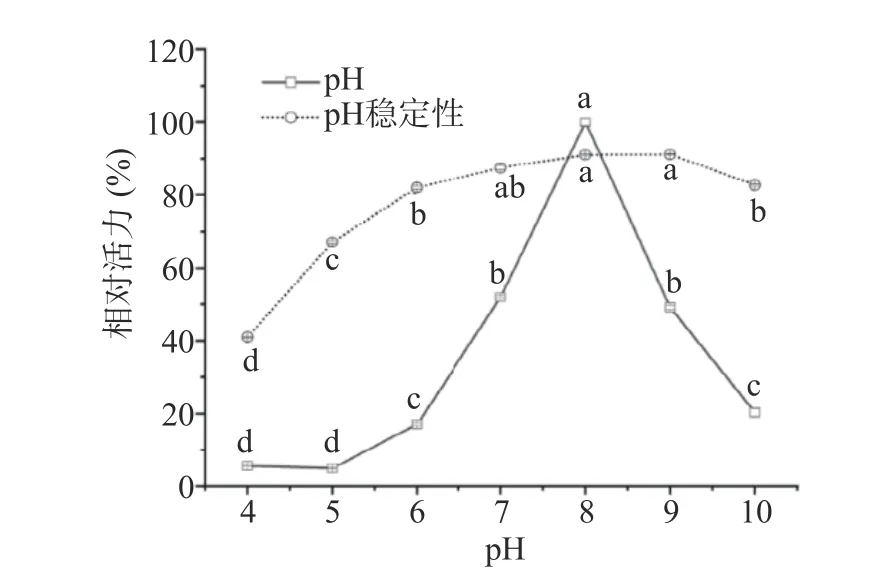
图10 不同pH对样品相对酶活力的影响Fig.10 Effect of different pH on relative enzyme activity of samples
2.5.4 溶剂耐受性 有机溶剂对酶活性会产生显著影响,如在疏水性较强溶剂中酶活力较高,相反在亲水性较强溶剂中特别是高极性溶剂体系易夺取酶分子表面的结构水,易导致酶失活[30]。如图11所示,甲苯对米糠酯酶活性无显著性影响(P>0.05),其它溶剂均显著降低米糠酯酶活性(P<0.05),结果表明,高极性的有机溶剂对米糠酯酶活性具有较强的抑制作用,低极性溶剂正己烷对米糠酯酶活性的影响较甲苯要大,研究结果与Yu等[29]报道类似。另外,NADES如PG和CG与水能以任何比例混溶,是强极性溶剂,但对于维持酶的稳定性也具有积极作用,说明极性不是影响酶稳定性的唯一关键因素,其他因素如溶剂分子结构及其官能团、酶的结构和表面氨基酸的类型也可能发挥作用,比如PG和CG中含有如脯氨酸、甘油这一类小分子“渗透调节物质”,根据“水替代假说”[31],即当蛋白在高浓度的酶保护剂中时,蛋白表面维持结构的结合水的位置被这些小分子有机物所取代,而这些小分子有机物具有比水分子更低的活动能力,能够抵抗外界复杂条件的影响,因此米糠酯酶在PG和CG溶剂中催化活性较高极性溶剂如甲醇等溶剂高。据此可知,含有渗透调节组分的NADES尽管表现出强极性,但对于米糠酯酶活性的保持仍具有高于传统强极性溶剂的贡献作用。
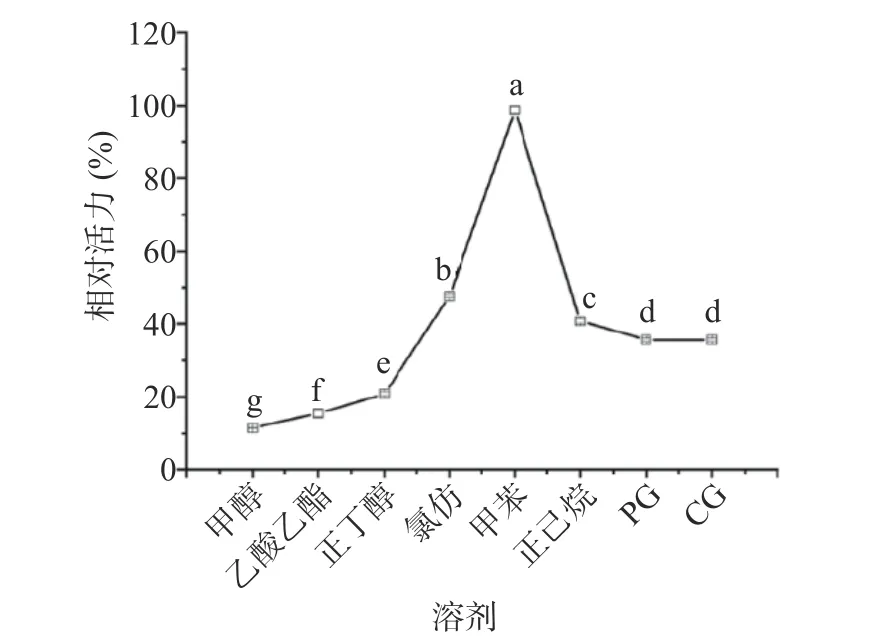
图11 不同有机溶剂对样品相对酶活力的影响Fig.11 Effect of different organic solvents on the relative enzyme activity of samples
3 结论
本研究建立了一种 NADES 辅助水浴搅拌法提取米糠酯酶的工艺。通过单因素和响应面试验,得到提取米糠酯酶的最佳条件为:在含有5%水分的脯氨酸-甘油(摩尔比1:2)溶剂体系中,水浴搅拌3.0 h,温度74.0 ℃,米糠和溶剂料液比为9:30。与传统水提法相比,NADES 法从米糠中提取米糠酯酶能更好地维持其催化活性。本文通过 DEAE 阴离子交换树脂获得了纯度较高的米糠酯酶,其纯化倍数为 1.74 倍,回收率为69.40%,分子量约为35 kDa,该酶最适底物为对硝基苯酚乙酯,最适温度和分别pH分别是40.0 ℃、pH8.0,在30.0~40.0 ℃和pH7.0~9.0 时均保持良好的稳定性。与传统高亲水性的有机溶剂比较,氯化胆碱-甘油和脯氨酸-甘油两种 NADES 对米糠酯酶的活力有较好的维持作用。结果表明,NADES提取法是一种简单高效、绿色环保、且有利于米糠酯酶活性保持的方法。本研究结果为进一步深入研究米糠深加工利用以及新型溶剂在食品领域的应用提供理论依据。
