辣椒素和辣椒水提物的抗氧化特性及对人粪便微生物体外培养特性的影响
2023-03-12王玮媛侯爱香李宗军
张 婷,王玮媛,彭 澳,侯爱香,李宗军
(湖南农业大学食品科学技术学院,湖南长沙 410128)
辣椒素(capsaicin,CAP)是辣椒中的主要辣味成分,辣椒素具有多种生理作用,包括抗肿瘤、镇痛、抗炎、抗氧化、心肌保护及调节血压等[1−2]。关于体外抗氧化性的评价方法大致可分为两类[3]:一类是基于H原子转移途径的自由基清除反应,另一类是基于电子转移的自由基清除反应。袁杨斌等[4]对辣椒素的抗氧化能力研究表明,辣椒素对DPPH、超氧阴离子和羟自由基均有一定的清除能力。段方娥等[5]研究了辣椒素和其他物质的协同抗氧化作用,在DPPH、ABTS+和总还原力分析模型中均表现出良好的抗氧化能力,说明辣椒素与槲皮素、芦丁复配后能产生较好的协同抗氧化作用。在细胞和高脂肪动物模型中也证实了辣椒素的抗氧化作用[6]。但目前对辣椒水提物的抗氧化特性研究还较少,对此,本文通过对辣椒水提物中的主要成分进行测定,并探究辣椒素和辣椒水提物的体外抗氧化活性,对于开发辣椒产品具有研究价值。
人体肠道内有复杂多样的肠道微生物菌群,这些肠道微生物菌群是膳食与人体健康之间的桥梁。有研究表明,辣椒素可以直接或间接改变肠道菌群,影响粪便中SCFAs的水平[6]。Sawatpanich等[7]研究表明,辣椒提取物能诱导肠道病原分子的易位和粪便生态失调,包括厚壁菌门减少,拟杆菌门增加,粪便中革兰氏阴性菌总数增加。王梦等[8]的抑菌试验也表明辣椒素具有普遍的抑菌作用。但目前为止,关于辣椒水提物对肠道微生物影响的研究还尚未可见。有研究显示,粪便与大肠中的微生物类群、丰度和功能相似[9],粪便代谢组可以部分地反映肠道微生物群的组成[10],且国内外的众多研究结果表明,人类粪便可大致反映患者消化道菌群的基本情况[11−12]。目前常见的肠道微生物体外发酵方法是分批发酵和连续系统发酵[13],本研究以健康大学生粪便为菌源,进行24 h体外分批厌氧发酵,探究辣椒水提物对肠道微生物生长的影响,为辣椒及其制品对人体健康的影响方面的研究提供参考依据。
1 材料与方法
1.1 材料与仪器
红色小米椒 湖南农业大学东之源超市;标准辣椒素(C18H27NO3,反式8-甲基-N-香草基-6-壬烯酰胺) 规格20 mg,上海麦克林生化科技有限公司。铁氰化钾、磷酸氢二钠、硫酸亚铁、柠檬酸、三(羟甲基)氨基甲烷(生化试剂)、维生素C标准品、三氯乙酸、三氯化铁、苯酚、氢氧化钠、酒石酸钾钠 国药集团化学试剂有限公司;30%过氧化氢 西陇科学股份有限公司;2,2-联苯基-1-苦基肼基 上海阿拉丁生物科技有限公司;草酸 广州市大名通用化工厂;所有分离用有机试剂均为分析纯;MRS培养基、双歧杆菌琼脂培养基、亚硫酸铁多粘菌素B培养基、紫红胆盐葡萄糖琼脂培养基 广东环凯微生物科技有限公司;Wilkins-Chalgren琼脂 青岛高科技工业园海博生物技术有限公司;拟杆菌矿物盐琼脂和含氮基础培养基 根据文献[14]自制。
JP-0305超声波清洗器 深圳市洁盟清洗设备有限公司;ATY124电子天平 岛津菲律宾工厂;HR2095飞利浦搅拌机 飞利浦电子香港有限公司;SP500高压蒸气灭菌锅 日本YAMATO;UV-1800PC紫外可见分光光度计 翱艺仪器(上海)有限公司;SpectraMax ABS Plus酶标仪 MD美谷分子;TD5A低速离心机 上海英泰仪器有限公司;LC-20AT液相色谱仪 济南赛畅科学仪器有限公司;Basic Ⅰ厌氧微氧工作站 重庆江雪科技有限公司;PHS-3E pH计 上海仪电科学仪器股份有限公司。
1.2 实验方法
1.2.1 辣椒水提物的制备 选择新鲜、幼嫩、质脆、无病、无虫、无腐烂的辣椒,除去辣椒梗并洗净。取处理好的辣椒与蒸馏水按照1:1的比例榨汁,使用超声波辅助提取辣椒素(提取温度60 ℃,时间45 min,超声频率53 kHz),再用无菌纱布过滤,121 ℃高温灭菌20 min后于冰箱分装保存,每次使用之前用手持式匀浆机进行均质乳化。
1.2.2 辣椒水提物中主要成分的测定
1.2.2.1 还原糖测定 参考文献[15]方法,向1 mL辣椒水提物中加入2 mL DNS试剂,摇匀,沸水浴5 min,冷却后用蒸馏水定容至10 mL,在540 nm处测量吸光度,绘制标准曲线得到还原糖浓度。
1.2.2.2 蛋白质测定 蛋白质标准曲线的绘制:参考文献[16]方法。辣椒水提物中蛋白质的测定:取0.1 mL提取液与5 mL考马斯亮蓝混匀,2 min后测定吸光度,蛋白质的浓度经标准曲线计算得出。
1.2.2.3 VC测定 VC标准曲线绘制参考文献[17]方法;辣椒水提物中VC的测定:以2%草酸溶液为提取剂,超声波(53 kHz)提取后所得提取液在1000 r/min的离心机中离心10 min,移取离心管上层清液10.00 mL,用2%草酸溶液定容至100 mL,摇匀,于246 nm波长处测吸光度,代入VC标准曲线计算得到辣椒水提物中VC浓度。
1.2.2.4 辣椒水提物中辣椒素含量的测定 依据GB/T 21266-2007,准确称取辣椒水提物15.000 g于100 mL三角瓶中,添加25 mL甲醇-四氢呋喃混合溶剂超声(53 kHz)浸提1 h,过滤;在滤渣连滤纸中加入25 mL混合溶剂,再次进行超声提取1次,重复提取操作两次,合并各提取液,在旋转蒸发器70 ℃条件下将提取液浓缩为10~20 mL,加入混合溶剂定容至15 mL(V),随后在0.45 μm有机滤膜过滤,经色谱分析后得辣椒水提物中辣椒素含量色谱条件:色谱柱:Zorbax SB-C18 4.6 mm×250 mm 5μm;流动相:甲醇+水(65+35);进样量:10 μL;流速:1 mL/min;紫外检测波长:280 nm;柱温箱温度:30 ℃。
1.2.3 辣椒水提物体及标准辣椒素体外抗氧化性能的测定
1.2.3.1 试验样品的处理 根据文献[18]将辣椒水提物配制成微辣样T1、中辣样T和特辣样T2,对应的辣椒素质量浓度分别为0.028、0.056、0.112 g/L。根据辣椒水提物的质量浓度,配制出对应浓度的标准辣椒素样品B1、B、B2作为阳性对照。
1.2.3.2 DPPH·清除能力测定 根据文献[19]方法,取微辣样T1、中辣样T和特辣样T2各2 mL分别与DPPH溶液混合均匀,25 ℃黑暗条件下放0.5 h,于517 nm处测定吸光度,DPPH自由基清除计算方法按式(1)。
式中:R1,DPPH自由基清除率,%; A0,在2 mL 95%乙醇+2 mL DPPH下的吸光度值;A1,在2 mL样液+2 mL DPPH下的吸光度值;A2,在2 mL 95%乙醇+2 mL样液的吸光度值。
1.2.3.3 超氧阴离子清除能力测定 根据文献[19]的方法,邻苯三酚自氧化速率A0的测定:取9 mL pH为8.2的0.05 mol/L Tris-HCL缓冲液与8.4 mL蒸馏水混匀,25 ℃孵育20 min,快速加入0.6 mL邻苯三酚溶液,混匀后于320 nm测吸光度,记下5 min内的变化。以时间为横坐标,吸光度为纵坐标绘制曲线,曲线斜率即A0。
受试物作用下邻苯三酚自养化速率A1的测定:取9 mL pH为8.2的0.05 mol/L Tris-HCL缓冲液与6.6 mL蒸馏水混匀,25 ℃孵育20 min,快速加入1.8 mL辣椒水提物及0.6 mL邻苯三酚溶液,混匀后于320 nm测吸光度,记下5 min内的变化。以时间为横坐标,吸光度为纵坐标绘制曲线,曲线斜率即A1,超氧阴离子清除能力计算方法按式(2)。
式中:R2,超氧阴离子(O2–)自由基清除率,%;A0,邻苯三酚自氧化速率,%;A1,受试物作用下邻苯三酚自养化速率,%。
1.2.3.4 羟自由基清除率的测定 参考文献[19]所述的方法对羟自由基的清除率进行测定,计算方法按式(3)。
式中,A0—空白对照;Ax—加样液;Ax0—不加显色剂H2O2。
1.2.3.5 总还原能力的测定 参考文献[19]所述的方法对辣椒水提物及辣椒素中的总还原能力进行测定,以蒸馏水为空白对照,平行测定三次,计算方法按式(4)。
式中,A0—样液+试剂;A1—蒸馏水+试剂。
1.2.4 辣椒水提物与人粪便微生物的体外厌氧培养
1.2.4.1 粪便菌悬液的制备 采集3位健康大学生的粪便(3个月内未服用过抗生素或有肠胃病史),将采集的粪便混和均匀并按10%的比例加入到生理盐水中进行稀释,振动摇匀后制得粪便菌悬液。
1.2.4.2 人粪便微生物体外培养模型 设置三个试验组:根据前期辣椒水提物中辣椒素含量测定结果,参考膳食中特辣级别辣椒素浓度,本研究选取特辣浓度0.112 g/L作为试验浓度。Control组:将粪便菌悬液按10%比例接种到含氮基础培养基中,间歇式静态厌氧培养;PE组:将含辣椒素0.112 g/kg的辣椒水提物按1%的量加入含氮基础培养基中、粪便菌悬液接种量为10%,间歇式静态厌氧培养;SC组:将配制好的浓度为0.112 g/kg标准辣椒素溶液按1%的量加入含氮基础培养基中、粪便菌悬液接种量为10%,间歇式静态厌氧培养。
1.2.5 pH的测定 将pH计插入发酵液中直接测定。
1.2.6 主要短链脂肪酸的测定 主要短链脂肪酸的测定方法为气相色谱法[20],色谱条件:色谱柱为DBFFAP(60 m×0.25 mm×0.25 μm),流速0.8 mL/min,进样量1 μL,程序升温条件:60 ℃,保持2 min,以20 ℃升至220 ℃,保持3.5 min,检测器:氢火焰离子化检测器,温度:250 ℃。
1.2.7 益生元指数的计算 用10倍梯度稀释法(稀释液为0.9%生理盐水),选取合适梯度稀释液100 μL均匀涂布于7种选择性培养基上。涂布后乳酸杆菌、肠杆菌和总需氧菌在37℃需氧培养24~48 h后分别计数, 而总厌氧菌、拟杆菌、双歧杆菌和梭状芽孢杆菌在37 ℃厌氧培养48~96 h分别计数。将得到的菌落总数参照Palframan等[21]采用的PI计算方法,代入如下计算公式:
式中,Total、Bif、Lac、Clos、Bac分别指的是初始培养液中总厌氧菌、双歧杆菌、乳杆菌、拟杆菌、梭状芽孢杆菌与取样时总厌氧菌、双歧杆菌、乳杆菌、拟杆菌、梭状芽孢杆菌的比值。
1.2.8 B/E 值的计算 B/E值=粪便中双歧杆菌数量/粪便中肠杆菌数量
1.3 数据处理
数据处理使用SPSS 18.0和GraphPad Prism 7.00和软件,计量资料用±s表示,实验重复次数均为三次,统计差异比较采用单因素方差分析。
2 结果与分析
2.1 辣椒水提物主要成分含量分析
将辣椒水提物样T在540、595和246 nm处测得的吸光度分别代入图1标准曲线得还原糖、蛋白质和VC质量浓度分别为3690、194.010和29.09 μg/mL。还原糖质量浓度结果与崔桂娟等[22]还原糖含量相比结果基本一致。所测得蛋白质含量低于吉雪花等[23]的研究,推测是因为鲜辣椒在干制过程中水分大量散失,干物质浓度提高,使干辣椒中蛋白质的含量增加;或者是由于品种不同,新鲜程度不一,各物质本身的含量也存在差异;与吕玲玲等[24]的研究结果相比,本试验得到得到VC含量居于中间水平,可能是由于受到品种、存放条件、种植过程中的施肥水平等因素的影响所致。
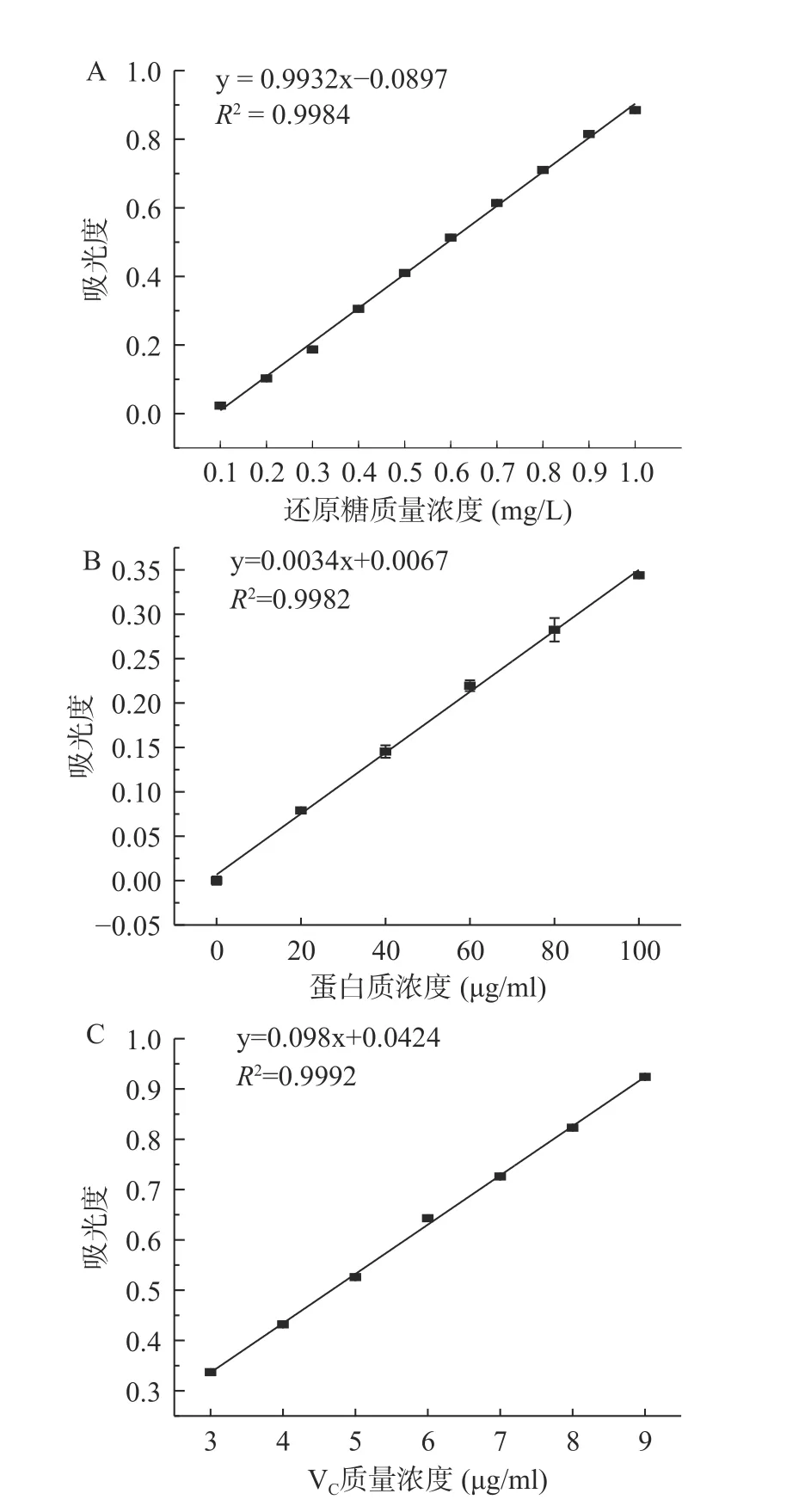
图1 辣椒水提物中还原糖浓度、蛋白质浓度和VC浓度的标准曲线Fig.1 Standard curves of reducing sugar, protein and VC concentration in capsicum aqueous extracts
辣椒水提物和辣椒素标准品色谱图结果如图2和图3所示,测得辣椒素含量为0.056 g/L,根据文献[18],该辣椒素浓度对应的辣度为中辣。与厉志伟等[25]用甲醇提取辣椒中的辣椒素含量相一致。
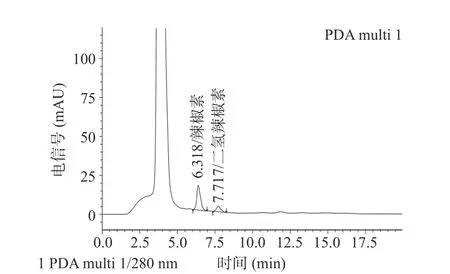
图2 辣椒水提物的色谱图Fig.2 Chromatogram of capsicum aqueous extracts
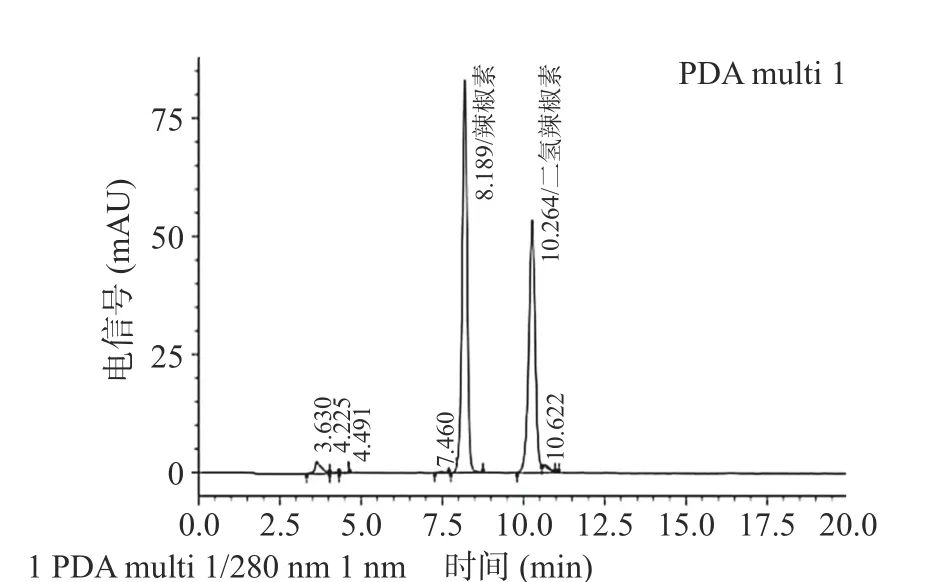
图3 辣椒素标准品的色谱图Fig.3 Chromatogram of capsaicin standard
2.2 体外抗氧化能力的测定结果
由图4可得知,4种抗氧化能力均随辣椒水提物和标准辣椒素的质量浓度的增加而增加,但辣椒水提物的清除能力稍弱于标准辣椒素,可能是其中的蛋白质和还原糖等成分影响所致。在质量浓度为0.028 g/L时,两者对DPPH自由基的清除能力最强,分别为81.92%和75.25%,标准辣椒素在0.112 g/L时对超氧阴离子和羟自由基的清除率达到最大值,分别为17.58%和22.03%,这与袁杨斌等[4]的清除效果相一致。刘安等[26]研究发现,VC对DPPH自由基和羟自由基的清除能力与辣椒素相近,并且都对DPPH自由基的清除能力最强,其结论在本实验中也得到了相同体现。
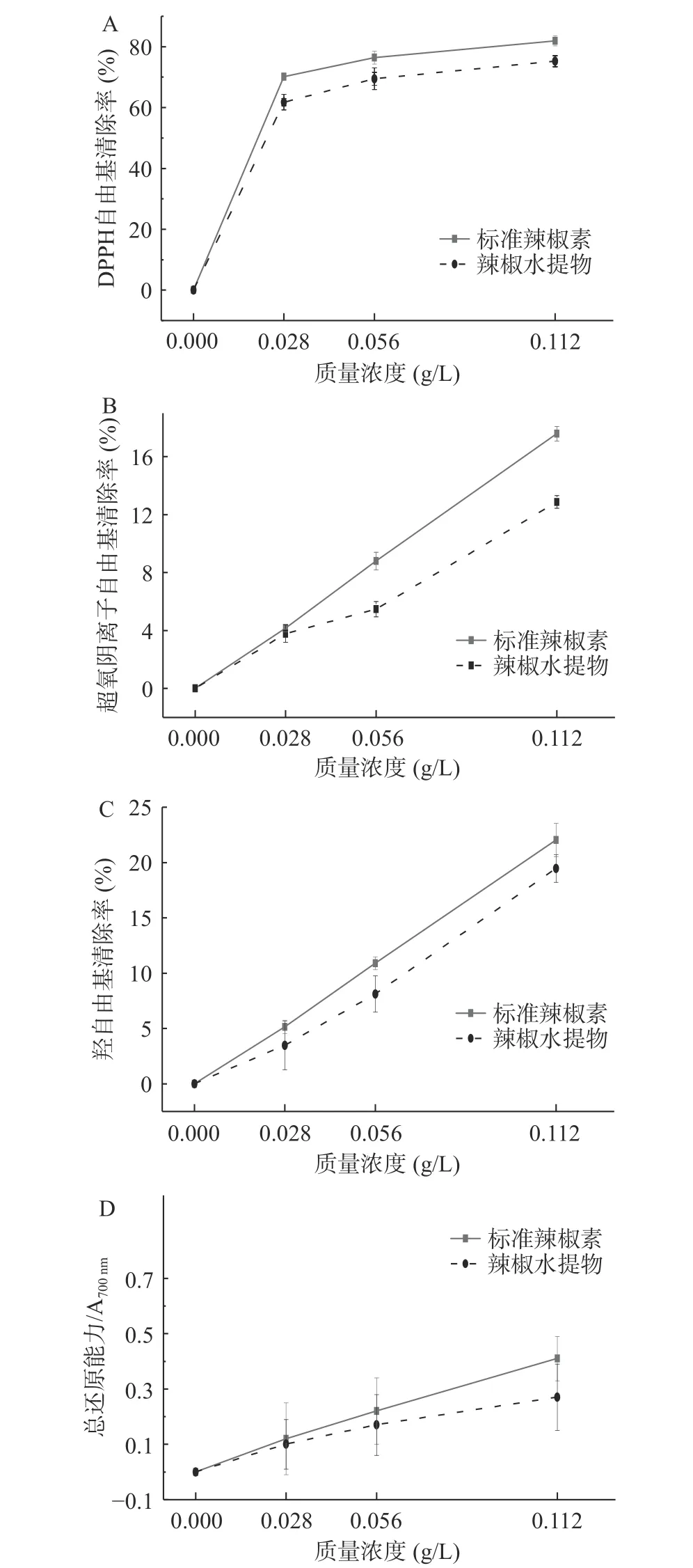
图4 辣椒水提物和辣椒素对DPPH自由基、超氧阴离子自由基、羟自由基清除效果及其总还原能力Fig.4 Scavenging effect of capsicum aqueous extracts and capsaicin on DPPH free radicals, superoxide anion free radicals,hydroxyl free radicals, and its total reducing power
2.3 体外发酵实验结果
2.3.1 不同时段培养液pH的变化 各组培养液不同时间段pH的测定结果如表1所示。从表1可以看出,随着培养时间的增加,各组培养液的pH都呈现出先下降后上升的趋势,并且与初始值存在显著差异(P<0.05)。其可能原因是,厌氧培养前期产酸的微生物快速繁殖,代谢产生乙酸、丙酸等短链脂肪酸,致使培养液pH下降。而培养到后期,培养液中的营养物质减少,生存空间变小,微生物的繁殖速度减慢,数量变化趋于稳定,因此,培养液的pH的变化也趋于稳定,且辣椒素本身呈碱性,辣椒素会通过降低肠道发酵中有机酸的产生量来抑制肠道益生菌对碳水化合物的发酵,使pH上升[27]。辣椒水提物因为含有一些酸性物质以及蛋白质、糖类等,培养液的pH会显著低于(P<0.05)Control组和SC组。综合表1中pH的变化可以得出辣椒水提物对培养体系pH的影响要强于辣椒素,且对一些依赖培养环境酸碱度的微生物有调节作用。
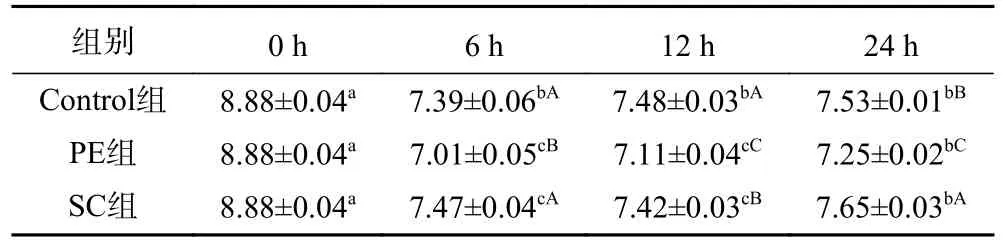
表1 不同时段培养液pH的变化Table 1 Different periods the change of the nutrient solution pH
2.3.2 不同时段培养液短链脂肪酸含量的变化 采用气相色谱测定SCFA,发现气相色谱柱对4种SCFA有着较好的分离效果,图5为其标准气相色谱图。乙酸、丙酸、丁酸和戊酸的保留时间分别为10.702、11.282、11.876和12.619 min。表2为Control组、PE组、SC组培养液不同时段SCFA的含量表。
图5 标准样品GC图谱Fig.5 GC atlas of standard samples
由表2可知,SCFA含量与培养时间呈正相关性,且分别在培养6、12、24 h时,PE组和SC组培养液中的SCFA含量与空白对照组Control组的SCFA含量均具有显著差异(P<0.05),说明微生物与辣椒水提物互相作用,促进了微生物对物质的代谢。任文瑾等[27]的研究结果表明,2.5~7.5 mg的辣椒素会导致肠道发酵中有机酸的产生量降低;苏昕峰[28]的研究显示,灌胃2.5~10 mg/kg的辣椒素对雌雄大鼠盲肠内容物SCFA均有极显著降低作用。这与本实验的结果不一致,推测可能是消化道内胃酸的影响或是本实验所使用的辣椒素浓度较高(0.112 g/L)所致。
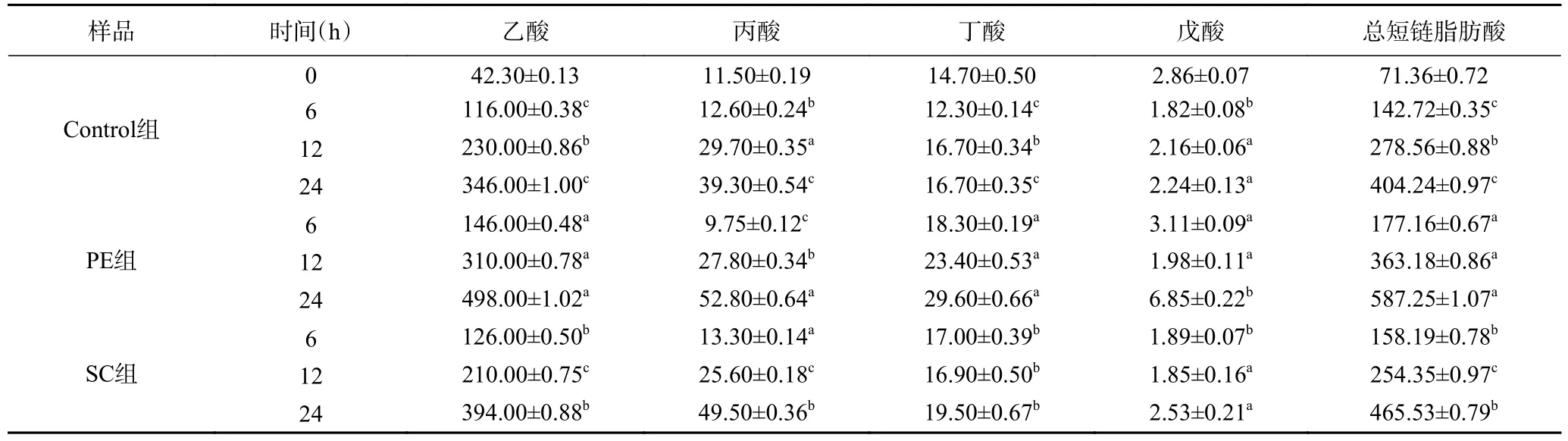
表2 不同时段培养液短链脂肪酸含量变化(μg/mL)Table 2 Table of short-chain fatty acid content in nutrient solution at different time (μg/mL)
通过单个数据分析可知,肠道微生物的代谢产物中数量最多的为乙酸,其次是丙酸、丁酸、戊酸,这几种酸含量的最大值都是在PE组,这说明辣椒水提物中的糖类、蛋白质对培养体系中有益菌的生长繁殖有促进作用。
2.3.3 不同时段培养液主要肠道微生物数量的变化 由图6可得知,在培养6 h时,PE组和SC组的总厌氧菌、梭状芽孢杆菌、双歧杆菌、乳酸杆菌和肠杆菌的数量均显著低于Control组(P<0.05),而拟杆菌的数量与Control组无显著差异(P<0.05),数量差别仅为0.1~0.2 lg(CFU/mL)。表明在此时,辣椒水提物与辣椒素抑制了总厌氧菌、梭状芽孢杆菌、双歧杆菌、乳酸杆菌和肠杆菌的生长,可能是培养体系SCFA的增加使得pH下降[29]所致;辣椒水提物与辣椒素对拟杆菌生长有促进作用,但作用比较微小。而培养至12 h时,PE组和SC组的总厌氧菌、梭状芽孢杆菌、双歧杆菌、乳酸杆菌和拟杆菌的数量均显著高于Control组(P<0.05),表明在此时,总厌氧菌、梭状芽孢杆菌、双歧杆菌、乳酸杆菌和拟杆菌能够利用代谢辣椒素以及辣椒水提物中的一些营养物质加快自身繁殖速度,而肠杆菌生长则受到了辣椒素以及辣椒水提物抑制。培养至24 h时,PE组和SC组的总厌氧菌、梭状芽孢杆菌、双歧杆菌、乳酸杆菌和拟杆菌的数量也均与Control组有显著差异(P<0.05),且总厌氧菌、梭状芽孢杆菌和肠杆菌数量低于Control组,双歧杆菌、乳酸杆菌和拟杆菌高于Control组,表明培养至24 h时,辣椒水提物与辣椒素抑制了总厌氧菌、梭状芽孢杆菌和肠杆菌的生长,但对双歧杆菌、乳酸杆菌和拟杆菌的生长表现出促进作用,可能由于培养后期培养体系的营养物质减少,生存空间不足,同时短链脂肪酸增多,所以使其生长受限,而乳酸杆菌和双歧杆菌由于具有较好的耐酸性所以依然可以生长繁殖。值得注意的是,在培养6~24 h时,各菌的PE组数量均显著高于SC组(P<0.05)。这是因为,辣椒水提物中含有的蛋白质、还原糖等物质与辣椒素产生协同作用,促进微生物的生长。葛婷等[30]的研究也表明,蛋白质底物的添加可以促进肠道微生物菌体合成。
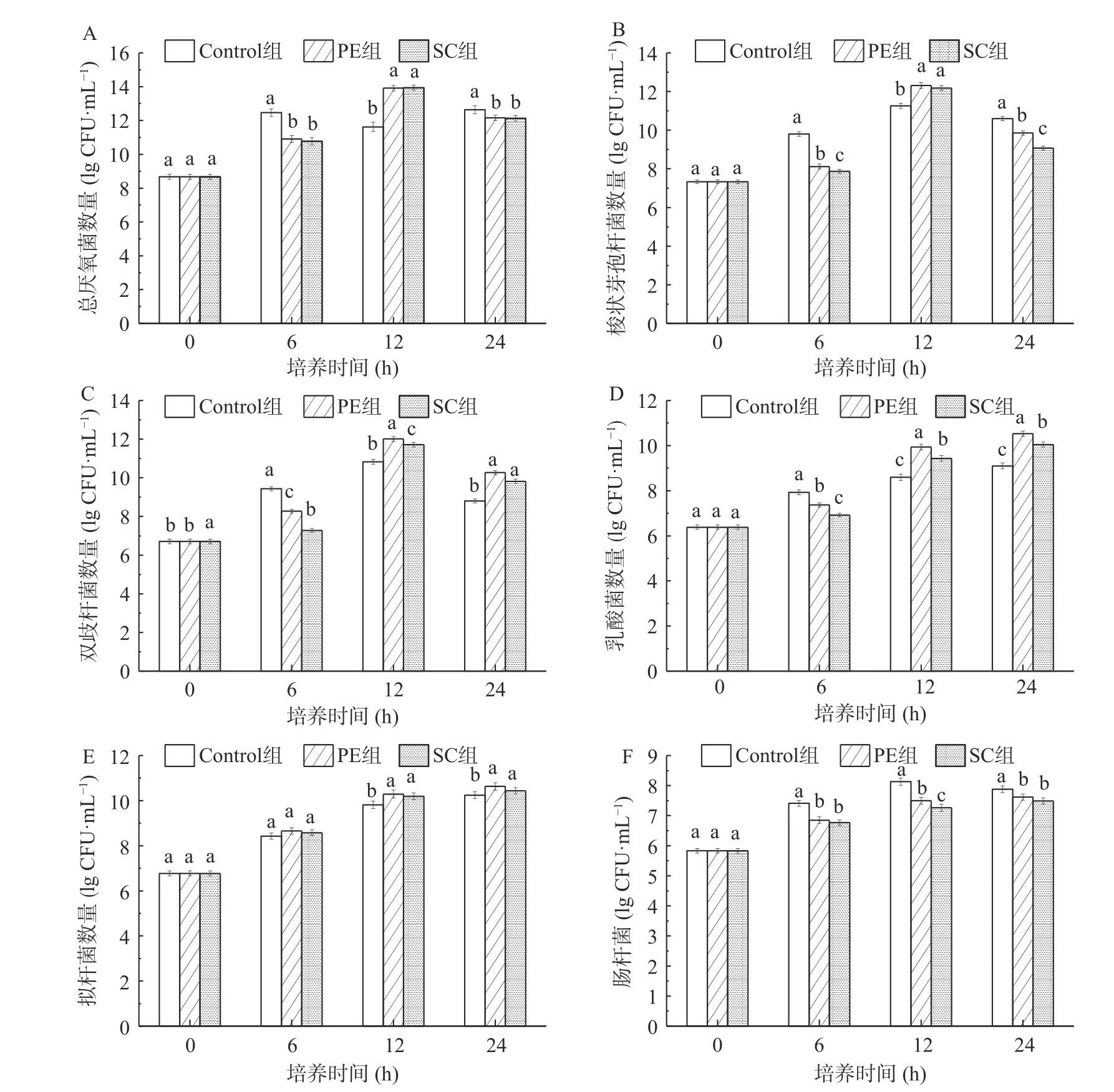
图6 不同时段各组培养液主要肠道微生物数量的变化Fig.6 Different times each medium, the quantitative change of major intestinal microbe
2.3.4 PE组和SC组培养液辣椒素含量的变化PE组和SC组的培养液测定的辣椒素含量变化如表3所示,辣椒素是按1%的比例加入,因此0 h时辣椒素辣椒素含量为1.12 mg/L。由表3可知,PE组和SC组分别培养至24和12 h时辣椒素含量减少为了0,减少的辣椒素可能是被肠道微生物代谢利用了,康超[31]的研究表明,辣椒素能增加肠道菌群中厚壁菌门/拟杆菌门的比例;叶敏等[32]研究发现,短期低、中剂量辣椒总碱可以促进肠道双歧杆菌,乳酸菌等有益菌的生长。通过代谢辣椒素与辣椒水提物中的其他物质,可以促进一些肠道微生物的生长,这表明肠道微生物对辣椒素的利用是存在的。
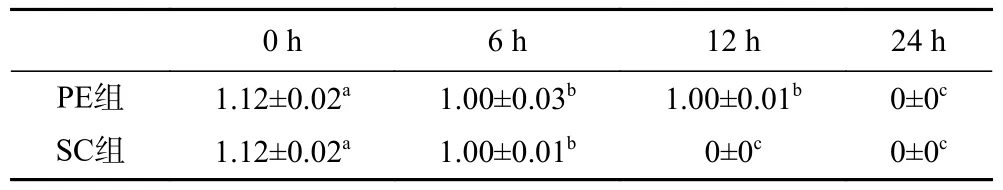
表3 不同时间段各组培养液辣椒素含量变化(mg/L)Table 3 Changes of capsaicin content in each group of culrure medium at different times periods (mg/L)
2.3.5 PI值和B/E值的变化 根据PI值和B/E值的计算公式,采用传统选择性培养基, 对涉及的肠道微生物进行培养计数,即体外发酵过程中的总厌氧菌、总需氧菌、双歧杆菌、乳酸杆菌、拟杆菌、肠杆菌和梭状芽孢杆菌,将以上6种肠道微生物的数据带入到PI值计算公式,并将双歧杆菌数量和肠杆菌数量代入B/E值的计算公式,绘图,得到PI值如图7所示,B/E值如图8所示。
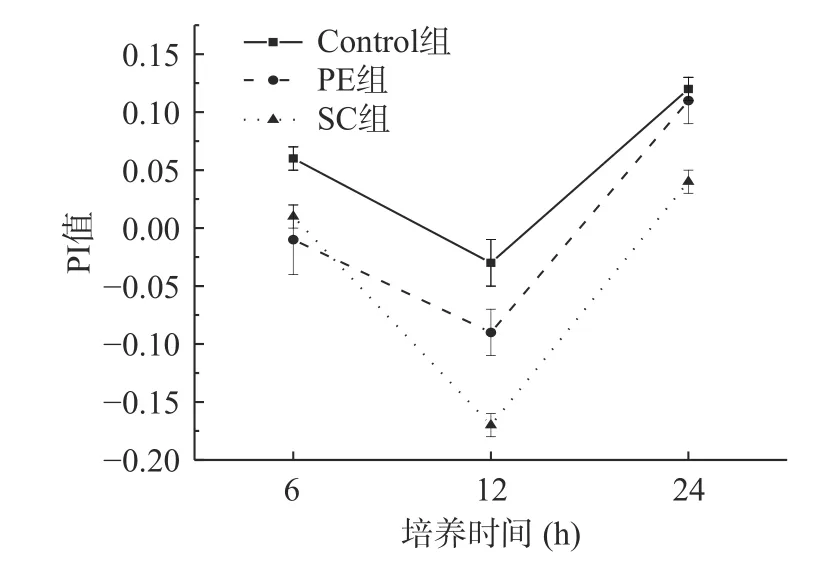
图7 体外培养过程中各组益生元指数的变化Fig.7 In vitro between groups of prebiotics index in the process of change
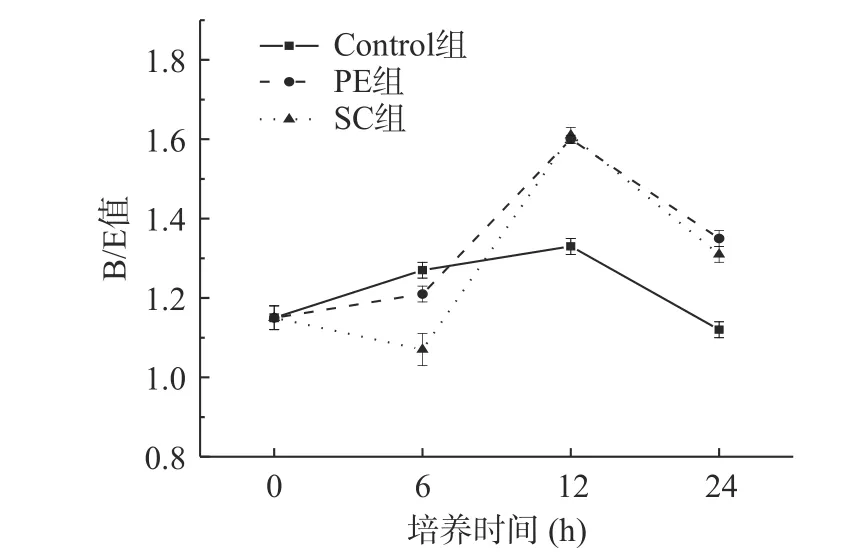
图8 体外培养过程中各组B/E值的变化Fig.8 In vitro between groups B/E value in the process of change
从图7中可知,三组试验的PI值都在12 h时出现转折点,随后持续上升,这是因为在6~12 h,梭状芽孢杆菌等有害菌快速繁殖,而12 h后,乳酸菌和双歧杆菌等有益菌开始快速增加,在6 h时辣椒素对于乳酸菌、双歧杆菌有抑制作用,因此PE组、SC组的PI值要始终低于Control组,表明添加了辣椒水提物与辣椒素的培养体系具有的益生作用较小,Control组24 h的PI值要高于其6 h的PI值,可推测,24及24 h后的PI值表现出的益生作用会更明显。
从图8上看,每组B/E值都是>1的,说明双歧杆菌在肠道内的数量占比大于肠杆菌,在6 h时,PE组和SC组对培养体系中肠道微生物的调节作用较小,弱于Control组,而在12、24 h时,PE组、SC组的调节作用强于Control组,其B/E值在12 h时有最大值为1.60、1.61。这也表明辣椒水提物与辣椒素可以提高双歧杆菌在肠道菌群的数量占比,调节作用在12 h时效果最明显。Haddad等[33]研究发现,在体外,辣椒作为双歧杆菌和乳酸杆菌的益生元是有效的,这在本研究中也得到了验证。
3 结论与讨论
本研究探明了红色小米椒水提物中还原糖、蛋白质、VC和辣椒素的含量,由于辣椒品种、新鲜程度等差异,发现其各物质含量与文献报道有一定的差异,笔者的后续研究中可以继续探究不同辣椒品种、产地、成熟度、贮藏方式等因素对这类物质含量的影响。参考食用辣度微辣到特辣范围的辣椒素含量值,发现在该范围内其体外抗氧化特性与辣椒素质量浓度呈现正相关,辣椒水提物中的其他成分对其抗氧化特性有一定的影响,使同辣椒素浓度下辣椒水提物的抗氧化能力稍弱于标准辣椒素溶液,这些成分对抗氧化性能的影响机理值得进一步探讨,如VC是有抗氧化特性的物质,但是在辣椒水提物中VC的存在没有与辣椒素在抗氧化性能方面形成加成效应,可能除了还原性糖外辣椒水提物中还有其他本研究未测到的成分促进了氧化,降低了辣椒水提物的抗氧化性能。同时,如辣椒素浓度小于微辣大于特辣范围,其抗氧化性能是不是还随着浓度的增大而加强,这个问题也值得进一步研究。
体外静态发酵过程中,发现发酵6 h时,辣椒水提物和辣椒素标品对大部分的肠道微生物都有抑制作用,如对乳酸菌、双歧杆菌、梭状芽孢杆菌、肠杆菌和总厌氧菌的生长具有抑制作用,仅对拟杆菌无明显抑菌效果,这是辣椒素刺激下不同微生物对其的适应能力的差异还是因为发酵体系pH不断下降导致的值得深究。发酵中后期,它们对双歧杆菌、乳酸杆菌等有益微生物以及拟杆菌都有促进作用,但对肠杆菌和梭状芽孢杆菌等有害微生物有一定的抑制作用,结合其发酵过程益生元指数值和辣椒素含量变化,发现发酵中后期其益生效果明显。因此推测在食用辣椒素或辣椒的过程中,前期是刺激和适应阶段,中后期是肠道微生物利用其代谢产物,发挥生理功能的阶段。当然,体外静态发酵模拟人体肠道,其与实际人体的消化过程有一定的差异,在肠道之前的消化过程会分解改变一些营养成分,因此辣椒素和辣椒水提物生理功效还有待进一步研究和验证。
