湿法糖基化改性对蛋清蛋白凝胶特性及微观结构的影响
2023-03-12张根生徐旖梦刘欣慈孙立瑞赵金娜
张根生,徐旖梦,刘欣慈,孙立瑞,赵金娜
(哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150028)
蛋清蛋白质(Egg White Protein,EWP)不仅具有较高的营养价值,还具有改善食品风味、质地和功能的特性,尤其是蛋清蛋白的凝胶性能,是一种重要的功能特性,被广泛地应用到食品加工的各种领域,在鱼糜肉糜、焙烤制品及蛋糕的制作中起到关键作用[1−2]。但天然蛋白质的功能特性尚不突出,不能完全满足实际生产应用的需要,通常要用特定的手段提高它的功能特性,使其应用领域更加广泛[3]。
近年来,利用蛋清蛋白与糖相互作用(共价相互作用和非共价相互作用)形成蛋清蛋白-糖类复合凝聚物提高蛋清蛋白凝胶性能的研究非常多,其产物主要为美拉德耦合物及蛋白质-糖静电复合物[4−8]。蛋白质与糖类的共价相互作用也称为糖基化交联作用,蛋白质的糖基化改性仅通过加热就能使糖基化反应自发进行,且接枝产物具有一定的安全性及可操控性。主要分为湿法糖基化和干法糖基化,这两种反应的主要区别就是反应体系的相对湿度和加热温度不同[9−10]。湿法糖基化是将蛋白质与糖的混合溶液在较高温度下直接加热,反应结束后迅速冷却,得到蛋白质-糖复合物,具有反应时间短、速度快、反应过程较干法糖基化易控制等优点[11−12]。刘建华等[13]采用3%的刺槐豆胶对卵白蛋白进行湿法糖基化改性,研究糖基化凝胶对鱼糜凝胶强度的影响,结果显示添加改性蛋清凝胶的鱼糜制品凝胶强度提高64%。魏晨[14]以卵白蛋白与D-木糖作为反应物,采用湿法糖基化进行反应,发现时间118.2 min,温度55.6 ℃,实际接枝率可达28.27%。目前,湿法糖基化改性蛋清蛋白凝胶特性主要集中在糖基化反应条件上,糖基化作用机理还需进一步深入研究。
低聚半乳糖(Galactooligosaccharides,GOS)是一种具有天然属性的功能性低聚糖,也是母乳中的重要益生元,具有较强的耐酸性、耐热性,不会因为在加工过程中的高温杀菌及人体内胃酸分解而失去其本来应有的特性,且与蛋白质发生反应需要很少或不需要其它化学试剂,避免了化学物质修饰的潜在安全风险[15]。低聚半乳糖特殊的功能特性使其被广泛地应用于各类食品加工中,如饮料、烘焙食品以及保健品[14]。近年来,低聚半乳糖也被用于糖基化改性乳清蛋白及大豆蛋白的功能特性,但糖基化改性蛋清蛋白功能特性未见探讨[16−17]。
本实验采用湿法糖基化制备蛋清蛋白-低聚半乳糖复合凝胶,探究低聚半乳糖改性对蛋清蛋白凝胶性能的影响及蛋清蛋白-低聚半乳糖复合凝胶形成机理,为拓宽蛋清蛋白凝胶的应用范围提供理论基础。
1 材料与方法
1.1 材料与仪器
鸡蛋 市售;低聚半乳糖 食品级,云浮市新金山生物科技有限公司;柠檬酸 分析纯,天津市大陆化学试剂厂;尿素 分析级,天津市登封化学试剂厂;二硫苏糖醇 分析级,合肥博美生物有限公司;盐酸胍 分析级,上海国药化学试剂有限公司。
HH 511-4恒温水浴锅 上海跃进医疗器械厂;CL-200型集热式恒温磁力搅拌器 巩义市予华仪器有限责任公司;Spectrum Two傅里叶红外光谱 美国珀金埃尔默股份有限公司;SU8010扫描电子显微镜 日本日立公司;TA.new plus质构仪 上海瑞玢智能科技有限公司;CS-800分光测色仪 杭州彩谱科技有限公司;BS 224S电子分析天平 赛多利斯贸易有限公司;TG16-WS型台式高速离心机 上海卢湘仪离心机仪器有限公司;Anton-Paar MCR 302动态流变仪 奥地利安东帕有限公司;KDY-9820型凯氏定氮仪 苏州江东精密科学仪器有限公司;7LG-10型真空冷冻干燥机 中国宁夏亚康设备有限公司;PHS-25雷磁pH计 上海仪电科学仪器有限公司。
1.2 实验方法
1.2.1 样品预处理 新鲜鸡蛋脱壳后分离蛋黄、蛋清膜及系带,剔除蛋清液中杂质过滤,用《食品中蛋白质的测定》即GB 5009.5-2016中凯氏定氮法测定样品中蛋白质含量,再将蛋白液稀释至蛋白浓度8%,用柠檬酸调节pH至7,4 ℃储藏备用。
1.2.2 样品的制备 取20 g蛋清液置于50 mL小烧杯中,边搅拌边加入4% (w/w)即0.8 g低聚半乳糖,将蛋清蛋白-低聚半乳糖混合物90 ℃水浴加热40 min诱导形成凝胶,停止加热后立即冰水浴降温,烧杯用保鲜膜封口,置于4 ℃下24 h后测定样品的凝胶性能。
1.2.3 低聚半乳糖添加量对复合凝胶质构性能的影响 蛋清液中加入0%、1%、2%、4%、6%、8%、10%(w/w)低聚半乳糖,90 ℃水浴加热40 min诱导形成复合凝胶,置于4 ℃下24 h后测定样品的硬度和弹性。
1.2.4 热诱导时间对复合凝胶质构性能的影响 蛋清蛋白与4%(w/w)低聚半乳糖混合于90 ℃水浴加热20、25、30、35、40、45、50、55 min诱导形成凝胶,置于4 ℃下24 h后测定样品的硬度和弹性。
1.2.5 热诱导温度对复合凝胶质构性能的影响 蛋清蛋白与4%(w/w)低聚半乳糖混合于65、70、75、80、85、90、95 ℃水浴加热40 min诱导形成凝胶,置于4 ℃下24 h后测定样品的硬度和弹性。
1.2.6 质构性能测定 参照曲超[18]的方法稍作修改,分析凝胶样品的质构特性。将蛋清蛋白、蛋清蛋白-低聚半乳糖复合凝胶切成10 mm×10 mm×10 mm大小,使用装有探头P/36R的质构分析仪进行质构分析,测定凝胶的硬度及弹性。设置参数为:测前速2 mm/s;测试速度1 mm/s;测后速度2 mm/s;压缩比例50%;触发点负载5 g;两个压缩循环间隔5 s,每个样品平行测3次。
1.2.7 色差的测定 凝胶色度参考Xia等[19]的方法略有修改,将蛋清蛋白及蛋清蛋白-低聚半乳糖复合凝胶切成10 mm×10 mm×10 mm方块,用标准黑白背景板校准分光测色仪后,凝胶将出光口完全覆盖,测量样品的L*、a*和b*值。每个样品上取正面、侧面、上面三个方向测定,并获得每个样品的平均值,以EWP凝胶为参考对照[20]。计算凝胶样品的白度(W),计算公式如下。
式中:W为白度;L*为亮度;a*为红蓝度;b*为黄绿度。
1.2.8 保水性的测定 凝胶保水性的测定参考杜文琪等[21]的方法稍作修改。取一定质量的蛋清蛋白及蛋清蛋白-低聚半乳糖复合凝胶,称量后以滤纸包裹并转移至离心管中,称重配平,于10000 r/min下在离心机中充分离心15 min,离心后的凝胶用滤纸吸干样品表面水分后称重。每个样品平行测定5次。保水性计算公式如下:
式中:W:凝胶保水性,%;W0:离心前称取的凝胶质量,g;W1:离心后测定的凝胶质量,g。
1.2.9 低场核磁分析 凝胶水分分布测定参考王晨莹[22]的方法稍作修改。取5 mm×5 mm×20 mm凝胶样品,包裹保鲜膜后置于低场核磁专用玻璃管中,将玻璃管置于射频线圈中心。采用CPMG程序对样品进行测定,设置参数如下:重复采样时间间隔TW=5000.0 ms,累加扫描次数NS=2,前置放大倍数PRG=1,回波个数NECH=12000。采样结束后采用纽迈核磁共振反演软件对得到的CPMG指数衰减曲线进行反演,得到低场核磁弛豫时间谱图,得到样品的横向弛豫时间(T2),对弛豫峰进行积分得到峰面积(A2),每个样品平行测定3次。
1.2.10 流变特性测定 采用流变仪(选用直径40 mm的平板)对复合蛋清液的流变性能进行测定。实验时取适量蛋清蛋白与蛋清蛋白-低聚半乳糖混合溶液置于测试台中央,设置平板与测试台间距为1.0 mm,去除多余的样品后在样品周围涂抹一圈液体硅油以防止水分的蒸发。对样品进行温度扫描,样品从25 ℃开始升温,设置参数:固定频率为1 Hz,应变为0.5%,设置温度以10 ℃/min的变化速率从25 ℃上升至80 ℃,恒温10 min后再下降至25 ℃,以观察不同样品的储能模量G'与温度的相关性;最后对样品进行频率扫描,在25 ℃下,固定形变为0.5%,设置角频率变化范围为0.1~100 rad/s,测定样品的储能模量G'与损失模量G"[23]。
采用幂律定律模型对频率扫描曲线进行拟合,以分析储能模量G'对频率的依赖性。幂律模型计算公式如下所示:
式中:ω表示角频率;G'是样品的储能模量;K'、n'分别表示幂律模型的常数和指数。指数n'反映了G'对频率的依赖程度,常数K'是每个正弦剪切变形循环所储存和恢复的能量,它的增加表明样品的刚性与弹性凝胶结构的形成有关[24]。
1.2.11 分子力分析 参考Abdelhedi等[23]和Li等[24]的研究方法并稍作修改。称取20 g蛋清液,加入具有破坏不同作用力的试剂,然后90 ℃加热40 min制备热凝胶,使用质构仪进行数据的采集与分析。选择2 mol/L尿素溶液破坏溶液中的氢键;选择2 mol/L盐酸胍溶液破坏溶液中的氢键和疏水相互作用;选择0.5%(w/w)二硫苏糖醇溶液破坏溶液中的二硫键。硬度损失比例计算公式如下所示:
式中:H为添加了蛋白变性剂的凝胶硬度;H0为空白对照的凝胶硬度。
1.2.12 傅里叶红外光谱(Fourier Transform Infrared Spectroscopy,FTIR)分析 蛋清蛋白和蛋清蛋白-低聚半乳糖复合凝胶经冷冻干燥处理后,取少量样品粉末与KBr粉末混合,研磨均匀,压片机压片。扫描范围4000~400 cm−1,分辨率4 cm−1,扫描次数32次,谱图经标准化后采用Peakfit 4.12软件进行蛋白质二级结构分析,计算各种二级结构的相对百分含量[25]。
1.2.13 微观结构分析 蛋清蛋白复合凝胶切成2 mm×2 mm×2 mm立方体小块,冷冻干燥,干燥后的样品喷金,扫描电子显微镜上观察样品的微观结构,放大倍数为5000、10000倍。通过电子显微镜观察蛋清蛋白-低聚半乳糖复合凝胶的微观结构[26]。
1.3 数据处理
采用Origin 2018软件制图,显著性分析采用Duncan's法,数据采用平均值±标准偏差表示。
2 结果与分析
2.1 低聚半乳糖添加量对复合凝胶质构性能的影响
由图1可知,EWP-GOS复合凝胶的硬度和弹性均随低聚半乳糖添加量的增加呈先增大后减小的趋势,在低聚半乳糖添加量4%时达到最大,硬度为1369.64 g,弹性为0.925 g,硬度和弹性较未添加低聚半乳糖的EWP凝胶比分别增加了68.30%和15.05%。低聚半乳糖添加量逐渐增加,与体系中的蛋白分子接触面积增大,随着温度升高,蛋清蛋白结构被破坏,暴露出来的结合位点可与低聚半乳糖迅速接枝,改变了复合凝胶的质构性能,使硬度和弹性增大。但随着低聚半乳糖的添加量增加到一定范围,浓度过高的低聚半乳糖与大分子蛋白同时存在时空间位阻大,结合位点不易接触,游离氨基与低聚半乳糖羰基在接枝前蛋白凝胶就已经形成,导致最终凝胶稳定性下降[27]。
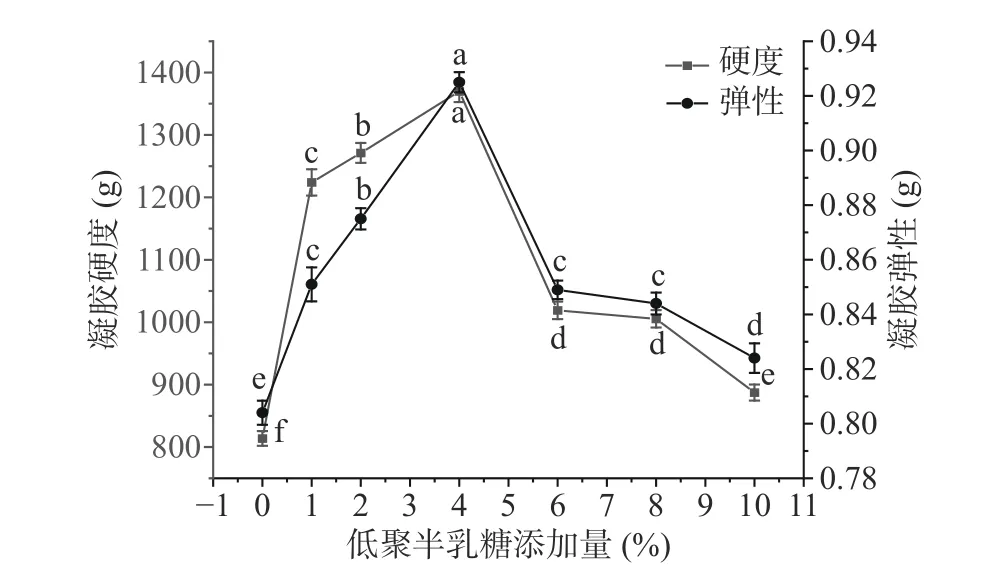
图1 低聚半乳糖添加量对复合凝胶的凝胶性影响Fig.1 Effect of galactooligosaccharide addition on gel properties of composite gels
2.2 热诱导时间对复合凝胶质构性能的影响
如图2所示,蛋清蛋白凝胶稳定性随热诱导时间增加呈先增大后减小的趋势,热诱导时间40 min时,EWP-GOS复合凝胶的硬度及弹性达到最大,硬度为1218.03 g,弹性为0.936 g,与EWP凝胶相比均有提升。最佳凝胶强度与蛋清蛋白质的变性程度有关,加热时间不足,蛋清蛋白质展开后未能与低聚半乳糖的游离羰基相结合,导致低聚半乳糖与蛋白质结合程度低,凝胶网络结合不紧密,凝胶强度下降。但加热时间过长,会使稳定的复合凝胶结构在持续受热的情况下遭到二次破坏,原本稳定的凝胶网络向不规律的方向发展,复合凝胶硬度及弹性略有下降。
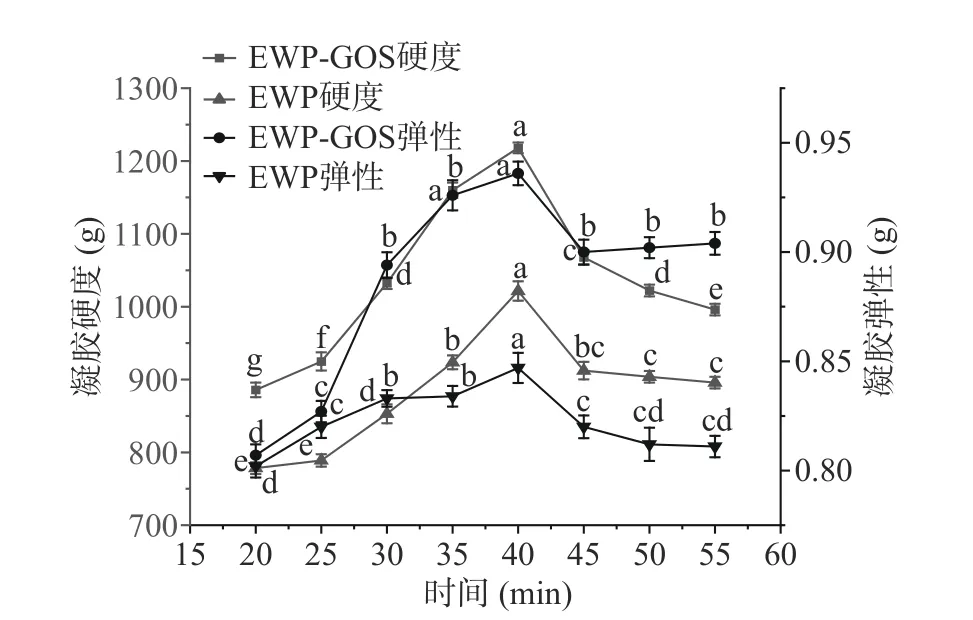
图2 热诱导时间对复合凝胶的凝胶性影响Fig.2 Effect of thermal induction time on the gel properties of composite gels
2.3 热诱导温度对复合凝胶质构性能的影响
图3表明热诱导温度达到90 ℃前蛋清蛋白复合凝胶硬度和弹性逐渐增大,在温度达到90 ℃后,凝胶硬度和弹性略有减小。这是由于达到蛋清蛋白质变性温度(65 ℃)后,升高的温度使蛋白变性程度增大,更多蛋白质结构被破坏,疏水性基团暴露,分子间加速聚合使微观网络结构更致密[21]。热诱导温度超过90 ℃时,蛋白质凝胶化速率增速明显,推测蛋白分子在聚集前就已经形成凝胶,小分子聚集物无法继续结合形成大分子网络结构,使硬度略有下降。

图3 热诱导温度对复合凝胶的凝胶性影响Fig.3 Effect of heat-induced temperature on the gel properties of composite gels
2.4 蛋清蛋白-低聚半乳糖复合凝胶色差分析
凝胶的颜色是影响凝胶产品外观及其接受度的重要因素之一。从表1中可以看到,蛋清蛋白凝胶和复合凝胶在亮度上没有显著差异(P>0.05);EWPGOS复合凝胶在a*值上更偏向于红色,EWP凝胶更偏向于绿色;两者在b*值上都明显趋于黄色,但EWP凝胶的黄色程度明显小于复合凝胶。经糖基化改性的蛋清蛋白凝胶白度显著下降23.37%(P<0.05)。蛋清色泽变化是一个复杂的过程,目前较为认可的是由于复合凝胶中的低聚半乳糖和蛋清液在受热时产生轻微的美拉德褐变,这种褐变改变了凝胶的颜色[28]。

表1 蛋清蛋白凝胶和蛋清蛋白-低聚半乳糖复合凝胶的色差Table 1 Color difference between egg white protein gel and egg white protein-galactooligosaccharide composite gel
2.5 蛋清蛋白-低聚半乳糖复合凝胶保水性及水分分布分析
保水性是反映凝胶性能的重要指标之一,它表征了凝胶网络结构的持水能力[29−30]。通过离心测定蛋清蛋白-低聚半乳糖复合凝胶的水分保持能力,如图4显示,添加了低聚半乳糖的蛋白质凝胶保水性较EWP凝胶更好,保水性显著(P<0.05)增大了27.54%。
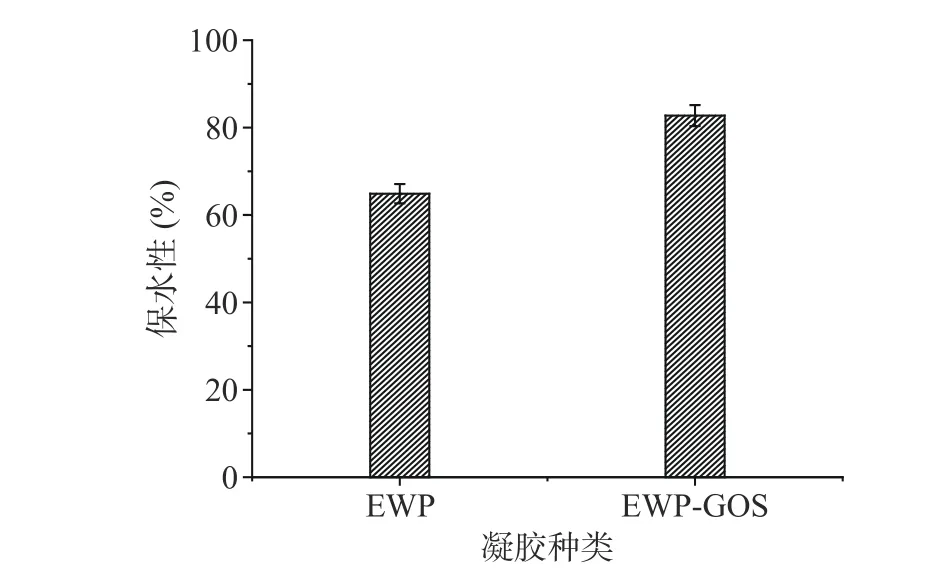
图4 蛋清蛋白-低聚半乳糖复合凝胶的保水性Fig.4 Water retention of egg white proteingalactooligosaccharide composite gel
通过对EWP凝胶及EWP-GOS复合凝胶横向弛豫时间T2分布分析(图5),可以明显发现加入低聚半乳糖使蛋清凝胶的弛豫时间T2和信号强度显著(P<0.05)减小,表明水分结合程度增加,自由度降低[31]。EWP凝胶及EWP-GOS复合凝胶对应的峰面积如表2所示,EWP凝胶在弛豫时间T21为1.52 ms处的峰面积为3.69%,而EWP-GOS复合凝胶在弛豫时间T21为1 ms处的峰面积为10.66%;EWP凝胶T22峰面积为94.02%,EWP-GOS复合凝胶T22峰面积为86.42%;EWP凝胶T23峰面积为2.29%,EWPGOS复合凝胶T23峰面积为2.92%,证明经低聚半乳糖改性后的蛋清蛋白凝胶部分不易流动水变成结合水,复合凝胶中的水分与蛋白结合程度更高,结构更紧密。推断通过氢键、分子偶极、诱导偶极、瞬间偶极等作用力,蛋白质结合大量水分,形成难于自由运动的巨大分子,低聚半乳糖促进蛋白质大分子建立网络结构,从而增加其保水性,形成的多孔凝胶结构也增加了对水分的束缚作用[32]。Wang等[33]用低聚异麦芽糖对蛋清蛋白进行糖基化改性,发现更多的水分子作为束缚水分布在凝胶网络中,自由水含量减少,经糖基化后,水与蛋清蛋白-低聚异麦芽糖复合凝胶结合得更紧密,与本实验结论一致。
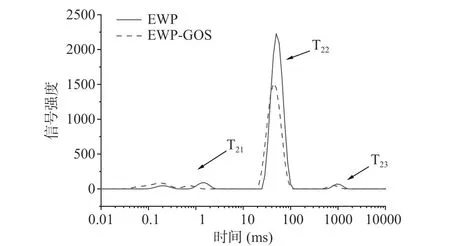
图5 蛋清蛋白-低聚半乳糖复合凝胶的水分分布状态Fig.5 Moisture distribution of egg white proteingalactooligosaccharide composite gel
表2 复合凝胶的弛豫时间T2和峰占比R2Table 2 Relaxation time T2 and peak ratio R2 of composite gel
2.6 蛋清蛋白-低聚半乳糖复合凝胶流变特性分析
为了探究糖基化改性后蛋清蛋白溶液在升温过程中流变特性的影响,测定了溶液升温凝胶化过程中的储能模量(G')和损耗模量(G")。图6为蛋清蛋白-低聚半乳糖复合凝胶和空白对照组的温度扫描曲线,储能模量(G')和损耗模量(G")随温度变化而变化的曲线属于典型的热致凝胶升温曲线。图6能够明显看出糖基化改性后的蛋清蛋白凝胶模量明显大于未改性的蛋清蛋白凝胶,这可能是因为糖基化反应可以使蛋白质分子展开,而蛋白质间交联可以提高模量值[34]。蛋白质受热变性,疏水基团暴露,体系中疏水作用增大是图中凝胶的G'和G"都随温度升高而增大的原因[35]。改性与未改性的蛋清蛋白凝胶的损耗模量(G")与弹性模量(G')曲线变化相似,均是G'>G",说明形成的都是弹性凝胶。当温度升到80 ℃时,蛋清蛋白凝胶和复合凝胶的G'和G"骤然升高,表明蛋清溶液和复合溶液均开始由液态向固态转变。在降温过程中蛋清蛋白凝胶及复合凝胶的G'仍明显增大(表3),说明蛋清凝胶及复合凝胶还在形成稳定的凝胶结构。在升温及降温阶段,EWP-GOS复合凝胶G'始终大于EWP凝胶G',说明EWP-GOS复合凝胶的凝胶性能优于EWP凝胶。
图6 蛋清蛋白-低聚半乳糖溶液升温过程中的流变学性质Fig.6 Rheological properties of egg white proteinoligosaccharide solution during heating
表3 蛋清蛋白和蛋清蛋白-低聚糖溶液凝胶化过程中的储能模量(G')Table 3 Storage modulus (G') of egg white protein and egg white protein-oligosaccharide solution during gelation
2.7 蛋清蛋白-低聚半乳糖复合凝胶分子间作用力分析
蛋清蛋白质热凝胶化涉及疏水相互作用、氢键、二硫键等,为考察各分子间作用力对凝胶成胶的影响,向热凝胶化前的复合溶液中添加具有破坏相应作用力的化学试剂,通过对复合凝胶硬度测定来表征各分子间作用力在凝胶化中的贡献度。由图7可以看出,疏水作用、氢键及二硫键对EWP-GOS复合凝胶硬度损失的影响,加入盐酸胍和二硫苏糖醇后,EWPGOS复合凝胶和EWP凝胶硬度损失具有显著差异(P<0.05);加入尿素后,EWP-GOS复合凝胶和EWP凝胶硬度损失没有显著差异(P>0.05),说明糖基化改性蛋清蛋白后,参与凝胶形成的疏水相互作用及二硫键作用力增强,氢键没有显著变化。低聚半乳糖的加入使蛋清蛋白内部疏水基团暴露在表面,形成疏水相互作用,因此疏水基团对复合凝胶的形成贡献较大,这与王超颖等[36]的结论一致。蛋清蛋白经糖基化修饰后,巯基氧化形成二硫键,导致蛋白交联增加,从而改善了蛋清蛋白凝胶特性[37]。
图7 蛋清蛋白-低聚半乳糖复合凝胶中的分子作用力Fig.7 Molecular forces in egg white proteingalactooligosaccharide composite gel
2.8 蛋清蛋白-低聚半乳糖复合凝胶二级结构分析
蛋清蛋白-低聚半乳糖复合凝胶与对照组蛋清蛋白凝胶FTIR谱线如图8所示,波长3200~3650 cm−1为-OH的伸缩振动峰,是糖链的特征结构吸收带;波长2800 cm−1为-CH键的伸缩振动;1650~1900 cm−1为C=O键的伸缩振动;1630 cm−1为氢键的吸收峰。糖基化改性后,EWP在3277 cm−1处的吸收峰迁移至3270 cm−1,表明有部分低聚半乳糖与蛋清蛋白产生共价交联;1700~1750 cm−1为醛基吸收峰,糖基化改性后,EWP在1743 cm−1处的吸收峰迁移至1750 cm−1,说明GOS在溶液中结构展开,糖环中的碳氧双键暴露,与蛋清蛋白伯氨基共价交联,导致蛋清蛋白二级结构发生改变。
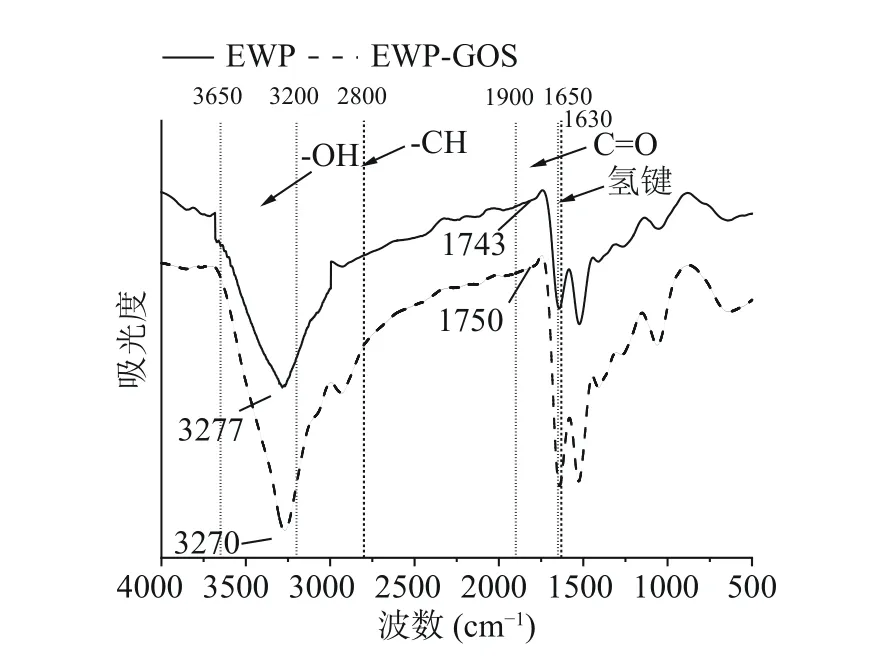
图8 蛋清蛋白-低聚半乳糖复合凝胶的傅里叶红外谱图Fig.8 Fourier transform infrared spectra of egg white proteingalactooligosaccharide composite gel
通过对图8中FTIR谱图中酰胺带的求导及积分,表4展示了糖基化改性后的蛋清蛋白凝胶中蛋白质的二级结构占比。GOS对EWP二级结构中的β-折叠含量有增益影响。由于β-折叠的特殊结构,当β-折叠含量占比大时,热诱导过程中蛋白质展开程度也随之增大,更多疏水基团暴露,因疏水力增大而使蛋白分子在聚集前充分结合,形成更规则致密的网络结构,凝胶的硬度达到最大,凝胶结构也越稳定,这与TPA测定结论相吻合。

表4 蛋清蛋白和蛋清蛋白-低聚糖凝胶的二级结构百分比Table 4 Percentage of egg white protein and egg white proteingalactooligosaccharide composite gel two level structure
2.9 蛋清蛋白-低聚半乳糖复合凝胶微观结构分析
图9是蛋清蛋白凝胶、蛋清蛋白-低聚半乳糖复合凝胶的微观结构,反映了糖基化对蛋清蛋白凝胶的网络结构影响。从图9中可知,添加了低聚半乳糖的复合凝胶较对照组蛋清蛋白凝胶微观网络结构有明显改善。EWP凝胶结构孔隙大、结构疏松,低聚半乳糖-蛋清蛋白复合凝胶的微观凝胶结构致密光滑,结合凝胶性能来看,致密结构使凝胶具有较好的质构性能和保水性。

图9 蛋清蛋白凝胶和蛋清蛋白-低聚半乳糖复合凝胶的微观结构比较Fig.9 Comparison of microstructure between egg white Gel and egg white protein- galactooligosaccharide composite gel
3 结论
经低聚半乳糖改性后的蛋清蛋白凝胶性能具有明显增强效果。添加4%低聚半乳糖,可以促进蛋清蛋白形成致密有序的凝胶网络结构,硬度和弹性分别增大68.30%和15.05%。经低聚半乳糖改性后的蛋清蛋白凝胶中的自由水和不易流动水转变为结合水,使复合凝胶的保水性提高了27.54%。在热诱导下,低聚半乳糖与蛋清蛋白质发生美拉德反应,显著(P<0.05)降低了蛋清蛋白凝胶的白度,且热诱导过程中低聚半乳糖结构展开,糖环中的碳氧双键暴露,与蛋清蛋白伯氨基发生共价交联,改善了蛋清蛋白的凝胶性能,使微观结构更加致密。因此,低聚半乳糖改性蛋清蛋白凝胶性能是一种很有前景的方法。在后续的研究中,低聚半乳糖协同酶或其它加工方式对蛋清蛋白凝胶性能的影响需要进一步深入讨论。
