经肋间单孔胸腔镜肺叶切除术联合消癌平对非小细胞肺癌患者miR-210 和miR-101 表达的影响*
2023-03-12王维新何国丽张剑锋付红艳左晶晶任宏玲
王维新,何国丽,张剑锋,付红艳,左晶晶,任宏玲
(1.河北省秦皇岛市第二医院,河北 秦皇岛 066600;2.河北省秦皇岛市第四医院,河北 秦皇岛 066600)
肺癌以非小细胞肺癌(NSCLC)最常见,占70%~80%[1]。NSCLC 的癌细胞生长分裂较慢,扩散转移相对较晚,早期无明显症状,确诊时多处于早中期阶段,此时可通过手术切除治疗而抑制癌细胞的增殖、转移、扩散[2]。经肋间单孔胸腔镜(IUVATS)肺叶切除术创伤小、痛苦轻、恢复快、疗效确切、安全可靠,近年来广泛应用于治疗NSCLC[3]。为了提高手术治疗效果,临床推荐术后行辅助化疗。常规西药化疗对癌细胞有较好的抑制及杀灭作用,但存在细胞毒性大、患者免疫功能下降、耐药等问题[4]。中医认为,癌症是由癌毒积聚、正气不足、脾肾亏虚等导致[5]。消癌平具有清热解毒、化痰软坚、益气养阴功效,既往用于肝癌、肺癌、胃癌、食管癌等癌症的辅助化疗效果较好[6]。微小RNA210(miR-210)、微小RNA101(miR-101)在癌症肿瘤疾病中呈现异常表达,与NSCLC 病情进展有一定关联[7],可作为NSCLC 诊断及疗效评估的标志物。本研究中探讨了IUVATS 肺叶切除术后给予消癌平注射液辅助治疗NSCLC 的疗效,以及对miR-210 和miR-101 表达水平的影响。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:确诊NSCLC,符合《Ⅰ~ⅢB期非小细胞肺癌完全切除术后辅助诊疗指南(2021版)》中相关诊断标准[8];IUVATS肺叶切除术治疗指征;对消癌平注射液等治疗药物无禁忌证。本研究方案经医院医学伦理委员会审查批准,患者签署知情同意书。
排除标准:预计生存周期不足3 个月;术后出现严重并发症转入重症监护室;入组前已接受其他治疗药物干预;未严格执行预定的化疗方案;治疗期间出现严重不良反应需停止治疗。
病例选择与分组:选取我院2020年4月至2021年4月收治的NSCLC 患者118例,按随机数字表法分为对照组和观察组,各59 例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。详见表1。

表1 两组患者一般资料比较(n=59)Tab.1 Comparison of the patients' general data between the two groups(n=59)
1.2 方法
对照组患者以IUVATS 肺叶切除术治疗,行双腔气管内插管静脉复合全身麻醉后,采用健侧侧卧位,用3 孔法行手术操作。选择腋中线与腋后线第7 或第8 肋间为观察孔,肩脚下角线第7 或第8 肋间取长约1.5 cm的切口为辅助操作孔,第4 或第5 肋间腋前线取长约3~4 cm 的切口为主操作孔。胸腔镜下探查胸腔,分离粘连,排除胸腔内转移情况。若术前病理诊断明确,则行肺叶切除及淋巴结清扫术;若术前病理诊断不明确,则术中行楔形切除,冰冻病理证实为肿瘤再行肺叶切除及淋巴结清扫,分别处理肺动脉、肺静脉及支气管。具体方案:一般先游离切断肺静脉,处理肺动脉和支气管,以直线切割缝合器进行切断,离断支气管前请麻醉师鼓肺,确认病变肺叶及余肺复张情况,用标本袋自主操作孔取出病变肺组织,常规清扫肺门和纵隔淋巴结,即对目标区域内的所有淋巴结及周围脂肪组织等进行整块切除。完成后胸腔内注入0.9%氯化钠注射液,麻醉师协助鼓肺检查有无支气管残端及其他部位漏气,分别放置上下胸腔闭式引流管,关闭切口。术后,辅以EP(顺铂+依托泊苷)化疗方案,给予注射用顺铂(山东罗欣药业集团股份有限公司,国药准字H20046375,规格为每支10 mg)50 mg/m2+500 mL 0.9%氯化钠注射液缓慢静脉滴注,第1天;依托泊苷注射液(华润双鹤药业股份有限公司,国药准字H11021801,规格为每支5 mL∶0.1 g)120 mg/ m2+500 mL 0.9%氯化钠注射液缓慢静脉滴注,第1 天至第3 天。以21 d 为1 个化疗周期,1 个化疗周期结束后休息7 d,观察组患者在对照组治疗基础上加用消癌平注射液(南京圣和药业有限公司,规格为每支20 mL,国药准字Z20025868)60 mL +250 mL 0.9%氯化钠注射液静脉滴注,滴注时间60~90 min。以21 d为1个化疗周期,在化疗周期的第1天至第14天每日给药1次。两组均连续治疗4个周期。
1.3 观察指标与疗效判定标准
肿瘤标志物水平:分别于治疗开始前、治疗结束后1 d 采集空腹静脉血各3 mL,采用TD-5M 型实验室高速离心机(山东博科医学仪器厂)离心(离心半径5 cm,转速5 000 r/min)15 min。采用酶联免疫吸附法检测肿瘤标志物水平,包括糖类抗原199(CA199)、糖类抗原153(CA153)、人细胞角蛋白21-1片段(CYFRA21-1)水平,检测仪器为HED-SY96S型多功能酶标仪(山东霍尔德科技公司),试剂盒由深圳芬德生物技术公司提供。
2)免疫功能指标:取血清上清液,采用FACS Canto10型荧光流式细胞仪(美国BD公司)检测患者的T淋巴细胞亚群CD3+,CD4+,CD8+水平,计算CD4+/CD8+,试剂盒由上海康朗生物技术公司提供,将10 μL CD3+,CD4+,CD8+试剂加入各指标检测管中,分别加入抗凝血酶100 μL,并设立同型对照管,振荡均匀,避光室温孵育20 min。加入2 mL 溶血素,振荡均匀,避光室温孵育5 min,离心(转速1 000 r/min)5 min,弃去上清液,加入2 mL 磷酸盐缓冲液,离心(转速1 000 r/min)5 min,弃去上清液,再加入300 μL 磷酸盐缓冲液,混匀,然后采用流式细胞仪检测。miR-210 和miR-101 水平:采用逆转录合酶链式反应(RT-PCR)法提取细胞总RNA,检测RNA 纯度、含量,逆转录处理后获得cDNA,采用Primer 5.0软件设计引物,采用2-ΔΔCt方法计算(内参U6),采用2-ΔΔCt法计算。
疗效判定[9]:完全缓解(CR),治疗4 个周期后,1 个月内CT 探查显示肿瘤病灶完全消退;部分缓解(PR),疗程结束后1 个月内,CT 探查肿瘤病灶减小超过50%;稳定(SD),疗程结束后1 个月内,患者影像学检查癌症病灶缩小不超过50%,增大不超过25%;进展(PD),疗程结束后1 个月内,CT 探查病灶无减小或有增大。客观缓解(ORR)=CR+PR;疾病控制(DCR)=CR+PR+SD。
安全性:统计并比较两组患者治疗期间恶心呕吐、腹泻、消化道出血、关节痛等不良反应发生情况。
1.4 统计学处理
采用SPSS 25.0 统计学软件分析。计量资料符合正态分布和方差齐性规律以表示,行t检验;计数资料以率(%)表示,行χ2检验。P<0.05 为差异有统计学意义。
2 结果
结果见表2至表6。
表2 两组患者肿瘤标志物水平比较(,U/L,n=59)Tab.2 Comparison of tumor marker levels between the two groups(,U/L,n=59)
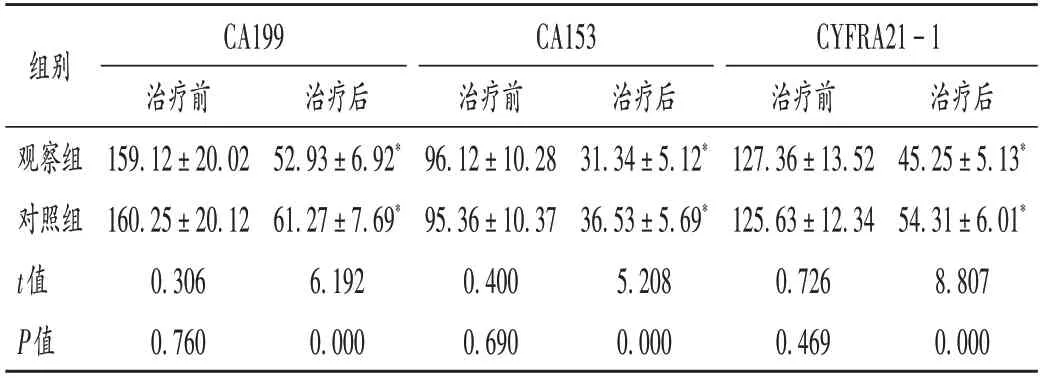
表2 两组患者肿瘤标志物水平比较(,U/L,n=59)Tab.2 Comparison of tumor marker levels between the two groups(,U/L,n=59)
注:与本组治疗前比较,*P <0.05。表3和表4同。Note:Compared with those before treatment,*P < 0.05(for Tab.2-4).
表3 两组患者miR-210和miR-101表达水平比较(,ng/L,n=59)Tab.3 Comparison of miR-210 and miR-101 expression levels between the two groups(,ng/L,n=59)
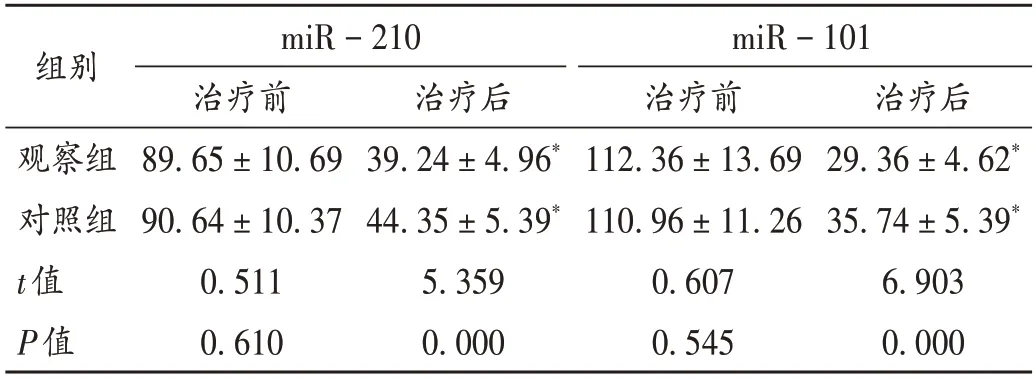
表3 两组患者miR-210和miR-101表达水平比较(,ng/L,n=59)Tab.3 Comparison of miR-210 and miR-101 expression levels between the two groups(,ng/L,n=59)
表4 两组患者免疫功能指标比较(,n=59)Tab.4 Comparison of immune function indexes between the two groups(,n=59)
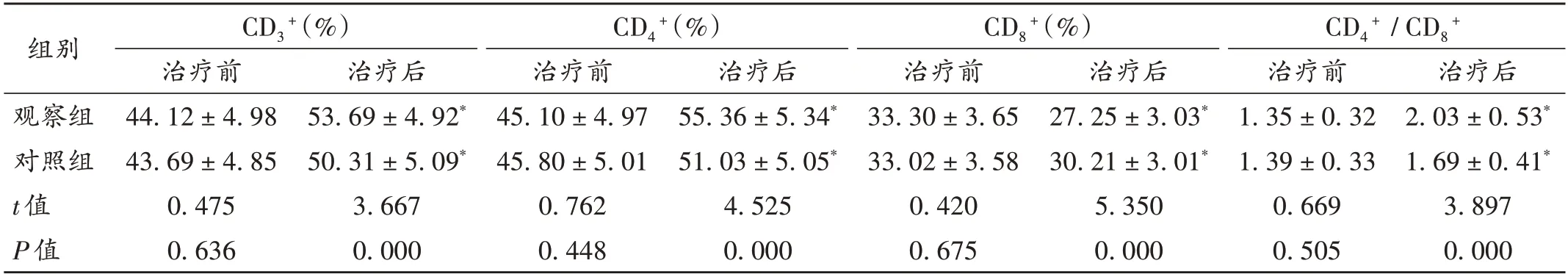
表4 两组患者免疫功能指标比较(,n=59)Tab.4 Comparison of immune function indexes between the two groups(,n=59)

表5 两组患者临床疗效比较[例(%),n=59]Tab.5 Comparison of clinical efficacy between the two groups[case(%),n=59]

表6 两组患者不良反应发生情况比较[例(%),n=59]Tab.6 Comparison of the incidence of adverse reactions between the two groups[case(%),n=59]
3 讨论
对于有手术治疗指征的早中期NSCLC 患者,IUVATS 肺叶切除术仍为首选治疗方案,为了提高术后预后效果和生存周期,术后需行辅助化疗[10]。EP 方案为NSCLC 常用一线化疗方案,即给予抗癌药物依托泊苷和顺铂抑制及杀灭癌细胞,两药联用能从不同作用机制和途径发挥协同增效作用。但常规化疗药物的毒性较大,杀灭癌细胞的同时对机体正常组织的损伤较大,患者耐受性较低,且不良反应影响化疗效果,破坏免疫功能系统[11]。
中医认为,NSCLC 属“癌病”“胸痛”“咳嗽”病变范畴,为正气亏虚、外邪侵肺、脏腑失调等导致的邪积胸中、阻塞气逆、痰血瘀滞等遂结成块而发病,病机根本在气阴两虚、热毒侵犯、痰瘀互结,故应以清热解毒、化痰软坚、扶正固本为主要治疗原则[12]。观察组患者增加消癌平治疗,ORR 和DCR 均显著升高,表明消癌平在NSCLC 术后辅助化疗中有良好应用价值。消癌平是中药通关藤的活性提取成分。通关藤归肺经,具有清热解毒、化痰通络之功效,可有效对抗NSCLC 的热毒侵犯、痰瘀互结[13]。通关藤提取物活性成分包括多种有机酸、生物碱、皂苷、多糖类成分。其中,绿原酸、咖啡酸等有机酸具有抗癌、抗病毒、抗菌和镇痛作用;生物碱可促进生长抑素的分泌作用,抑制肿瘤细胞增殖,诱导癌细胞凋亡[14];多糖类成分能清除机体氧自由基,减轻氧化应激损伤;皂苷类活性成分可增强机体的免疫力,提高机体的活动能力,改善术后的乏力、气虚、神疲等不适感[15]。故从中医理论和现代药理学角度均证实消癌平对NSCLC术后的辅助治疗效果良好。
CD3+是细胞免疫的主要组成部分,而CD4+主要起调节作用,CD8+为细胞毒性T淋巴细胞,具有抑制CD4+及诱导靶细胞死亡的作用[16]。NSCLC 患者受癌细胞增殖及化疗药物治疗的影响,免疫功能处于较低水平,表现 为CD3+,CD4+,CD8+等细胞免疫指标的异常表达[17]。本研究中,观察组患者治疗后的CD3+,CD4+,CD4+/CD8+表达水平均显著高于对照组,CD8+表达水平显著低于对照组,表明消癌平能辅助改善患者的免疫功能。在癌症发病过程中伴随着多种血清学指标水平的异常改变[18],miR-210是微小RNA家族中的一员,在多种生物学过程中起重要作用。有报道显示,miR-210与炎性损伤、癌细胞增殖有一定关联,可通过抑制肿瘤细胞促凋亡基因的表达,进而促进癌细胞的增殖转移[19]。miR-101 在NSCLC 患者中呈高表达,在肺上皮细胞中作为促癌炎性因子促进肿瘤的发生和癌细胞的增殖、转移,在肿瘤病情的进展中有重要调控作用[20]。本研究中,观察组患者治疗后的miR-210和miR-101表达水平均显著低于对照组,表明消癌平的辅助化疗能有效抑制上述指标的表达,进一步证实消癌平在NSCLC术后辅助化疗中的良好作用。观察组联用消癌平治疗的不良反应未显著增加,提示安全性良好。
综上所述,IUVATS 肺叶切除术联合消癌平治疗NSCLC 的临床疗效良好,能降低患者的肿瘤标志物水平,增强免疫力,抑制miR-210和miR-101的表达,且治疗安全性较好。
