表没食子儿茶素没食子酸酯抑制人腹膜间皮细胞上皮-间质转化的作用及机制*
2023-03-12谢斌洪慧帅欢张林
谢斌,洪慧,帅欢,张林
(1.湖南中医药高等专科学校附属第一医院,湖南 株洲 412000;2.湖南省长沙市第四医院,湖南 长沙 410006)
腹膜透析(PD)是终末期肾病的替代疗法,占全球所有形式肾病替代治疗的10%以上[1]。上皮-间质转化(EMT)是上皮细胞在高糖、转化生长因子-β(TGF-β)等因素诱导下,上皮细胞特异性标志物表达丧失,并获得肌成纤维细胞表型的过程[2]。人腹膜间皮细胞(HPMCs)被认为是腹膜纤维化的核心机制[3]。腹膜纤维化的发生会导致PD 失败,极大地限制了PD 的应用。绿茶提取物表没食子儿茶素没食子酸酯(EGCG)是绿茶多酚的主要单体及活性成分,其化学结构中包含没食子酰侧链,具有抗氧化、抗肿瘤、抗炎等生物学特性[4]。最新的研究发现,EGCG 可通过增加细胞内自噬而抑制人成纤维细胞的肌成纤维细胞转化[5]。PANJI等[6]研究发现,EGCG 通过活性氧(ROS)/Smad 信号传导抑制TGF-β 诱导的人宫颈癌细胞EMT。Notch 是编码哺乳动物细胞中跨膜受体家族的一组基因,主要调控细胞的增殖、分化和凋亡,影响细胞的正常生长,在机体稳态、血管生成和癌症发生中起重要作用,Notch受体家族有4 个成员,其中Notch 受体3(Notch3)较常见[7]。ZHU等[8]的研究结果显示,EGCG通过靶向抑制Notch信号通路,抑制链脲佐菌素诱导的糖尿病模型小鼠的肾纤维化过程,提示EGCG可能是一种潜在的抗纤维化试剂,可调节细胞EMT过程。本研究中通过体外建立晚期糖基化终产物(AGEs)诱导的HPMCs EMT 的模型,并采用绿茶提取物EGCG 对EMT过程进行干预,探讨EGCG 对保护腹膜超滤功能的作用机制。现报道如下。
1 材料与方法
1.1 样本来源
腹膜来源于新开管的PD和PD 1年以上患者,获取的腹膜标本立即放入D-Hank液中低温保存,短时间内处理。所有患者均签署知情同意书,本研究方案经湖南中医药高等专科学校附属第一医院医学伦理委员会审批。
1.2 细胞与试药
细胞:HPMCs 细胞株HMrSV5(中国科学院上海细胞库,批号为XY-XB-1663)。
试药:EGCG(上海源叶公司,批号为B20106);AGEs(美国Biovision公司,批号为4271-100);Dulbecco改良Eagel 培养基(DMEM,批号为SH30243),牛血清白蛋白(FBS,批号为SH30070.03),均购自美国Hyclone公司;Ham's F12 培养基(批号为31765035),LipofectamineTM2000(批号为11668019),均购自美国Thermo Fisher 公司;逆转录实时荧光定量聚合酶链反应(qRTPCR)试剂盒(RNA 提取试剂,批号为R401-01),逆转录试剂盒(批号为R223-01),SYBR Green试剂(批号为Q221-01),CCK-8试剂盒(批号为A311-01),均购自南京诺唯赞生物科技股份有限公司;紧密连接蛋白1(ZO-1)抗体(批号为ab276131),E-钙黏蛋白(E-cadherin)抗体(批号为ab40772),铁死亡抑制蛋白1(FSP1)抗体(批号为ab197896),Notch3 抗体(批号为ab300527),均购自英国Abcam公司;si-NC,si-Notch3(美国Invitrogen公司);ZO-1,E-cadherin,FSP1,Notch3 引物,甘油醛-3-磷酸脱氢酶(GAPDH)引物,均购自生工生物工程(上海)公司。
1.3 方法
原代细胞提取和培养:将无菌腹膜组织移入烧杯中,加入预冷的磷酸盐缓冲液(PBS)中洗涤2次,剥离多余的脂肪组织及血管,PBS 冲洗至无油珠漂浮,将网膜组织平铺于无菌培养皿,剪成0.7 cm×0.7 cm 大小,加入胰蛋白酶和0.02%依地酸二钠(EDTA)消化液,用吸管反复吹打均匀,移入细胞培养瓶内消化25 min,每5 min 振摇1次,消化结束后,将消化液经100 目滤网过滤于烧杯中,加入Ham's F12 完全培养基终止消化,离心,收集细胞,将细胞铺至细胞培养皿中,在5% CO2、37 ℃恒温培养箱中培养,得到原代HPMCs。HMrSV5 用含15%FBS的DMEM,在5%CO2、37 ℃恒温培养箱中培养,细胞密度达80%时用胰酶消化细胞,显微镜下观察到大部分细胞变圆时终止消化,加入新鲜培养基,每隔2 d 更换1 次新鲜培养基,待细胞生长密度达80%时进行消化和传代,取对数生长期的细胞进行实验。
AGEs 诱导的HPMCs EMT:AGEs 诱导HMrSV5 的EMT 模型,将细胞分为1 组(正常HMrSV5,培养基不加AGEs)、2 组(加入200 μg/ mL AGEs 诱导HMrSV5)、3组(加入500 μg/mL AGEs 诱导HMrSV5)[9],培养72 h后收集细胞,检测ZO-1,E-cadherin,FSP1 的mRNA和蛋白表达水平。
qRT-PCR法检测HPMCs中的ZO-1,E-cadherin,FSP1,Notch3 mRNA 表达水平及相关性:TRIzol 试剂提取原代HPMCs 和HMrSV5 中的总RNA,酶标仪检测总RNA 的纯度和含量,按qRT-PCR 试剂盒说明,依次进行逆转录和qRT-PCR 实验。qRT-PCR 反应体系为cDNA 模板2 ng,上下游引物各0.4 μL,SYBR Primix Ex TaqTM 5 μL,ddH2O 补充至10 μL;qRT-PCR 反应条件为预变性95 ℃(30 s),变性95 ℃(7 s),退火55 ℃(30 s),延伸72 ℃(15 s),40 个循环周期。扩增结果根据2-ΔΔCt法计算mRNA 的相对表达量,采用Spearman 相关性分析ZO-1,E-cadherin,FSP1,Notch3 mRNA 表达的相关性。qRT-PCR引物序列见表1。

表1 逆转录实时荧光定量聚合酶链反应引物序列Tab.1 Primer sequences of qRT-PCR
免疫印迹(Western blot)法检测HPMCs 中ZO-1,E-cadherin,FSP1,Notch3 的蛋白表达水平:收集各组细胞,使用RIPA 裂解提取总蛋白,通过BCA 法进行蛋白定量。样品变性后,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离等量蛋白,转移至聚偏二氟乙烯(PVDF)膜上,5%脱脂牛奶4 ℃下封闭1 h,TBST 洗膜5 min,共3次,加入ZO-1 抗体(1∶1 000)、E-cadherin抗体(1∶1 000)、FSP1抗体(1∶1 000)、Notch3 抗体(1∶1 000),4 ℃摇床孵育过夜,TBST 洗膜5 min,共3次,加入辣根过氧化物酶(HRP)标记的羊抗兔的二抗(1∶1 000),37 ℃下孵育1 h,TBST 洗膜5 min,共5 次。显影曝光,利用Image-Pro Plus图像分析系统分析蛋白条带的灰度值。重复3次,取平均值。
CCK-8 法检测EGCG 对HPMCs 的细胞毒性:收集HMrSV5,用含10%胎牛血清的DMEM 完全培养基稀释成单细胞悬液,以3×104/mL密度接种于96孔板,接种体积为200 μL。EGCG 溶于DMEM 完全培养基中,分别采用0,20,40,60,80,100 μg/ mL EGCG 处理各组细胞,在细胞培养箱中培养24 h 后加入20 μL CCK-8 检测试剂,1 h后用酶标仪于450 nm波长处测定吸光度。
细胞转染:将HMrSV5 细胞分为si-NC+EGCG 组和si-Notch3+EGCG组,按美国Invitrogen 公司Lipofectamine 2000 说明书步骤进行转染。调整HPMCs 数量,接种于6 孔板,使用不含抗菌药物的完全培养基培养,使转染时细胞生长密度达70%。制备Notch3 特异性si-RNA(si-Notch3)与脂质体复合物,同时制备无干扰作用的si-RNA(si-Control)与脂质体复合物,将复合物加入6 孔板相应si-Notch3+EGCG 组和si-NC+EGCG 组的孔内,摇动、混匀,6 h 后弃去细胞培养基,用PBS 洗涤细胞2次,更换为DMEM 完全培养基,24 h 后更换为含有抗菌药物的完全培养基。采用qRT-PCR 法检测转染后细胞中Notch3的表达。
1.4 统计学处理
采用SPSS 20.0 和GraphPad Prism 7.0 统计学软件分析。符合正态分布的计量资料以表示,组间两两比较采用LSD-t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
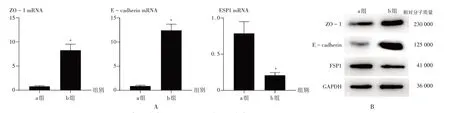
注:a组为新开管PD患者组,b组为PD 1年以上患者组。与a组比较,*P <0.05。图5同。A.qRT-PCR法检测ZO-1,E-cadherin,FSP1 mRNA表达水平 B.Western blot法检测ZO-1,E-cadherin,FSP1 蛋白表达水平图1 新开管PD和PD 1年以上患者HPMCs中ZO-1,E-cadherin,FSP1的mRNA和蛋白表达水平比较Note:Group a refers to the group starting PD,and group b refers to the group underwent PD for more than one year.Compared with those in the group a,*P <0.05(for Fig.1 and Fig.5).A.Expression levels of ZO-1,E-cadherin and FSP1 mRNA(qRT-PCR)B.Expression levels of ZO-1,E-cadherin and FSP1 protein(Western blot)Fig.1 Comparison of expression levels of ZO-1,E-cadherin and FSP1 mRNA and protein of HPMCs in patients starting PD and underwent PD for more than one year
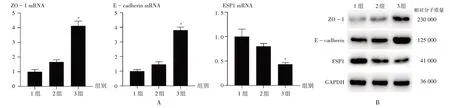
注:1组为正常HMrSV5,2组为200 μg/mL AGEs诱导HMrSV5,3组为500 μg/mL AGEs诱导HMrSV5。与1组比较,*P <0.05。A.qRT-PCR法检测ZO-1,E-cadherin,FSP1 mRNA表达水平 B.Western blot法检测ZO-1,E-cadherin,FSP1 蛋白表达水平图2 不同质量浓度AGEs诱导HPMCs EMTNote:Group 1 refers to normal HMrSV5,group 2 refers to HMrSV5 induced by 200 μg/ mL AGEs,and group 3 refers to HMrSV5 induced by 500 μg/mL AGEs.Compared with those in the group 1,*P <0.05.A.Expression levels of ZO-1,E-cadherin and FSP1 mRNA(qRT-PCR)B.Expression levels of ZO-1,E-cadherin and FSP1 protein(Western blot)Fig.2 EMT of HPMCs induced by different mass concentrations of AGEs
2 结果
2.1 不同阶段PD 患者HPMCs 中ZO-1,E-cadherin,FSP1 表达水平比较
qRT-PCR 法检测结果显示,与a 组比较,b 组患者的ZO-1 和E-cadherin mRNA 表达水平均显著升高,FSP1 mRNA表达水平显著降低(P<0.05),详见图1 A。Western blot 法检测结果显示,与a 组比较,b 组患者的ZO-1 和E-cadherin 蛋白表达水平均升高,FSP1 蛋白表达水平降低,详见图1 B。结果表明,PD 1 年患者的HPMCs已向EMT转化。
2.2 AGEs 诱导HPMCs EMT
qRT-PCR 法检测结果显示,与1 组比较,3 组患者的ZO-1和E-cadherin mRNA表达水平均显著升高,FSP1 mRNA表达水平显著降低(P<0.05),详见图2 A。Western blot法检测结果显示,加入500 μg/mL AGEs诱导HMrSV5后,ZO-1 和E-cadherin 蛋白表达水平均升高,FSP1 蛋白表达水平降低,详见图2 B。结果表明,500 μg/ mL AGEs 可有效诱导HPMCs EMT,后续实验可选择此浓度构建EMT模型。
2.3 EGCG 对HPMCs 的细胞毒性
CCK-8法检测结果显示,与0 μg/mL比较,60,80,100 μg/mL EGCG 能显著抑制细胞的活性(P<0.05),详见图3。故选择40 μg/mL 为EGCG给药浓度。
2.4 Notch3 在EGCG 治疗HPMCs EMT 中的作用
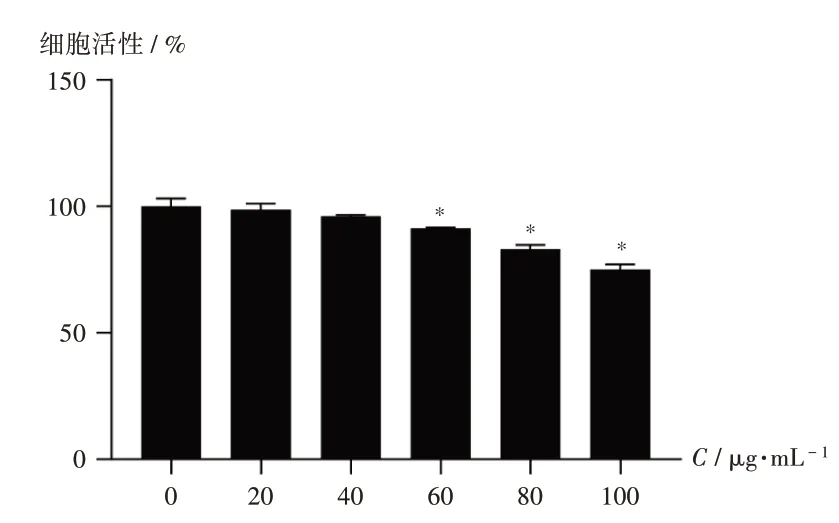
注:与0 μg/mL比较,*P <0.05。图3 不同质量浓度EGCG对HMrSV5的细胞毒性Note:Compared with those in the 0 μg/ mL,*P <0.05.Fig.3 Cytotoxicity of EGCG with different mass concentrations on HMrSV5
qRT-PCR法检测结果显示,与对照组比较,实验组患者的ZO-1和E-cadherin mRNA 表达水平均显著降低,FSP1和Notch3 mRNA表达水平均显著升高(P<0.05);与si-NC+EGCG组比较,si-Notch3+EGCG组患者的ZO-1 和E-cadherin mRNA表达水平均显著升高,FSP1和Notch3 mRNA表达水平均显著降低(P<0.05),详见图4 A。Western blot 法检测结果显示,与对照组比较,实验组患者的ZO-1 和E-cadherin 蛋白表达水平均降低,FSP1和Notch3蛋白表达水平均升高;与si-NC+EGCG 组比较,si-Notch3+EGCG 组患者的ZO-1 和E-cadherin 蛋白表达水平均升高,FSP1 和Notch3 蛋白表达水平均降低,详见图4 B。
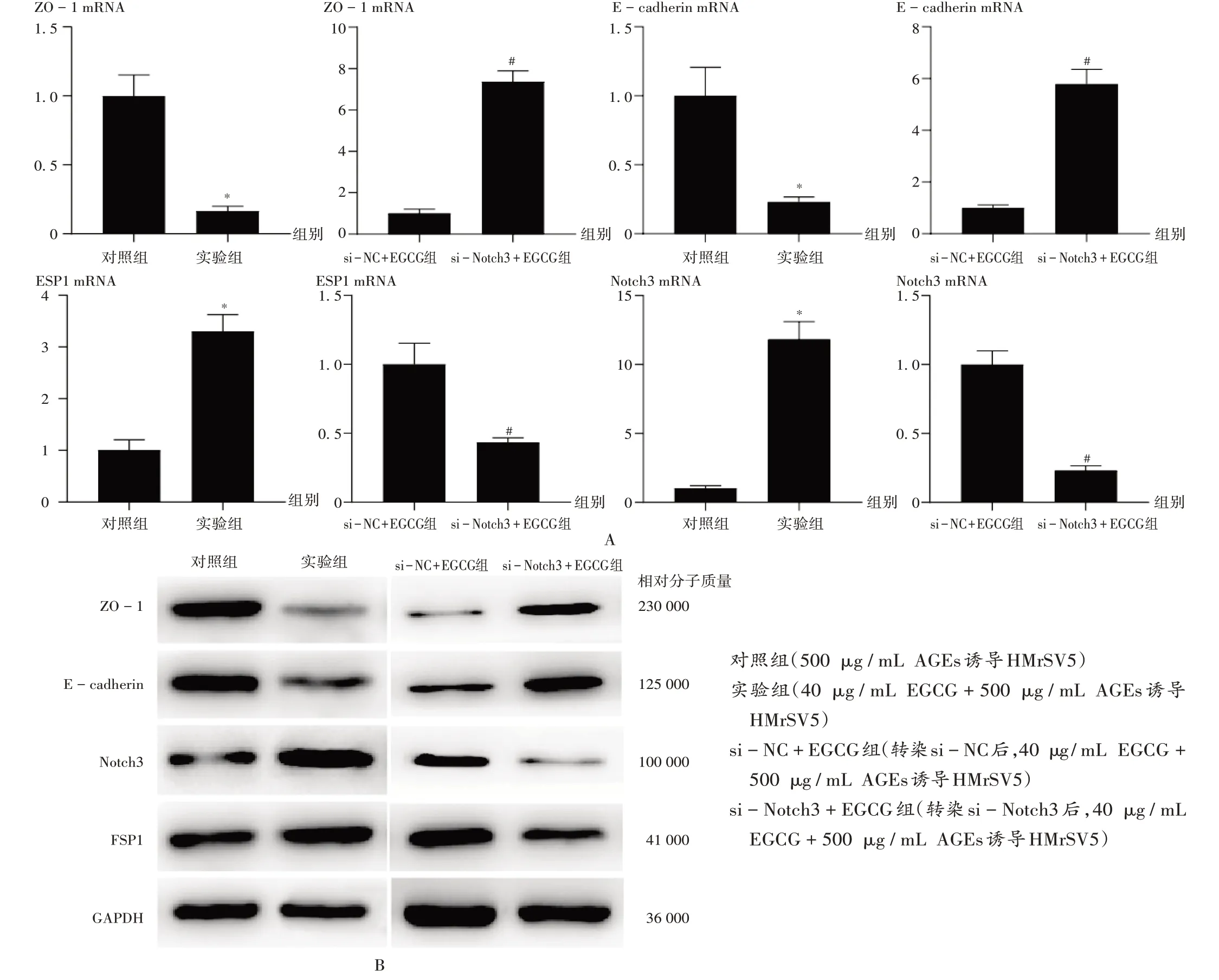
注:与对照组比较,*P <0.05;与si-NC+EGCG组比较,#P <0.05。A.qRT-PCR法检测 B.Western blot法检测图4 Notch3对经EGCG干预的HPMCs中ZO-1,E-cadherin,FSP1 mRNA和蛋白表达水平的影响Note:Compared with those in the control group,*P <0.05;Compared with those in the si-NC+EGCG group,#P <0.05.A.Results of detection(qRT-PCR)B.Results of detection(Western blot)Fig.4 Effect of Notch3 on the expression levels of ZO-1,E-cadherin,FSP1 mRNA and protein in HPMCs after the intervention of EGCG
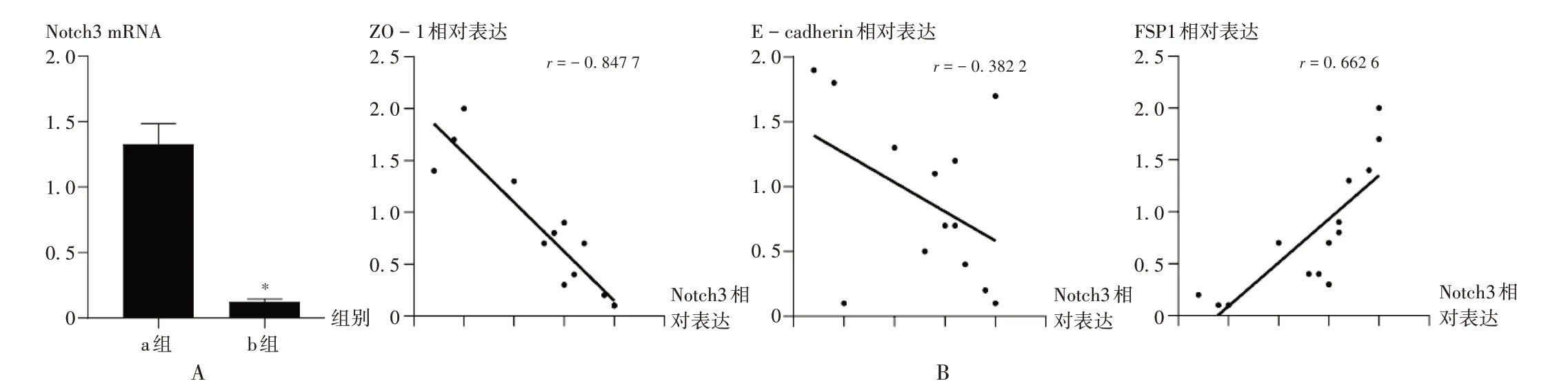
A.qRT-PCR法检测Notch3 mRNA表达水平 B.PD患者中Notch3与ZO-1,E-cadherin,FSP1相关性分析图5 PD患者HPMCs中Notch3与ZO-1,E-cadherin,FSP1表达水平相关性分析A.Expression level of Notch3 mRNA(qRT-PCR)B.Correlation analysis of Notch3 with ZO-1,E-cadherin and FSP1 in patients underwent PDFig.5 Correlation analysis of Notch3 with ZO-1,E-cadherin and FSP1 expression levels of HPMCs in patients underwnet PD
2.5 PD 患者HPMCs 中Notch3 与EMT 基因表达水平相关性
采用qRT-PCR 法检测PD 患者HPMCs 中Notch3 mRNA 表达水平,结果显示,与a 组比较,b 组患者Notch3 mRNA表达水平显著降低(P<0.05),详见图5 A。Notch3表达水平与上皮分子标志物(ZO-1和E-cadherin)及间质分子标志物(FSP1)相关性分析结果显示,PD 患者HPMCs 中Notch3 与ZO-1,E-cadherin 的表达水平呈负相关(r=-0.847 7,-0.382 2,P<0.05),与FSP1的表达水平呈正相关(r=0.662 6,P<0.05),详见图5 B。
3 讨论
我国慢性肾脏病发病率为10.8%[10],部分患者进展至终末期肾病,PD 已成为终末期肾病患者肾脏替代疗法的重要选择之一,但PD液的低pH、高葡萄糖、乳酸和葡萄糖降解产物会引起HPMCs 的慢性炎症和损伤,导致腹膜纤维化而致PD 失败[11]。EMT 是HPMCs 腹膜纤维化的核心机制。EMT 是指上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程[12],在胚胎发育、慢性炎症、组织重建、癌症转移等多种纤维化疾病中起重要作用,主要特征为细胞黏附分子如E-cadherin表达下调、细胞角蛋白转化为波形蛋白细胞骨架,且形态学上具有外间充质细胞特点等[13]。
研究显示,高渗透压、高糖及各种细胞因子等刺激均可促进HPMCs EMT,使腹膜间皮细胞失去细胞极性和丧失黏附性,E-cadherin表达水平降低,向成纤维细胞转化,迁移和侵袭能力增强,α-平滑肌肌动蛋白(α-SMA)和波形蛋白过度表达等,HPMCs EMT 是腹膜纤维化的起始及关键环节,且与腹膜功能密切相关[14]。因此,抑制HPMCs EMT 对治疗PD 具有重要意义。本研究中发现,相比于新开管的PD 患者,PD 1 年以上患者HPMCs 的ZO-1 和E-cadherin 表达水平均显著升高,FSP1 表达水平显著降低,表明HPMCs 已向EMT 转化。AGEs 能引起体外培养的HPMCs 形态逐渐变为梭形,上调HPMCs的α-SMA 表达,下调E-cadherin 表达,从而诱导HPMCs上皮-间叶转化[15]。考虑到原代HPMCs难以转染等因素,本研究中采用HPMCs 细胞系HMrSV5 进行体外实验研究。结果显示,500 μg/mL AGEs 可显著上调HMrSV5 细胞ZO-1 和E-cadherin 表达,显著下调FSP1表达。故选择500 μg/mL AGEs 作为造模剂量。绿茶提取物EGCG 具有很强的生物活性和抗肾癌作用,能抑制肾癌细胞生长,缩小新生微血管面积[16]。在非酒精性脂肪性肝病模型小鼠中,EGCG 治疗使肝纤维化相关基因显著下调,促进脂质和糖代谢、抗脂质过氧化和抗炎活性、抗纤维化,从而减缓非酒精性脂肪性肝病的进展[17]。本研究中,EGCG 可显著减弱AGEs 对ZO-1,E-cadherin,FSP1表达的影响,表明EGCG可抑制AGEs诱导的HPMCs EMT;通过抑制E-cadherin 和波形蛋白的表达来抑制甲状腺癌细胞的EMT、侵袭和迁移,这可能通过调节TGF-β/ Smad 信号通路实现[18]。此外,EGCG 预防肾小管细胞EMT 的分子机制很可能是通过激活转录因子核因子E2相关因子2(Nrf2)信号传导和增加过氧化氢酶抗氧化酶来减少细胞内ROS 的产生[19],但EGCG影响HPMCs EMT的具体作用机制仍不明确。
Notch3 是Notch 信号通路中的关键受体,可影响细胞的增殖、分化、迁移、生长、凋亡等过程。研究发现,赖氨酸特异性去甲基化酶1通过Jagged-1/Notch信号通路诱导EMT 并促进肾纤维化[20]。MATSUURA 等[21]研究发现,Notch3 可能通过调节EMT 来控制食管鳞状细胞癌的化疗敏感性。故本研究中重点关注Notch3 在EGCG 治疗HPMCs EMT 中的作用。结果显示,EGCG 可上调HPMCs 中Notch3 的表达,抑制Notch3 表达可减弱EGCG 对HPMCs 中ZO-1 和E-cadherin 表达上调及FSP1 表达下调的作用,表明EGCG 对HPMCs EMT 影响与调节Notch3 表达有关。LIN 等[22]研究发现,Notch3 的表达与GATA 结合蛋白3(GATA-3)的表达呈正相关,Notch3胞内结构域的过表达可能通过激活GATA-3转录来抑制EMT 的发展。另有研究表明,Notch3 胞内结构域可激活雌激素受体α(ERα)的表达,抑制乳腺癌细胞的EMT 表型[21]。本研究中发现,PD 患者HPMCs 中Notch3 与上皮分子标志(ZO-1 和E-cadherin)表达呈负相关,与间皮分子标志物(FSP1)表达呈正相关,表明Notch3在PD患者HPMCs EMT中发挥重要作用。
综上所述,EGCG 可抑制HPMCs EMT,其作用机制与调节Notch3 表达有关。初步明确EGCG 对HPMCs EMT 的治疗作用,可为进一步研究EGCG 对肾脏疾病的治疗提供参考。
