土大黄根提取物对银屑病模型小鼠血清代谢组学指标的影响*
2023-03-12巴合沙拉马乃甫尤力都孜买买提玉素甫江艾力阿布都帕塔尔阿布迪热扎克热比姑丽伊斯拉木
巴合沙拉·马乃甫,尤力都孜·买买提,玉素甫江·艾力,阿布都帕塔尔·阿布迪热扎克,热比姑丽·伊斯拉木△
(1.新疆维吾尔自治区维吾尔医药研究所,新疆 乌鲁木齐 830000;2.新疆维吾尔医方剂学实验室,新疆 乌鲁木齐 830000)
土大黄是蓼科酸模属RumexL.植物,产于新疆各地。民间调查发现,维吾尔族常用土大黄根、茎和全草水煎煮液治疗银屑病等各种皮肤病,且疗效较好。本课题组分别用小鼠尾部鳞片角化不全模型、雌鼠阴道上皮模型[1]、普萘洛尔诱导耳部角化模型[2]、咪喹莫特诱导小鼠模型[3-4]等银屑病样模型开展土大黄治疗银屑病的药理学研究,以验证民间用药的合理性和科学性。本研究中以土大黄干预银屑病角化异常的传统天然模型(小鼠尾部鳞片角化不全模型),从小鼠血清代谢组学、尾部皮肤组织病理学角度探讨了土大黄根治疗银屑病的作用机制,为开发及利用维吾尔民间药材土大黄奠定基础。现报道如下。
1 材料与方法
1.1 仪器、试药与动物
仪器:DW-86L338J 型海尔超低温冰箱(海尔集团公司);5415D 型低温高速离心机(德国Eppendorf 股份公司);Inova 600 兆超导核磁共振波谱仪(美国Varian公司),配有核磁共振波谱仪工作站;LEICA TP1020 型生物组织脱水机,LEICA RM2235 型切片机,LEICA DM4000型生物显微镜,LEICA LAS V4.5版显微成像系统,均购自德国莱卡公司;KD-BMⅢ型生物组织包埋机(浙江金华科迪仪器设备有限公司)。
试药:土大黄根(新疆华安中药饮片有限责任公司,批号为12110),经新疆大学资源与环境科学学院努尔巴依·阿不都沙力克教授鉴定为正品;醋酸地塞米松片(浙江仙琚制药股份有限公司,国药准字H33020822,批号为140670);消银颗粒(陕西康惠制药股份有限公司,国药准字Z20000019,批号为130809);异常黏液质成熟剂浸膏粉[新疆维吾尔自治区维吾尔医医院制剂室提供,木尼孜其白里海密,维吾尔语命名为Munziq Balgam(MB),批准文号M20052633];重水(D2O,Cambridage Isotop Laboratories,Inc.)。
动物:KM 小鼠80只,雄性,体质量18~22 g,由新疆实验动物研究中心提供。实验动物生产许可证号为SCXK(新)2011-0001,实验动物使用许可证号为SYXK(新)2011-0005。实验开始前检疫2 d,观察一般状况,最终选用符合要求的70只小鼠用于实验。本实验已通过新疆维吾尔自治区维吾尔医药研究所药物安全性评价中心审核,均符合动物伦理委员会的管理准则。
1.2 方法
土大黄根提取物制备[1-5]:称取适量土大黄根,加8 倍量70%乙醇溶液室温密闭浸泡1 h,回流提取3次,每次1.5~2.0 h,滤过,合并滤液,减压浓缩,真空干燥,得干膏粉。
小鼠给药剂量计算[2-8]:消银颗粒临床服用量为0.175 g/(kg·d),根据人与实验小鼠体质量比例计算,本研究中的用量与临床等效剂量相当,设定为1.577 g/(kg·d)。同公式换算得地塞米松的临床等效量为1.05 mg/(kg·d),异常黏液质成熟剂浸膏粉的临床等效量为2 g/(kg·d)[6]。土大黄根提取物用药剂量根据小鼠单次给药毒性实验和大鼠反复给药毒性实验的有效剂量设置为1,2,4 g/kg(低、中、高剂量)[7-8]。
建模、分组与给药:小鼠尾部鳞片角化不全模型[9-10]于20 世纪70 年代初被应用于探讨药物抗银屑病样作用。正常情况下,小鼠尾部鳞片的表皮角质层角质形成细胞保留有细胞核,而颗粒层细胞缺失,其天然的角化形式与人类银屑病表皮相似,可模拟银屑病角化不全的特点,故可作为银屑病角化异常的传统天然模型。将70 只KM 小鼠按体质量随机分为模型对照组(CON 组),化学药阳性对照组(DXM组,1.05 mg/ kg醋酸地塞米松片),中药制剂阳性对照组(XYKL组,1.577 g/ kg 消银颗粒),维吾尔医药阳性对照组(MB组,2 g/kg 异常黏液质成熟剂浸膏粉),土大黄根提取物低、中、高剂量组(RE-L 组、RE-M 组、RE-H组,1,2,4 g/kg),各10只。CON 组小鼠灌胃等体积0.5%羧甲基纤维素钠(0.5%CMC-Na),其余各组小鼠以每10 g体质量灌胃0.2 mL相应药物,每天1次,连续15 d。实验过程中,观察小鼠一般状况,每周测1次体质量,根据体质量变化调整给药剂量。
样品收集与处理:末次给药2 h后,采用摘眼球法取血,4 ℃离心(转速为3 000 r/ min)10 min,分离血清,保存于-80 ℃低温冰箱。测试时室温解冻,取血样200 μL,加400 μL 磷酸盐生理盐水缓冲液,混匀,放置10 min,低温高速离心机离心(转速为10 000 r/min,离心半径为5 cm)10 min,取上清液550 μL,置5 mm 核磁管内,取鼠尾距离根部3 cm 皮肤标本,用15%甲醛水溶液固定、脱水、石蜡包埋,并用苏木精-伊红(HE)染色,光学显微镜下观察尾部皮肤组织病理学变化。
核磁共振氢谱测试:将装有血样的5 mm核磁管置核磁共振仪进行1H-NMR谱测定,本实验均在Inova 600兆核磁共振波谱仪上用ID探头以弛豫编辑(CPMG)脉冲序RD-90°-τ-180°-2τ-180°-2τ-180°-…-ACQ进行。设置参数1H 核磁共振频率599.15 MHz,扫描累积128次,采样数据点32 768,谱宽20×10-6,采样延迟2 min,采样时间(AQ)1.64 min,测试温度25 ℃,采用预饱和方法压制水峰。为了解谱工作的顺利进行,选取质量较高的1H-NMR 谱样品进行二维核磁共振图谱测试,包括1H-1H 同核相关谱(1H-1H COSY)、质子全相关谱(TOCSY)和J-分解谱(J-RES)等,用于谱图中各峰的指认,以便鉴定代谢成分。
1.3 统计学处理
受原始1H-NMR 图谱数据量庞大、数据点具有高度相关性、溶剂峰等因素影响,需对1H-NMR 图谱数据进行预处理。本研究中血样1H-NMR 图谱数据采用0.3 Hz 线宽的指数窗函数,先进行傅里叶变换后进行基线及相位调整。血清图谱以α-葡萄糖δ5.233×10-6质子信号作为参考定标,在δ9.0~0.5 范围内对每段δ0.003 积分段自动积分。同时,排除血清1H-NMR 谱水信号范围为δ5.22~4.66的积分数据,对剩余积分值进行归一化处理。积分值导入Microsoft Excel软件,采用SIMCA-P+11.0 软件包进行正交偏最小二乘法判别分析(OPLS-DA),根据所得代谢物相关系数确定对照组与给药组的差异性代谢成分,检验水准α=0.05,以R2X,R2Y,Q2为所建模型的质量评价指标。本研究中通过Pearson 相关系数显著性检验的r与R的临界值确定有统计学意义(P<0.05)的代谢产物临界值。
2 结果
2.1 OPLS-DA 模式分析
利用OPLS-DA 建立模型的方法评估各组小鼠的代谢物差异,结果显示,CON 组与各给药组间均有一定分离趋势,小鼠尾部鳞片角化不全模型的区分程度和预测程度均可达到要求,CON 组与DXM 组、XYKL 组、MB组、RE-L组、RE-M组、RE-H组的模型预测参数见图1。结果表明,醋酸地塞米松,消银颗粒,异常黏液质成熟剂浸膏粉,低、中、高剂量土大黄根提取物对尾部鳞片角化不全模型小鼠均有一定治疗作用。
2.2 血清标记物的发现与鉴定
2.2.1 CON 组与各阳性对照药组血清差异性代谢物组分

注:模型预测参数分别为R2X=0.40,R2Y=0.87,Q2=0.71;R2X=0.36,R2Y=0.81,Q2=0.51;R2X=0.37,R2Y=0.91,Q2=0.71;R2X=0.27,R2Y=0.94,Q2=0.76;R2X=0.33,R2Y=0.96,Q2=0.85;R2X=0.22,R2Y=0.95,Q2=0.80。图1 各组小鼠血清OPLS-DA得分图Note:Predictive parameters of the model are as follows:R2 X=0.40,R2 Y=0.87 and Q2=0.71;R2 X=0.36,R2 Y=0.81 and Q2=0.51;R2 X=0.37,R2 Y=0.91 and Q2=0.71;R2 X=0.27,R2 Y=0.94 and Q2=0.76;R2 X=0.33,R2 Y=0.96 and Q2=0.85;R2 X=0.22,R2 Y=0.95 and Q2=0.80.Fig.1 Scoring plot of OPLS-DA of serum in each group
通过数据分析,CON 组与DXM 组、XYKL 组、MB 组小鼠血清中共发现23 种差异性代谢物,详见表1。与CON 组比较,DXM 组、XYKL 组、MB 组小鼠血清丙氨酸、甘氨酸、乳酸水平均显著升高,不饱和脂类、低密度脂蛋白(LDL)、极低密度脂蛋白(VLDL)水平均显著降低(P<0.05);DXM 组、XYKL 组小鼠血清亮氨酸、异亮氨酸、缬氨酸、谷氨酰胺、酪氨酸、胆碱、蛋氨酸、乙酸、苯丙氨酸水平均显著升高(P<0.05);DXM 组小鼠血清肌醇、鲨肌醇、乙酰半胱氨酸、柠檬酸水平均显著升高,糖蛋白和丙酮水平均显著降低(P<0.05);XYKL组小鼠血清瓜氨酸和肌酸水平均显著升高(P<0.05);MB 组小鼠血清肌醇和丙酮水平均显著降低,肌酸水平显著升高(P<0.05)。
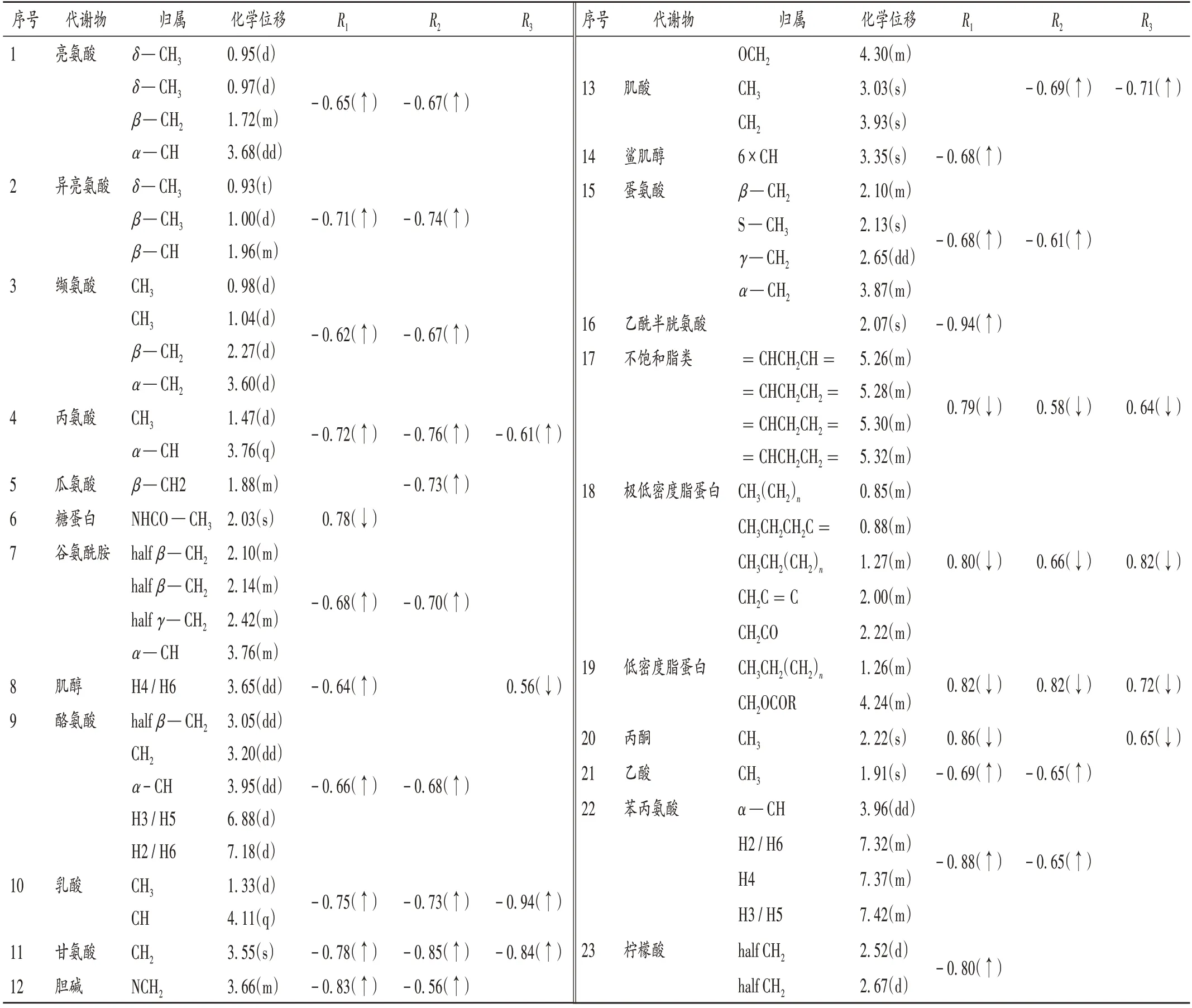
表1 模型对照组与阳性对照组小鼠血清主要差异性代谢物及相关系数Tab.1 Main differential metabolites and correlation coefficients in serum in the CON group and the positive control groups
2.2.2 CON 组与土大黄根提取物组血清差异性代谢物组分
通过数据分析,CON 组与RE-L 组、RE-M 组、RE-H 组小鼠血清中共发现13 种差异性代谢物,详见表2。与CON组比较,RE-L组、RE-M组、RE-H 组小鼠血清丙氨酸、乳酸、甘氨酸、胆碱、肌酸水平均显著升高,LDL和VLDL水平均显著降低(P<0.05);RE-M 组、RE-H 组小鼠血清α-葡萄糖和β-葡萄糖水平均显著升高,糖蛋白水平显著降低(P<0.05);RE-H 组小鼠血清不饱和脂类和苯丙氨酸水平均显著升高,丙酮水平显著降低(P<0.05)。
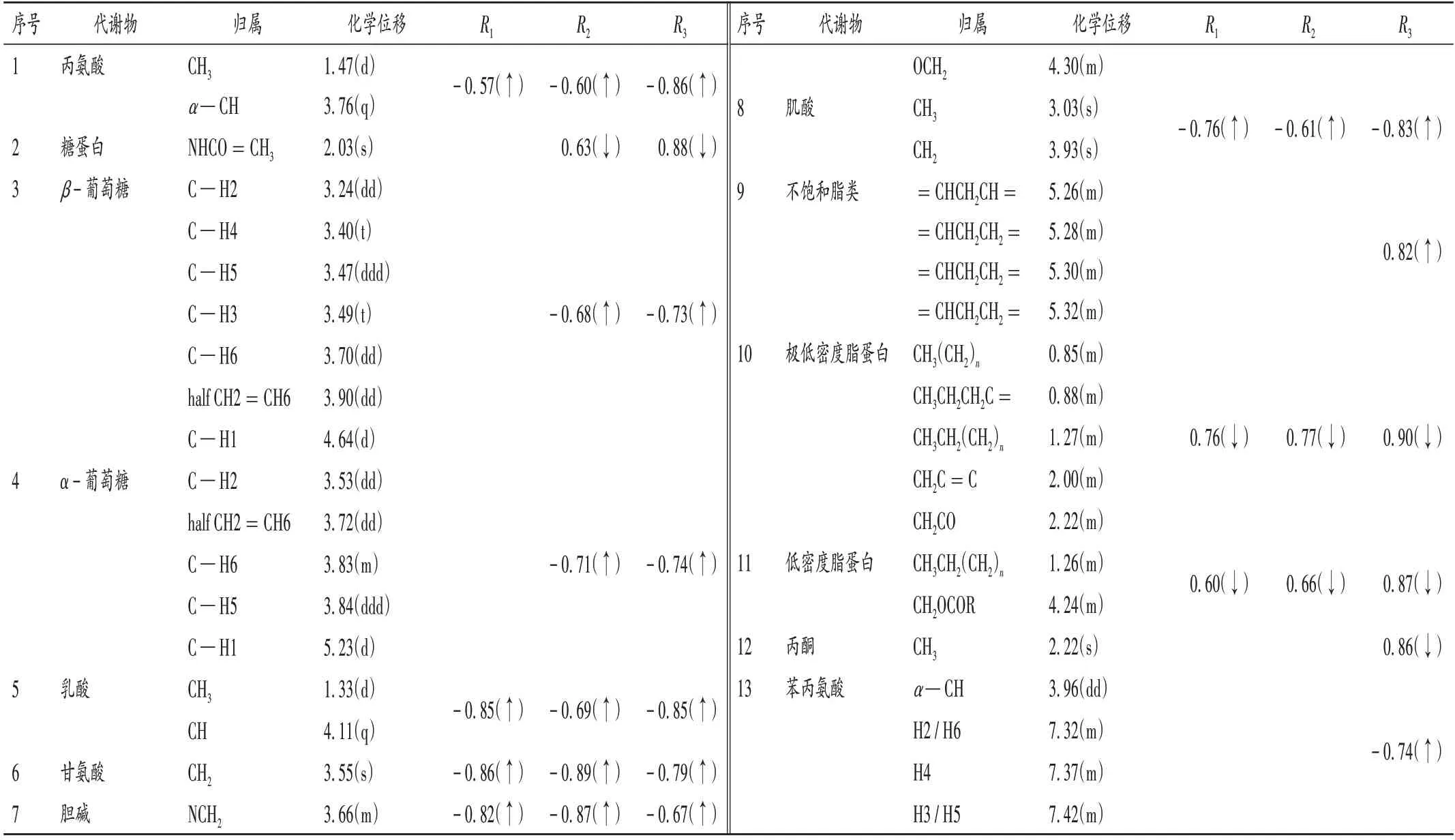
表2 模型对照组与土大黄根提取物组小鼠血清主要差异性代谢物及相关系数Tab.2 Main differential metabolites and correlation coefficients in serum in the CON group and the RE groups
2.3 皮肤组织病理学变化
CON 组小鼠皮肤完全角化,颗粒层变薄或缺乏。与CON 组比较,DXM 组、XYKL 组、MB 组小鼠均出现不同程度的颗粒细胞层增厚或促进形成颗粒细胞层,相互间略有差异,但不显著;RE-L组、RE-M组、RE-H组小鼠也均出现不同程度的颗粒细胞层增厚或促进颗粒细胞层形成,且呈剂量规律性。与DXM组、XYKL组、MB组比较,RE-L 组、RE-M 组、RE-H 组小鼠尾部皮肤组织病理学变化略有差异,但不显著。详见图2。
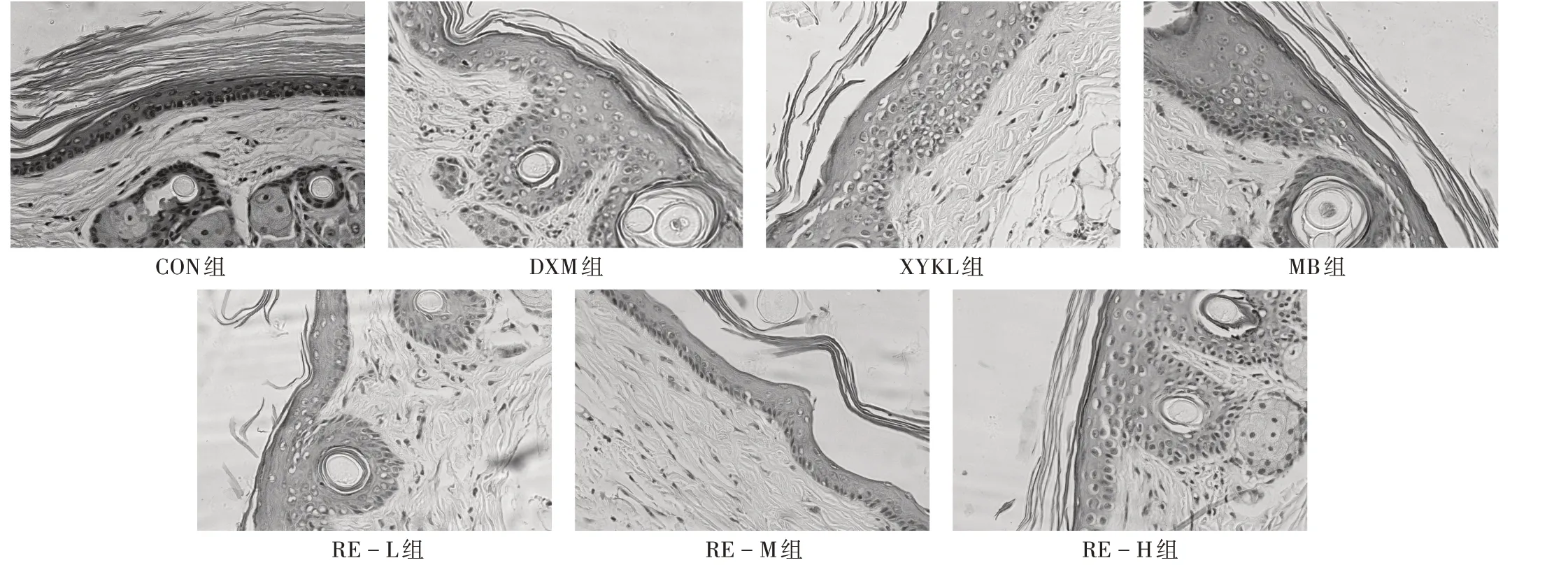
图2 各组尾部鳞片角化不全模型小鼠皮肤组织病理变化(HE染色,×40,n=10)Fig.2 Histopathological changes of skin of mouse tail model in each group(HE staining,×40,n=10)
3 讨论
银屑病为常见慢性复发性炎性皮肤病,全球发病率为2%~3%,欧洲南部国家发病率为8%~11%[11]。近年来,银屑病与代谢综合征的相关性成为皮肤病领域的研究热点,代谢组学技术为证候本质的研究提供了强有力的手段[12-17]。文献[18-22]报道,代谢组学用于新药筛选、作用机制、中枢神经系统疾病治疗等的研究。动物模型是研究人类疾病病因、发病机制、治疗方法的一种重要工具,其中银屑病罕见于任何非人类动物,且自然出现的病例极少见,不适于进行科学研究。因此,建立银屑病动物模型显得尤为必要[23]。作为研究银屑病的可用模型,应具备相应的组织病理学特征、类似发病机制、对抗治疗药物的相似反应。其中,小鼠尾部鳞片角化不全模型操作简单,经济易得,国内外公认,并普遍使用。本研究中利用银屑病角化异常的传统天然模型(小鼠尾部鳞片角化不全模型),经血清代谢组学、皮肤组织病理学检查,初步探讨了土大黄根提取物对实验性银屑病的作用机制。
研究结果显示,灌胃给药15 d后,对模型小鼠血清化学成分的影响,DXM 组、XYKL 组、MB 组主要表现为上调血清氨基酸(丙氨酸、甘氨酸)、乳酸,下调血清不饱和脂类、脂类(LDL 和VLDL);DXM 组、XYKL 组主要表现为上调血清氨基酸(亮氨酸、异亮氨酸、缬氨酸、谷氨酰胺、酪氨酸、蛋氨酸、苯丙氨酸)、胆碱、乙酸;DXM组主要表现为上调血清肌醇、鲨肌醇、乙酰半胱氨酸、柠檬酸,下调血清糖蛋白和丙酮;XYKL 组主要表现为上调血清瓜氨酸和肌酸;MB 组主要表现为上调血清肌酸,下调肌醇和丙酮。结果表明,地塞米松、消银颗粒、异常黏液质成熟剂浸膏粉对模型小鼠血清化学成分的影响主要表现在上调血清氨基酸和乳酸,下调不饱和脂类、脂类(LDL和VLDL)水平而起作用,尤其是对血清丙氨酸、甘氨酸影响普遍。提示DXM组、XYKL组、MB组抗银屑病作用代谢标记物主要为丙氨酸、甘氨酸、乳酸、不饱和脂类、脂类(LDL和VLDL),这与文献[12-17]报道结论相似,但不同的阳性对照药物代谢产物不同。
研究结果显示,灌胃给药15 d后,对模型小鼠血清化学成分的影响,RE-L 组、RE-M 组、RE-H 组主要表现为上调血清氨基酸(丙氨酸、甘氨酸)、肌酸、乳酸、胆碱,下调血清脂类(LDL和VLDL);RE-M组、RE-H组主要表现为上调血清α-葡萄糖和β-葡萄糖,下调血清糖蛋白;RE-H 组主要表现为上调血清不饱和脂类和苯丙氨酸,下调血清丙酮。结果表明,土大黄根提取物对模型小鼠血清化学成分的影响主要表现在上调血清氨基酸和下调血清脂类(LDL 和VLDL)而起作用。提示土大黄根提取物(1,2,4 g/kg)抗银屑病作用代谢标记物主要为丙氨酸、甘氨酸、肌酸、乳酸、胆碱、脂类(LDL 和VLDL),这与文献[12-17]报道结论相似,但不同剂量土大黄根提取物的代谢产物不同。
研究结果显示,灌胃给药15 d后,HE 染色结果表明,CON 组小鼠皮肤完全角化,颗粒层变薄或缺乏;与CON组比较,DXM组、XYKL组、MB组、RE-L组、RE-M组、RE-H 组均可出现不同程度的颗粒细胞层增厚或促进颗粒细胞层形成。提示阳性对照药物和土大黄根提取物均能改变其天然的角化形式与人类银屑病表皮相似的小鼠尾部鳞片角化不全模型,具有治疗银屑病的作用。
综上所述,地塞米松、消银颗粒、异常黏液质成熟剂浸膏粉和土大黄根提取物均能调节尾部鳞片角化不全模型小鼠血清氨基酸及小分子物质代谢紊乱,升高血清丙氨酸、甘氨酸、乳酸水平,降低血清脂类(LDL和VLDL)水平,改善该模型小鼠的皮肤完全角化、颗粒层变薄或缺乏,达到治疗银屑病的作用。不同药物对其模型的影响有差异,其中地塞米松临床作用最强烈、血清差异性代谢物最多;其次为消银颗粒、异常黏液质成熟剂浸膏粉、土大黄根提取物,但其优势、实际作用价值有待深入研究。
